INTRODUCCIÓN
El modelo actual de producción agrícola se basa en el uso de agroquímicos: fertilizantes, insecticidas, herbicidas, fungicidas y nematicidas que justifican el aumento de la productividad, pero su uso desmedido ha repercutido en el ambiente y la salud (Sparks y Lorsbach 2017). Respecto a las denominadas “malezas”, se argumenta que, sin restricción, la merma puede llegar hasta el 30 % del total de la producción, por lo que se han implementado principalmente técnicas de labranza y uso de herbicidas para su control (Oerke 2006, Marín y Weiner 2014). Sin embargo, se ha demostrado que, después de varios años, estas estrategias han provocado degradación de los agroecosistemas, contaminación del ambiente y daños a la salud humana (Waggoner et al. 2013, MacLaren et al. 2020). También se ha reportado que la eliminación de arvenses competitivas con el cultivo repercute en la disminución de otras especies silvestres (Smith et al. 2020). En el aspecto económico, la contaminación de los agroecosistemas por el uso excesivo de plaguicidas reduce los rendimientos del cultivo de interés; por ejemplo, se ha estimado que los agricultores de EUA pierden al menos 200 millones de dólares al año por la reducción de la polinización de los cultivos debido a los efectos tóx icos de los plaguicidas aplicados (incluyendo herbicidas) en los organismos polinizadores (Tyler 2004). Además en el caso de los herbicidas, la aparición de malezas resistentes al producto implica en el corto término mayores gastos para su control (MacLaren et al. 2020).
La actividad herbicida del glifosato fue descubierta en 1970 y durante los 20 años posteriores su uso creció por tratarse de un herbicida de aplicación tanto preemergente como postemergente, una característica deseable de esos productos (Benbrook 2016). A partir de 1996, en EUA se autorizó la siembra de diversas variedades de maíz, soya y algodón genéticamente modificados (GM) o transgénicos, para tolerar el glifosato (Benbrook 2016, ISAAA 2019). La tolerancia al glifosato se introdujo en los cultivos GM insertándoles, mediante ingeniería genética, el gen cp4 epsps de la cepa CP4 de Agrobacterium tumefaciens, que codifica para la proteína responsable de metabolizar el glifosato y hace que la planta modificada sea tolerante al herbicida (Mazur y Falco 1989).
Los cultivos GM tolerantes a glifosato ampliaron los usos y periodos en los cuales este herbicida podía asperjarse durante el ciclo agrícola (Benbrook 2016). Posteriormente, se desarrollaron variedades de plantas modificadas que tienen la capacidad de tolerar altas concentraciones de glifosato sin afectaciones aparentes en el rendimiento agrícola, debido a la aparición de especies vegetales resistentes al glifosato consideradas malezas agrícolas (Guo et al. 2015). La tolerancia a herbicidas es el principal rasgo de los cultivos transgénicos disponibles actualmente y esta tendencia se mantendrá (Parisi et al. 2016) con la introducción de nuevos cultivos GM con dicho rasgo, e incluso con un aumento creciente de variedades transgénicas con rasgos biotecnológicos apilados (stacked transgenes) (Green 2014, James 2015, Parisi et al. 2016).
El uso de herbicidas, incluido el glifosato, se ha incrementado en los sistemas con agricultura de conservación, en contraste con los convencionales, debido a la reducción del movimiento del suelo, lo que incrementa la aparición de arvenses que compiten con el cultivo (Sepat et al. 2017). Desde la década de 1980, el glifosato también se usa como agente desecante de cultivos anuales como maíz, trigo, cebada, avena, frijol, papa, lenteja y garbanzo, entre otros, para acelerar y sincronizar la muerte de las plantas (Darwent et al. 1994, Monsanto 2010).
El uso de glifosato ha generado una gran presión de selección sobre especies vegetales que desarrollaron resistencia natural a este herbicida, las cuales se han considerado como malezas. La resistencia a los herbicidas es la capacidad heredada de una planta de sobrevivir y reproducirse después de la exposición a una dosis de herbicida, que sería normalmente letal para un individuo silvestre (White and Allison 1998, WSSA 1998). Algunas plantas consideradas como malezas pueden poseer naturalmente diversos grados de resistencia al glifosato (u otros herbicidas) debido a circunstancias temporales, espaciales o fisiológicas específicas (por ejemplo, translocación del herbicida hacia algún órgano u organelo celular, mecanismos de detoxificación o insensibilidad al herbicida en el sitio de acción del mismo, entre otros). De manera general, las especies vegetales en las que se han detectado diversos grados de resistencia natural al glifosato tienen en común la expresión diferenciada del gen 5-enolpiruvilshikimato-3-fosfato sintasa, o variaciones (mutaciones) en la secuencia aminoacídica de esta proteína, por ejemplo Asp71Met, Ala112Ile y Val201Met, en comparación con más de 200 secuencias de aminoácidos descritas para otras especies vegetales (Mao et al. 2016). En el Cuadro I se listan algunas especies vegetales en las que se ha determinado resistencia natural al herbicida glifosato.
CUADRO I ESPECIES VEGETALES EN LAS QUE SE HA REPORTADO RESISTENCIA NATURAL AL GLIFOSATO.
| Especie | Año de confirmación | Contexto agronómico | Referencia |
| Commelina communis L. | 2005 | Algodón, soya, cacahuate | Owen and Zelaya, 2005 |
| Lotus corniculatus L. | 1990 | Regenerada a partir de callos | Boerboom et al., 1990 |
| Dicliptera chinensis(L.) Juss | 2002 | Huertos | Yuan et al., 2002 |
| Chenopodium album L. | 2005 | Soya modificada genéticamente | Owen and Zelaya, 2005 |
| Convolvulus arvensis L. | 1984 | Sin datos | DeGennaro and Weller, 1984 |
| Commelina benghalensis L. | 2004 | Algodón modificado genéticamente | Culpepper et al., 2004 |
| Abutilon theophrasti (L.) Medic | 2005 | Soya modificada genéticamente | Owen and Zelaya, 2005 |
Los reportes sobre la expansión de malezas resistentes a glifosato aumentaron a partir de 2003 (Bonny 2016). La adopción de cultivos tolerantes a herbicidas en monocultivo redujo la práctica de rotación de cultivos y favoreció la emergencia de malezas resistentes (Mortensen et al. 2012).
Existe poca información sobre los patrones de uso de plaguicidas en México (García et al. 2018). A partir de la llamada Revolución verde su uso aumentó significativamente (Bejarano-González 2017). Los plaguicidas son el segundo insumo de mayor valor para la producción agrícola, después de los fertilizantes (COFECE 2015). En México están autorizados 183 ingredientes activos de plaguicidas catalogados como altamente peligrosos, los cuales representan el 33 % de los ingredientes activos del Catálogo Oficial de Plaguicidas de México (SENASICA 2020). El herbicida más usado en la agricultura en México es el glifosato por su menor costo respecto a otros herbicidas (García et al. 2018). Se comercializa con nombres tales como Faena, Cacique 480, Nobel 62 %, Lafam, Eurosato y Agroma (Arellano-Aguilar y Montero-Montoya 2017). Comúnmente se utiliza como parte de una combinación de plaguicidas (insecticidas, fungicidas, herbicidas), lo que ha dificultado determinar su impacto y el de otros herbicidas en los ecosistemas, en la biodiversidad, en la producción y en la salud de la población. Arellano-Aguilar y Rendón (2016) documentaron la presencia de plaguicidas (entre ellos glifosato) en ríos, drenes y lagunas de Sinaloa, así como en mar y lagunas de la Península de Yucatán.
En Sinaloa se cuantificó presencia de glifosato entre 3.6 y 4.2 ng/mL en todas las localidades muestreadas. La normatividad mexicana establece para el glifosato los siguientes parámetros: dosis letal 50 (DL50) (oral en ratas) mayor a 5000 mg/kg, ingesta diaria admisible (IDA) de 0.3 mg/kg y límite máximo residual (LMR) en maíz y frijol de 0.1 y 0.2 mg/kg, respectivamente (SENASICA 2020). El uso de glifosato en la Península de Yucatán se acentuó en los últimos años por la introducción de soya tolerante a este herbicida. Se reportó la presencia de glifosato en agua subterránea, en muestras de agua embotellada (1.42 μg/L) y en orina humana (0.47 μg/L) recolectadas en municipios de Campeche (Rendón y Dzul 2017), lo cual implica un riesgo potencial para la salud de la población en regiones donde se ha implementado la agricultura industrial y/o con variedades transgénicas, lo cual evidencia los efectos negativos de la acumulación de glifosato en seres vivos (Mesnage et al. 2013, 2015). En una región rural de Jalisco, México, se reportó la presencia de glifosato (entre otros plaguicidas) en orina de escolares (hasta 0.60 ng/mL) cuyo centro educativo se encontraba en una zona de producción agrícola intensiva (Sierra-Díaz et al. 2019). Agencias gubernamentales de diferentes países (EPA 1993, EC 2002), laboratorios contratados por compañías comercializadoras de herbicidas (Mink et al. 2011, Williams et al. 2012, Greim et al. 2015) e incluso grupos académicos independientes (Astiz et al. 2009, Antoniou et al. 2012, López et al. 2012, Székács y Darvas 2012) han realizado, a través del tiempo, revisiones sobre los efectos del glifosato en la salud. Lamentablemente no existen tales estudios para México. En Europa, el límite de glifosato recientemente actualizado para la toxicidad a largo plazo (establecido en ratas) es de 350 mg/kg de peso por día (bw/d). La dosis aceptable diaria (ADI, por su sigla en inglés) se determinó a partir de la concentración mínima para no presentar efectos adversos (no-observed-adverse-effect level [NOAEL]) en conejos (50 mg/kg bw/d). Al considerarse el factor de seguridad de 100 (10 por la variabilidad intraespecies y 10 por la variabilidad interespecies), la ADI para el glifosato es de 0.5 mg/kg bw/d. En EUA, el equivalente a la ADI es la dosis de referencia (RfD), que se determinó en 1.75 mg/kg bw/d (EPA 2009 <no incluido en referencias>). Es importante destacar que se han reportado daños hepáticos y renales en los modelos experimentales en estudios realizados a concentraciones por debajo de las establecidas por diversas normativas y por las empresas comercializadoras de herbicidas, e incluso por debajo de los límites considerados como seguros (Mesnage et al. 2015). Además, la toxicidad no sólo se limita al ingrediente activo; diversas investigaciones han demostrado que la formulación comercial puede ser incluso más tóxica que el ingrediente activo solo (Mesnage et al. 2013, 2015, Defarge et al. 2018). Los ingredientes añadidos en los herbicidas basados en glifosato alteran la absorción, distribución, metabolismo, excreción y posiblemente la toxicidad del glifosato en las formulaciones comerciales (Mesnage et al. 2013, 2015, Clausing 2015, EFSA 2015, EPA 2017, Benbrook 2019). La polioxietilenamina (POEA, por sus siglas en inglés) es considerada 10 mil veces más tóxica que el glifosato de acuerdo con su evaluación en tres diferentes líneas celulares humanas (Mesnage et al. 2013).
DINÁMICA DEL GLIFOSATO EN EL SUELO
El glifosato es un ácido orgánico soluble en agua, derivado fosfonometilo del aminoácido glicina cuyo ingrediente activo es N-(fosfonometil) glicina (Davoren y Schiestl 2018). Se han descrito dos vías de degradación del glifosato en el suelo: una relacionada con la actividad enzimática liasa sobre los ligandos C-P que libera sarcosina y fosfato (Hove-Jensen et al. 2014, Sun et al. 2019); y otra consistente en un proceso de oxidación a través de una enzima glifosato reductasa (GOX) que rompe el enlace C-N, formando el metabolito ácido aminometilfosfnico (AMPA), el cual es más persistente que el propio glifosato. Las bacterias oxidan o hidrolizan hasta el 98 % del glifosato y solo el 9 % del ácido aminometilfosfónico (AMPA) (Duke 2011, Primost et al. 2017, Sun et al. 2019, la Cecilia y Maggi 2020).
El periodo de vida media del glifosato antes de metabolizarse a AMPA es de 2 a 215 días y presenta una vida media acuática de 2 a 91 días (Giesy et al. 2000, Grunewald et al. 2001). Las tasas de biodegradación del glifosato en el suelo dependen del tipo de suelo, pH, concentración de fosfatos y, principalmente, del O2 disuelto en agua, los microorganismos asociados al proceso y las condiciones ambientales (Strange-Hansen et al. 2004, Sviridov et al. 2015).
Las formulaciones comerciales de herbicidas no contienen únicamente glifosato. Defarge et al. (2018) mostraron que herbicidas con 36-48 % de dicho ingrediente contienen moléculas de acción surfactante con base en petróleo, como POEA y otros contaminantes. Estos autores detectaron metales pesados como cromo, cobalto, plomo y níquel, además de arséni veles permitidos de arsénico en agua, incluso después de las diluciones recomendadas para uso agrícola de los herbicidas (Defarge et al. 2018).
El suelo es un subsistema multifuncional que provee de nutrimentos y agua a las plantas, y actúa como sostén de la cubierta vegetal, lo cual resulta en la producción de alimentos; asimismo, se relaciona con algunos servicios ecosistémicos: secuestro de carbono, mantenimiento y promoción de la biodiversidad, hábitat de microorganismos, regulador hidrológico y amortiguador o filtro que retiene sustancias contaminantes para que no lleguen a mantos acuíferos como resultado del uso desmedido de agroquímicos (Jarvis 1998, Hatfield et al. 2017).
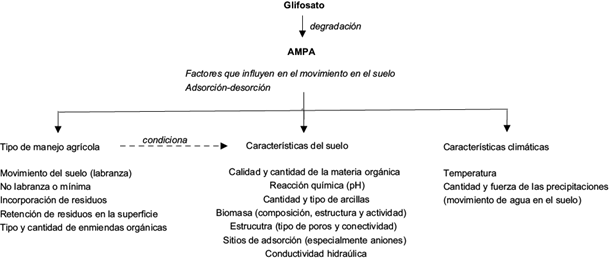
La retención o el movimiento de los solutos en el suelo -incluyendo los herbicidas- depende de las características edáficas, dependientes de la formación del suelo y el contexto climático y geobiofísico en el que se desarrollaron. En el caso de los agroecosistemas, dichas características son modificadas por el manejo agrícola, lo que determina el movimiento y/o permanencia del glifosato y sus metabolitos en él, así como la velocidad de flujo a mantos acuíferos, ligada a los fenómenos de biodegradación, adsorción-desorción y lixiviación (Mickelson et al. 2001) (Fig. 1).
La materia orgánica (MO) es uno de los indicadores más importantes de la calidad del suelo (Andrews et al. 2004). Su proporción y calidad r epercuten en la dinámica del glifosato y el AMPA en el medio, por su relación con los fenómenos de adsorción-desorción e inmovilización, y su acción retardante del movimiento de las moléculas hacia los mantos acuíferos (Bento et al. 2016, Cassigneul et al. 2016). Muskus et al. (2020) mostraron que la variación de temperatura y proporción de MO en el suelo condicionan la degradación y adsorción del glifosato y el AMPA. El experimento se realizó en un suelo incubado a 30 ºC, y se comparó con tratamientos incubados a 10 y 20 ºC, con contenidos de carbono orgánico mayores a 4-5 % (una proporción alta para un suelo agrícola), resultando que la degradación de glifosato y la adsorción de AMPA en la matriz del suelo se incrementó. Esto afectó la actividad microbiana, la cual aumentó debido a la disponibilidad de glifosato como sustrato, y el pH se redujo a 5.5 y 6.5. Lo anterior supondría que, si existe un incremento en la actividad microbiana habrá más degradación. Sin embargo, la formación de biomoléculas a partir del glifosato aumenta el fenómeno de adsorción de residuos xenobióticos y biogénicos no extraíbles, posiblemente tóxicos (Muskus et al. 2020). Ante la degradación del glifosato, el AMPA, que es más tóxico y persistente en el ambiente que el glifosato (Cassigneul et al. 2015, Grandcoin et al. 2017), aumenta la capacidad de adsorción a la matriz del suelo . También se liberan biomoléculas -sarcosina y glicina- que son utilizadas como sustrato por los microorganismos, esto aunado a liberación de P disponible, que puede ser utilizado por las plantas o acomplejarse con elementos del medio (Sun et al. 2019).
Comparados con herbicidas como metazacloro, metamitrón y sulcotriona, el glifosato y el AMPA tienen baja movilidad en los suelos debido a su alta capacidad de adsorción (Gimsing et al. 2004, Mamy y Barriuso 2005). Por ello el contenido de MO y el manejo de residuos en los agrosistemas determina la velocidad de degradación, mineralización y movimiento del glifosato y el AMPA en el suelo. El proceso de desorción está restringido al movimiento del agua en el suelo, por lo que los regímenes de lluvia de cada sitio son decisivos (Daouk et al. 2013, Soracco et al. 2018). Otro factor que influye en la degradación del glifosato en el suelo es el porcentaje y tipo de arcilla; la adsorción aumenta en proporción directa con la cantidad de arcilla (Romano-Armada et al. 2019). La dosis y frecuencia de aplicación del herbicida es un determinante esencial en el tiempo de permanencia del glifosato y el AMPA en el suelo. Un estudio con cultivos genéticamente modificados que empleó glifosato, demostró que éste y el AMPA son contaminantes pseudopersistentes: las tasas de aplicación del herbicida son más altas que las tasas de disipación y por eso hay acumulación tanto de glifosato como de AMPA en el suelo (Primost et al. 2017).
Oluwaranti et al. (2019) señalan que la desorción también está relacionada con la competencia entre el fosfato y el glifosato por sitios de adsorción. Cuando se utilizan fertilizantes fosfatados o enmiendas orgánicas se reduce la adsorción del glifosato, lo que provoca su movilidad y lixiviación (Oluwaranti et al. 2019). Los manejos agrícolas que utilizan labranza reducen los contenidos de MO del suelo al aumentar la mineralización, lo que supondría mayor lixiviación por la reducción de zonas de adsorción (Soracco et al. 2018); sin embargo, se han encontrado otras dinámicas: la labranza convencional afecta la estructura reduciendo la conductividad hidráulica y el movimiento del glifosato en el suelo (Soracco et al. 2018). En contraposición, en los sistemas donde no se realiza labranza, la estructura del suelo se conserva formando flujos preferenciales (presencia de macroporos) que aumentan la conductividad del agua en el suelo, incrementando el fenómeno de desorción y movilidad del glifosato y el AMPA, relacionado con la cantidad y fuerza de la precipitación de la zona (Kjær et al. 2011, Daouk et al. 2013, Soracco et al. 2018).
En los sistemas de agricultura de conservación, los residuos de cosecha se dejan sobre la superficie del suelo. Se ha detectado que el glifosato y su metabolito permanecen más tiempo en los residuos, aumentando su tiempo de vida respecto a su permanencia en el suelo. Al principio son solubles, pero con el paso del tiempo dejan de ser extraíbles; así los residuos no actúan como barrera sino que retienen el herbicida, aumentando su potencial de lixiviarse y pasar a mantos acuíferos (Cassigneul 2016).
Manejos agrícolas donde se incorpora MO provocan diferentes procesos de degradación y adsorción-desorción del glifosato y el AMPA (Erban et al. 2018). En un suelo con bajo contenido de MO se adicionó composta y se observó que la degradación del herbicida aumentó debido a la presencia de la biomasa microbiana; sin embargo, al agregar composta en exceso, el efecto fue contrario porque se aumentaron los puntos de adsorción tanto para glifosato como para AMPA (Erban et al. 2018). En otro estudio se añadió estiércol de vaca al suelo, lo que disminuyó la adsorción del glifosato debido a la competencia por las superficies de carga del suelo, que fueron ocupadas por los fosfatos provenientes de la mineralización de la MO. Los autores consideran el uso de enmiendas orgánicas para reducir la permanencia del glifosato en el suelo y su movimiento fuera del sitio donde fue aplicado, aunque debe estudiarse el destino del herbicida (Oluwaranti et al. 2019).
Respecto a la velocidad de mineralización, el glifosato es estable debido a los enlaces C-P que impiden su hidrólisis, fotolisis y degradación química (Chekan et al. 2016, García-Muñoz et al. 2020), lo cual también depende de las características de los suelos, tales como el pH. Los tiempos de vida del glifosato son menores en pH neutros y alcalinos que en ácidos, lo que es atribuible a las diferencias en la comunidad microbiana del suelo: las bacterias crecen mejor en condiciones neutras y alcalinas, lo que resalta su importancia en la degradación del glifosato en los suelos (Ghafoor et al. 2011). Cuando el pH del suelo se incrementa se reduce la adsorción del glifosato (Zhao et al. 2009) debido a que la variación del pH afecta la superficie de carga del suelo. Esto se debe a que el herbicida es un anión que disminuye su capacidad de unión al aumentar el pH, lo que incrementa la desorción, la lixiviación y el movimiento de la molécula (Oluwaranti et al. 2019). Un estudio demostró que la movilidad del glifosato y el AMPA en el suelo se incrementó con pH > 8 y presencia de Cu (Daouk et al. 2014).
Se ha considerado que el glifosato en el suelo podría ser una fuente de C y P para la microbiota (Sun et al. 2019, Muskus et al. 2020), por lo que debería aumentar su degradación, pero no siempre resulta así, probablemente debido a la adsorción de las biomoléculas o la afectación de la microbiota ante el uso del herbicida. Se ha demostrado que, en algunos casos, la aplicación de glifosato altera la cantidad, actividad y composición de la comunidad microbiana (Nguyen et al. 2016, Allegrini et al. 2017, Romano-Armada et al. 2019). La biomasa edáfica está relacionada con la calidad química y física del suelo (Pronk et al. 2017). Algunos autores afirman que el glifosato afecta la estructura y función de la biomasa microbiana, mientras que otros argumentan que aplicaciones consecutivas provocan un cambio adaptativo en la comunidad microbiana, la cual adquiere la capacidad de degradar el glifosato (Allegrini et al. 2015, 2017).
GLIFOSATO Y MICROBIOTA DEL SUELO
Los microorganismos del suelo (microbiota) desempeñan un papel decisivo en la regulación de los ciclos de nutrientes al degradar la MO, propiciando la disponibilidad y asimilación de nutrimentos esenciales para las plantas (Harris 2009) y transformar nutrientes inorgánicos (C, N, S, P, Fe, Ni, Ag) a través de procesos metabólicos propios (Cherni et al. 2015), por lo cual influyen en la productividad y salud de las plantas (Lakshmanan et al. 2014, Nguyen et al. 2016). La rizósfera es la región del suelo que está influida por las raíces a través de la deposición de exudados, mucílagos y células desprendidas. En el suelo rizosférico, la masa microbiana puede ser de cinco a 100 veces mayor que en el suelo sin raíces (Arshad et al. 2007). En la rizósfera se degradan compuestos orgánicos; por ello, la dinámica microbiana en esta zona ejerce una influencia positiva o negativa en el crecimiento y desarrollo de las plantas (Dubey y Fulekar 2013). También el manejo agrícola y factores ecológicos influyen en la diversidad de la microbiota del suelo (Pancher et al. 2012).
Las prácticas para controlar arvenses pueden afectar a los microorganismos del suelo mediante la eliminación de plantas con las que interactúan o al actuar directamente sobre la fisiología y metabolismo de los microorganismos. Originalmente se argumentó que el glifosato actúa únicamente en vegetales interfiriendo la síntesis de aminoácidos aromáticos esenciales, pero actualmente se sabe que la vía del shikimato está presente también en una gran diversidad de microorganismos, por lo que el glifosato podría alterar el crecimiento y actividad metabólica microbianas en las especies procariontes sensibles del suelo (Nguyen et al. 2016). Varios estudios han reportado la presencia de residuos de glifosato en suelos agrícolas en el rango de 25 a 1000 μg/kg de suelo (Laitinen et al. 2006, 2007, Syan et al. 2014). Se ha descrito que el glifosato alcanza concentraciones de hasta 4000 μg/kg en la rizósfera de plantas tratadas con el herbicida (Syan et al. 2014). Usualmente, las investigaciones orientadas a determinar los efectos toxicológicos del glifosato en los organismos emplean concentraciones mayores a las indicadas o sugeridas en las presentaciones comerciales de los herbicidas (Nguyen et al. 2016).
Se estima que variables como la formulación comercial, dosis aplicadas, tiempo de exposición a los herbicidas, pH, concentraciones de fósforo, materia orgánica y mineralogía del suelo, y presencia o ausencia de plantas en el sistema, entre otras, influyen en la actividad metabólica o la biomasa cuantificada en el sistema edáfico (Nguyen et al. 2016). Algunos plaguicidas pueden tener efectos refractarios en el crecimiento de los microorganismos, ya que podrían estimular o inhibir su crecimiento (Lo 2010). Se han reportado comportamientos diferenciales entre bacterias grampositivas y gramnegativas en suelos tratados con las mismas concentraciones de glifosato (Sihtmäe et al. 2013).
En experimentos in vitro se encontró que el glifosato inhibe el crecimiento microbiano de aislados ambientales (Bonnet et al. 2007) y de la microbiota intestinal a concentraciones mayores a 75 mg/L (Shehata et al. 2013). El glifosato puede ser una fuente de C para la bacterias, estimulando su actividad e incrementando la mineralización (Araújo et al. 2003). La degradación del glifosato por parte de los microorganismos del suelo implica procesos metabólicos conjugados con el ambiente rizosférico; a su vez, la tasa de degradación del herbicida dependerá de la actividad de las poblaciones microbianas, el tipo de suelo y la dinámica del mismo (Accinelli et al. 2005). Sin embargo, los posibles efectos del glifosato en la microbiota podrían estar enmascarados debido a redundancia funcional, en la cual los parámetros metabólicos cuantificados podrían estar inalterados, pero la composición de las comunidades microbianas podría afectarse (Newman et al. 2016). Se ha evidenciado que tratamientos con altas concentraciones de glifosato reducen el número de microorganismos, en comparación con la cantidad encontrada en suelos tratados con la cantidad recomendada del herbicida (Ayansina y Oso 2006).
La degradación del glifosato es realizada por una diversidad de filos bacterianos (Proteobacterias, Actinobacterias, Bacteroidetes, Acidobacteria, Nitrospirae, Cianobacteria, entre otros), y la biodisponibilidad del herbicida para dichas comunidades depende en gran medida de las características del suelo (Guijarro et al. 2018). Los efectos del glifosato en la microbiota del suelo dependen de varios factores: la formulación comercial y concentración del herbicida, el tiempo de exposición de la microbiota y la física y química del suelo. De manera general, ante la exposición a herbicidas con glifosato, la composición de la comunidad bacteriana del suelo sufre cambios adaptativos que favorecen la prevalencia de especies tolerantes al glifosato (Jacobsen y Hjelmsø 2014), con efectos potenciales en la capacidad o eficiencia de la microbiota del suelo para completar los ciclos del C, N, P.
Liu et al. (2018) encontraron que la actividad catabólica de bacterias gramnegativas se incrementó al aplicar glifosato al suelo en una concentración 10 veces mayor que la recomendada para el herbicida comercial, lo cual indica que las bacterias gramnegativas no se reproducen, pero activan su metabolismo para eliminar el glifosato presente en el suelo y sobrevivir a las condiciones de estrés existentes. Algunas de las especies identificadas en dicho estudio son: Ralstonia sp., Gamma proteobacterium, Burkholderia sp. y Devosia sp. También encontraron que las comunidades fúngicas del suelo se inhibieron con el tratamiento del herbicida (Liu et al. 2018). En contraste, la interrupción del crecimiento de microorgansimos vía inhibición de la enzima EPSPS pudiera ser una estrategia terapéutica contra infecciones patogénicas provocadas por Toxoplasma gondii, Plasmodium falciparum y Cryptosporidium parvumb (U.S. Patent No. 7771736 B2) (Paul et al. 2005, Liu et al. 2018).
Como parte del análisis de riesgo a los herbicidas previo a su liberación comercial, se evalúan los efectos toxicológicos pero no los subletales o crónicos en los organismos. Kurenbach et al. (2015) analizaron el comportamiento de Escherichia coli y Salmonella enterica serovar Typhimurium sometidas a tres diferentes formulaciones comerciales de herbicidas: dicamba, ácido 2,4-diclorofenoxiacético (2,4-D) y glifosato. Encontraron que dichos herbicidas indujeron cambios en la respuesta de las bacterias a cinco de los principales grupos de antibióticos: β-lactamas (ampicilina), cloramfenicol, tetraciclina, fluroquinolonas (ciprofloxacina) y aminoglicosidos (kanamicina). La exposición de las cepas al glifosato incrementó significativamente la tolerancia a los antibióticos ampicilina, cloramfenicol, y tretraciclina. Posteriormente, estos investigadores encontraron que el glifosato incrementa más de 100 mil veces la resistencia bacteriana en E. coli y Salmonella a los antibióticos. Progresivamente se está haciendo un mayor uso de herbicidas en la agricultura comercial y, por otro lado, el uso de antibióticos en la producción pecuaria es una práctica común, por lo que la aparición de cepas resistentes a los antibióticos es inminente.
EFECTO DEL GLIFOSATO EN LOS HONGOS
Hay una diversidad de efectos del herbicida glifosato sobre especies de hongos del suelo. Algunas investigaciones apuntan a que el glifosato no altera determinadas especies fúngicas, mientras que otros estudios indican alteraciones a nivel de inhibición del crecimiento (debida a la toxicidad del herbicida) a tal grado que podrían ser los organismos microscópicos del suelo más afectados (Magan 2008). Además, existe un número limitado de reportes sobre especies fúngicas capaces de degradar compuestos organofosfatados (como el glifosato) y desarrollarse en medio de cultivos que contengan este químico y lo usen como fuente de carbono y fósforo. Entre las especies más frecuentemente estudiadas se encuentran Aspergillus flavus, Aspergillus sydowii, Aspergillus niger, Trichoderma viride, Penicillium waksmanii, Penicillium lilacinum, Mucor spp., Fusarium spp. and Saccharomyces rouxii (Bujacz et al. 1995, Krzyśko-Łupicka y Orlik 1997, Krzyśko-Łupicka et al. 1997, Klimek et al. 2001, Sudoł y Krzyśko-Łupicka 2005, Castro et al. 2007, Krzyśko-Łupicka y Sudoł 2008, Tanney y Hutchison 2010, Ramadevi et al. 2012, Zheng et al. 2013). En congruencia con el principio de precaución (Gremmen y Belt 2000, Carranza et al. 2017) y el cuidado de los agrosistemas, se mencionan los efectos tóxicos más relevantes provocados por el glifosato sobre especies fúngicas del suelo.
Los hongos micorrízicos arbusculares, que forman simbiosis hasta con el 80 % de las especies vegetales, son considerados esenciales en los ecosistemas por su rol en la nutrición de las plantas (Cameron 2010). Se analizó el efecto del glifosato en la relación entre hongos micorrízicos y lombrices de tierra (Lucumbris terrestris). El glifosato disminuyó significativamente (hasta el 40 %) la tasa de formación de micorrizas en la rizósfera, así como la biomasa de las esporas micorrízicas. El glifosato provocó un aumento en la masa de las lombrices (hasta en un 50 %), aunque presentaron menor actividad (Zaller et al. 2014). No existen muchas investigaciones que aborden la ecología de la rizósfera, por lo que es esencial realizar más estudios al respecto.
Un estudio muy relevante realizado por Mesnage et al. (2020) señala que el glifosato (450 g/L de formulación comercial) provoca múltiples efectos tóxicos en procesos biológicos de Aspergillus nidulans, un hongo filamentoso del suelo utilizado comúnmente como bioindicador experimental de la salud del suelo, a dosis muy por debajo de las recomendadas en la práctica agrícola, incluidas concentraciones mínimas para no presentar efectos adversos (no-observed-adverse-effect level [NOAEL]) (Nicolas et al. 2016). Se encontró que más de 60 genes relacionados con la transcripción y síntesis de proteínas en A. nidulans tenían alteraciones en los patrones de expresión como resultado de la exposición al glifosato. El metabolismo de micotoxinas producidas por el hongo también mostró alteraciones, como regulación negativa de los genes relacionados con la biosíntesis de sterigmatocistina/aflatoxina y regulación positiva (sobreexpresión) de genes asociados con la biosíntesis de penicilina y cefalosporina. Además, el glifosato afectó el metabolismo de los aminoácidos tirosina, fenilalanina, triptofano, arginina, prolina y lisina, y las vías metabólicas relacionadas con detoxificación (citocromos P450, glutatión S-transferasa, entre otros) (Mesnage et al. 2020).
EFECTO DEL GLIFOSATO EN LOMBRICES
En el suelo, las lombrices realizan funciones esenciales para el agroecosistema: modelan la estructura del suelo aumentando la macroporosidad al cavar túneles de hasta 8900 km de longitud (Kretzschmar 1982); producen coprolitos (excremento formado de MO y suelo) (van Groenigen et al. 2014) que incrementan la dinámica del agua y la aeración del suelo; influyen en las poblaciones bacterianas; coadyuvan a la mineralización de la MO y al crecimiento vegetal; representan una fuente de alimento para otros organismos, y son un indicador de la salud del suelo (Edwards y Bohlen 1996, Fragoso et al. 1997, Yasmin y D’Souza 2010). Las especies de lombrices que habitan en los suelos frecuentemente constituyen la mayoría de mesofauna: más de 1000 individuos y 300 g de biomasa por metro cuadrado de suelo (Edwards y Bohlen 1996).
Las investigaciones sobre el efecto toxicológico del glifosato en especies de lombrices no son concluyentes (Domínguez et al. 2016, Dennis et al. 2018), aunque la evidencia parece indicar que el glifosato sí ejerce toxicidad en estos anélidos (Zaller et al. 2021)
En muchos casos se ha analizado el efecto del glifosato en condiciones de laboratorio utilizando especies que comúnmente no habitan en los agroecosistemas (p. ej., lombrices del género Eisenia) (Verrell y van Buskirk 2004, Yasmin y D’Souza 2007, Correia y Moreira 2010, Buch et al. 2013, Piola et al. 2013). Se ha sugerido que el glifosato afecta, entre otros procesos metabólicos, las vías de regulación del estrés oxidativo (afectando la ruta de la enzima aceticolinesterasa), ejerciendo un efecto toxicológico crónico y no letal en especies de lombrices como E. hortensis (Hackenberger et al. 2018). Por otro lado, se encontraron resultados contrastantes en la actividad y viabilidad de dos especies (Lumbricus terrestris y Aporrectodea caliginosa) expuestas a concentraciones de trabajo de glifosato. El herbicida estimuló inicialmente la actividad de L. terrestris, sin embargo, la actividad cesó drásticamente después de una aplicación del herbicida. El glifosato redujo también la masa de los coprolitos producidos; en contraste la producción y masa de coprolitos no se afectó en el caso de A. caliginosa; sin embargo, la aplicación del herbicida afectó la tasa de reproducción en ambas especies (Hagner et al. 2019). Aunque se ha investigado el efecto de ciertos plaguicidas (cipermetrina, glifosato, mancozeb, clorpirifos, carbendazim, dimetoato), son necesarios más estudios para determinar las secuelas de muchos agroquímicos que siguen usándose ampliamente en la agricultura (Pelosi et al. 2014). Dichos estudios deben incluir análisis ecotoxicológicos del efecto de formulaciones comerciales de glifosato en las lombrices de tierra, dado que dichas presentaciones contienen elementos llamados “inertes”, los cuales han mostrado ser incluso más tóxicos que la molécula de glifosato (Defarge et al. 2018). Una investigación reciente determinó que tanto las formulaciones comerciales de glifosato como el ingrediente activo solo alteran actividades metabólicas esenciales para las lombrices de tierra (Zaller et al. 2021).
PROPUESTAS PARA REDUCIR EL IMPACTO DEL USO DE GLIFOSATO
La agricultura convencional pretende erradicar todas aquellas plantas que no sean el cultivo de interés utilizando herbicidas como el glifosato y prácticas de labranza (Sparks y Lorsbach 2017, MacLaren et al. 2020), lo que ha provocado, entre otras cosas, la aparición de plantas resistentes a los herbicidas (denominadas malezas), la reducción de la biodiversidad, que es una característica fundamental para que un agrosistema sea sustentable (Schütte et al. 2017). En las últimas décadas también se introdujeron organismos transgénicos tolerantes a herbicidas, particularmente al glifosato, lo cual ha implicado un aumento del uso de herbicidas aunado a la aparición de malezas resistentes (Bonny 2016, Schütte et al. 2017). Las arvenses son parte de la biodiversidad del agrosistema, ya que garantizan la diversidad de la vida silvestre como organismos descomponedores y depredadores, necesarios para el sistema (Thies et al. 2011, Smith et al. 2020). Sin embargo, el incremento en su biomasa puede reducir el rendimiento de los cultivos (Zimdahl 2007), por lo cual deben buscarse opciones para su manejo. Para eliminar el uso de herbicidas existen diferentes enfoques, uno de los cuales es no eliminar completamente las arvenses; esto implica un cambio de paradigma (manejo en lugar de control) que diversifique el agrosistema incluyendo cultivos de cobertura, mixtos, intercalados y agroforestales (Altieri et al. 2012, Chappell y LaValle 2011). Se ha demostrado que los monocultivos son ineficientes para competir con las arvenses (Finn et al. 2013).
Los manejos agrodiversos presentan complicaciones en la mecanización de las diferentes prácticas y muchas veces el control de arvenses significa aumentar los costos relacionados con la mano de obra, por lo cual algunos productores lo rechazan (Davis et al. 2012). Es necesario analizar las repercusiones a largo plazo, más allá de resultados inmediatos en extensiones reducidsa. El uso excesivo de herbicidas y labranza han provocado la degradación del suelo, contaminación ambiental y repercusiones en la salud humana, así como la dependencia de insumos y el incremento en los costos de producción (MacLaren et al. 2020). Es imperativo proponer manejos sostenibles de arvenses, que consideren las interacciones entre las diferentes plantas dentro de la parcela, el tipo de manejo agrícola, y el entorno ecosistémico a diferentes escalas espaciales y temporales (Ward et al. 2014, Neve et al. 2018). Una de las propuestas es el manejo integrado de arvenses o malezas, el cual emplea técnicas mixtas que incluyen opciones mecánicas y culturales, centrando la estrategia en la rotación de cultivos; sin embargo, incorpora el uso de herbicidas y ha presentado dificultades para el control de malezas resistentes (Mortensen et al. 2012).
Algunos investigadores proponen continuar con monocultivos, aumentando la densidad de siembra para inhibir el crecimiento de las arvenses. Marín y Weiner (2014) demostraron que este método podría resultar viable en el cultivo del maíz; sin embargo, incrementa las necesidades de nutrientes y agua por parte del cultivo. Un estudio sugiere investigar las relaciones ecológicas del agrosistema, centrándose en las propiedades y procesos que determinan la abundancia, diversidad y composición de las arvenses, para generar una estrategia de manejo selectivo acorde con las funciones negativas o positivas de dicha comunidad (MacLaren et al. 2020). Dicha investigación afirma que sistemas intensos y simplificados generan disponibilidad de recursos que fomentan la alta densidad de arvenses pero baja competitividad entre ellas, en tanto que sistemas agrodiversos (en tiempo y espacio), con menor disponibilidad de recursos, incrementan las interacciones, generando una comunidad de arvenses más diversa que tiende a autorregularse además de propiciar un mejor control de plagas (Storkey et al. 2019). En la lógica de control de arvenses a partir de la diversidad, se han probado sistemas que integran la producción agrícola y ganadera, tanto en la incorporación de cultivos forrajeros a las parcelas agrícolas, intercalados o en rotación, como en el pastoreo como control de arvenses (Tracy and Sanderson 2004, Hilimire 2011). En México, en sistemas como la milpa, los productores tradicionales reconocen el valor de plantas no cultivadas y no las consideran malezas. A partir de dicha concepción se han realizado investigaciones para su caracterización y ampliación de su consumo (Chacón y Gliessman 1981, Marshall et al. 2003, Blanckaert et al. 2007).
Existen pocos estudios sobre el control de arvenses en sistemas no tradicionales, que no estén ligados al uso de herbicidas o de organismos genéticamente modificados. Caamal-Maldonado et al. (2001) rescatan las prácticas tradicionales de control de arvenses, utilizando leguminosas de zonas tropicales como Mucuna deeringiana, Canavalia ensiformis, Leucaena leucocephala y Lysiloma latisiliquum por su efecto halelopático. A partir de bioensayos, estos autores demostraron que los lixiviados acuosos de las cuatro leguminosas ejercen un efecto fitotóxico sobre el crecimiento de la radícula de las plantas. En campo se utilizaron las leguminosas como cultivos de cobertura, y en todos los casos se redujo el crecimiento de arvenses.
CONCLUSIONES
La agricultura tecnificada ha hecho un uso desmedido de insumos agrícolas como los herbicidas, de los cuales el glifosato es el más utilizado actualmente. Se ha mostrado científicamente la persistencia de este herbicida en suelos y mantos freáticos, así como su toxicidad en muchos organismos no blanco. La Organización Mundial de la Salud recientemente reclasificó al glifosato como probablemente cancerígeno. Ante tales evidencias, es necesario encontrar alternativas para el manejo de plantas no deseadas en los cultivos. La biomasa bacteriana es afectada de diferentes maneras (genética, fisiológica y poblacionalmente) por la exposición al glifosato; sin embargo, hay algunas especies cuyo crecimiento parece promoverse en suelos tratados con éste. El glifosato ejerce múltiples efectos sobre los hongos, como la inhibición de la actividad micorrízica, lo cual se refleja en la nutrición vegetal e incluso en la rizósfera. Se informan resultados contrastantes sobre el efecto del glifosato en especies de lombrices de tierra y, en el contexto del principio precautorio, puede aseverarse que es tóxico para estos anélidos, afectando su actividad esencial promotora de la calidad del suelo y el desarrollo vegetal. El manejo y control de arvenses sin el uso de herbicidas es un campo de investigación poco explorado que urge fomentar considerando la diversidad de cultivos, climas y manejos agrícolas, asó como contextos socioeconómicos.











 nueva página del texto (beta)
nueva página del texto (beta)