INTRODUCCIÓN
El fósforo (P), uno de los macronutrientes que las plantas requieren para su adecuado desarrollo y crecimiento, es esencial debido a que forma parte de los fosfatos portadores de energía (ATP-ADP), fosfolípidos, ácidos nucleicos y varias coenzimas (Khan et al. 2014). Las plantas absorben el P como iones dihidrógeno fosfato (H2PO4 -2) y trihidrógeno fosfato (HPO4 -3). Sin embargo, una gran parte de estos iones (aproximadamente 95-99 %) está en el suelo en forma de fosfatos insolubles, los cuales no pueden ser absorbidos por la mayoría de las plantas (Hernando-Posada et al. 2013).
En la agricultura se aplican grandes cantidades de fertilizantes fosfóricos, a manera de fertilización de fondo, para aumentar la disponibilidad de P en los suelos (Barrios-Díaz et al. 2015); sin embargo, una gran porción del P contenido en los fertilizantes se transforma rápidamente a la forma insoluble, al fijarse a la materia orgánica y a los cationes del suelo (Ca2+, Mg2+, Fe3+ y Al3+) (Khan et al. 2010). Por lo tanto, un bajo porcentaje del P aplicado se encuentra disponible para las plantas, lo que hace necesario la aplicación continua de fertilizantes fosfóricos (Barrios-Díaz et al. 2015). Esta situación se refleja en el incremento en la producción de fertilizantes a nivel nacional, la cual se elevó de 2.0 a 2.27 millones de toneladas por año a partir de 2008, y para 2018 se pronostica un aumento del 3.0 % (FAO 2015, Gaucín-Piedra 2017). Esto se debe principalmente al incremento en la fabricación de fertilizantes fosfóricos (Gaucín-Piedra y Torres-Garrido 2011, Gaucín-Piedra 2017).
La fertilización química representa uno de los mayores costos en la producción agrícola; además, conlleva problemas asociados como desequilibrio en la fertilidad del suelo y contaminación de agua de uso humano, animal y vegetal (Mora-Ravelo et al. 2014, Barrios-Díaz et al. 2015). Tomando en cuenta tanto el alto costo económico como las potenciales consecuencias ecológicas adversas en algunas circunstancias, es necesario utilizar alternativas ambientalmente amigables para hacer disponible el P para los cultivos (Hernández-Leal et al. 2011). Una alternativa de bajo impacto ambiental es el uso de hongos microscópicos solubilizadores de P (HMSP), los cuales son capaces de convertir en formas solubles las formas insolubles de este elemento, tales como fosfato tricálcico [Ca3(PO4)2], fosfato de aluminio (Al3PO4) y fosfato férrico (FePO4). Los HMSP generalmente son más efectivos para la solubilización de estas fuentes fosfóricas en comparación con otros microorganismos como bacterias, microalgas y asociaciones simbióticas, p. ej. las micorrizas (Toro 2007). Además, los HMSP son más versátiles en cuanto a la adaptación a ambientes hostiles, como suelos contaminados por plaguicidas (Torres 2003).
En este tenor, cuando los HMSP se aplican al suelo como biofertilizantes, el primer reto es que se adapten a las condiciones edáficas, crezcan y se reproduzcan para lograr la solubilización de P (Chaves-Bedoya et al. 2013). Un obstáculo para estos microorganismos son los residuos de herbicidas contenidos en el suelo que, de acuerdo con su naturaleza y toxicidad, pueden inhibir el crecimiento, desarrollo y esporulación de los micromicetos (Mahakhode 2016). Además, pueden modificar la estructura de las comunidades microbianas y suprimir sus principales actividades bioquímicas, como la síntesis de aminoácidos y enzimas (Bórtoli et al. 2012).
En el sistema de producción de papaya var. Maradol (Carica papaya L.), dos de los herbicidas más empleados en la limpieza y preparación del terreno para el cultivo son el glifosato (N-fosfonometilglicina) y el 2,4-D (ácido 2,4-diclorofenoxiacético). Este último se aplica hasta que el cultivo tiene cuatro meses de edad, ya que resulta tóxico para la planta (Bogantes-Arias et al. 2010). Por otra parte, si se desea aislar y seleccionar HMSP con el objetivo de desarrollar biofertilizantes aplicables al cultivo de C. papaya, la selección de aislamientos fúngicos tolerantes al glifosato y 2,4-D es una actividad preponderante de estudio. Por lo tanto, los objetivos de este estudio fueron: 1) aislar micromicetos nativos de la rizosfera de plantas de C. papaya y caracterizar su crecimiento, esporulación y habilidad para la solubilización de Ca3(PO4)2 y FePO4 en cultivo semisólido; 2) evaluar cuantitativamente la solubilización de Ca3(PO4)2 y FePO4 en fermentación líquida, y 3) evaluar la toxicidad del glifosato y 2,4-D para el crecimiento de micromicetos aislados de la rizosfera de plantas C. papaya.
MATERIALES Y MÉTODOS
Recolección y análisis del suelo
Se recolectó suelo rizosférico (0-35 cm) de plantas de C. papaya con cuatro meses de trasplante en una parcela con al menos dos años de ausencia de aplicación de agroquímicos, ubicado en Tecomán, Colima, México (18º 51’ 41.8” N, 103º 39’ 57.5” O). El muestreo se realizó en una superficie total de 1 ha. Se recolectaron 25 muestras simples (1 kg por muestra) de suelo rizosférico en forma de zigzag a una distancia de 20 m entre cada una. Las muestras simples se agruparon y mezclaron en una muestra compuesta. Posteriormente la partición se realizó por cuarteo homogéneo, del cual se tomaron 2 kg de suelo para su caracterización física y química (Cuadro I) y aislamiento de HMSP.
CUADRO I PROPIEDADES FÍSICAS Y QUÍMICAS DEL SUELO RIZOSFÉRICO DE Carica papaya VAR. MARADOL
| Parámetro | Resultado |
| Textura | Migajón arcilloso-arenoso |
| Materia orgánica | 1.47 % |
| N-NH4 | 3.98 mg/kg |
| N total | 0.10 % |
| K | 0.47 cmol/kg |
| P | 13 mg/kg |
| C total | 1.0 |
| Relación C/N | 11 |
| pH | 7.26 |
| Humedad | 3.8 % |
| Capacidad de campo | 16.13 % |
| Capacidad de intercambio catiónico | 7.96 cmol/kg |
| Carbono orgánico | 85 % |
| Conductividad eléctrica | 0.18 mS/cm |
| Densidad aparente | 1.872 g/cm3 |
| Densidad real | 2.671 g/cm3 |
| Porosidad | 29.91 |
C: carbono, N: nitrógeno, P: fósforo, K: potasio, N-NH4: nitrógeno amoniacal
Aislamiento e identificación de micromicetos
El aislamiento de los micromicetos se realizó mediante el método de lavado de partículas de suelo descrito por Bills et al. (2004), que consiste en lavar 1 g de suelo con 3 L de agua destilada estéril sobre tres tamices (Alcon® México), uno sobre el otro, con tamaños de malla de 500, 250 y 150 µm, respectivamente. Las partículas lavadas de 150 µm se depositaron sobre un disco de papel filtro estéril por 24 h para que perdieran el exceso de humedad. Diez partículas se sembraron en agar de papa dextrosa (APD) más cloranfenicol (150 ppm). Se sembraron diez cajas de Petri en total. Las cajas se depositaron en una incubadora (Forma Scientific 3740, USA) a 25 ºC y 75 % de humedad relativa (HR). Las colonias fúngicas se purificaron por reaislamiento en APD. Los cinco aislamientos evaluados en el experimento en fermentación líquida fueron identificados a nivel de género a través de microcultivos, empleando literatura especializada (Rehner et al. 2011, Visagie et al. 2014).
Únicamente los aislamientos SP9 y SP16 fueron seleccionados para su identificación a nivel molecular, ya que poseen un adecuado crecimiento y solubilizan el Ca3(PO4)2 de manera eficiente. La producción de biomasa y la extracción de ADN se realizaron empleando la metodología de Challen et al. (1995). Las amplificaciones en reacción en cadena de la polimerasa (PCR, por sus siglas en inglés) de las regiones ITS1-5.8S-ITS2 se realizaron empleando los iniciadores (primers) ITS1 (TCCGTAGGTGAACCTGCGG) e ITS4 (TCCTCCGCTTATTGATATGC) a través de la metodología descrita por White et al. (1990). Las amplificaciones purificadas de la PCR fueron secuenciadas por el Centro de Biotecnología Genómica del Instituto Politécnico Nacional (Reynosa, Tamaulipas, México). Los análisis de las secuencias de ADN se realizaron utilizando el programa BLAST de alineación de secuencias básicas, y se compararon con la base de datos del Centro Nacional de Información Biotecnológica (NCBI 2017).
Solubilización de Ca 3 (PO 4 ) 2 y FePO 4 en medio de cultivo semisólido
La solubilización de Ca3(PO4)2 y FePO4 se evaluó en 15 aislamientos en medio de cultivo Pikovskaya-agar. Éste se preparó disolviendo (NH4)2SO4 (0.5 g), KCl (0.2 g), MgSO4•7H2O (0.1 g), MnSO4•H2O (0.004 g), NaCl (0.2 g), D-glucosa (10 g), FeSO4•7H2O (0.002 g), extracto de levadura (0.5 g) y agar (18 g) en 900 mL de agua destilada (Hernández-Leal et al. 2011). La solución se esterilizó en autoclave a 120 ºC y 125 lb de presión durante 15 min. Por separado se le añadió una solución estéril de una mezcla de Ca3(PO4)2 o FePO4 (0.5 g) y goma arábiga (0.5 g) en 100 mL de agua destilada. La mezcla de ambas soluciones se vació en cajas Petri (90 mm de Ø). La solubilización del Ca3(PO4)2 y FePO4 se evaluó mediante la detección de un halo de solubilización (Nopparat et al. 2009), para lo cual se inocularon 2 μL de una solución de 1×107 esporas/mL en el centro de las cajas de Petri con medio Pikovskaya-agar. Las cajas de Petri se incubaron a 25 ºC, 75 % de HR y 12 h luz/oscuridad (L/O), y se emplearon cuatro réplicas por aislamiento.
Variables evaluadas en cultivo semisólido
Diariamente se mideron los diámetros de la colonia y del halo de solubilización empleando una escuadra milimétrica. Cuando la colonia o el halo de solubilización llenaron la caja Petri, se finalizaron las mediciones. Con los diámetros de crecimiento de la colonia y del halo, se calcularon las tasas de crecimiento diaria de la colonia (TCDC) y del halo (TCDH) empleando la fórmula general TCD = [∑=(R1- R2)/(T1 - T2)n], donde n es el número de evaluaciones, y R1 y R2 son el crecimiento (en mm) del halo o la colonia en los tiempos T1 y T2 (en días). Con los datos del crecimiento del halo y la colonia se calculó el índice de solubilización (IS) con la formula IS = A/B, donde A es el diámetro del halo más la colonia y B es el diámetro de la colonia.
Solubilización de Ca 3 (PO 4 ) 2 y FePO 4 en fermentación líquida
Únicamente se evaluaron cinco aislamientos fúngicos originarios del experimento anterior. Los aislamientos SP9, SP11 y SP16 fueron seleccionados por presentar un considerable IS de 2.2, 5.0 y 2.5, respectivamente, en tanto que los aislamientos SP1 y SP18, fueron seleccionados por presentar un bajo IS de 1.3 y 1.6, respectivamente. El medio de cultivo Pikovskaya líquido se preparó como se describió anteriormente, sin la adición del agar. Se depositaron 120 mL del medio de cultivo en matraces Erlenmeyer (250 mL) y se esterilizaron. Posteriormente, en cada matraz se inocularon cuatro discos de micelio-agar (6 mm de Ø) de los aislamientos a estudiar. Los matraces inoculados se depositaron en una incubadora con agitación orbital a 25 ºC y 120 rpm con 12 h L/O. Cada 48 h se colectaron alícuotas de 7 mL del medio de cultivo y se filtraron en papel Whatman núm. 1. En el filtrado se cuantificaron las variables de respuesta que se describen a continuación.
Variables evaluadas en fermentación líquida
Se cuantificó el P-soluble por espectrofotometría (Luzeren®, modelo L6S, USA) a 880 nm, utilizando el método descrito por Watanabe y Olsen (1965); la cantidad de P-soluble se calculó a partir de una curva estándar con KH2PO4 (P-soluble = [absorbancia - 0.4306]/0.1188, R2 = 0.9915, p = 0.0011). El contenido de proteína total se determinó empleando el método Bradford; la absorbancia de la reacción leída en un espectrofotómetro fue de 595 nm; el contenido total de proteína total se calculó a través de una curva estándar con albumina de huevo (proteína total = (absorbancia - 0.1000)/0.009074, R2 = 0.976, p = 0.0001).
Bioensayos dosis-respuesta con glifosato y 2,4-D
Se emplearon formulaciones comerciales de los herbicidas glifosato y 2,4-D. Para el glifosato se usó el producto Rival® (Monsanto Comercial, México) con una concentración de 680 g/kg de ingrediente activo (IA). De acuerdo con la recomendación del producto, la dosis aplicada en campo es de 1836 mg de IA/L de agua (0.54 kg de producto comercial/200 L de agua/ha). Para el 2,4-D se empleó la formulación comercial Desmonte A® (SIFACTEC, México) con una concentración de 480 g/L de IA. De acuerdo con la recomendación del producto, la dosis aplicada en campo es de 3705 mg de IA/L de agua (1.5 L de producto comercial/200 L de agua/ha).
Los bioensayos dosis-respuesta se establecieron con cuatro concentraciones de cada herbicida y un testigo (sin herbicida). Las concentraciones evaluadas para el glifosato fueron de 1836, 918, 459 y 229 mg de IA/L, en tanto que para el 2,4-D fueron de 3705, 1853, 926 y 463 mg de IA/L. Las diferentes concentraciones de los herbicidas se añadieron al APD cuando éste se encontraba a una temperatura de 40 ± 5 ºC, después de esterilizado, para evitar la degradación de los herbicidas. El APD más herbicida se agitó manualmente y se vertió en cajas Petri de 90 × 15 mm de Ø a razón de 20 mL/caja. La inoculación de los aislamientos se realizó depositando en el centro de la caja Petri 5 µL de una solución de esporas a una concentración de 1 × 107 esporas/mL. Después de inocular las cajas de Petri se incubaron en las condiciones descritas anteriormente. Únicamente se evaluaron los aislamientos SP9, SP11 y SP16 por solubilizar la mayor cantidad de Ca3(PO4)2 y FePO4.
Se emplearon cinco replicas independientes por cada concentración y testigo. Diariamente se midió el diámetro del crecimiento de la colonia de los aislamientos al reverso de las cajas de Petri, empleando para ello una escuadra milimétrica. Con los diámetros, las concentraciones de herbicidas y el testigo se calculó el porcentaje de inhibición del crecimiento micelial (% ICM), con la fórmula % ICM = [(C - T)/C)] × 100, donde C es el crecimiento del testigo y T es el crecimiento correspondiente a las concentraciones de herbicidas. Además, con el % ICM se calculó la concentración letal media (CL50) de ambos herbicidas sobre los aislamientos evaluados utilizando un modelo logístico Probit.
Diseño experimental y análisis de datos
Asumiendo una homogeneidad de varianzas entre los tratamientos (prueba de Levene, p = 0.05) se realizó un análisis de varianza y una comparación de medias (empleando la mínima diferencia significativa [MDS], p = 0.05) a las variables de respuesta TCDC, TCDH, esporulación, IS del Ca3(PO4)2 y FePO4, P-soluble y contenido de proteína total. Los análisis se realizaron con el programa StatgGraphics-Plus. Para calcular la CL50 se utilizó una regresión lineal avanzada tipo Probit a través del programa SAS 8.1.
RESULTADOS Y DISCUSIÓN
Identificación morfológica y molecular de los aislamientos
Los aislamientos SP1, SP11, SP16 y SP18 correspondieron al género Penicillium, en tanto que el aislamiento SP9 correspondió al género Beauveria. Sólo los aislamientos SP9 y SP16 se sometieron a análisis molecular para su identificación a nivel especie. La secuenciación de ADN indicó que el aislamiento SP9 corresponde a Beauveria bassiana (Bals.-Criv.) (Vuill. 1912, Ascomycota: Cordycipitaceae) con el 100 % de identidad a las accesiones KC753386.1 (Landa et al. 2013), KC461113.1 y KC461106.1 (Carillo-Benítez et al. 2013), registradas en el GenBank, mientras que el aislamiento SP16 correspondió a Penicillium hispanicum (Ramírez, Martínez & Ferrer 1978, Ascomycota: Trichocomaceae) (Ramírez et al. 1978), con 99 % de identidad con la accesión NR_138307.1 (Chen et al. 2013) registrada en el GenBank.
Crecimiento fúngico y solubilización de Ca 3 (PO 4 ) 2 en placas de agar
El aislamiento SP6 mostró la TCDC más rápida con 32.9 mm/día, estadísticamente mayor (f = 4208.0, p = 0.00001) a lo observado en el resto de los aislamientos evaluados (Cuadro II). Por el contrario, los aislamientos con la TCDC más lenta fueron SP16 (Penicillium hispanicum) y SP17, con 1.6 y 2.0 mm/día, respectivamente. En cuanto a la TCDH, el aislamiento SP11 obtuvo la mayor (f = 65.46, p = 0.00001) velocidad en la formación del halo de solubilización del Ca3(PO4)2 con 38.4 mm/día. Los aislamientos SP5 (30.5 mm/día) y SP15 (28.6 mm/día) mostraron un considerable crecimiento del halo de solubilización, estadísticamente mayor al resto de los aislamientos, pero menor al obtenido con SP11. El aislamiento con menor TCDH fue SP17 con 3.5 mm/día (Cuadro II).
CUADRO II VARIABLES DE CRECIMIENTO FÚNGICO E ÍNDICE DE SOLUBILIZACIÓN (IS) DEL Ca3(PO4)2
| Aislamiento | TCDC (mm/día) | TCDH (mm/día) | IS | Esporulación (esporas/mL) |
| Penicillium sp. | 5.23 ± 0.27 g | 6.67 ± 0.10 def | 1.3 ± 0.08 g | 2.0E5 ± 2.0E4 f |
| SP2 | 13.6 ± 0.08 d | 13.3 ± 0.01 c | 1.0 ± 0.01 h | 6.7E5 ± 1.0E5 c |
| SP3 | 26.7 ± 0.10 b | NP | - | 1.4E6 ± 6.5E4 b |
| SP4 | 7.6 ± 0.18 e | 11.4 ± 0.10 cd | 1.5 ± 0.03 f | 6.0E5 ± 1.1E5 cd |
| SP5 | 4.3 ± 0.34 h | 25.0 ± 4.57 b | 5.6 ± 0.77 a | 2.6E5 ± 3.7E4 ef |
| SP6 | 32.9 ± 0.13 a | NP | - | 1.4E6 ± 1.3E5 b |
| Beauveria bassiana | 2.4 ± 0.03 i | 5.0 ± 0.10 e | 2.2 ± 0.21 d | 4.3E5 ± 5.5E4 de |
| Penicillium sp. | 7.7. ± 0.03 e | 38.4 ± 0.28 a | 5.0 ± 0.05 b | 1.7E5 ± 1.4E4 f |
| SP12 | 33.5 ± 0.14 a | NP | - | 3.0E6 ± 4.2E4 a |
| SP13 | 7.4 ± 0.03 ef | 10.0 ± 0.10 cde | 1.3 ± 0.05 g | 1.3E6 ± 6.5E4 b |
| SP14 | 4.4 ± 0.20 h | 8.9 ± 0.10 def | 2.0 ± 0.08 e | NE |
| SP15 | 17.3 ± 0.16 c | 26.67 ± 0.10 b | 0.65 ± 0.01 i | 7.0E5 ± 6.1E4 c |
| Penicillium hispanicum | 2.0 ± 0.05 ij | 5.2 ± 0.06 ef | 2.5 ± 0.08 c | 7.1E5 ± 6.5E4 c |
| SP17 | 1.6 ± 0.07 j | 3.3 ± 0.28 e | 2.0 ± 0.12 e | 5.8E5 ± 6.5E4 cd |
| Penicillium sp. | 7.0 ± 0.09 f | 11.4 ± 0.10 cd | 1.6 ± 0.02 f | 5.5E5 ± 6.1E4 cd |
Medias (± error estándar) entre filas. Letras distintas indican diferencias significativas (mínima diferencia significativa, p = 0.05, n = 4)
TCDC: tasa de crecimiento diaria de la colonia, TCDH: tasa de crecimiento diaria del halo, NP: no presentó, NE: no esporuló, SP: especie
Respecto al IS, el aislamiento SP5 obtuvo el valor más alto (f = 1016.45, p = 0.00001) con 5.6, seguido de los aislamientos SP11 (5.0) y SP16 (2.5, P. hispanicum), los cuales fueron estadísticamente menores al IS de SP5. Por otra parte, el aislamiento con menor IS fue SP15 con 0.65 (Cuadro II). En cuanto a la producción de esporas, el aislamiento con mayor esporulación (f = 115.69, p = 0.00001) fue SP12 con 3.0 × 106 esporas/mL, mientras que las cepas SP3, SP6 y SP13 mostraron una esporulación considerable con 1.4, 1.4 y 1.3 × 106 esporas/mL, respectivamente, pero fueron estadísticamente menores a la esporulación de SP12. Por el contrario, los aislamientos con menor esporulación fueron SP1 (Penicillium sp.) y SP11 (Penicillium sp.) con 2.0 y 1.7 × 105 esporas/mL, respectivamente (Cuadro II).
El IS es un parámetro cualitativo que únicamente determina si un aislamiento tiene la capacidad o no de solubilizar una fuente fosfórica (Nopparat et al. 2009). Al respecto, Hernando-Posada et al. (2013) reportaron 76 aislamientos de micromicetos con habilidad cualitativa para solubilizar Ca3(PO4)2 a través de la eficiencia relativa de solubilización (ERS), que a diferencia del IS no se multiplica por 100 para expresarse en porcentaje. Los géneros más importantes reportados para la solubilización de Ca3(PO4)2 fueron Chaetomium, Cylindrocarpon, Fusarium, Penicillium y Paecilomyces, en que los valores de ERS variaron de 100 a 529 % (este último valor no puede compararse con nuestros resultados).
En otro estudio, Yasser et al. (2014) informaron sobre la solubilización de Ca3(PO4)2 por micromicetos de suelos egipcios con valores de IS de 1.08 a 1.45, destacando las especies Aspergillus japonicus (1.45), Aspergillus niger (1.12), Penicillium expansum (1.20), Penicillium funiculosum (1.40), Penicillium variable (1.13) y Penicillium purporogenum (1.30). Recientemente, Elias et al. (2016) obtuvieron IS de 1.10 a 3.05 con aislamientos nativos de suelos etíopes, que en su mayoría fueron aislamientos de los géneros Penicillium y Aspergillus. En ambos estudios se reportaron IS menores a los obtenidos por los aislamientos SP5 (5.6) y SP11 (5.0, Penicillium sp.) del presente estudio.
Solubilización de Ca 3 (PO 4 ) 2 y producción de proteína en fermentación líquida
Se estudiaron únicamente cinco aislamientos, tres con considerable IS (Beauveria bassiana SP9, Penicillium sp. SP11 y Penicillium hispanicum SP16) y dos con bajo IS (SP1 y SP18, ambos Penicillium sp.). El cuadro III muestra los valores de P-soluble durante un periodo de seis días de cultivo. A los dos días de cultivo, en el aislamiento P. hispanicum SP16 (90.4 mg/L) se solubilizó estadísticamente (f = 36.56, p = 0.00001) la mayor cantidad de P en comparación con el resto de los aislamientos evaluados. Los aislamientos con menos solubilización de P fueron B. bassiana SP9, Penicillium sp. SP11 y Penicillium sp. SP1 con 25.8, 15.5 y 0.0 mg/L de P, respectivamente. A los cuatro días, el aislamiento P. hispanicum SP16 mostró nuevamente el mayor contenido de P-soluble (96.6 mg/L) en el extracto de cultivo, resultando estadísticamente mayor (f = 37.52, p = 0.00001) que el resto de los aislamientos. Los aislamientos B. bassiana SP9 y Penicillium sp. SP18 mostraron la menor cantidad de P-soluble con 67.9 y 73.9 mg/L, respectivamente. En el último muestreo (seis días) el aislamiento Penicillium sp. SP1 mostró un IS similar al de P. hispanicum SP16, y ambos solubilizaron estadísticamente (f = 3828.85, p = 0.00001) la mayor cantidad de P (108.5 y 106.5 mg/L), respectivamente, en tanto que las cepas B. bassiana SP9 y Penicillium sp. SP18 mostraron nuevamente los menores valores de P-soluble, con 66.2 y 62.2 mg/L, respectivamente.
CUADRO III SOLUBILIZACIÓN DE Ca3(PO4)2 Y PRODUCCIÓN DE PROTEÍNA POR MICROMICETOS AISLADOS DE LA RIZOSFERA DE Carica papaya VAR. MARADOL
| Aislamiento | P-soluble (mg/L) | Proteína total (mg/L) | |||||
| 2 d | 4 d | 6 d | 2 d | 4 d | 6 d | ||
| Testigo | 0.0 d | 0.0 d | 0.0 d | 16.5 ± 0.68 c | 18.2 ± 1.1 c | 15.9 ± 0.4 e | |
| Penicillium SP1 | 0.0 d | 78.9 ± 3.3 b | 108.5 ± 8.1 a | 17.8 ± 0.53 bc | 16.8 ± 0.1 c | 30.7 ± 0.7 d | |
| B. bassiana | 25.8 ± 0.5 c | 67.9 ± 2.4 c | 66.2 ± 5.1 c | 19.0 ± 0.12 b | 22.8 ± 1.8 b | 75.2 ± 0.1 a | |
| Penicillium SP11 | 15.5 ± 0.3 d | 81.3 ± 4.0 b | 89.3 ± 6.7 b | 18.5 ± 0.60 b | 10.8 ±0.6 d | 11.9 ± 0.3 f | |
| P. hispanicum | 90.4 ± 4.3 a | 96.6 ± 0.9 a | 106.5 ± 5.4 ab | 11.1 ± 0.50 d | 19.6 ± 0.6 c | 47.1 ± 0.2 b | |
| Penicillium SP18 | 63.4 ± 6.5 b | 73.9 ± 1.2 bc | 62.2 ± 3.3 c | 22.8 ± 0.16 a | 28.6 ± 0.5 a | 43.9 ± 0.2 c | |
Medias (± error estándar), letras distintas indican diferencias significativas (mínima diferencia significativa, p = 0.05, n = 4)
SP: especie, d: días
En cuanto a la producción de proteína total en la solubilización de Ca3(PO4)2 se encontraron diferencias significativas en las tres evaluaciones, a los dos (f = 36.56, p = 0.00001), cuatro (f = 37.52, p = 0.00001) y seis (f = 3828.85, p = 0.00001) días de cultivo (Cuadro III). La evaluación obtenida a los dos y cuatro días mostró que el aislamiento con mayor contenido de proteína fue Penicillium sp. SP18 con 22.8 y 28.6 mg/L, respectivamente. Sin embargo, al final del experimento, el aislamiento con mayor producción de proteína fue B. bassiana SP9 con 75.2 mg/L; mientras que Penicillium sp. SP11 obtuvo la menor producción de proteína con 11.9 mg/L (Cuadro III).
Los valores obtenidos de P-soluble son mayores a los reportados por Hernando-Posada et al. (2013) con las especies Paecilomyces marquandii y Cylindrocarpon didymum, las cuales solubilizaron únicamente 1.9 y 9.9 mg/L de P a los 24 días de cultivo. En otro estudio, Perea-Rojas (2013) reportó eficiente solubilización de Ca3(PO4)2 por Penicillium brevicompactun, Penicillium waksmanii y Sagenomella diversispora, que liberaron 85.0, 62.0, y 49.0 mg/L de P, respectivamente, a los 10 días de cultivo en el medio Pikovskaya. Tanto Hernando-Posada et al. (2013) como Perea-Rojas (2013) trabajaron con aislamientos nativos de la rizosfera de cafetales mexicanos (Coffea arabica).
Por otro lado, Toledo-García et al. (2013) reportaron aislamientos nativos de la rizosfera de banano (Musa sp.) con excelente habilidad para la solubilización de Ca3(PO4)2. Algunos aislamientos solubilizaron hasta 200 mg/L de P a las 120 h (cepa AT22p0). Estos valores de P son elevados, ya que usualmente se adicionan 0.5 g de Ca3(PO4)2 al medio de cultivo base, obteniéndose así aproximadamente 98.9 mg/L de P total en el medio de cultivo. Esta divergencia en la cantidad de P-soluble podría estar relacionada con la precisión en el método analítico para cuantificación de P-soluble.
Asimismo, una aportación del presente trabajo es informar sobre la habilidad de Beauveria bassiana SP9 como micromiceto solubilizador de P. Esta especie es bien conocida por ser un parásito facultativo de insectos (entomopatógeno) y saprobio del suelo (Tamayo-Mejía et al. 2015). Sin embargo, de acuerdo con los resultados obtenidos, posee una excelente habilidad para solubilizar Ca3(PO4)2. Recientemente, Gudiño-Gómez et al. (2015) realizaron un análisis de metadatos hasta marzo de 2011 empleando la plataforma de ISI Web of Knowledge, concluyendo que existen limitados reportes del género Beauveria como solubilizador de P insoluble. La única especie mencionada en la base de datos es Beauveria caledonica, que tiene la capacidad de solubilizar Zn3(PO4)2 (Fomina et al. 2004).
Por otra parte, la producción de proteína total por los aislamientos evaluados es un indicador que podría sugerir la actividad de algunas enzimas fúngicas relacionadas con la solubilización de P. Algunas de estas enzimas ya conocidas son la fosfatasa ácida y la alcalina, que están implicadas en la solubilización de fosfatos insolubles (Gómez-Guiñan 2004). Recientemente Gaind (2016) reportó que el mecanismo involucrado en la solubilización de Ca3(PO4)2 en aislamientos fúngicos es una cualidad especie dependiente; por ejemplo, Trichoderma harzianum incrementa su producción de ácido cítrico y reduce su pH en el medio de cultivo, en tanto que Aspergillus niger incrementa la actividad enzimática de fitasas y reduce su actividad de fosfatasas ácidas.
Crecimiento fúngico y solubilización de FePO 4 en placas de agar
En la TCDC de los aislamientos en medio de cultivo Pikovskaya con FePO4, se encontraron diferencias altamente significativas (f = 3582.85, p = 0.00001). El aislamiento con mayor TCDC fue SP12 con 67.6 mm/día (Cuadro IV), mientras que los aislamientos SP5, SP9 (B. bassiana), SP14, SP16 (P. hispanicum) y SP17 obtuvieron el menor crecimiento de colonia con 1.4. 1.7, 2.2, 1.8 y 1.6 mm/día, respectivamente. Por otra parte, TCDH sólo se obtuvo en el aislamientos SP9 (B. bassiana) con un promedio de 2.4 mm/día. Dicha cepa fue la única que mostró un halo de solubilización, por lo tanto, obtuvo un IS de 1.4. En términos generales, de manera cualitativa, sólo la especie B. bassiana SP9 mostró habilidad para la solubilización del FePO4. En cuanto a la esporulación, hay diferencias altamente significativas (f = 125.92, p = 0.00001) entre los aislamientos estudiados. El aislamiento con mayor esporulación fue SP12 con 3.2 × 106 esporas/mL (Cuadro IV). Por el contrario, SP18 obtuvo la menor esporulación con 2.6 × 105 esporas/mL. El resto de los aislamientos mostraron una esporulación de 3.6 × 105 a 1.2 × 106 esporas/mL.
CUADRO IV VARIABLES DE CRECIMIENTO FÚNGICO E ÍNDICE DE SOLUBILIZACIÓN DEL FePO4
| Aislamiento | TCDC (mm/día) | TCDH (mm/día) | IS | Esporulación (esporas/mL) |
| Penicillium sp. | 3.97 ± 0.01 gh | NP | - | 3.6E5 ± 3.1E4 fg |
| SP2 | 6.3 ± 0.02 e | NP | - | 8.6E5± 3.1E4 bcde |
| SP3 | 20.0 ± 0.01 c | NP | - | 7.0E5± 6.7E4 cdef |
| SP4 | 3.3 ± 0.08 h | NP | - | 1.0E6 ± 4.2E4 bcd |
| SP5 | 1.4 ± 0.02 i | NP | - | 2.6E5 ± 1.2E4 g |
| SP6 | 33.2 ± 0.2 b | NP | - | 1.0E6 ± 8.4E4 bcd |
| Beauveria bassiana | 1.7 ± 0.06 i | 2.4 ± 0.07 | 1.4 ± 0.09 | 4.0E5 ± 6.4E4 fg |
| Penicillium sp. | 4.2 ± 0.11 g | NP | - | 3.6E5 ± 3.1E4 defg |
| SP12 | 67.6 ± 1.1 a | NP | - | 3.7E6 ± 6.9E4 a |
| SP13 | 6.4 ± 0.04 e | NP | - | 1.0E6 ± 1.0E4 bcde |
| SP14 | 2.2 ± 0.07 i | NP | - | NE |
| SP15 | 9.2 ± 0.03 d | NP | - | 1.2E6 ± 5.4E4 b |
| Penicillium hispanicum | 1.8 ± 0.02 i | NP | - | 5.5E5 ± 3.5E4 efg |
| SP17 | 1.6 ± 0.07 i | NP | - | 6.1E5 ± 8.2E4 fg |
| Penicillium sp. | 5.2 ± 0.08 f | NP | - | 1.2E6 ± 5.5E4 bc |
Medias (± error estándar) entre filas con diferente literal son significativamente diferentes entre sí (mínima diferencia significativa, p = 0.05, n = 4)
TCDC: tasa de crecimiento diaria de la colonia, TCDH: tasa de crecimiento diaria del halo, IS: índice de solubilización, NP: no presentó, NE: no esporuló, SP: especie
Son limitados los reportes respecto a la solubilización in vitro de FePO4. Al respecto, Hernando-Posada et al. (2013) reportaron una ERS de 24 (Humicola sp., Chaetomium sp. y Penicillium sp.) a 353 % (Paecilomyces marquandii) en la solubilización de FePO4 por micromicetos nativos de la rizosfera de plantas de C. arabica. En otro estudio, Vitorino et al. (2012) aislaron microorganismos nativos de la rizosfera de Hyptis marrubioides y encontraron microorganismos capaces de solubilizar FePO4, reportando IS de 0.3 (RG12) a 8.4 (RG8). Es bien sabido que el Fe2+ del FePO4 puede resultar tóxico para los microorganismo (Illmer y Buttinger 2006), de ahí la complejidad bioquímica de este compuesto para la solubilización.
Solubilización de FePO 4 y producción de proteína en fermentación líquida
En el medio de cultivo Pikovskaya líquido con FePO4 no se encontró P-soluble a los dos y cuatro días de evaluación. Sin embargo, el día seis se encontraron valores de P-soluble. Los resultados indicaron que el aislamiento con mayor solubilización de FePO4 fue P. hispanicum SP16 con 39.6 mg/L (Cuadro V), en tanto que la cepa con menor solubilización de FePO4 fue Penicillium sp. SP18, con 18.1 mg/L. Por su parte, los aislamientos B. bassiana SP9 y Penicillium sp. SP11 no mostraron solubilización en ninguna de las evaluaciones. En cuanto a la producción de proteína, a los dos días de evaluación el aislamiento con mayor producción de proteína (f = 145.08, p = 0.0001) fue Penicillium sp. SP11 con 52.0 mg/L, en tanto que B. bassiana SP9 (5.1 mg/L) y P. hispanicum SP16 (6.0 mg/L) obtuvieron los valores más bajos. Sin embargo, a los cuatro y seis días el aislamiento B. bassiana SP9 obtuvo la producción más alta de proteína con 70.5 mg/L (f = 871.49, p = 0.00001) y 105.2 mg/L (f = 421.66, p = 0.0001), respectivamente.
CUADRO V SOLUBILIZACIÓN DE FePO4 Y PRODUCCIÓN DE PROTEÍNA POR MICROMICETOS AISLADOS DE LA RIZÓSFERA DE Carica papaya VAR. MARADOL
| Aislamiento | P-soluble (mg/L) | Proteína total (mg/L) | |||||
| 2 d | 4 d | 6 d | 2 d | 4 d | 6 d | ||
| Testigo | 0 | 0 | 0 | 9.2 ± 0.9 d | 11.8 ± 0.5 b | 10.7 ± 0.6 b | |
| Penicillium SP1 | - | - | 27.0 ± 2.9 b | 18.2 ± 1.7 b | 2.9 ± 0.2 c | 6.3 ± 0.2 c | |
| B. bassiana | - | - | - | 5.1 ± 0.6 e | 70.5 ± 2.0 a | 105.2 ± 6.4 a | |
| Penicillium SP11 | - | - | - | 52.0 ± 2.9 a | ND | 4.8 ± 0.6 c | |
| P. hispanicum | - | - | 39.6 ± 5.4 a | 6.0 ± 0.6 e | 12.4 ± 0.9 b | 9.6 ± 0.01 b | |
| Penicillium SP18 | - | - | 18.1 ± 1.1 c | 13.8 ± 0.7 c | 12.9 ± 0.6 b | 9.7 ± 0.5 b | |
Medias (± error estándar), letras distintas indican diferencias significativas (mínima diferencia significativa, p = 0.05, n = 4)
SP: especie, d: días
La producción de proteína es una variable bioquímica en la fermentación microbiana. El contenido de proteína en los extractos de cultivo es un indicador de una buena actividad bioquímica de los hongos solubilizadores de P (Babu et al. 2015). El contenido total de proteína de una fermentación donde se incluye P insoluble (p. ej., Ca3[PO4]2 o FePO4) para su mineralización, es común que se relacione con la actividad de enzimas específicas, especialmente con las fosfatasas (ácida y alcalina) y fitasas, liberadas por los hongos en el metabolismo secundario de manera extracelular (Khan et al. 2014). Por otra parte, algunos iones metálicos como el Fe2+ pueden causar un estrés oxidativo en organismos fúngicos, provocando lisis celular o incrementando la actividad de algunas enzimas relacionadas con la defensa (p. ej., lacasas fúngicas), lo que podría repercutir en un aumento de la producción de proteína total (Illmer y Buttinger 2006, Gomaa y Momtaz 2015).
Por otra parte, la solubilización de FePO4 ha sido poco estudiada en comparación con la de Ca3(PO4)2, debido a que químicamente es más compleja. Al respecto, Paixao-Resende et al. (2014) reportaron aislamientos del género Trichoderma nativos de la rizosfera de Calophyllum brasiliense, capaces de solubilizar FePO4; sin embargo, los valores de P-soluble fueron bajos, en un rango de 5.13 a 6.09 mg/L. Recientemente, Ramos-dos Santos et al. (2015) reportaron microorganismos fúngicos aislados de la rizosfera de C. brasiliense con habilidad para la solubilización de FePO4. Los aislamientos fúngicos denominados PSF8 y PSF4 mostraron la solubilización más baja y alta con 1.18 y 3.78 mg/L, respectivamente. Ambos estudios reportaron valores bajos de P-Soluble en comparación con Penicillium sp. SP1 (27.0 mg/L) y P. hispanicum SP16 (39.6 mg/L) a los seis días de cultivo. Sin embargo, es necesario seguir evaluando ambos aislamientos con el objetivo de optimizar la solubilización de FePO4 a través de diseños experimentales más robustos y precisos que involucren un mayor número de variables.
Bioensayos dosis-respuesta con glifosato y 2,4-D
La figura 1 muestra el crecimiento acumulado de los aislamientos B. bassiana SP9, Penicillium sp. SP11 y P. hispanicum SP16 con diferentes concentraciones de glifosato y 2,4-D. Con glifosato, B. bassiana SP9 redujo su crecimiento en un rango de 4.1 a 29.5 % (f = 15.50, p = 0.0001) en las concentraciones evaluadas (Cuadro VI). Esta reducción puede observarse en las concentraciones de 918 y 1836 mg/L (Fig. 1A). Penicillium sp. SP11 mostró un patrón poco común, ya que la concentración más baja de glifosato (229 mg/L) indujo un mayor crecimiento micelial de la colonia respecto al testigo (Fig. 1C), en tanto que las concentraciones de 229 y 459 mg/L no inhibieron ni estimularon el crecimiento del aislamiento; por el contrario, las dos concentraciones más altas del herbicida redujeron (f = 44.20, p = 0.00001) el crecimiento del hongo en 4.6 (918 mg/L) y 14.4 % (1836 mg/L, Cuadro VI), sugiriendo que las concentraciones elevadas de este herbicida pueden ser tóxicas para este aislamiento. Este mismo comportamiento se observó con P. hispanicum SP16 (Fig. 1E), cuyo crecimiento acumulado se redujo (f = 92.71, p = 0.00001) en presencia de las dos concentraciones más altas de glifosato (918 mg/L [4.3 %] y 1836 mg/L [20.2 %]).
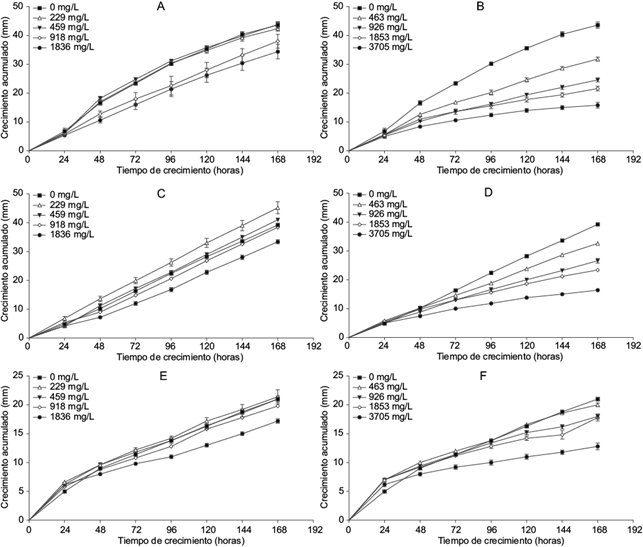
Fig. 1 (A y B) Crecimiento acumulado de Beauveria bassiana con diferentes concentraciones de glifosato y 2,4-D, respectivamente; (C y D) igual que A y B para Penicillium SP11; (E y F) igual que A y B para Penicillium hispanicum
CUADRO VI PORCENTAJE DE INHIBICIÓN DEL CRECIMIENTO MICELIAL (% ICM) DE TRES MICROMICETOS AISLADOS DE LA RIZOSFERA DE PAPAYA CON DIFERENTES CONCENTRACIONES DE GLIFOSATO Y 2,4-D
| Aislamiento | Glifosato (mg/L) | |||
| 229 | 459 | 918 | 1836 | |
| B. bassiana | 4.1 ± 0.4 b | 2.8 ± 0.3 b | 20.8 ± 0.6 a | 29.5 ± 4.8 a |
| Penicillium SP11 | 0 | 0 | 4.6 ± 0.1 b | 14.4 ± 0.2 a |
| P. hispanicum | 0 | 0 | 4.3 ± 0.1 b | 20.2 ± 0.3 a |
| Aislamiento | 2,4-D (mg/L) | |||
| 463 | 926 | 1853 | 3705 | |
| B. bassiana | 29.2 ± 0.4 d | 45.5 ± 0.4 c | 52.0 ± 0.4 b | 62.9 ± 0.4 a |
| Penicillium SP11 | 14.9 ± 1.2 d | 31.0 ± 1.7 c | 36.9 ± 1.1 b | 56.0 ± 0.6 a |
| P. hispanicum | 0 | 13.8 ± 1.9 c | 21.3 ± 3.9 b | 37.2 ± 1.9 a |
Medias (± error estándar), letras distintas indican diferencias significativas (mínima diferencia significativa, p = 0.05, n = 4)
SP: especie
En cuanto al 2,4-D, B. bassiana SP9 (Fig. 1B) y Penicillium sp. SP11 (Fig. 1D) mostraron una reducción en el crecimiento micelial acumulado con las cuatro diferentes concentraciones del herbicida. La dosis más alta (3705.0 mg/L) inhibió significativamente (62.9 %, f = 67.36, p = 0.00001) el crecimiento de B. bassiana SP9 (Cuadro VI). Para Penicillium SP11 la concentración más alta (3705.0 mg/L) redujo significativamente (56.0 %, f = 191.12, p = 0.00001) el crecimiento de la colonia. En P. hispanicum SP16 la concentración más baja (463.0 mg/L) no redujo el crecimiento acumulado de la colonia. Sin embargo, al final de estudio, la concentración más alta de 2,4-D disminuyó significativamente (37.2 %, f = 191.12, p = 0.00001) el crecimiento de P. hispanicum SP16 (Fig. 1F, Cuadro VI).
Es de suma importancia conocer la capacidad de los HMSP para tolerar el estrés por herbicidas contenidos en el suelo, y una aproximación para ello son los estudios in vitro. El presente estudio sugiere que el glifosato es menos fungitóxico para los HMSP nativos de la rizosfera de C. papaya, ya que ninguna de las concentraciones evaluadas presentó más del 50 % de inhibición en el crecimiento micelial, lo cual sugiere una baja susceptibilidad al glifosato. En estudios previos, Zain et al. (2013) evaluaron la susceptibilidad del glifosato en Mucor sp., Penicillium sp. y Aspergillus sp. en concentraciones de 440, 880 y 1760 mg/L, reportando inhibiciones de 85 a 100 % para las tres especies evaluadas. En otro estudio, Eman et al. (2013) reportaron inhibiciones in vitro del 36.3 y 42.8 % al exponer a Aspergillus sp. (FDCZ2) y Penicillium sp. (CGCZ3), respectivamente, a concentraciones de 300 mg/L.
Por el contrario, algunos hongos microscópicos del suelo pueden incrementar su producción de biomasa en condiciones in vitro por efecto la aplicación de concentraciones de glifosato. Tal es el caso de Aspergillus sp., que incrementa en 26.09 y 21.74 % su crecimiento micelial al exponerse a 50 y 100 ppm de glifosato, respectivamente (Eman et al. 2013). En otro estudio, Barberis et al. (2013) reportaron que el glifosato incrementa significativamente el crecimiento de Aspergillus flavus en diferentes porcentajes, dependiendo de la concentración del herbicida, siendo más evidente el incremento en concentraciones de 5 y 10 mM.
En cuanto al 2,4-D, éste redujo más del 50 % el crecimiento micelial de los aislamientos SP9 y SP11 a la concentración más alta, lo cual indica que el aislamiento SP16 es menos susceptible a este herbicida. El 2,4-D es tóxico para la mayoría de los hongos; sin embargo, algunos son capaces de emplear al herbicida como fuente de carbono, entre ellos los géneros Aspergillus, Fusarium y Penicillium sp. (Bukowska 2006). Al respecto, Silva et al. (2007) reportaron que Penicillium sp. es capaz de degradar al herbicida hasta en un 29.8 %. En otro estudio más reciente, Ferreira-Guedes et al. (2012) reportaron un 31.0 % en la inhibición del crecimiento de Penicillium chrysogenum por 2,4-D a una concentración de 1000 mg/L. Sin embargo, P. chrysogenum logró degradar hasta un 18.0 % el herbicida.
Aún se desconoce cuáles son los mecanismos por los cuales los hongos incrementan o disminuyen su tasa de crecimiento y producción de biomasa ante el estrés ocasionado por los herbicidas glifosato y 2,4-D. Estas respuestas son individuales, dependen de cada especie y pueden variar dependiendo de su susceptibilidad al herbicida. Por ejemplo, el glifosato actúa bloqueando la enzima 5-enolpiruvil shikimmato-3-fosfato sintetasa (EPSPS, por sus siglas en inglés) e inhibiendo la ruta del ácido shikímico, tanto en plantas como en hongos, lo que da como resultado la reducción de la síntesis de aminoácidos aromáticos como fenilalanina, tirosina y triptófano (Anderson y Kolmer 2005). Sin embargo, numerosos hongos son capaces de metabolizar la molécula de glifosato mostrando un incremento de biomasa en los medios de cultivo con el herbicida (Carranza et al. 2014).
En cuanto al 2,4-D, se conoce muy poco sobre el mecanismo específico de acción. Este herbicida actúa a nivel celular sobre las auxinas y provoca cambios que producen daños en la planta. La molécula se enlaza al receptor del ácido indolacético (AIA) y activa genes en la célula, desencadenando respuestas secundarias como epinastia, elongación celular, cierre de estomas y reducción en la producción de etileno (Song 2014). Recientemente, Chanclud y Morel (2016) describieron la síntesis de fitohormonas por organismos fúngicos, mencionando que tanto los hongos micorrízicos y microscópicos de suelo como las bacterias poseen el mismo precursor (indol-3-acetamina) para la producción de AIA, a través de una misma ruta metabólica. Por lo tanto, este precursor tanto en organismos fúngicos como en bacterias podría ser inhibido por el 2,4-D, dando como resultado una reducción en la producción de biomasa, como se observó en el presente estudio. Sin embargo, para aclarar los mecanismos de acción, se requieren estudiar a futuro las respuestas fisiológicas (metabolómica) y enzimáticas de los hongos a los herbicidas glifosato y 2,4-D.
Concentración letal media (CL 50 )
El aislamiento B. bassiana SP9 es más susceptible al glifosato (CL50 = 2748 mg/L) comparado con los aislamientos SP11 (CL50 = 7560.0 mg/L) y SP16 (CL50 = 5376 mg/L). Es decir, requiere menor concentración de glifosato para que inhibir el 50 % de su crecimiento micelial, en comparación con SP11 y SP16. Sin embargo, las CL50 encontradas con el modelo Probit para los tres aislamientos estudiados son altas en relación con la concentración de glifosato aplicado en campo (1836 mg/L); esto significa que los tres aislamientos son tolerantes a este herbicida (Cuadro VII). Respecto al 2,4-D, los valores de CL50 para SP9, SP11 y SP16 fueron de 3248.0, 4450.0 y 3256.0 mg/L, respectivamente. Los tres aislamientos poseen estadísticamente la misma CL50, si se toman en cuenta los traslapes de los intervalos de confianza. Únicamente SP11 posee un valor de CL50 mayor que la dosis aplicada en campo del 2,4-D (3705 mg/L), por lo tanto, SP11 es el aislamiento más tolerante entre los evaluados.
CUADRO VII CONCENTRACIÓN LETAL MEDIA (CL50) DE LOS HERBICIDAS GLIFOSATO Y 2,4-D EN TRES MICROMICETOS SOLUBILIZADORES DE P AISLADOS DE LA RIZOSFERA DE Carica papaya
| Aislamiento | Glifosato | ||||
| CL50 (mg/mL) | IC (mg/mL) | Modelo Probit | χ 2 | p > χ 2 | |
| B. bassiana | 2748.0 a | 2215.0 - 3704.0 | Y = -2.4489X + 0.7121 | 69.1 | 0.0001 |
| Penicillium SP11 | 7560.0 b | 5202.0 - 13687.0 | Y = -2.7658X + 0.7131 | 62.4 | 0.0001 |
| P. hispanicum | 5376.0 b | 4648.0 - 6450.0 | Y = -7.0260X + 1.8834 | 221.6 | 0.0001 |
| Aislamiento | 2,4-D | ||||
| CL50 (mg/mL) | IC (mg/mL) | Modelo Probit | χ 2 | p > χ 2 | |
| B. bassiana | 3248.0 a | 2716.0 - 4086.0 | Y = -6.0225X + 1.7150 | 193.08 | 0.0001 |
| Penicillium SP11 | 4450.0 a | 3545.0 - 6297.0 | Y = -9.7345X + 2.6682 | 78.56 | 0.0001 |
| P. hispanicum | 3256.0 a | 2811.0 - 4017.0 | Y = -11.533X + 3.2833 | 101.61 | 0.0001 |
Letras diferentes muestran diferencias significativas de acuerdo con el traslape de los intervalos de confianza
IC: intervalo de confianza al 95 %, SP: especie
La CL50 es un parámetro empleado para determinar la toxicidad de un contaminante sobre microorganismos fúngicos. Recientemente Zaller et al. (2014) dieron a conocer que el glifosato reduce de 50 a 56 % la colonización de Trifolium repens por micorrizas arbusculares. Por otra parte, Joshi y Gupta (2012) reportaron que una concentración de 138.0 mg/L de 2,4-D inhibió el crecimiento del 50 % de la población total de hongos microscópicos filamentosos de un suelo de la India. Recientemente, el efecto fungicida del 2,4-D fue confirmado por Mahakhode (2016), quien informó que el herbicida posee efectos negativos fuertes sobre Oomycetos, Zygomycetes y Ascomycetes. Aunque no se calculó la CL50, el autor sugiere que el 2,4-D posee efectos letales a partir de 1000 mg/L en micromicetos.
CONCLUSIONES
Las características físicas y químicas del suelo y la rizosfera del cultivo de papaya var. Maradol permiten albergar micoflora benéfica, en especial hongos microscópicos solubilizadores de Ca3(PO4)2. Sólo Penicillium sp. SP1 y Penicillium hispanicum SP16 solubilizaron al 100 % el Ca3(PO4)2. Los micromicetos aislados no fueron capaces de solubilizar eficientemente el FePO4. A este respecto, únicamente el aislamiento Penicillium hispanicum SP16 solubilizó un 39 % del FePO4 contenido en el medio de cultivo. Además, por la presión de selección de plaguicidas aplicados al cultivo de C. papaya, específicamente por los herbicidas glifosato y 2,4-D, el aislamiento más tolerante a ambos herbicidas fue Penicillium hispanicum SP16. Por lo tanto, este aislamiento es candidato a emplearse en estudios de campo para evaluar su efectividad en la promoción del crecimiento vegetal en C. papaya, como un biofertilizante microbiano de origen nativo.











 nueva página del texto (beta)
nueva página del texto (beta)


