INTRODUCCIÓN
En la producción hortícola y en la agricultura en general, una de las prácticas de mayor costo es la fertilización inorgánica, que reduce las utilidades del productor y a la vez induce la contaminación y degradación de los suelos por el excesivo uso de estos insumos. Se ha observado que las aplicaciones continuas de fertilizantes en suelos cultivados de manera intensiva originan disminución de materia orgánica y de actividad biológica, así como un desbalance nutrimental (Ndiaye et al. 2000, Sharma et al. 2012). Además, la práctica de fertilización química origina contaminación agroecológica, ya que es ineficiente: se estima que sólo del 10 a 40 % de los fertilizantes aplicados son utilizados por la planta y el 60 a 90 % se pierden o lixivian (Barlog y Grzebisz 2004, Grageda-Cabrera et al. 2012).
Por lo anterior, es necesario desarrollar tecnologías que permitan mejorar la productividad de los cultivos, mitigar efectos adversos en el suelo, disminuir la tasa de uso de fertilizantes químicos y aumentar las ganancias por área cultivada (Adesemoye y Kloepper 2009). No obstante, es importante que las nuevas tecnologías cumplan con el criterio de agricultura sostenible a través del manejo racional de los recursos disponibles. Todo ello mediante el uso de prácticas ecológicamente sanas, que satisfagan las necesidades de producción, contribuyan a la economía y mantengan los recursos naturales en equilibrio. La fertilización biológica representa una práctica que encaja en ese contexto (Hamel y Strullu 2006, Roldán et al. 2006, Grageda-Cabrera et al. 2012).
La fertilización biológica es un concepto general que se basa en la utilización de insumos naturales (bioinoculantes y materiales orgánicos) y que acarrea beneficios desde las perspectivas económica, social y ambiental. Con la sensibilidad ecológica y económica que ha surgido recientemente, el empleo de fertilizantes biológicos se ha incrementado de manera considerable en los últimos años (Carvajal-Muñoz y Mera-Benavides 2010, Xiang et al. 2012). Adesemoye y Kloepper (2009) enfatizaron la necesidad de optimizar la fertilización inorgánica a través de asociaciones microorganismo-planta eficientes. Dentro de estas asociaciones, los hongos micorrícicos arbusculares (HMA) aportan beneficios a las plantas durante la simbiosis, como la promoción del crecimiento, mayor nutrición mineral (Carpio et al. 2005), tolerancia a patógenos del suelo (Tahat et al. 2010) y a condiciones abióticas adversas (Davies et al. 2002, Rabie 2005), e incremento de la productividad (Carpio et al. 2005, Rabie 2005). Esto, aunque el nivel de colonización micorrícica no siempre esté asociado con el rendimiento o sus componentes (Sylvia et al. 1993, Allen et al. 2001). Otra opción viable es utilizar abonos orgánicos, ya que tienen el potencial de ser una fuente de nutrimentos económica y de gran eficacia en la nutrición de los cultivos. La descomposición o mineralización de cualquier abono orgánico una vez incorporado al suelo es afectada por diversos factores como humedad, temperatura, aireación, tipo de material orgánico, cantidad aplicada y tipo de suelo, entre otros (Eghball et al. 2002, Flores-Margez et al. 2007). Dentro de los abonos orgánicos, los estiércoles gallinaza y porqueraza son los más ricos desde el punto nutrimental y de mayor liberación de nutrimentos en el primer año (Hue y Silva 2000).
En particular, la combinación de HMA y gallinaza no ha tenido un efecto sinérgico o aditivo en cultivos hortícolas (Becerra et al. 2004, Rojas y Ortuño 2007). Además, diferentes estudios han demostrado la reducción de la fertilización química en cultivos hortícolas mediante la adición de abonos orgánicos o inoculantes con hongos micorrícicos (Macías-Duarte et al. 2012, Meneses et al. 2014, Vázquez-Santiago et al. 2014, Díaz-Franco et al. 2016). Por lo anterior, el objetivo del presente estudio fue investigar la influencia de la gallinaza y la micorriza arbuscular, en combinación con la mitad del fertilizante inorgánico, en el cultivo de calabacita (Cucurbita pepo L.) y pepino (Cucumis sativus L.).
MATERIALES Y MÉTODOS
Descripción del sitio experimental
El estudio se inició en el ciclo otoño-invierno de 2014 en terrenos del Campo Experimental Río Bravo del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias ubicado en Río Bravo, Tamaulipas (25º 57’ N, 98º 01’ O, 30 masl). Se tomaron muestras de suelo en presiembra de los primeros 30 cm de profundidad para analizar sus propiedades físicas y químicas (Cuadro I). El pH se determinó en solución acuosa (1:2), la conductividad eléctrica (CE) con el porcentaje de saturación, la materia orgánica (MO) se midió con dicromato de potasio, el N inorgánico (NO3-N) se determinó mediante ácido salicílico, el P disponible se midió con el método de Olsen y el K intercambiable con acetato de amonio (Plenecassange et al. 1999).
Manejo experimental
Los híbridos utilizados fueron “Summer Squash” de calabacita y “Poinsett 76” de pepino. Ambos cultivos se sembraron en dos hileras de plantas en camas de 1.6 × 30 m, con distancia entre plantas de 0.6 m. El riego se realizó a través de un sistema de goteo con mangueras como líneas regantes superficiales y goteros espaciados cada 30 cm, con goteo individual de 8 L/h. Los riegos se aplicaron cuando los tensiómetros indicaron 20 centibares (aproximadamente tres riegos por semana). En cada cama se distribuyeron los siguientes tratamientos: 1) fertilización química (FQ) convencional: 120-90-00 para calabacita y 140-90-00 para pepino (Masabni 2010); 2) inoculación de semilla con el hongo micorrícico arbuscular Rhizophagus intraradices (Schenk and Smith) Walker and Schubler (Sin. Glomus intraradices Schenk and Smith) (micorriza INIFAP, 0.5 kg/ha) + 50 % FQ; 3) gallinaza, 3 t/ha + 50 % FQ; y 4) testigo absoluto. El P (superfosfato triple de calcio) y la mitad de N (urea) se aplicaron en presiembra y la otra mitad de N (nitrato de calcio) se aplicó mediante cintilla en prefloración. La gallinaza procesada y deshidratada (Meyfer® [04.64 % N total, 5.42 % P, 3.13 % K, 338 mg/kg Cu, 6588 mg/kg Fe, 799 mg/kg Mn, 568 mg/kg Zn, 42.1 % M.O.]), se incorporó en la parte central de las camas y previo al riego de presiembra. El hongo micorrícico R. intraradices (con ≥ 60 esporas/g) se inoculó en la semilla a razón de 0.5 kg/ha (Díaz-Franco et al. 2016). Otras prácticas agronómicas se siguieron según las recomendaciones de Masabni (2010). Para evaluar el rendimiento de fruto se marcaron cuatro subparcelas de 1.6 × 5 m por tratamiento en cada cultivo.
Análisis de la información
Se estimó el rendimiento acumulado, para lo cual se hicieron ocho cortes para calabacita cada 2-3 días, iniciando el 26 de mayo, y 10 cortes semanales para pepino, a partir del 28 de mayo. El rendimiento comparativo entre los tratamientos se determinó mediante la prueba t de Student (p ≤ 0.05). Además, se calculó la rentabilidad con las siguientes expresiones algebraicas basadas en la teoría económica: CT = Px X, donde CT representa los costos totales de producción, Px el precio del insumo o actividad y X la actividad o insumo; IT = Py Y, donde IT son los ingresos totales, Py el precio del producto y Y el rendimiento del cultivo. La utilidad bruta es la diferencia entre los ingresos totales y los costos totales de producción (Samuelson y Nordhaus 2009, Ayala et al. 2014). Como indicador económico de rentabilidad se utilizó el modelo beneficio-costo, que determina los beneficios obtenidos por cada peso invertido en la producción mediante la expresión B/C = IT/CT (Terrones y Sánchez 2011, Ugalde et al. 2011).
RESULTADOS Y DISCUSIÓN
Los resultados del rendimiento acumulado de fruto en los tratamientos de calabacita indicaron que donde se utilizó la gallinaza o la inoculación micorrícica en combinación con la mitad del fertilizante químico, la producción fue semejante a la obtenida con la aplicación del 100 % de la fertilización química, tratamientos que promediaron 18.2 t/ha, y fueron superiores al testigo absoluto (Fig. 1; Cuadro II).
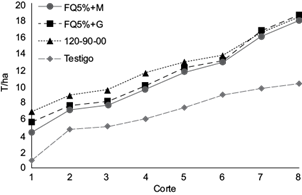
Fig. 1 Rendimiento acumulado de calabacita con la mitad del fertilizante químico y micorriza arbuscular (FQ50 % + M), la mitad del fertilizante químico y gallinaza (FQ50 % + G), y fertilización química convencional (120-90-00)
CUADRO II RENDIMIENTO DE FRUTO (T/HA) Y RENTABILIDAD (B/C) DE CALABACITA Y PEPINO CON FERTILIZACIÓN BIOLÓGICA Y QUÍMICA
| Tratamiento | Calabacita | Pepino | |||
| T/ha | B/C* | T/ha | B/C | ||
| Rhizophagus intraradices (M) + FQ 50 % | 18.0 a | 2.1 | 70.2 b | 8.1 | |
| Gallinaza (G) + FQ 50 % | 18.5 a | 1.9 | 77.5 a | 7.8 | |
| FQ 100 % | |||||
| 120-90-00 | 18.3 a | 2.0 | -- | ||
| 140-90-00 | -- | 67.4 b | 7.2 | ||
| Testigo | 10.2 b | 1.3 | 48.0 c | 6.2 | |
B/C: beneficio/costo, FQ: fertilización química.
*Gallinaza: $1600/t; micorriza: $40/ha; FQ 100 % en calabacita: $5,795.77/ha; FQ 100 % en pepino: $6,091.13/ha; precio medio rural de calabacita y pepino: $4000/t. Letras diferentes indican diferencias significativas (p ≤ 0.05).
Una respuesta similar se observó en el pepino. Los resultados de 10 cortes demostraron que los mayores rendimientos de fruto se registraron con gallinaza más la mitad de la fertilización química (77.2 t/ha), seguidos de forma semejante por la inoculación de R. intraradices y la fertilización al 100 %, tratamientos que promediaron 68.8 t/ha y fueron estadísticamente semejantes (Fig. 2; Cuadro II). En un estudio con pepino producido en condiciones de casa malla, Meneses et al. (2014) reportaron rendimientos similares entre la fertilización tradicional (165-60-90) comparada con la aplicación de 5 t/ha de lombricomposta, inoculación de R. intraradices y el 50 % del fertilizante, que en promedio fueron de 77.0 t/ha.
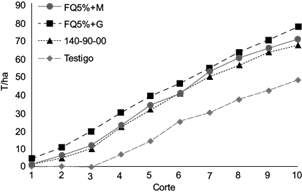
Fig. 2 Rendimiento acumulado de pepino con la mitad del fertilizante químico y micorriza arbuscular (FQ50 % + M), la mitad del fertilizante químico y gallinaza (FQ50 % + G), y fertilización química convencional (140-90-00)
Los resultados del presente estudio coinciden con lo informado en investigaciones anteriores para cultivos hortícolas, y confirman el hecho de que con la mitad de la fertilización química más la inoculación micorrícica o la adición de gallinaza se alcanzan rendimientos óptimos, comparables o superiores a los obtenidos con la fertilización tradicional. Los rendimientos obtenidos con la fertilización química completa se han igualado con la mitad del fertilizante mineral combinada con R. intraradices o gallinaza (3 t/ha) en cebolla (Allium cepa L.) y papa (Solanum tuberosum L.) (Becerra et al. 2004, Rojas y Ortuño 2007), o con bioinoculantes en pepino (Vázquez-Santiago et al. 2014). En chile jalapeño (Capsicum annuum L.), Macías-Duarte et al. (2012) informaron que el rendimiento con la adición de 5 t/ha de gallinaza más 80 kg/ha de N fue de 65.2 t/ha, mientras que con la dosis convencional de 150-150-00 se obtuvieron 43.3 t/ha. Sharma et al. (2011) reportaron el máximo rendimiento de trigo (Triticum aestivum L.) con la inoculación de R. intraradices y el 75 % de N-P-K adicionado al suelo. Carpio et al. (2005) indicaron que las mejores características para el mercado de Ipomoea carnea fistulosa (Mart. ex Choisy), así como la mayor absorción de N-P-K ocurrió tanto con el inoculante BioterraPLUS® y la adición de 50 % de los tres elementos N-P-K en el suelo, como con la fertilización al 100 %. Igualmente, en sorgo (Sorghum bicolor Moench), maíz (Zea mays L.) y alfalfa (Medicago sativa L.), se ha determinado que la fertilización biológica puede ser competitiva con la fertilización mineral (López-Martínez et al. 2001, Flores-Margez et al. 2007, Díaz-Franco et al. 2015). Hue y Silva (2000) y Carvajal-Muñoz y Mera-Benavides (2010) señalaron que, no obstante que los abonos orgánicos tienen menor cantidad de nutrimentos, en comparación con los fertilizantes inorgánicos, la disponibilidad de dichos elementos es más constante durante el desarrollo del cultivo por la mineralización gradual a que están sometidos.
Por otro lado, Jeffries et al. (2003) y Adesemoye y Kloepper (2009) indicaron que los hongos micorrícicos tienen la capacidad de promover el desarrollo y crecimiento de las plantas, debido a que mejoran la disponibilidad y la absorción de los nutrimentos, así como la sanidad de las plantas. Xiang et al. (2012) han destacado que los inoculantes microbianos, además del efecto benéfico en la productividad agrícola, tienen gran relevancia en los agroecosistemas debido a que pueden reducir el uso de la fertilización mineral y su consecuente contaminación del entorno. Otro aspecto importante del uso de inoculantes microbianos en los cultivos es el hecho de que se pueden reducir las emisiones de N2O asociadas con la aplicación de fertilizantes nitrogenados (Calvo et al. 2013).
El análisis económico indicó que el rendimiento de fruto de calabacita y la rentabilidad de la producción (beneficio-costo) con los tratamientos de fertilización biológica más la mitad de la fertilización química, fue similar (1.9-2.1) al de la fertilización completa (FQ 100 %) (2.0). En pepino, el rendimiento con la combinación de gallinaza más la mitad del fertilizante químico superó a la fertilización completa y a la inoculación con R. intraradices más la mitad del fertilizante, aunque la mayor relación beneficio-costo se obtuvo con la combinación entre la mitad del fertilizante más R. intraradices, que registró un beneficio-costo de 8.1 (Cuadro II). Durante los últimos años se ha acrecentado comercialmente el empleo de bioinoculantes, entre los cuales revisten gran importancia aquellos que tienen efectividad en los cultivos y son viables económicamente (Grageda-Cabrera et al. 2012, Sharma et al. 2012, Xiang et al. 2012).
CONCLUSIONES
La fertilización química convencional en calabacita y pepino se pudo sustituir mediante la inoculación con R. intraradices o gallinaza (3 t/ha) y la mitad de la fertilización química. Este manejo, además de ser más amigable con el ambiente, igualó la rentabilidad de la producción respecto a la fertilización química en calabacita; en pepino, la mayor rentabilidad se obtuvo con el inoculante micorrícico y la mitad de la fertilización química.











 nueva página del texto (beta)
nueva página del texto (beta)


