Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.25 no.2 Ciudad de México may. 2009
Optimización del proceso de obtención enzimática de azúcares fermentables a partir de aserrín de pino
Optimization of the process for the enzymatic production of fermentable sugars obtained from pine sawdust
Javier LÓPEZ–MIRANDA1,2, Nicolás O. SOTO–CRUZ1, Olga M. RUTIAGA–QUIÑONES1, Hiram MEDRANO–ROLDÁN1 y Katiuska ARÉVALO–NIÑO2
1 Instituto Tecnológico de Durango, Felipe Pescador 1830 Ote., Col. Nueva Vizcaya, Durango, Dgo., México, Correo electrónico: jlopez@itdposgrado-bioquimica.com.mx
2 Universidad Autónoma de Nuevo León.
Recibido enero 2007
Aceptado octubre 2008
RESUMEN
Con el propósito de aprovechar un recurso que en la actualidad es un desecho contaminante generado durante el aserre de la madera en Durango, México, se probaron los métodos de pretratamiento alcalino, ácido y explosión con vapor a temperatura de autoclave, para realizar la hidrólisis enzimática de aserrín de pino obtenido de tres aserraderos de la ciudad de Durango y recuperar los azúcares contenidos en él. Se encontró que el pretratamiento con NaOH a 120 °C proporciona mejores resultados que los tratamientos con ácido sulfúrico diluido y por explosión con vapor a 121 °C. Se optimizó el pretratamiento alcalino por el método de superficie de respuesta. Los resultados muestran que la concentración óptima de azúcares reductores, con un valor de 48 %, se obtuvo después de un pretratamiento con 8 % de NaOH durante 85 minutos a 120 °C, a un pH de hidrólisis de 4.5, durante 240 h, con una carga enzimática de 25 UPF/g de carbohidratos totales. Por comparación con los resultados reportados en la literatura, se encuentra que el procedimiento obtenido es susceptible de ser utilizado para el aprovechamiento de este recurso.
Palabras clave: hidrólisis enzimática, aserrín de pino, pretratamiento, azúcares fermentables.
ABSTRACT
This paper discusses the use of an industrial residue to reduce the pollution produced at sawmills in Durango, Mexico. Pine sawdust was alkali, acid and vapor pretreated in order to make an enzymatic hydrolysis of the sawdust coming from three different sawmills in the city of Durango and therefore recover the fermentable sugar present in the sawdust. The alkaline pretreatment at autoclave temperature of 120 °C delivers the best results compared to the sulfuric acid pretreatment and steam explosion at 121 °C. The alkaline pretreatment was optimized by the use of the surface response method. The results show that the highest sugar yield (48 %) happened with a concentration of 8 % NaOH at 120 °C for 85 min and at a hydrolysis pH of 4.5 for 240 h, with an enzyme concentration of 25 FPU/g of total carbohydrates. The results show that the method used may be applied to take advantage of the sawdust.
Key words: enzymatic hydrolysis, pine sawdust, pretreatment, fermentable sugars.
INTRODUCCIÓN
El aserrín es un producto altamente estable con escasas alternativas de uso; su acumulación constituye un serio problema de contaminación en los suelos en que se deposita (Starbuck 1997). El aserrín puede causar enfermedades como asma, bronquitis crónica y otros problemas respiratorios asociados con alergias (Malström et al. 1999); también puede causar dermatitis, cánceres pulmonares, gastrointestinales y nasales (Seguros de Texas 2004). Tradicionalmente se ha usado la combustión como alternativa para reducir la acumulación, pero su quema, además de ser ilegal, contribuye a la emisión a la atmósfera de más de 200 compuestos orgánicos potencialmente peligrosos (Wolfang et al. 1998), tales como hidrocarburos aromáticos policíclicos (HAP), que son potencialmente mutagénicos y carcinogénicos (Ramdahl y Becher 1982, Claessens et al. 1987).
Por otra parte, tanto el aserrín como los demás desperdicios de la explotación de las maderas suaves pueden ser utilizados como materia prima para la producción de etanol combustible y otros químicos (Palonen et al. 2004) por ser los materiales lignocelulósicos dominantes en el hemisferio norte (Galbe y Zacchi 2002). En México, la industria del aserrío genera alrededor de 0.35 m3 de aserrín de pino por m3 de madera (SEMARNAP 2000), lo cual representa en promedio 206,000 m3 al año (INEGI 2008). Considerando que su densidad promedio es de 500 kg/m3 (Valencia 1999), esta producción equivale a 103,000 ton anuales, a partir de los cuales se podría obtener alrededor de 33x106 L de etanol combustible. No obstante, la mayor limitante para la producción de etanol combustible a partir de aserrín es la recuperación de los azúcares que contiene y ésta a su vez está determinada por el procedimiento de hidrólisis que se utilice (ácido o enzimático). El procedimiento enzimático está limitado por la presencia de lignina y la cristalinidad de la celulosa (Millet y Baker 1975, Kent y Chang 1981, Marten et al. 1996, Åkerholm y Salmén 2001 y 2002, McLean et al. 2002, Schell et al. 2003), por ello se han venido utilizando diversos procedimientos de pretratamiento, entre los que destacan el alcalino, el ácido y la explosión con vapor (Schultz y Burns 1990, Marten et al. 1996, Åkerholm y Salmén 2001 y 2002). Cada uno produce cambios particulares en las materias primas; así, el pretratamiento con ácido diluido hidroliza principalmente a las hemicelulosas, dejando una estructura porosa formada principalmente por celulosa y lignina, la cual es más accesible a la acción de las enzimas (Wyman 1994). La explosión con vapor rompe la estructura del material y aumenta la accesibilidad de la celulosa al ataque enzimático (Bender 1979, Shimizu et al. 1994, Gregg y Saddler 1996) y el pretratamiento con hidróxido de sodio (NaOH) rompe los enlaces lignina–carbohidrato, retira parte de la lignina y de las hemicelulosas, abre las estructuras del material, incrementa el área interfacial y reduce el grado de polimerización y cristalinidad de la celulosa, favoreciendo su sacarificación enzimática (Tuor et al. 1995). De acuerdo con Wyman et al. (2005), la biomasa lignocelulósica deberá ser pretratada para elevar los rendimientos; no obstante, este es uno de los pasos más costosos, de manera que deberá prestársele particular atención a fin de ganar ventaja de esta operación. En 1977, Martínez et al. encontraron que es posible producir cambios muy similares en la composición química del sustrato lignocelulósico durante el pretratamiento, utilizando diferentes combinaciones de las principales variables de operación (temperatura, tiempo y concentración). Por lo anterior, el presente trabajo tiene como objetivo identificar y optimizar las condiciones de pretratamiento e hidrólisis enzimática del aserrín de pino, con el propósito de utilizar un material considerado un contaminante potencialmente riesgoso, como materia prima para la obtención de azúcares fermentables susceptibles de ser utilizados en la producción de etanol combustible.
MATERIALES Y MÉTODOS
Muestreo y caracterización de la materia prima
Las muestras fueron colectadas de tres aserraderos de la ciudad de Durango, tamizadas con un tamaño de partícula comprendido entre las mallas 20 y 40 y almacenadas a temperatura ambiente. Se determinó por cuadruplicado su contenido de humedad (norma TAPPI T 258 om–89), extraíbles (TAPPI T 204 om–88), cenizas (TAPPI T 211 om– 85) y lignina (TAPPI T 222 om–88). El contenido de carbohidratos totales se obtuvo por cálculo (100–humedad–extraíbles–cenizas–lignina).
Selección del método de pretratamiento
El aserrín se extrajo durante 24 h con etanol al 95 %, se lavó con agua destilada, se secó a 70 °C durante 24 h y se almacenó a temperatura ambiente. Se probaron los métodos de pretratamiento con NaOH, H2SO4 y explosión con vapor. El material pretratado se sometió a hidrólisis enzimática, utilizando para ello un preparado comercial, Celluclast 1.5 L proporcionado por Novozym de México. Se determinó el contenido de azúcares reductores en el hidrolizado por el método de Miller (1959). Los resultados se multiplicaron por 0.9 para corregir el agua añadida a la molécula durante la hidrólisis de la celulosa. Se calculó el porcentaje de sacarificación respecto a los azúcares potencialmente hidrolizables (ecuación 1). Las condiciones experimentales se muestran en la figura 1. Se utilizó el diseño experimental 2K factorial, con k igual a 3 para los pretratamientos ácido y alcalino, e igual a 2 para el pretratamiento por explosión con vapor. Todos los experimentos se realizaron por duplicado. Los resultados se analizaron por el procedimiento de ANOVA y las mejores condiciones de pretratamiento se identificaron por el método estadístico de la diferencia mínima significativa (LSD). Las mejores condiciones de pretratamiento e hidrólisis obtenidas para cada uno de los procedimientos probados se compararon entre sí mediante la prueba de t para muestras dependientes (Montgomery 1991). Se seleccionó el mejor procedimiento y se optimizó por el método de superficie de respuesta (Montgomery 1991, Soto–Cruz et al. 1999, Ge et al. 2002). Los resultados se analizaron con el software Statistica 5.5 de Statistics Inc.
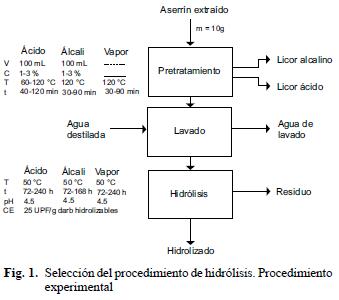
RESULTADOS Y DISCUSIÓN
Caracterización química de la materia prima
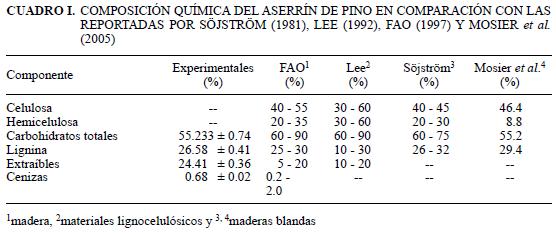
La composición química del aserrín (Cuadro I) es similar a la reportada por FAO (1997) para madera, Lee (1992) para materiales lignocelulósicos y Söjström (1981) y Mosier et al. (2005) para madera blanda. Las diferencias encontradas dependen del tipo de biomasa, el lugar de crecimiento, los fertilizantes usados, el tiempo de cosecha y las condiciones de almacenamiento (de Boer y den Uil 1997).
Selección del método de pretratamiento
El análisis de varianza de los resultados de la hidrólisis enzimática del aserrín de pino pretratado con NaOH (Cuadro II) mostró que las variables probadas y sus interacciones (con excepción de la interacción tiempo de pretratamiento–tiempo de hidrólisis) influyen significativamente (p<0.05) sobre los rendimientos de hidrólisis. El método de la diferencia mínima significativa (LSD) muestra que es posible obtener rendimientos de hidrólisis similares bajo condiciones diferentes de pretratamiento e hidrólisis y que las condiciones de pretratamiento que produjeron el mejor rendimiento (33.2624±0.24 %) son 3 % de NaOH, 90 minutos de pretratamiento a 121 °C y 168 h de hidrólisis a un pH de 4.5 con una carga enzimática de 25 UPF/g de celulosa potencial (Cuadro II). Este rendimiento es 1.5 veces menor que el reportado por Soto et al. (1994) para cascarilla de girasol pretratada con 0.5 % de NaOH, a 120 °C durante 90 minutos, e hidrolizada con Celluclast suplementada con Novozym 188, para una carga enzimática de 25 UPF/g de celulosa. Por otra parte, es 1.75 veces menor que la reportada por Latif et al. (1994), quienes pretrataron pasto Kallar con NaOH al 2 % a 121 °C e hidrolizado con un concentrado enzimático obtenido de Clostridium thermofillus; la hidrólisis se efectuó a 60 °C durante 90 h. Adicionalmente, es 1.85 veces mayor que la reportada por estos mismos autores para el mismo sustrato sometido a las mismas condiciones de pretratamiento, pero hidrolizado con un concentrado enzimático obtenido de una cepa autóctona de Trichoderma. reesei (cepa VTT–D–79125).
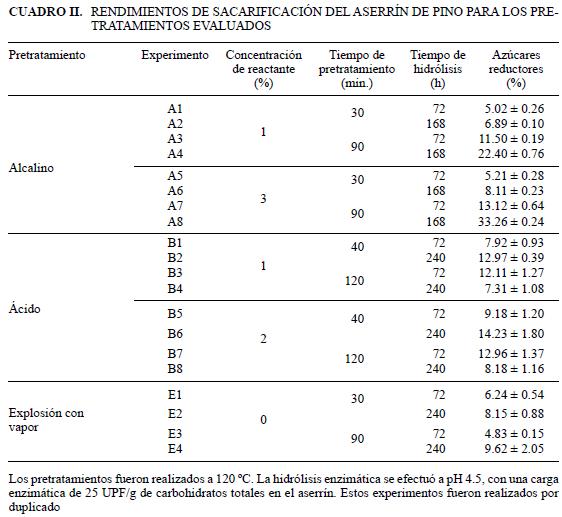
Para el pretratamiento con H2SO4, el análisis de varianza muestra que el tiempo de hidrólisis (th) y las interacciones (concentración de H2SO4, tiempo de pretratamiento [tp] y concentración de H2SO4, tiempo de pretratamiento, tiempo de hidrólisis) influyen significativamente (p<0.05) sobre los rendimientos de azúcar. La comparación entre tratamientos dentro de este grupo (LSD, p<0.05) señala que los mejores resultados (9.59±0.39 %) se obtuvieron para las siguientes condiciones de hidrólisis: H2SO4 = 2 %, tp = 40 min a 121 °C y th = 240 h, pH = 4.5, con una carga enzimática de 25 UPF/g de celulosa potencial. Este rendimiento es dos veces menor que el reportado por Saha et al. (2005) para cascarilla de arroz pretratada durante 1 h a 121 °C con H2SO4 al 1 %, hidrolizada con una mezcla de enzimas comerciales (Celluclast y Novozym 188), adicionadas con Twen 80, a pH 5.0, durante 72 h. A su vez, es 5.5 veces menor que la obtenida de la hidrólisis de desperdicios de papel pretratado con 1.1 % de H2SO4 a 160 °C por 10 minutos, con 10 g/L de un concentrado enzimático de T. reesei (con una potencia de 0.184 FPU/mg), adicionada con Tween 80 y Tween 20 como surfactantes (Wu y Kwang 1998). Kadam et al. (2004) pretrataron rastrojo de maíz con H2SO4 a 50 °C y obtuvieron una concentración de glucosa de 52 % en el material pretratado. Por otra parte, Rosgard et al. (2006) hidrolizaron paja de cebada pretratada por explosión con vapor a 170 °C, después de haberla humectado con H2SO4 al 1% (v/v), con una mezcla de Celluclast y Novozym 188, obteniendo una conversión de 95 % en 6 h y de casi el 100 % después de 48 h de hidrólisis. Estas diferencias pueden atribuirse al tipo de sustrato o a las diferentes condiciones utilizadas durante la experimentación, aunque es definitivo que la composición del preparado enzimático y la presencia de surfactantes afectan benéficamente a la sacarificación enzimática (Wu y Kwang 1988). El pretratamiento con ácido sulfúrico remueve a las hemicelulosas de manera casi completa e incrementa el rendimiento de la glucosa proveniente de la hidrólisis enzimática de la celulosa (Wyman et al. 2005); sin embargo, es claro que la eficacia del método depende del material a hidrolizar, así como de las condiciones del pretratamiento y la hidrólisis. Podemos decir que para el aserrín de pino, en las condiciones probadas, el pretratamiento con ácido diluido es poco efectivo para hidrolizar la celulosa que contiene.
Para el pretratamiento por explosión con vapor, el análisis de varianza muestra que los tratamientos probados y su interacción producen resultados estadísticamente diferentes. La comparación entre tratamientos del mismo grupo (LSD, p<0.05) muestra que el rendimiento máximo (17.87±1.49 %) de azúcares reductores se obtuvo para un tiempo de pretratamiento de 90 minutos a 121 °C y un tiempo de hidrólisis de 240 h, a un pH de 4.5, con una carga enzimática de 25 UPF/g de celulosa potencial. Palmarola et al. (2004) reportan que la hidrólisis de una mezcla de fibra de la industria de almidón (libre de almidón) con 5 % de agua desionizada y calentada a temperaturas entre 110–210 °C durante 20 y 60 minutos (pretratada por explosión con vapor), e hidrolizada con Celluclast 1.5 L y Ultraflo L de Novozyme, a pH de 5 durante 48 h, a 200 rpm, produjo rendimientos dos veces mayores que para el aserrín de pino en 48 h de hidrólisis. Es claro que un rendimiento del 17.87 % sigue siendo bajo, por lo que el procedimiento de explosión con vapor utilizado no es recomendable para el procesamiento del aserrín de pino.
Es importante mencionar que los contenidos de lignina en el material pretratado son muy parecidos a los del aserrín sin tratar (26.58±0.37 %) y que la máxima deslignificación se obtuvo para el pretratamiento con NaOH al 1 %, mientras que la concentración máxima de azúcares reductores se obtuvo para el pretratamiento con NaOH al 3 %. Lo anterior hace suponer que las modificaciones ocurridas en el material pretratado tienen una influencia mayor sobre los rendimientos de sacarificación que el contenido mismo de lignina.
Selección del método de pretratamiento
Como puede observarse, los rendimientos obtenidos durante la hidrólisis enzimática del aserrín de pino pretratado con NaOH fueron 3.5 veces mayores que los logrados por el tratamiento con H2SO4 y 1.86 veces mayores que el obtenido por el procedimiento por explosión con vapor. La comparación estadística de los rendimientos máximos de hidrólisis se hizo con la prueba de t para muestras dependientes, y se encontró que son estadísticamente diferentes (p>0.05), por lo cual se eligió al pretratamiento con NaOH para su optimización.
Optimización del proceso de hidrólisis enzimática del aserrín de pino pretratado con NaOH
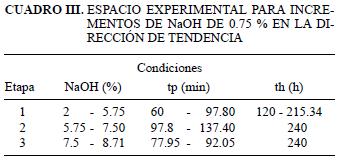
Para la definición del espacio experimental se determinaron las tendencias de optimización mediante un ajuste lineal de los resultados (ecuación 1), las cuales están especificadas por las ecuaciones 2 y 3. El espacio experimental explorado se obtuvo para incrementos de la concentración de NaOH de 0.75 % en la dirección de tendencia (Cuadro III).
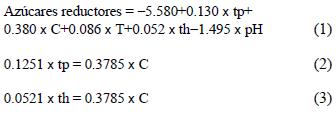
donde, tp es tiempo de pretratamiento; th, tiempo de hidrólisis; C, concentración de NaOH, y pH, potencial de hidrógeno.
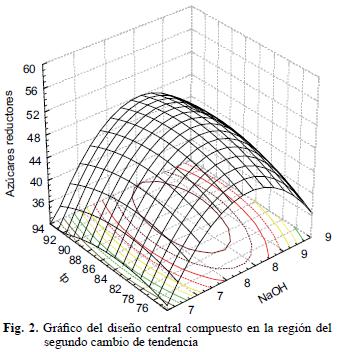
El experimento se realizó en dos etapas. El análisis de varianza de la primera etapa mostró que la temperatura de hidrólisis dejó de tener influencia significativa después de 240 °C; por ello, la segunda se realizó a temperatura constante (240 °C). Los resultados de esta última mostraron que los rendimientos de hidrólisis son muy parecidos entre sí para las condiciones probadas, por lo que se procedió a la realización de un experimento final mediante un diseño central compuesto en la región definida en la segunda etapa. Los resultados de ésta se presentan en la figura 2, donde se muestra que la producción óptima de azúcares reductores (48 %) fue obtenida para una concentración de NaOH del 8 % y un tiempo de pretratamiento de 87 minutos a 120 °C, con un tiempo de hidrólisis 240 h, a pH de 4.5 y una carga enzimática 25 UPF/g de celulosa. Los resultados obtenidos en el presente trabajo fueron superiores a los reportados por Lee et al. (1995), quienes pretrataron madera por explosión con vapor a 121°C durante 3 min, para obtener un rendimiento de glucosa de 4 %; tales resultados son muy similares a los reportados por Yang et al. (2002) para astillas de madera pretratada con 0.4 % de NaOH a 60 °C, y cuyos rendimientos obtenidos fueron de 45 % respecto al material pretratado y ligeramente inferiores (2 %) a los reportados por Latif et al. (1994) para pasto Kallar. Lo anterior permite afirmar que bajo las condiciones especificadas, este material puede ser utilizado como materia prima para la obtención de ácidos orgánicos, pigmentos y etanol combustible. No obstante, las condiciones de pretratamiento obtenidas en el presente trabajo son más severas que la mayoría de las reportadas en la literatura, por ello es recomendable buscar la reutilización del hidróxido de sodio, a fin de mejorar la viabilidad económica del proceso y eliminar las cargas contaminantes que produciría su descarga al ambiente.
CONCLUSIONES
El pretratamiento alcalino es el que más favorece a la hidrólisis enzimática, ya que produce los rendimientos más altos de azúcares reductores. Con este pretratamiento se obtiene un rendimiento de sacarificación 134 % mayor que con el pretratamiento con ácido sulfúrico y 246 % mayor que el de explosión con vapor. La optimización del tratamiento alcalino por el método de superficie de respuesta mostró que las condiciones optimas son: tiempo de pretratamiento de 85 minutos, concentración de NaOH al 8 %, temperatura de pretratamiento de 120 °C, tiempo de hidrólisis de 240 h. Bajo estas condiciones se obtuvo un rendimiento de 48 % de azúcares reductores respecto a los azúcares potencialmente hidrolizables. Estos resultados permitirán el desarrollo de una tecnología para el aprovechamiento del aserrín de pino en la generación de un combustible alterno para la industria automotriz y eliminarán un contaminante del suelo potencialmente riesgoso para la salud de los habitantes del bosque, al igual que la necesidad de quemarlo a cielo abierto para disponer de él.
AGRADECIMIENTOS
El presente trabajo fue financiado por el COSNET (Clave del proyecto: 2458–P). JLM agradece al CONACyT–México por la beca otorgada para los estudios de doctorado y a Novozyme–México por proveer el complejo enzimático utilizado.
REFERENCIAS
Akerholm M. y Salmen L. (2001). Interactions between wood polymers studied by dynamic FT–I spectroscopy. Polymer 42, 963–969. [ Links ]
Akerholm M. y Salmen L. (2002). Dynamic FTIR spectroscopy for carbohydrate analysis of wood pulps. J. Pulp Pap. Sc. 28, 245–249. [ Links ]
Bender R. (1979). [ Links ] EUA Patent, 4136297.
Claessens H.A. y Lammerts van Bueren L.G.D. (1987). An off–line two–dimensional analytical procedure for the determination of polycyclic aromatic hydrocarbons in smoke aerosol. J. High Res. Chromatog. 10, 342–347. [ Links ]
De Boer A.J. y Den Uil H. (1997). An evaluation of three routes for the production of liquid fuels from biomass. Fuel Energ. Abstr. 38, 326–326. [ Links ]
EPA (1998). Introduction to: CERCLA and EPCRA Release Reporting Requirements (CERCLA  103 and EPCRA
103 and EPCRA  304). [ Links ]
304). [ Links ]
Galbe M. y Zacchi G. (2002). A review of the production of ethanol from softwood. Appl. Microbiol. Biotechnol. 59, 618–628. [ Links ]
Ge Y., Ni Y., Yan H., Chen Y. y Cai T. (2002). Optimization of the supercritical fluid extraction of natural vitamin E from wheat germ using response surface methodology. J. Food Sci. 67, 239–243. [ Links ]
Gregg D. y Saddler J. N. (1996) A technoeconomic assessment of the pretreatment and fractionation steps of a biomass–to–ethanol process. Appl. Biochem. Biotech. 57/58, 711–727. [ Links ]
Hamelinck C.N., van Hooijdonk G., Faaij A. (2005). Etanol from lignocellulosic biomass: techno–economic performance in short–, middle– and long term. Biomass Bioenerg. 28, 384–410. [ Links ]
Holtzapple M.T. y Davison R.R. (1999). Methods of biomass pretreatment. [ Links ] USA Patent. 5865898.
INEGI (2008). Agenda Estadística de los Estados Unidos Mexicanos. http://www.inegi.gob.mx/prod_serv/contenidos/espanol/bvinegi/productos/integracion/pais/agenda/2008/Agenda_2008.pdf Consultado: octubre 16, 2006. [ Links ]
Kirk T.K. y Chang H.M. (1981). Potential applications of bio–lignilolytic systems. Enz. Microb. Technol. 3, 189–196. [ Links ]
Lee J. M. (1992). Biochemical engineering. Prentice Hall, Nueva Jersey, 321 pp. [ Links ]
Latif F., Rajoka M.I. y Malik K.A. (1994). Saccharification of Leptochloa fusca (Kallar grass straw) using thermostable cellulases. Biores. Technol. 30, 107–111. [ Links ]
Malström K., Savolainen J. y Terho E. O. (1999). Allergic alveolitis from pine sawdust. Allergy 54, 526–533. [ Links ]
Marten M.R., Velkovska S., Khan S.A. y Ollis D.F. (1996). Rheological, mass transfer, and mixing characterization of cellulase–producing Trichoderma reesei suspensions. Biotechnol. Prog. 12, 602–611. [ Links ]
Martínez J.M., Reguant J., Montero M.A., Montané D., Salvadó J. y Farriol X. (1997). Hydrolytic pretreatment of softwood and almond shells. Degree of polymerization and enzymatic digestibility of cellulose. Ind. Eng. Chem. Res. 36, 688–696. [ Links ]
McLean B.W., Boraston A.B., Brouwer D., Sanaie N., Fyfe C.A.,Warren R., Kilburn D.G. y Haynes C.A. (2002). Carbohydrate–binding modules recognize fine substructures of cellulose. J. Biol. Chem. 277, 50245–50254. [ Links ]
Miller G. L. (1959). Use of dinitrosalicylic acid reagent for determination of reducing sugars. Anal. Chem. 31, 426–428. [ Links ]
Millet M.A., Baker A.J. y Satter L.D. (1975). Pretreatments to enhance chemical, enzymatic, and microbiological attack of cellulosic materials. Biotechnol. Bioeng. Symp. 5, 192–219. [ Links ]
Montgomery D.C. (1991). Diseño y análisis de experimentos. Editorial Iberoamericana. México, 704 pp. [ Links ]
Mosier N., Wyman C., Dale B., Elander R., Lee Y.Y., Holtzapple M. y Ladisch M. (2005). Features of promising technologies for pretreatment of lignocellulosic biomass. Biores. Tech. 96, 673–686. [ Links ]
Palonen H., Tjerneld F., Zacchi G. y Tenkanen M. (2004). Adsorption of Trichoderma reesei CBH I and EG II and their catalytic domains on steam pretreated softwood and isolated lignin. J. Biotechnol. 107, 65–72. [ Links ]
Ramdahl T. y Becher G. (I982). Characterization of polynuclear aromatic hydrocarbon derivatives in emissions from wood and cereal straw combustion. Anal. Chim. Acta 144, 83–91. [ Links ]
Saha B.C., Iten L.B., Cotta M.A., y Wu V.Y. (2005). Dilute acid pretreatment, enzymatic saccharification, and fermentation of rice hulls to ethanol. Biotechnol. Prog. 21, 816–822. [ Links ]
SEMARNAP (2000). Guía forestal. Secretaría del Medio Ambiente Recursos Naturales y Pesca, México, D. F. 105 pp. [ Links ]
Shimizu K., Sudo K., Ono H., Ishihara M. y Fujii T. (1994). Total utilization of wood components by steam explosion pretreatment. Trans. Mater. Res. Soc. Jpn. 18A, 491–496. [ Links ]
Schell D.J., Farmer J., Newman M. y McMillan J.D. (2003). Dilute–sulfuric acid pretreatment of corn stover in pilot–scale reactor. Appl. Biochem. Biotech. 105, 69–85. [ Links ]
Seguros de Texas (2004). Peligros y Control del Aserrín. División de Compensación para Trabajadores (TDI/DWC). Pub No. HS98–134B (9–04). Austin, Texas. [ Links ]
Sjöström E. (1981). Wood chemistry: Fundamentals and Applications. Academic Press, San Diego California, 293 pp. [ Links ]
Soto–Cruz Ó., Saucedo–Castañeda G., Pabls–Hach J.L., Gutiérrez–Rojas M. y Favela–Torres E. (1999). Effect of substrate composition on mycelial growth of Pleurotus ostreatus. An analysis by mixture and response surface methodologies. Proc. Biochem. 35, 127–133. [ Links ]
Starbuck, C. (1997). Producción y uso de composta de aserrín de avena y estiércol. III Simposium Internacional y IV Reunión Nacional de Agricultura Sostenible. Universidad de Guadalajara, 16 a 19 de Noviembre, Guadalajara Jalisco, 96 pp. [ Links ]
TAPPI (1991). Fibrous materials and Pulp Testing T1–T270, Paper and Paperboard Testing T400–T550. Vol. 1. Technical Association of the Pulp and Papes Industry. TAPPI Press, Norcross, Georgia. [ Links ]
Tuor U.,Winterhalter K. y Fiechter A. (1995). Enzymes of white–rot fungi involved in lignin degradation and ecological determinants for wood decay. J. Biotechol. 411, 1–17. [ Links ]
Valencia S. y López F. (1999). Variación de la densidad de la madera dentro y entre árboles de Pinus rudis Endl., en Sierra Las Alazanas, Arteaga, Coah. Foresta–AN. Nota Técnica No. 1. Universidad Autónoma Agraria Antonio Narro. Saltillo, Coah. 17 pp. [ Links ]
Wyman C.E. (1994). Ethanol from lignocellulosic biomass: technology, economics, and opportunities. Biores. Tech. 50, 3–15. [ Links ]
Yang B., Boussaid A., Mansfield S., Gregg D.J. y Saddler J.N. (2002). Fast and efficient alkaline peroxide treatment to enhance the enzymatic digestibility of steam–exploded softwood substrates. Biotechol. Bioeng. 77, 678–684. [ Links ]














