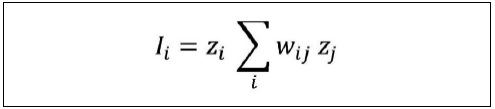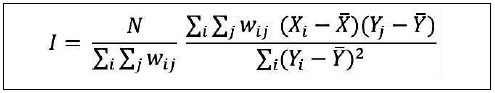INTRODUCCIÓN
Las neoplasias malignas constituyen una de las causas de mortalidad más importantes a nivel mundial, con aproximadamente 9 millones de casos diagnósticados y más de 10 millones de defunciones en 2020. Se trata de un amplio grupo de dolencias que afectan a cualquier parte del organismo, caracterizándose por una multiplicación rápida de células anormales que, escapando a los sistemas de control orgánicos, se extienden más allá de sus límites habituales y pueden invadir tejidos contiguos o propagarse a otros distantes (Ferlay et al., 2020). Según la clasificación internacional de enfermedades (CIE), las neoplasias malignas se clasifican de C00 a D48 (OPS, 2003).
Las neoplasias malignas son producto de la transformación a lo largo de varias etapas de células normales en células tumorales desde una lesión precancerosa a un tumor maligno, como resultado de la interacción entre factores genéticos y una serie de factores externos ambientales: carcinógenos físicos, como las radiaciones ultravioletas e ionizantes; carcinógenos químicos, como el amianto, tabaco en cigarros o substancias en alimentos, como aflatoxinas, y carcinógenos biológicos, como virus, bacterias y parásitos. Otro factor importante es el envejecimiento (Martínez, 2019), debido a una acumulación de factores de riesgo en combinación con la pérdida de eficacia de los mecanismos de reparación celular.
En mujeres las neoplasias malignas de mama y cuello de útero tienen particular importancia: a nivel mundial, el cáncer de mama (clasificación CIE-10: C-50) fue el más diagnosticado en mujeres y el primero en número de muertes (2.26 millones de nuevos casos y 685 mil defunciones en 2020). Se consideraba como un cáncer propio de los países más desarrollados, realidad que se halla en proceso de cambio, ya que en 2015 el 52% de los diagnósticos y 62% de muertes se producían en países en vías de desarrollo (De Santis et al., 2015). En cambio, el cáncer de cuello de útero (clasificación CIE-10: C-53) presenta cifras menores, siendo el cuarto entre mujeres, y con una distribución espacial más desequilibrada, en 2018 hubo 570,000 nuevos casos y unas 311 mil muertes (Ferlay et al., 2020), siendo más frecuente en los países menos desarrollados.
En México las tasas brutas de mortalidad (TBM) por cáncer se han incrementado de 59.3 por cien mil en 2000, a un 70.4 por cien mil en 2015 (en mujeres de 60 a 70.1, respectivamente). En mujeres, el primer puesto lo ocupó el cáncer de mama, con 7 mil 816 muertes, 16.4% del total y en cuarto lugar, el de cuello de útero, con 4 mil 211 defunciones (8.5%), ambos suponen casi 25% de las muertes. Sus dinámicas y patrones espaciales de distribución son diferentes. El cáncer de mama se asocia tradicionalmente a niveles superiores de renta y educación, siendo más altas sus TBM en Ciudad de México y norte del país. Este cáncer muestra una tendencia creciente: TBM en 2000 de 7 por cien mil a 10.2 por cien mil en 2020. En cambio, las TBM de cáncer de cuello de útero han declinado de 9.1 en 2000 a un 6.25 por cien mil en 2020, siendo más frecuente en el sur y sureste del país (INEGI, 2021a).
En México las TBM de CM son más elevadas son en el norte del país (Baja California, Coahuila, Chihuahua, Jalisco, San Luís Potosí, Sinaloa y Sonora) en tanto que las más bajas son en el sur (Campeche, Chiapas y Oaxaca), siguiendo un patrón espacial gradual que se repite con factores socioeconómicos (Castrezana, 2017). Las neoplasias de cuello de útero están asociadas indirectamente a situaciones de pobreza y rezago educativo, al influir en la difusión del virus del papiloma humano (VPH), principal causa de esta neoplasia (Vall Llossera et al., 2001). En México las TBM son en general superiores en los estados con menor desarrollo socioeconómico, como Chiapas o Nayarit, con una tendencia creciente de los estados del norte y noroeste hacia los de sur y sureste, asimismo afecta en mayor medida a mujeres de zonas rurales (Castrezana, 2017).
Las enfermedades, infecciosas o no, presentan una distribución generalmente desigual sobre el espacio, por lo que cae dentro de los posibles campos de investigación de la ciencia geográfica, que tiene por objeto básico el análisis de la localización, distribución y relaciones de fenómenos con dimensión espacial (Martonne, 1973). El estudio de la distribución geográfica y asociación espacial de enfermedades y otros temas relacionados con la salud recibe la denominación de epidemiología espacial. Esta subdisciplina de la geografía se preocupa de la descripción, cuantificación y explicación de las variaciones geográficas de las enfermedades, su relación con posibles factores de riesgo, y detectar conglomerados anómalos de incidencia y mortalidad (Pina et al., 2010).
El análisis espacial, métodos cuantitativos y geoestadísticos del tipo del análisis exploratorio de datos espaciales (AEDE) permiten descubrir y delimitar las zonas más afectadas por cierta enfermedad y ponerlas en relación con las características poblacionales y factores de riesgo de tipo socioeconómico, ambiental y demográfico (Cuadros et al., 2021). La identificación de estas zonas puede evidenciar poblaciones en situación de riesgo y revelar los factores relacionados con la persistencia y expansión de la enfermedad, facilitando la toma de decisiones y aplicación de políticas de tratamiento y prevención.
Objetivo
Las neoplasias malignas presentan un reto para la salud pública de todos los países. En México su impacto es creciente, al encontrarse en una fase de la transición demográfica prácticamente completa en camino de un régimen demográfico moderno de incipiente envejecimiento. Para las mujeres los cánceres de mama y cuello de útero suponen una especial amenaza al suponer un 25% de las muertes por cáncer.
En este contexto, en los últimos años han aparecido estudios del CM y de CCU con una perspectiva geográfica y con aplicación de análisis espacial, fundamentalmente mediante correlaciones bivariadas con los factores de riesgo (sobre todo socioeconómicos). Los estudios versan sobre el CM con mayor frecuencia (Bermudi et al., 2020) y sobre el CCU en mucha menor medida. Los trabajos son más frecuentes en países en vías de desarrollo como Brasil (Azevedo et al., 2019; Bermudi et al., 2020). En el caso de México hay estudios con dimensión espacial de estas patologías a escala nacional para el cáncer de mama (Castrezana, 2017) y a nivel de estado para CM en el estado de Jalisco (Ramos-Herrera et al., 2020) y de CCU en el estado de San Luís Potosí (Terán et al., 2016).
Por ello, el objetivo de este trabajo es determinar la distribución espacial de las TBM por CM y CCU en la Megalópolis del Centro de México para el periodo 2013-2020 mediante técnicas de AEDE como el análisis de clúster y correlaciones bivariadas entre los patrones espaciales de las TBM con factores de tipo demográfico, socioeconómico y educativo. Se utiliza el nivel de desagregación municipal para detectar y delimitar áreas más afectadas y causas, de forma que puedan darse elementos orientados a medidas de intervención.
MATERIALES Y MÉTODOS
Zona de estudio
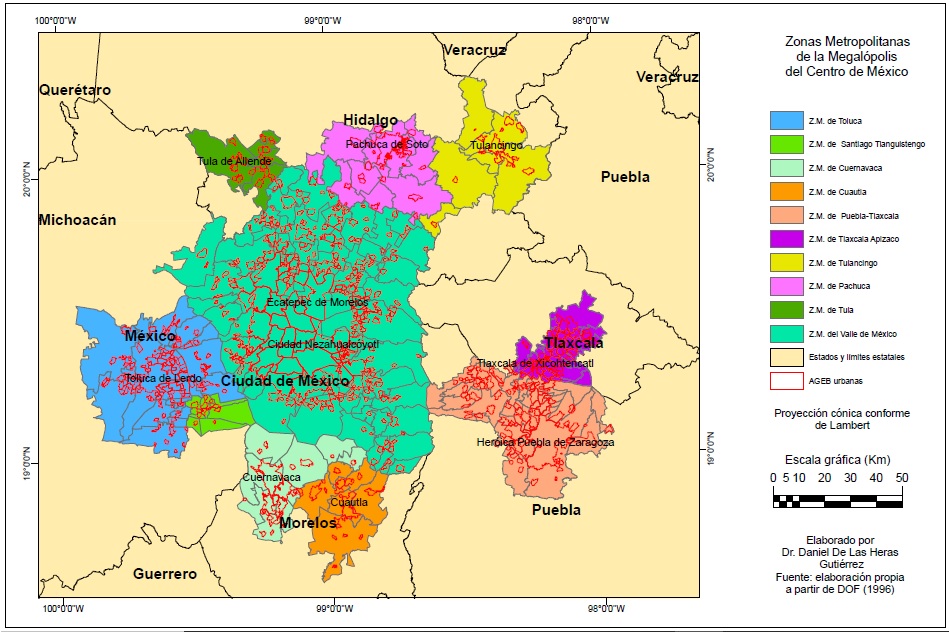
La Megalópolis del Centro de México (MCM) es un complejo urbano policéntrico con una superficie de 18 mil 841 km2 y 30 millones 754 mil 24 habitantes en 2020 (INEGI, 2021b), conformado por una serie de áreas urbanas jerarquizadas con centro en la Ciudad de México, englobadas por un proceso de absorción geográfica y funcional de territorios urbanos y suburbanos.
La MCM (Figura 1) incluye 189 municipios y alcaldías de las zonas metropolitanas de Cuautla, Cuernavaca, Pachuca, Puebla-Tlaxcala, Santiago Tianguistengo, Tlaxcala-Apizaco, Toluca, Tula-Tulancingo y Valle de México. Legalmente fue definido por vez primera en 1996 (DOF, 1996).
La MCM presenta fuertes desequilibrios espaciales socioeconómicos de nivel de ingreso o marginación, acceso a servicios, condiciones educativas y sanitarias. Presenta notables diferencias internas, así como en sus niveles de sustentabilidad ambiental urbana, en particular en las áreas no conurbadas de las diferentes periferias metropolitanas.
Datos
Los datos de defunciones por municipio y alcaldía por tumores malignos de mama y de cuello de útero se obtuvieron de INEGI de su base de datos de Defunciones registradas (mortalidad general). Esta base de datos sigue la clasificación internacional de enfermedades (CIE), que es el estándar de clasificación diagnóstica para todos los fines clínicos y de investigación. Define enfermedades, trastornos, lesiones y otras afecciones de salud relacionadas, enumeradas jerárquica e integralmente (OPS, 2003).
Cáncer de mama (CIE C-50)
El CM es cualquier neoplasia maligna (carcinoma o sarcoma) de la mama (Tabla 1). Se trata de tumores malignos de origen epitelial derivados de las células que componen los lobulillos mamarios (Real Academia Nacional de Medicina, 2011). Se ha establecido que su origen se debe tanto a causas endógenas como exógenas, aun cuando la mayor parte de los estudios epidemiológicos hacen hincapié en cómo el cáncer es influenciado por hormonas endógenas y en menor medida a los agentes exógenos que pueden actuar de una manera similar y disparar la enfermedad (Batista, Alegret y Antón, 2013). Como se anotó, hay diferente impacto a nivel global de la enfermedad según países por su desarrollo socioeconómico. Por región, en su incidencia actúan como factores de riesgo características geográficas, sociales y medioambientales de cada población (Ocón et al., 2010).
Tabla 1 Subdivisiones tipológicas de los CM y de CCU.
| Tumor maligno de mama (C-50) |
| (C500) T. M. del pezón y de la aureola mamaria |
| (C501) T. M.de la porción central de la mama |
| (C502) T. M. del cuadrante superior interno |
| (C503) T. M. del cuadrante inferior interno |
| (C504) T. M. del cuadrante superior externo |
| (C505) T. M. del cuadrante inferior externo |
| (C506) T. M. de la prolongación axilar de la mama |
| (C508) Lesión de sitios contiguos |
| (C509) T.M. de mama, parte no especificada (phyloides maligno, linfoma etc...) |
| Tumor maligno de cuello de útero (C-53) |
| (C530) T. M. del endocérvix |
| (C531) T. M. del exocérvix |
| (C538) Lesión de sitios contiguos |
| (C539) T. M. del cuello del útero, sin otra especificación |
Se trata de una alteración celular originada en el epitelio del cuello del útero debida a la persistencia de serotipos oncogénicos del VPH (Real Academia Nacional de Medicina, 2011). Su factor de riesgo fundamental es infección por el VPH, generalmente a través de transmisión sexual, con una serie de cofactores como el inicio temprano de relaciones sexuales, alto número de parejas, antecedentes de enfermedades de transmisión sexual (ETS), consumo de anticonceptivos orales y patologías o terapias inmunodepresoras. Se trata de una neoplasia prevenible y detectable en fases tempranas (papanicolau) por su origen infeccioso y lenta evolución a lo largo de varias fases de lesiones precancerosas y de cáncer in situ.
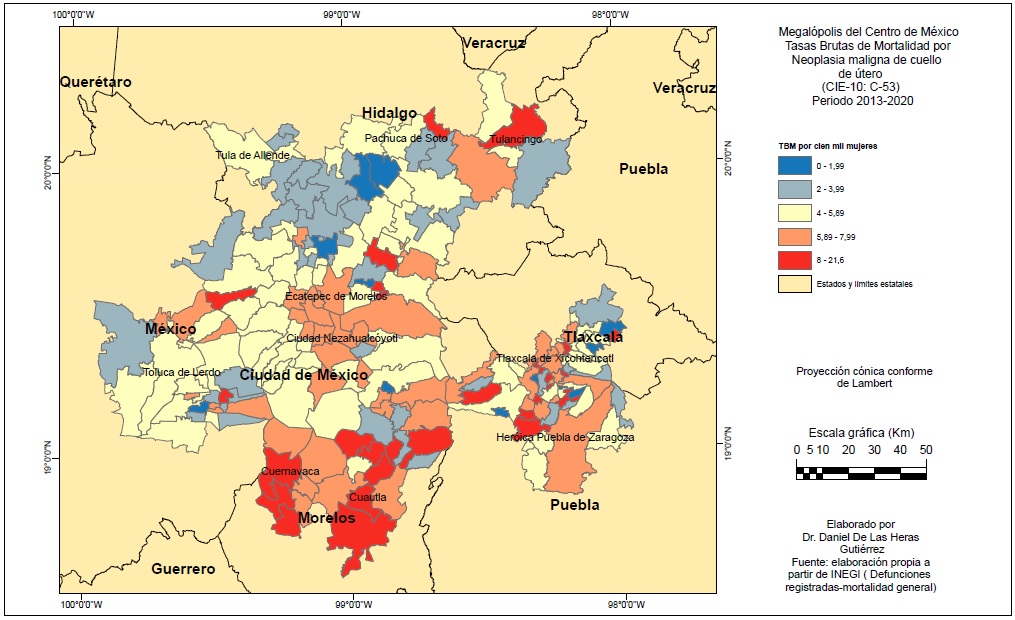
Se elaboró una base de datos con las defunciones para cada municipio y alcaldía para el periodo 2013 y 2020. Se calculó el promedio anual y se calculó la Tasa Bruta de Mortalidad (TBM), es decir, número total de defunciones por cáncer C-50 (únicamente mujeres) y C-53 que ocurrieron por cada 100 mil mujeres con el año de referencia de población total femenina de 2020 según el censo de población (INEGI, 2021b) (Figura 2)
Variables demográficas, socioeconómicas, educativas y culturales
Por ausencia de datos de otro tipo, se emplearon seis variables de tipo demográfico (Tabla 2) (envejecimiento); socioeconómico (marginación y dotación sanitaria), educativa (rezago educativo y educación superior), así como cultural (población hablante de lengua indígena). Todas ellas se obtuvieron de fuentes del Instituto Nacional de Estadística y Geografía (INEGI) del Censo de Población 2020 (INEGI, 2021b), con excepción del Índice de Marginación Municipal de 2020 (CONAPO, 2021). Para el cálculo de la variable de rezago educativo se emplearon 3 variables censales: Población femenina de 15 años y más analfabeta; Población femenina de 15 años y más sin escolaridad y Población femenina de 15 años y más con primaria incompleta.
Tabla 2 Variables demográficas, socioeconómicas, educativas y culturales.
| Factores | Estructura por edades, envejecimiento demográfico |
Nivel de ingreso, dotación servicios médicos |
Nivel educativo | Raza, etnia |
| Tumor maligno de mama (C-50) | -Gutiérrez y Alarcón, 2008 | -Tumas, Pou y Díaz, 2017 | -Albano et al., 2007 | -Albano et al., 2007 |
| -Rocha et al., 2018 | -Amin, Fritz y Retzloff, 2019 | |||
| Tumor maligno de cuello de útero (C-53) | -Gutiérrez y Alarcón, 2008 | -Gao et al., 2013 | -Palacios et al., 2003 | -Eggleston et al., 2006 |
| -Azevedo et al., 2018 | ||||
| -Palacio et al., 2003 | ||||
| Variables seleccionadas | -Población Femenina mayor de 60 años | -Índice de Marginación Municipal 2020 | -Porcentaje de Mujeres con 18 años y más con educación postbásica | -Población femenina de 3 años y más que habla alguna lengua indígena |
| -Porcentaje de población sin acceso a servicios de salud | -Porcentaje de Mujeres con 15 años y más con rezago educativo |
Para el procesamiento y modelación se utilizaron Excel, SPSS 24 y ArcMap.
Análisis espacial
El análisis espacial permite detectar y delimitar áreas -municipios y alcaldías- con TBM de cáncer de mama y cuello de útero elevadas y bajas en la MCM, si estas zonas de distribuyen de manera aleatoria o si, por el contrario, existen aglomeraciones significativas (Índice de Autocorrelación Espacial Local de Moran, IALM). Con IALM se analiza la relación espacial existente entre las TBM y las variables socioeconómicas, demográficas, educativas y culturales que la literatura menciona como factores que influyen en la incidencia y mortalidad por cáncer de mama y cuello de útero entre mujeres.
Con el IALM (LISA en inglés) se cuantifica y representa cartográficamente la concentración espacial de las TBM con la identificación y delimitación de clústeres (agrupamientos espaciales, en este caso de municipios y alcaldías) de altas y bajas TBM (Anselin, 1995).
El IALM clasifica las unidades espaciales según la relación de su IALM con respecto a los valores registrados en las unidades espaciales de la siguiente forma: 1. Clústeres de tipo bajo-bajo: unidades espaciales con valores bajos en TBM y que tengan unidades espaciales vecinas con valores bajos de TBM; 2. Tipo alto-alto, unidades espaciales con valores altos de TBM y vecinas con valores elevados; 3. Tipo bajo-alto, unidades espaciales de valores bajos, rodeadas de unidades espaciales con valores altos; 4. Tipo alto-bajo. Municipios y alcaldías con niveles altos de TBM, rodeados de unidades espaciales que registran valores bajos; 5. Estadísticamente no significativo.
El valor de IALM oscila entre -1 y 1; su interpretación es similar a la del coeficiente de correlación de Pearson. Aproximándose a -1 implica un conglomerado de municipios y alcaldías con valores altos y bajos, y los valores tendientes a 1 significan presencia de conglomerados espaciales de unidades con niveles de atributo semejantes, ya sean altos o bajos. Los primeros (aproximándose a -1) se asocian a autocorrelación negativa y los tendientes a 1, autocorrelación positiva. Con valores alrededor de 0 hay una ausencia de correlación espacial de los valores de análisis, o lo que es lo mismo, no existe un patrón definido. Con valores superiores a 0.2-0.3 se consideran resultados significativos.
El IALM se expresa con la siguiente fórmula (Garrocho y Campos, 2013) (Figura 3).
La autocorrelación espacial puede ser univariada (IALM) o bivariada. En los dos tipos se procesan, por un lado, los valores estandarizados de cierta variable o atributo para cada municipio o alcaldía y, por otro lado, los puntajes estandarizados del promedio de los valores de municipios o alcaldías contiguas para la misma variable (IALM) o en relación con otra (autocorrelación bivariada). El Índice Local Bivariado de Moran (ILBM) permite correlacionar dos variables (distintas) en el tiempo y en el espacio (Garrocho, 2016), clasificando las unidades en una tipología de clústeres semejantes a los del IALM, pero en vez de tener en cuenta una misma variable, permite establecer la correlación espacial entre dos variables, los clústeres de tipo Alto-Alto bivariados nos indican unas unidades espaciales con valores de elevados de cierta variable rodeados de unidades vecinas con valores elevados de una segunda variable. El ILBM se define a través de la siguiente expresión (Figura 4).
Donde x i será la variable 01 y yj la variable 02. Los componentes wij determinan la relación de los valores centrales (xi) con los vecinos de la variable secundaria (yi) (Siabato y Guzmán, 2019).
El ILBM también oscila entre -1 y 1, considerándose significativos sus resultados al superar el puntaje de -0.2 y 0.2.
Para el cálculo del IALM y del ILBM se emplearon los programas ArcMap 10 y GeoDa.
RESULTADOS Y DISCUSIÓN
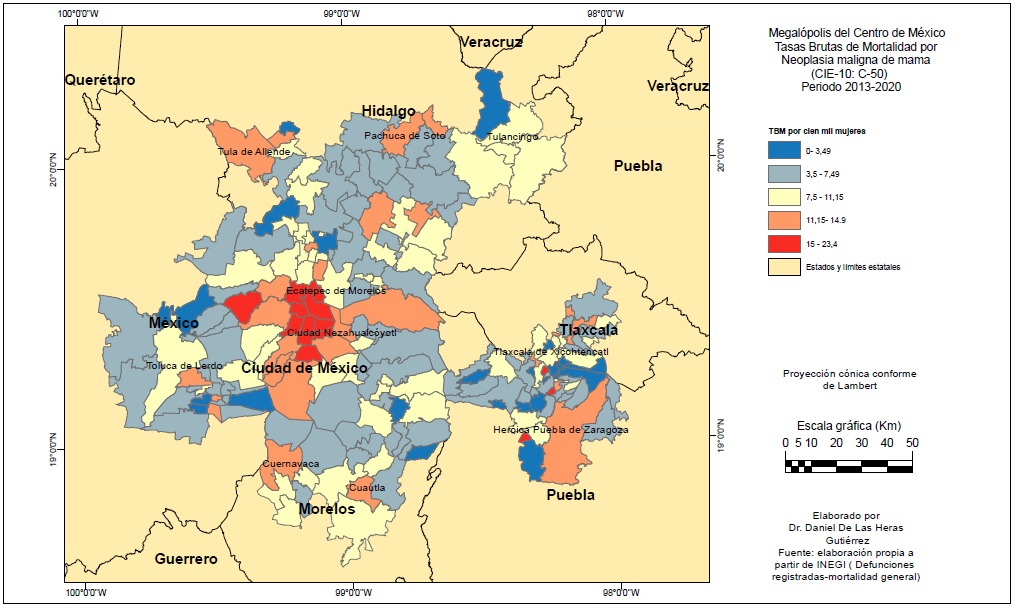
Las TBM por CM en la MCM en 2013-2020 fueron superiores a la media nacional, 11.15 por cien mil (México: 10.2) y para las de CCU algo inferiores: 5.9 por cien mil (media nacional: 6.25). Las defunciones por CM han crecido de 1 mil 512 en 2013 a 1 mil 995 en 2020 y por CCU son estables desde 2014 en torno a 950 anuales.
Los niveles de TBM para ambas clases de cáncer no son uniformes, presentando importantes variaciones y patrones espaciales muy diferentes (Figuras 5 y 6). Las TBM más elevadas por cáncer de mama se concentran en torno a la Ciudad de México e inmediata zona conurbada (Benito Juárez 23.4 por cien mil, Coyoacán 21 y Azcapotzalco con 19.6), noreste de la ZMVM (Nopaltepec 13.6 y Temascalapa 11.6); en el norte de la MCM Tula (12.5) y Tlaxcoapan (13.6) por una parte, y por otra Pachuca (11.4) y Mineral del Monte (13.2). En el sur destacan Cuernavaca (14.1) y Cuautla (13.2); al este, 8 municipios entre las ZM de Puebla-Tlaxcala y Tlaxcala-Apizaco, entre ellos Puebla (11.5) y Apizaco (11.8), siendo notables sus TBM San Jerónimo Zacualpan con cerca de 20 por cien mil. Al oeste destacan algunos municipios al sur de Toluca, en particular Metepec. El patrón espacial básico de las TBM por CM es de concentración de los valores elevados en los municipios centrales y contiguos de las diferentes zonas metropolitanas de la MCM, con las excepciones de Toluca (aunque si en su periferia con Metepec con 11.6), Tlaxcala y Tulancingo.
Los municipios con las TBM de CM más bajas (inferiores a 7.5 por cien mil) numéricamente son mayoritarios (97) y fundamentalmente se trata de municipios periféricos al norte y sur de la Ciudad de México, periferia de la ZM de Toluca y gran número de pequeños municipios entre Puebla y Tlaxcala, intercalados estos últimos con algunos de elevadas TBM.
Las TBM por CCU tienen un patrón espacial muy diferente (Figura 6), los valores más altos se concentran de forma significativa en el sur y este de la MCM en las ZM de Cuernavaca y Cuautla (destacando Tlanepantla con 21.6 por cien mil, Totolapan con 13.1, Cuautla 12.9, Xochitepec 11.7 y Tepetlixpa con 10.8), y Puebla-Tlaxcala y Tlaxcala-Apizaco al este (10 municipios con más de 8 por cien mil, destacando San Miguel Xoxtla con 13.5, San Jerónimo Zacualpan con 13.3, Juan Crisóstomo Bonilla con 11.6 y Santa Isabel Xiloxoxtla con 10.3). En las alcaldías del norte de la Ciudad de México y municipios conurbados las TBM son superiores a la media (no superiores a 7.85 por cien mil). Destaca al noreste algunos municipios con valores elevados, en particular Singuilucan, Tulancingo de Bravo (8.2) y Mineral del Monte (13.3).
Las TBM más bajas se concentran en el norte de la MCM, más concretamente al noroeste, en los municipios al norte de la conurbación de la Ciudad de México, entre esta y las ZM de Tula y Pachuca, como Tolcayuca y Nextlalpan con TBM muy bajas: 1.3 y 0.59 por cien mil.
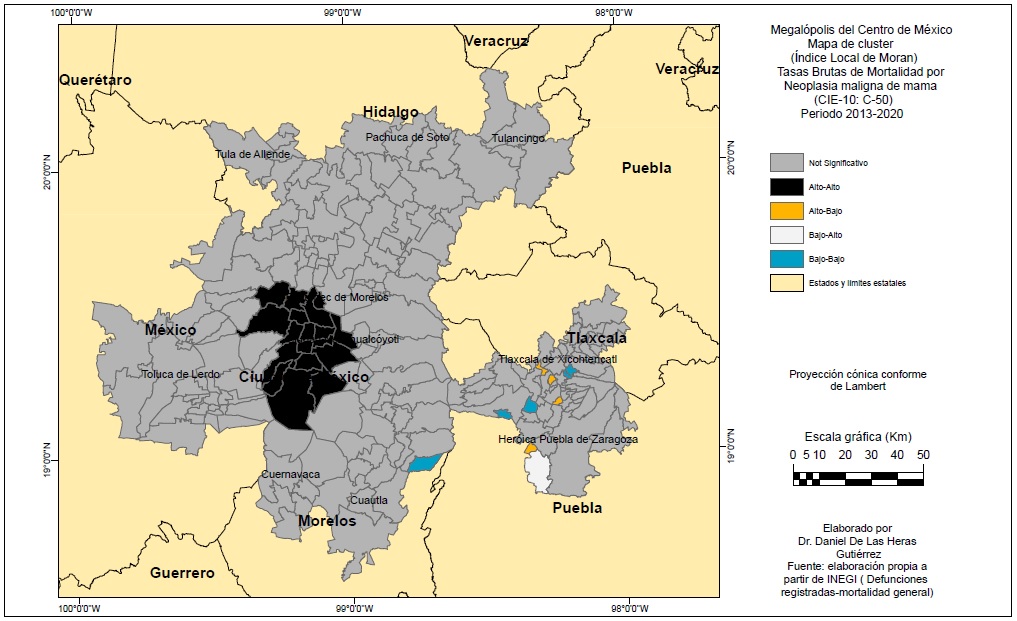
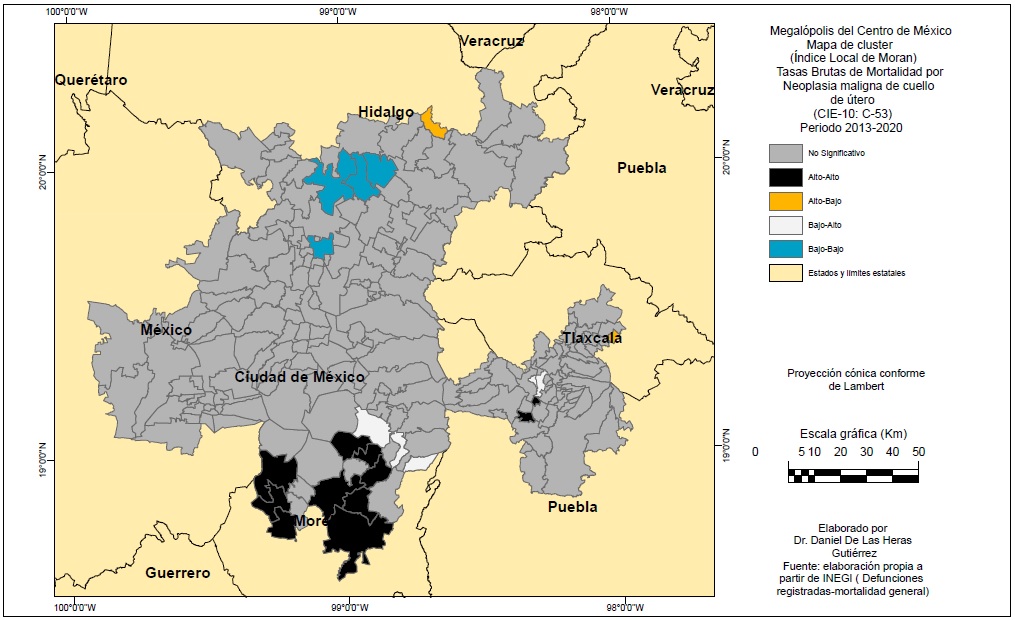
Con el IALM se obtuvieron mapas que nos muestran la presencia de clústeres y patrones espaciales de las dos enfermedades (Figuras 7 y 8). El IALM del cáncer de mama fue de +0.257 lo cual nos indica una autocorrelación espacial positiva significativa, es decir, existencia de aglomerados con valores altos y bajos de TBM. En el caso de las TBM por CCU el IALM fue menor, de +0.126, una autocorrelación positiva débil que no obstante indica que las TBM no tienen una distribución aleatoria.
La Figura 7 muestra un gran clúster de tipo alto-alto para el CM conformado sobre la Ciudad de México y municipios vecinos a su NO y, en la Figura 8, un clúster Alto-Alto para TBM de CCU en el sur de la MCM. Para los dos tipos de cáncer en el este de la MCM hay ciertos aglomerados aislados de diverso tipo entre las ZM de Puebla y Tlaxcala.
La distribución espacial del CM es en torno a los grandes centros urbanos metropolitanos y sus municipios vecinos, sobre todo Ciudad de México y capitales como Puebla, Cuernavaca, Pachuca o Cuautla. En cambio, el CCU presenta una distribución concentrada en el sur y sureste de la MCM y en municipios fundamentalmente periféricos. Este patrón espacial se constata tanto con la cartografía por TBM como por el cálculo del IALM y sus mapas de clústeres.
Aplicando el ILBM entre las TBM por cáncer de los tipos y las seis variables (Tabla 3) obtenemos una correlación espacial significativa entre 5 de las 6 variables con el CM y únicamente en 1 de las 6 variables (y con significancia débil) para el CCU.
Tabla 3 Resultados del Índice Local Bivariado de Moran.
| TBM C50 CM | TBM C53 CCU | |
| -Población femenina de 60 años y más | 0.36 | 0.13 |
| -Índice de Marginación Municipal 2020 | -0.38 | 0.07 |
| -Porcentaje de Población sin afiliación a servicios de salud | -0.11 | 0.02 |
| -Porcentaje de Población femenina de 18 años y más con educación posbásica | 0.31 | -0.05 |
| -Porcentaje de Población femenina con 15 años y más con rezago educativo | -0.12 | 0.05 |
| -Porcentaje de Población femenina de 3 años y más que habla alguna lengua indígena | -0.04 | 0.014 |
Para CM el envejecimiento demográfico y la proporción de mujeres con estudios superiores se asocia en la MCM con elevadas TBM, en tanto que el nivel de marginación elevado y en forma menos significativa, porcentajes de elevados de población sin acceso a servicios de salud y elevado porcentaje de rezago educativo se asocian con bajas TBM. Si bien la variable de tipo cultural (población que habla alguna lengua indígena) no arrojó un puntaje significativo, es negativo. Es decir, la mortalidad por CM se asocia a factores de desarrollo económico, social y educativo, a mayor envejecimiento, nivel educativo y menor marginación, no acceso a sanidad y población indígena, mayores TBM.
Los resultados del Bivariado de Moran para el CCU no son significativos para las variables empleadas, salvo el caso de la población mayor femenina, con un puntaje bajo (0.13). No obstante, es de destacar que el nivel de marginación, rezago educativo y población indígena tienen correlación positiva y el porcentaje de mujeres con educación superior, negativo. Ello revela relación entre esta neoplasia y situaciones socioeconómicas y educativas desfavorables.
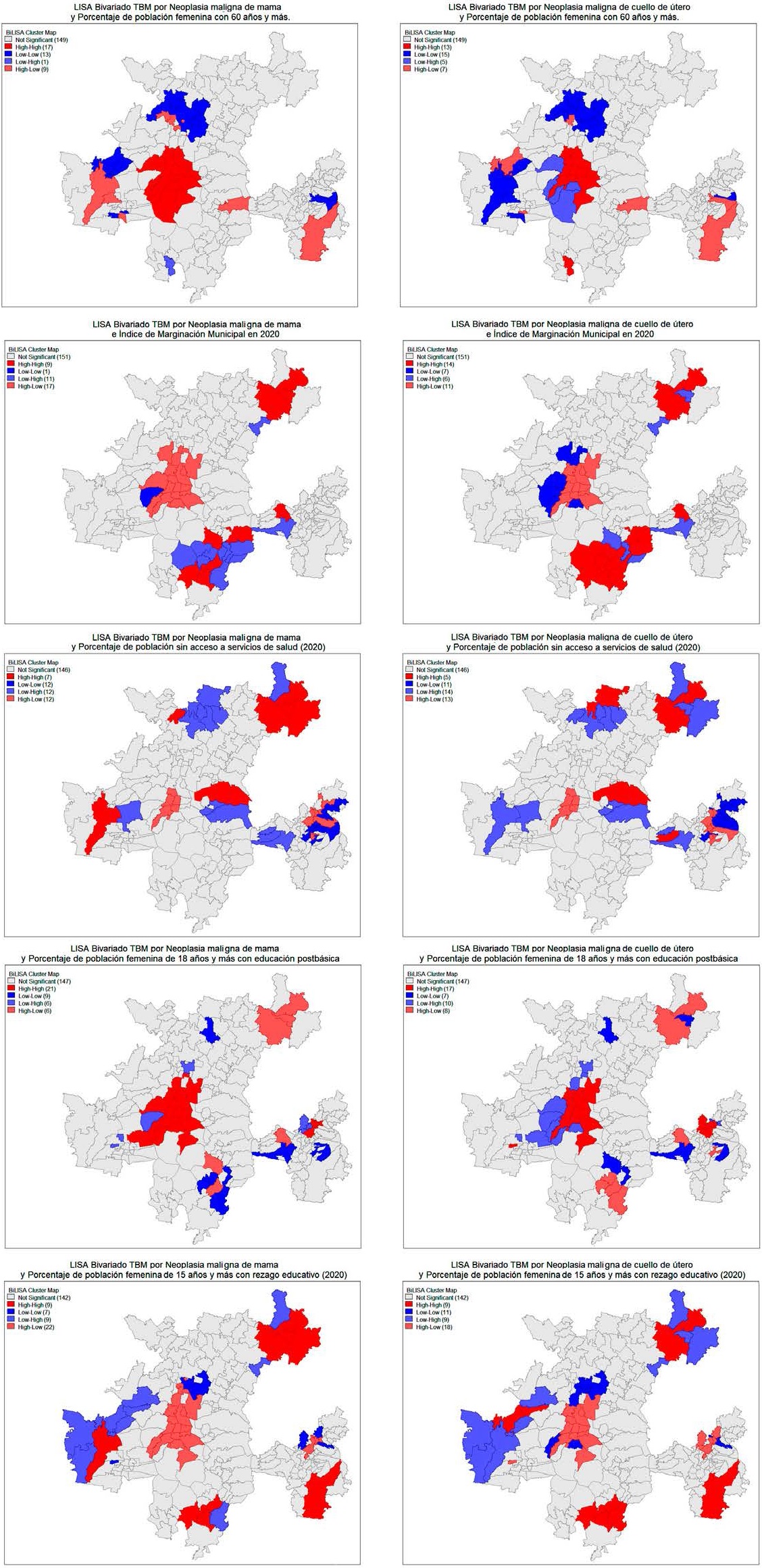
En el primer par de mapas de la Figura 9 se muestran resultados del análisis bivariado entre la población femenina de 60 años y más y las TBM. En ambos casos la relación fue positiva, más acusada para el CM, y la explicación radica en el comportamiento que existe en la Ciudad de México y en el área al norte de la ZMVM, en la que se hallan dos grandes clústeres de tipo Alto-Alto y Bajo-Bajo. En cambio, para el CCU el puntaje es positivo, poco significativo, por la existencia al este de la Ciudad de México de un importante clúster de niveles bajos de TBM rodeados de porcentajes elevados de población femenina mayor.
En el segundo par de mapas, de bivariado entre TBM e índice de marginación, es evidente para el CM la importancia de dos clústeres, uno en torno a la Ciudad de México y otro al sureste en la ZM de Cuautla de tipo alto-bajo y bajo-alto, que explica el valor -0.38, y es que en la Ciudad de México bajos niveles de marginación van asociados con elevadas TBM y en Cuautla al revés. Destaca que al noreste de la MCM, Tulancingo y Singuilucan, aparecen asociadas altas TBM y marginación. Para el CCU resaltan dos conglomerados de valores altos de mortalidad y marginación tanto al noreste (Tulancingo) como al sureste de la MCM (Cuautla).
En cobertura en servicios de salud, el Bivariado de Moran no otorgó valores significativos. En CM (-0.11), por el efecto que tiene la Ciudad de México, ya que en sus alcaldías y municipios conurbados hay una cobertura sanitaria más extensa. En el noreste de la MCM hay altas TBM y altos porcentajes de población sin acceso a seguros sanitarios, lo cual se repite para el CCU.
Respecto a educación (no se incluyeron los mapas de población indígena al no obtenerse ningún resultado significativo), la población femenina con educación superior se asocia de forma significativa positiva, de ahí el gran clúster Alto-Alto en Ciudad de México; y en la variable rezago educativo hay en el mismo espacio un clúster Alto-Bajo. En el mapa de rezago educativo y mortalidad por cáncer de cuello de útero es en el noreste (Tulancingo) donde las altas TBM aparecen asociadas con un elevado rezago educativo, así como en algunos municipios aislados al sur de la ZM de Cuautla.
Discusión
Las TBM en mujeres por CM y CCU en la MCM presentan en el periodo 2013-2020 una dinámica creciente en el primer caso y estable, en el segundo. Así mismo presentan una distribución espacial no aleatoria en la MCM y con patrón desigual para los dos tipos de neoplasias. Se detectaron conglomerados significativos de valores altos de mortalidad, para el cáncer de mama, en torno a los municipios centrales metropolitanos (sobre todo en la Ciudad de México) e inmediata periferia, y en el caso del CCU en el sur y este de la MCM, esencialmente en municipios periféricos. Se encontró una asociación significativa positiva entre las TBM de CM y el porcentaje de mujeres mayores y con estudios superiores, y negativa con el índice de marginación, población femenina con rezago educativo y población sin acceso a servicios de salud. En cambio, para el CCU solamente se encontró una asociación positiva, débil, con el porcentaje de mujeres mayores, no así con marginación ni rezago educativo, pese a que si existen clústeres bivariados con dichas variables.
La literatura indica, sobre todo en los países en vías de desarrollo, una dinámica de incremento de la incidencia y mortalidad por CM; para el caso de la MCM hemos constatado no solo el incremento en cifras entre 2013 y 2020, sino también con respecto al periodo 2005-2012, ya que las TBM fueron de 9.88 por cien mil y en 2013-2020 de 11.15, dinámica que también es observada en otros estados de México como en Jalisco en el periodo 2010-2017 (Ramos-Herrera et al., 2020) o en países como Ecuador para el periodo 2004-2018 (Jaramillo et al., 2020). La dinámica afecta a México globalmente, las TBM por CM se han incrementado: en 2000 un 7 por cien mil y en 2015 un 10.1 por cien mil. Este proceso se debe al envejecimiento demográfico y una exposición cada vez mayor según aumenta el nivel socioeconómico a ciertos carcinógenos (Diniz et al., 2017). Además, las TBM de CM en la MCM fueron ligeramente superiores a la media nacional. En el caso del CCU, la dinámica es de estancamiento en cifras absolutas, las TBM son ligeramente inferiores a la media nacional: 5.89 frente a 6.25, con un descenso para el país de 9.1 en 2000 a 6.4 en el año 2015, tendencia reflejada en otros análisis como el de la ciudad de Natal, en el NE brasileño (Azevedo et al., 2019).
Las TBM de CM y CCM no son homogéneas en la MCM, con patrones espaciales muy diferentes, y una distribución no aleatoria, con un Índice de Moran de 0.257 y 0.126, y presencia de clústeres significativos de valores altos y bajos. En el CM niveles elevados y clústeres se concentran en los espacios más urbanizados y consolidados. Esto se ha detectado en diversos estudios, en la provincia de Shandong en la República Popular China, donde los niveles altos de mortalidad y clústeres se concentran en las grandes áreas urbanas como Qingdao o Weihai (Chu et al., 2017), el estado de São Paulo para las ZM de São Paulo, Vale do Paraiba, Sorocaba, Campinas (Diniz et al., 2017). También este patrón ciudad-periferia se repite en el caso de Jalisco, con las tasas más altas en la propia capital Guadalajara (Ramos-Herrera et al., 2020). Las TBM de CCU presentan un patrón diferente, las más elevadas son en el sur y este de la MCM y en general en municipios periféricos, tal y como ocurre en el estado de San Luís Potosí (Terán et al., 2016), o incluso a escala de un gran municipio central megalopolitano como el de São Paulo, en el que los niveles elevados de CM son en el centro y los de CCU en las periferias (Bermudi et al., 2020).
Estos patrones espaciales diferenciados tienen una parcial explicación para la MCM con los resultados del Índice Bivariado de Moran y la desigual distribución de las variables socioeconómicas, demográficas y culturales, sobre todo para el caso del CM.
El envejecimiento demográfico es uno de los factores que aumenta la incidencia de enfermedades no transmisibles como las neoplasias, y se encontró, sobre todo para el CM, una asociación positiva significativa con la tasa de envejecimiento en las alcaldías de la Ciudad de México y municipios conurbados, así como en Cuernavaca, Pachuca y Puebla o contiguos al municipio central, como Metepec, donde el envejecimiento es más acusado, lo cual es coincidente con las TBM de CM más elevadas, sobre todo en el clúster de Ciudad de México. Las variables de desarrollo socioeconómico y cultural repiten el mismo patrón, ya que la situación es mejor en los municipios metropolitanos centrales y vecinos que en las periferias. La repercusión de lo urbano y no urbano en el CM se ha detectado en otros estudios (Batista, Alegret y Antón, 2013; Jaramillo et al., 2020; Bermudi et al., 2020), así como del nivel socioeconómico de que a mayor desarrollo, mayor mortalidad (Diniz et al., 2020; Bermudi et al., 2020; Rocha-Brischiliari et al., 2018), aun cuando algunos estudios han detectado una relación inversa (Tumas, Pou y Díaz, 2017).
En el CCU, si bien se ha detectado autocorrelación espacial y clústeres bien definidos, el análisis bivariado no arrojó resultados significativos, a excepción de la variable de envejecimiento. No obstante, los niveles elevados de TBM en áreas periféricas nos indican que se trata de un fenómeno ligado a problemas socioeconómicos y culturales. Los niveles elevados en áreas periféricas se repiten en territorios como San Luís Potosí (Terán et al., 2016) o el municipio de São Paulo (Bermudi et al., 2020).
La variable cultural (hablantes en alguna lengua indígena) mencionada en literatura especializada (Cuadro 2), no proporcionó ninguna correlación significativa, para el CM nos confirma en lo afirmado por otros autores (Vainshtein, 2008), que su incidencia y mortalidad tiene mayor relación con el medio socioeconómico que con la etnia o nacionalidad. Otro factor a tener en cuenta es que, de los 189 municipios, únicamente en 10 se supera el 5% de hablantes en lengua indígena. Probablemente la cartografía de este trabajo con las TBM de CCU dé una aproximación de la distribución espacial en la MCM del VPH.
CONCLUSIONES
El estudio del CM y CCU desde la geografía y análisis espacial nos proporciona una visión de la distribución y localización de las TBM elevadas y su exacta delimitación, así como una aproximación a la incidencia sobre las mismas de factores demográficos, socioeconómicos y culturales, en particular para el CM, que pueden servir de herramienta de diagnóstico para la toma de decisiones y de medidas paliativas en relación con el creciente envejecimiento o políticas de acción y concienciación en ciertas categorías socio-profesionales. En el CCU se ha determinado que localmente factores como la marginación ejercen una acción agravante y debido su comportamiento vinculado al VPH, y su carácter de ETS, la cartografía es de gran utilidad para políticas públicas sanitarias (programas de acción de pruebas diagnósticas como Papanicolau y concienciación entre jóvenes).
Entre las limitaciones de este trabajo se encuentran las derivadas de la inexistencia de datos sobre factores de riesgo con las neoplasias, como una indicación de mamografías practicadas, para el CM o de pruebas de papanicolau. Del mismo modo sería de gran utilidad una base de datos estandarizada de instituciones como INEGI y plenamente accesible de incidencia a nivel de desagregación inferior a municipio (Ageb y sección electoral).











 nueva página del texto (beta)
nueva página del texto (beta)