Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de cardiología
versión impresa ISSN 0188-2198
Rev. Mex. Cardiol vol.25 no.1 México ene./mar. 2014
Caso clínico
Tromboembolia pulmonar recurrente en paciente con trombofilia primaria, filtro en vena cava inferior y anticoagulada. Reporte de un caso
Appellant thrombophilia in patients with primary pulmonary thromboembolism, inferior vena cava filter and anticoagulation. A case report
Carlos Alberto Solís-Olivares*
* Médico Cardiólogo adscrito al Hospital General de Zona No. 67 del Instituto Mexicano del Seguro Social. Apodaca, Nuevo León.
Dirección para correspondencia:
Dr. Carlos Alberto Solís Olivares
Rubí Núm. 105,
Col. Cuauhtémoc,
San Nicolás de los Garza, Nuevo León
Tel: 81-8352-40-85
E-mail: caso105@hotmail.com
RESUMEN
La deficiencia de las proteínas C y S se consideran parte del grupo de las trombofilias primarias y ameritan un tratamiento anticoagulante de largo plazo, por el riesgo inherente de eventos tromboembólicos para los pacientes. Se presenta el caso de una paciente femenina de 51 años de edad portadora de esta trombofilia, con obesidad, insuficiencia venosa de miembros inferiores, diabetes tipo 2 e hipertensión arterial, la cual 10 años antes había tenido un severo episodio de tromboembolia pulmonar, colocándosele desde entonces un filtro permanente en la vena cava inferior y continuando de manera indefinida con la terapia anticoagulante. La paciente ingresó al hospital en esta ocasión por presentar un dolor subesternal intenso de tipo opresivo, más disnea severa y diaforesis, en el contexto clínico de una crisis hipertensiva. A su ingreso la relación internacional normalizada se reportó en 2.55; su electrocardiograma y radiografía de tórax fueron normales. Las enzimas cardiacas, la ecografía Doppler color de miembros inferiores y el ecocardiograma Doppler color no reportaron anormalidades significativas. Finalmente, una angiotomografía demostró un trombo en una de las ramas segmentarias de la rama superior de la arteria pulmonar derecha, egresándose asintomática cinco días después. Aunque las guías no han establecido, como recomendación, el uso conjunto por tiempo indefinido del filtro permanente en la vena cava inferior asociado con la terapia anticoagulante, en los pacientes con este perfil clínico de riesgo tan singular, es posible un beneficio sinérgico, sobre todo al prevenir episodios recurrentes de tromboembolismo pulmonar masivo.
Palabras clave: Enfermedad tromboembólica venosa, trombosis venosa profunda, tromboembolismo pulmonar, síndrome coronario agudo.
ABSTRACT
Protein C and S deficiencies are considered part of the group of primary thrombophilia and merit long-term anticoagulant therapy, with the risk inherent thromboembolic events for patients. We report the case of a female patient 51 years old who carry the thrombophilia, obese, with lower limb venous insufficiency, type 2 diabetes and hypertension, which 10 years ago presented a severe episode of pulmonary thromboembolism, standing from then a permanent filter in the inferior cava vein and continuing indefinitely with anticoagulant therapy. She arrived at the hospital on this occasion by presenting a severe substernal pain oppressive type and sweating more severe dysnea in the clinical setting of a hypertensive crisis. The INR on admission was reported in 2.55. His electrocardiogram and chest radiograph were normal. Cardiac enzymes, color Doppler ultrasound of the lower limbs and color Doppler echocardiography reported no significant abnormalities. Finally, a CT angiography showed a thrombus in one of the segmental branch of the upper right pulmonary artery, discharged asymptomatic form the hospital, after five days. Although the guidelines have not established a recommendation for use indefinitely permanent filter in the inferior cava vein associated with anticoagulant therapy, in patients with clinical risk profiles so unique, it is possible synergistic benefit primarily to prevent recurrent episodes of thromboembolism massive pulmonary.
Key words: Venous thromboembolism, deep vein thrombosis, pulmonary thromboembolism, acute coronary syndrome.
INTRODUCCIÓN
Los filtros permanentes colocados en la vena cava inferior (FVCI) emergieron a finales de los años 60 junto con el filtro de Mobin Uddin, como una alternativa mecánica de interrupción parcial del flujo, protectora contra la recurrencia del tromboembolismo pulmonar (TEP), ofreciendo una menor posibilidad de complicaciones trombóticas que la ligadura quirúrgica de este vaso.1 Estos dispositivos han evolucionado, mejorando en su tecnología con el tiempo y experimentado un notorio incremento en su utilización en las últimas dos décadas, sobre todo tras la introducción de los filtros temporales, aunque debe señalarse que en forma paralela ha crecido también la controversia acerca de su beneficio real, al no estar exentos de complicaciones a corto y largo plazos, entre la cuáles se pueden mencionar la trombosis in situ , la migración del filtro, la trombosis venosa recurrente, el síndrome postrombótico y la fractura del dispositivo.2
Las guías de prevención y terapia antitrombótica del American College of Chest Physicians (ACCP) novena edición,3 establecen que existe una clara indicación para colocar estos filtros en aquellos pacientes con TEP agudo que tienen contraindicaciones para recibir un tratamiento anticoagulante oral (ACO) o presentan falla terapéutica de la misma, desaconsejando su utilización en los pacientes que no llenen este requisito. Sin embargo, en el "mundo real" existe una laxitud mucho mayor, expendiéndose con frecuencia su indicación hasta en los pacientes con embolismo pulmonar y pobre reserva cardiopulmonar, así como en los pacientes con trombo en tránsito en las venas iliacas o vena cava inferior o en pacientes politraumatizados. En el Reino Unido, por ejemplo, en el periodo de 1994 a 2006 se informó que de 516 FVCI implantados 57% se colocó en indicaciones absolutas, 37% en relativas y 6% en forma profiláctica en los pacientes sin trombosis venenosa profunda (TVP) o tromboembolismo pulmonar (TEP).4 Por otra parte, la relación riesgo/beneficio del FVCI ha sido históricamente difícil de determinar, dado que la mayoría de los ensayos clínicos han carecido de un seguimiento temporal prospectivo adecuado y han adolecido de falta de objetividad para demostrar la recurrencia de los fenómenos tromboembólicos.
Se presenta el caso de una paciente con importantes factores de riesgo para la enfermedad tromboembólica venosa (ETV), la cual ingresó al hospital por dolor torácico y disnea, siendo portadora de un FVCI y tratada además con ACO.
REPORTE DEL CASO
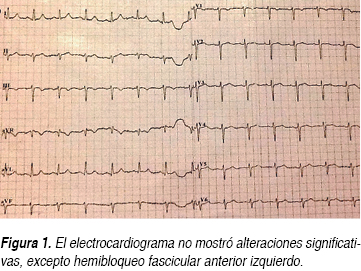
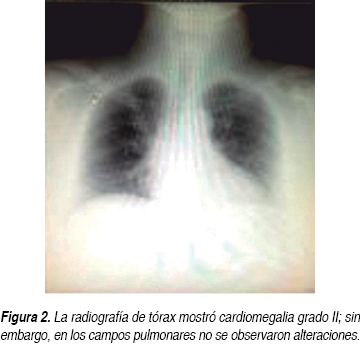
Una paciente del sexo femenino de 51 años de edad ingresó al servicio de urgencias de nuestro hospital el día 16 de octubre del 2013. Entre sus antecedentes de importancia se destacó la presencia de obesidad mórbida con un índice de masa corporal (IMC) de 47.6, negando toxicomanías. Ella refirió que 12 años atrás había sido atendida en el Hospital Universitario de la Ciudad de Monterrey, Nuevo León, México, debido a un tromboembolismo pulmonar (TEP) agudo, colocándosele filtros permanentes colocados en la vena cava inferior (FCVI). Se le diagnosticó, además, deficiencia de proteína C y S, la cual fue confirmada recientemente cuatro meses antes de su actual ingreso hospitalario, en el Hospital No. 25 del Instituto Mexicano del Seguro Social (IMSS), en donde fue atendida por un episodio de tromboflebitis en el brazo derecho. También se le diagnosticó diabetes mellitus tipo 2 (DM2) e hipertensión arterial sistémica (HAS) hace un año. Ella describió que dos semanas antes de su ingreso comenzó a manifestar disnea tras realizar esfuerzos físicos moderados. El día 16 de octubre se agregó a esta sintomatología dolor subesternal intenso de carácter opresivo, además de disnea severa en reposo y diaforesis profusa fría con irradiación a brazo izquierdo. Su exploración física no arrojó datos relevantes a nivel cardiopulmonar, destacándose solamente obesidad exógena, presión arterial de 170/100 mmHg, frecuencia cardiaca de 86 por minuto y una frecuencia respiratoria de 22 por minuto, sin fiebre. La paciente describió además dolor de intensidad moderada, continuo, en la cara posterior de la pierna izquierda con signo de Homman positivo, aunque la revisión no reportó cambios de coloración de tegumentos en esa zona. El electrocardiograma tomado en urgencias (Figura 1) reportó un ritmo sinusal con frecuencia de 90 por minuto, PR de 0.12, QRS de 0.08 segundos y AQRS a - 60 grados, reportando como única alteración un hemibloqueo de fascículo anterior izquierdo. La radiografía de tórax posteroanterior no mostró alteraciones significativas (Figura 2). Bajo el diagnóstico de crisis hipertensiva con sospecha de síndrome coronario agudo (SICA), la paciente fue ingresada al servicio de cardiología de este hospital. Le fueron solicitadas enzimas cardiacas en dos determinaciones con creatinfosfoquinasa (CPK) de 70 U/L, fracción muscular-cerebral (MB) de 22 U/L y deshidrogenasa láctica (DHL) de 215 U/L, como valores más altos. La glucosa se documentó en 155 mg/dL, el nitrógeno de la urea en 15 mg/dL y la creatinina en 0.6 mg/dL. El sodio fue de 139 meq/L y el potasio de 4.2 meq/L. La biometría hemática reportó hemoglobina de 13.3 g/dL, hematocrito de 42.1%, leucocitos de 9,330/mm3 con neutrófilos de 70.1%, linfocitos de 21.5%, eosinófilos de 1.75% y plaquetas de 259,000/mm3. La gasometría venosa mostró un potencial de hidrogeniones (PH) de 7.35, una presión parcial de dióxido de carbono (PCO2) de 42 mmHg y una presión parcial de oxígeno (PO2) de 46 mmHg, así como una concentración de bicarbonato (HCO3) de 23.2 mmol/L y un exceso de base (EB) de - 2.4 mmol/L. El tiempo de protrombina al ingreso fue de 32.7 segundos con testigo de 13 segundos con la relación internacional normalizada (INR) de 2.55. El tiempo de tromboplastina parcial (TTP) de 33.2 segundos con testigo de 30 segundos y el fibrinógeno de 533.0 mg/dL. No le fue solicitado el dímero D. A la paciente se le realizó un ecocardiograma transtorácico, el cual documentó fracción de eyección del ventrículo izquierdo (VI) normal de 63%, dimensiones intracavitarias normales y disfunción diastólica por trastorno de relajación del VI, sin observarse trastornos de la movilidad y/o dilatación del ventrículo derecho. No se documentó insuficiencia tricuspídea, y el tiempo de aceleración del flujo de la arteria pulmonar se registró en 183 milisegundos.
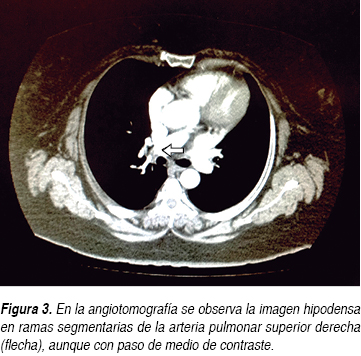
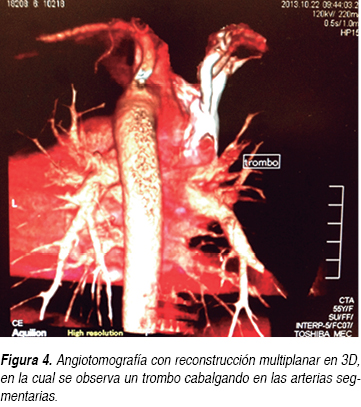
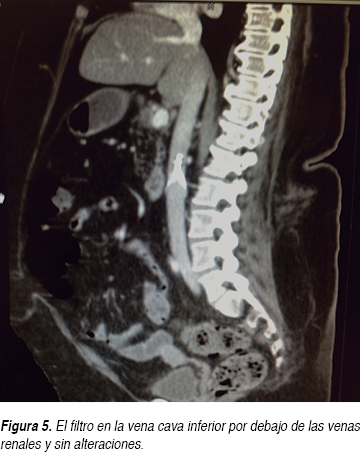
Durante su estancia hospitalaria la paciente presentó mejoría clínica, disminuyendo las cifras de presión arterial a valores normales tras ajustar el tratamiento antihipertensivo con losartán, nifedipino de liberación prolongada, nitratos orales, hipolipemiantes orales, sulfonilurea y metformina. Se incrementó la dosis de warfarina desde su ingreso a piso. Posteriormente, tras la desaparición del dolor subesternal y con la disminución de la disnea, se le pidió una ecografía de cuatro extremidades para ser realizada en un hospital de tercer nivel, sin embargo, sólo se reportó la ecografía Doppler color con enfoque en sistema venoso de miembros inferiores, sin documentarse anormalidades significativas que indicaran trombosis venosa profunda (TVP) en miembros inferiores; aunque cabe aclarar que clínicamente no presentaba dolor o datos sugestivos de tromboflebitis en extremidades superiores. Posteriormente se le solicitó a la paciente una angiotomografía de arteria pulmonar (Figuras 3 y 4), donde se demostró la presencia de un trombo (infarto pulmonar) en las ramas segmentarias de la arteria pulmonar superior derecha con datos de canalización parcial y sin imagen de semiluna, la cual orientó a pensar en un trombo crónico. No se reportaron anormalidades en el FVCI (Figura 5). La paciente fue egresada por mejoría clínica cinco días después de su hospitalización y la relación internacional normalizada (INR) a su egreso hospitalario se reportó en 3.5.
DISCUSIÓN
Aunque la trombosis venenosa profunda (TVP) y el tromboembolismo pulmonar (TEP) se consideran ordinariamente en conjunto, esto no implica que sean lo mismo, sino que representan estadios distintos de una misma enfermedad. La enfermedad tromboembólica venenosa (ETV) y la práctica clínica se presentan también de manera independiente. De hecho, el riesgo de muerte es por mucho más alto a corto y largo plazo después de un episodio de TEP que de una de TVP. Cada año en Estados Unidos se reportan 900,000 casos de la ETV, de la cual aproximadamente 300,000 son de TEP fatal y 240,000 de embolismos pulmonares no fatales, correspondiendo el resto a la TVP.5 En el estudio ICOPER6 ( International Cooperative Pulmonary Embolism Registry ) la mortalidad en quienes estuvieron hemodinámicamente inestables fue de 58.3% y en aquéllos estables fue de 15.1%. A pesar de que la terapia prolongada con warfarina es eficaz para reducir la incidencia de la TVP documentada, de 47 a 2%, se sabe que cerca de un tercio de los pacientes desarrollan un segundo evento de TEP pese a mantener un adecuado nivel de anticoagulación.7
Aunque los FVCI se han ido utilizando cada vez con mayor frecuencia para prevenir el TEP, sobre todo desde la aparición de los filtros temporales, documentándose recientemente 259,000 dispositivos aplicados en un año, tan sólo en Estados Unidos pocos estudios aleatorizados respaldan el incremento en su uso. Uno de estos estudios es el PREPIC8 ( Prévention du Risque d'Embolie Pulmonaire par Interruption Cave ), el cual fue realizado en 396 pacientes en 1998 y que contó con un seguimiento prospectivo de ocho años, demostró una menor recurrencia de TEP sintomático con los FVCI comparados con el tratamiento anticoagulante (6.2 versus 15.1%) p = 0.008, a expensas, sin embargo, dio un incremento en los episodios de la TVP a los dos años (35.7 versus 27.5%, p = 0.042) y sin diferencias reales respecto a la mortalidad a los ocho años de seguimiento. Notablemente, en este estudio excluyeron a los pacientes con contraindicación para tratar el anticoagulante oral (ACO) que son los que idealmente tienen la indicación de recibir estos filtros.
Por otra parte, Sarosiek y colaboradores9 recientemente revisaron la evolución clínica de 952 pacientes en un estudio retrospectivo en un centro médico de Boston, del 2003 al 2011, la mitad de ellos víctimas de traumatismos, encontrando que únicamente 8.5% de los filtros temporales fueron removidos, además de documentar recurrencia de episodios de TVP y TEP en 8 y 2.5% de los pacientes, respectivamente, después de haberse colocado el FVCI.
En el presente caso la paciente presentaba múltiples factores de riesgo para la ETV, de los cuales el más prominente fue la presencia de trombofilia primaria representada por la deficiencia de las proteínas C y S, las cuales por sí mismas le conferían un riesgo elevado para fenómenos trombóticos. La proteína C es una pequeña proteína plasmática dependiente de la vitamina K, la cual inactiva proteolíticamente los factores de coagulación Va y VIIIa, favoreciendo así la anticoagulación y mejorando la fibrinólisis en la interfase endotelio-plasma. Al igual que otros factores de la coagulación, ésta se encuentra en el plasma en forma de proenzima. Su transformación en enzima activa requiere de la presencia de trombina, calcio y fosfolípidos. Es activada por la trombina en presencia de la trombomodulina presente en el endotelio. La proteína S es un polipéptido dependiente también de la vitamina K, normalmente presente en el plasma y en los gránulos alfa de las plaquetas, la cual funciona como cofactor para la acción de la proteína C. La proteína S está involucrada en la destrucción del factor V y factor VIII dependiente de la proteína C activada, mejorando el enlace de la proteína C activada a las membranas y aumentando su acción enzimática hasta cuatro veces. Se requiere de la proteína S libre para que la proteína C tenga actividad anticoagulante en el plasma. Las proteínas C y S forman un complejo 1:1 en presencia de calcio y una superficie de fosfolípidos. Ambos trastornos se transmiten en forma autosómica dominante y en conjunto explican entre 4 a 10% de las causas de trombofilia primaria.10 Estos tipos de trastornos se sospechan cuando se documentan episodios de trombosis venosa recurrente en los pacientes menores a 45 años y que cuentan con antecedentes familiares de ETV.
Por su alto perfil de riesgo tromboembólico esta paciente fue tratada de manera dual desde una década atrás, tanto con un FVCI permanente como con una terapia ACO, al considerar su caso como una situación especial. A pesar de esta "doble protección" y a que su INR tenía un óptimo nivel de 2.55 al arribar al hospital, la paciente presentó recurrencia de TEP.
Llama la atención que la sospecha diagnóstica principal al ingresar al hospital haya sido un probable síndrome coronario agudo (SICA) asociado con la crisis hipertensiva, toda vez que el electrocardiograma no reportaba anormalidades, además de que por los antecedentes de esta paciente, siempre debió considerarse como muy probable un nuevo episodio de TEP. Es posible que la presencia del FVCI haya desviado la atención de esta posibilidad diagnóstica, por considerar los médicos que la paciente estaba "protegida" de nuevos eventos tromboembólicos por este dispositivo. Se puede afirmar que la colocación de un FVCI efectivamente proporciona un adecuado grado de protección, sobre todo cuando el contexto clínico implica una buena posibilidad de que la recurrencia se presente como un TEP masivo, si bien, de ningún modo se puede considerar infalible o carente de complicaciones. Esto establece como un error conceptual suponer la inexistencia de episodios recurrentes de TEP en aquellos pacientes con FVCI, sobre todo de tipo permanente, ya que un émbolo puede emerger de lugares atípicos como miembros superiores (5% de los casos), aurícula derecha o catéteres venosos centrales e incluso los microémbolos pueden traspasar la barrera del filtro, ya que su diseño está enfocado al atrapamiento de los émbolos grandes. Los mismos filtros a su vez pueden ser también el origen de la trombosis,11 reportándose este fenómeno hasta de 30% en algunos estudios. La frecuencia de recurrencia de TEP en presencia de estos dispositivos ha sido estimada entre 0.5 a 6%.12
El tratamiento medicamentoso en caso de trombosis de otros sitios como extremidades superiores es similar al de trombosis en miembros inferiores, e incluso se puede llegar a considerar la colocación del filtro en la vena cava superior y aunque algunos reportes indican un beneficio con este tipo de tratamiento,13 con riesgos mínimos de perforación de vena cava superior y/o taponamiento cardiaco, al momento actual no se tiene certeza para recomendarlo.
CONCLUSIÓN
El caso de esta paciente se puede considerar de excepción debido a su perfil de riesgo tan singular, el cual es observado raras veces en la práctica clínica y puede tomarse de paradigma para resaltar el hecho de que en un contexto clínico de alto riesgo para la ETV puede suscitarse la recurrencia de TEP, incluso en enfermos portadores de FVCI permanentes y que además cuentan con un adecuado nivel de anticoagulación, escenario inédito, puesto que los filtros tienen su principal indicación en aquellos pacientes no aptos para recibir este tipo de fármacos. La posible sinergia protectora que estas dos diferentes opciones terapéuticas proporcionaron a esta paciente, en particular, no puede ser subestimada sólo por el hecho de no evitar un nuevo episodio tromboembólico, en este caso un infarto pulmonar, sino que quizás tendría que visualizarse como la utilización exitosa de las únicas opciones terapéuticas disponibles a la fecha, para evitar la elevada posibilidad que en este caso existía un episodio de TEP masivo recurrente de alta mortalidad. A pesar de que actualmente no existe un consenso en las guías para recomendar una terapia combinada de largo plazo con ACO y FVCI permanentes contra el TEP recurrente, en situaciones especiales como la de esta paciente con trombofilia heredada y múltiples factores de riesgo adquiridos por la ETV, podría ser una conducta adecuada, además de buscar niveles más altos de anticoagulación oral que puedan realmente proteger a los pacientes de este tipo.
REFERENCIAS
1. Grassi CJ, Swan TL, Cardella JF et al. Quality improvement guidelines for percutaneous permanent inferior vena cava filter placement for the prevention of pulmonary embolism. J Vasc Interv Radiol. 2003; 14: S271-S275. [ Links ]
2. Torbicky A, Chairperson P, Perrier A et al. Guidelines on the diagnosis and management of acute pulmonary embolism. The task force for the diagnosis and management of acute pulmonary embolism of the european society of cardiology (ESC). European Heart Journal. 2008; 29: 2276-2315. [ Links ]
3. Kearon C, Akl EA, Comerota AJ et al. Antithrombotic therapy for VTE disease: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians. Evidence-based clinical practice guidelines. Chest. 2012; 141 (Suppl. 2): e419S-e494S. [ Links ]
4. Hammond CJ, Bakshi DR, Currie RJ et al. Audit of the use of IVC filters in the UK: experience from three centres over 12 years. Clin Radiol. 2009; 64: 502-510. [ Links ]
5. Raskob GE, Silverstein R, Bratzler BW, Heit JA, White RH. Surveillance for deep vein thrombosis and pulmonary embolism recommendations from a national workshop. Am J Prev Med. 2010; 38 (4S): S502-S509. [ Links ]
6. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the international cooperative pulmonary embolism registry (ICOPER). Lancet. 1999; 353: 1386-1389. [ Links ]
7. Ríos JL, Vargas CA. Filtros en vena cava inferior. Acta Médica Grupo Ángeles . 2006; 4 (2): 93-99. [ Links ]
8. The PREPIC Study Group. Eight-year follow-up of patients with permanent vena cava filters in the prevention of pulmonary embolism the PREPIC (prévention du risque d'embolie pulmonaire par interruption cave) randomized study. Circulation. 2005; 112: 416-422. [ Links ]
9. Sarosiek S, Crowther M, Sloan MJ. Indications, complications, and management of inferior vena cava filters: the experience in 952 patients at an academic hospital with a level I Trauma Center. JAMA Intern Med. 2013; 173 (7): 513-517. [ Links ]
10. Zamora Y, Agramonte OM, Rodríguez L. Deficiencia de proteínas C y S: marcadores de riesgo trombótico. Rev Cubana Hematol Inmunol Hemoter. 2013; 29 (1): 40-47. [ Links ]
11. Sohn CB, Lee SW, Kim SH. Inferior vena cava filter thrombosis in protein-S deficiency patient due to withdrawal of anticoagulation therapy after operation. J Med Cases. 2013; 4 (9): 612-615. [ Links ]
12. Hayduk B, Tomkowski WZ, Malek G, Davidson BL. Vena cava filter occlusion and venous thromboembolism risk in persistently anticoagulated patients a prospective, observational cohort study. Chest. 2010; 137 (4): 877-882. [ Links ]
13. Usoh F, Hingorani A, Ascher E et al. Long-term follow-up for superior vena cava filter placement. Ann Vasc Surg. 2009; 23 (3): 350-354. [ Links ]
Nota
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/revmexcardiol














