Introducción
La química es una ciencia natural primordialmente visual, que tiene un vocabulario muy específico y que agrupa una gran cantidad de información en sus distintas ramas y especialidades. La química requiere que el estudiante establezca relaciones conceptuales entre sus tres niveles de comprensión (Talanquer, 2011): el mundo fenomenológico en el que suceden las reacciones químicas, su representación a nivel microscópico y la transcripción al lenguaje simbólico, que permite la escritura de los fenómenos químicos de una forma clara, sencilla, sintética y universal (Wu y Shah, 2004). Por este motivo, ya sea en el bachillerato o a nivel superior, la enseñanza experimental de la química ha sido siempre imprescindible pues permite vincular los tres niveles antes descritos (Vega Botto, 2018). En este contexto, se puede afirmar que las prácticas de laboratorio son un instrumento de aprendizaje muy importante pues permiten que el estudiante se apropie de los conocimientos desde una óptica empírica (Franky, 2009; Kirchoff, 2007).
Sin embargo, en muchos cursos introductorios de química a nivel superior el tema de la seguridad en el laboratorio recae en exposiciones meramente descriptivas o juntas informativas. La seguridad en los laboratorios de docencia es un tema tan relevante (Catalá, 1993; El Hajjaji, 2020) que debería ser lo único que tendría que enseñarse (Chewprecha, 1992). En este sentido, y pese a que los estudiantes de los primeros semestres se enfrentan a una gran cantidad de conceptos fundamentales que en conjunto proveerán las bases para su formación (Gasque, 2007), estos empiezan su quehacer científico en los laboratorios docentes sin conocer o sin una idea clara, en el mejor de los casos, de cómo se almacenan y desechan los reactivos químicos, o de cómo deben actuar ante un accidente o una situación de emergencia. Preguntas como ¿dónde están las salidas de emergencia?, ¿cómo se utilizan la regadera y el lavaojos?, ¿por qué es importante utilizar una bata de algodón y no de otro material?, ¿por qué los guantes de látex y de nitrilo son necesarios?, ¿son realmente indispensables los lentes de seguridad? o preguntas que abordan la reactividad de las sustancias, como ¿por qué el clorato de cadmio y el sulfato de cobre (II) no deben guardarse en lugares próximos? (Catalá, 1993), o ¿por qué se recomienda con tanta insistencia no darle de beber a un ácido? Se responden muchas veces desde la autoridad de respetar las reglas de seguridad y no desde la voluntad de comprender el porqué.
En esta contribución, se aborda la cuestión de la seguridad en el laboratorio a partir de un trabajo previo (Prat, 2018) seguido de experimentos sencillos y útiles, en los que los estudiantes podrán dimensionar la importancia de la búsqueda de las fichas de seguridad de las sustancias que van a utilizar, de emplear el equipo de protección personal de uso obligatorio y de las normas básicas para prevenir un accidente. Además, la práctica propone un ejercicio de tipo simulacro en el que los estudiantes, con la guía de su profesor, podrán reflexionar sobre cómo deben comportarse ante una serie de situaciones imprevistas. Se presenta en primer lugar el protocolo experimental dirigido al alumno con las preguntas que deberá responder a medida que hace los experimentos y, a continuación, se presenta un documento dirigido al profesor, donde se detallan los conceptos más importantes que deberá tener en cuenta a la hora de realizar la práctica, así como las respuestas a las preguntas de los cuestionarios.
Documento para el alumno
Seguridad en el laboratorio
Preguntas para responder al final de la sesión: ¿Por qué es importante conocer los equipos básicos de seguridad en el laboratorio?, ¿por qué se debe conocer la información de las fichas de seguridad de las sustancias con las que se trabaja? Se menciona constantemente que no debe agregarse agua al ácido, pero ¿por qué?
Objetivos
Conocer el equipo básico de seguridad de un laboratorio.
Analizar la importancia de emplear el equipo de seguridad correcto en el laboratorio.
Aprender a leer las hojas de seguridad de diferentes sustancias para tomar las medidas pertinentes cuando se trabaja con ellas en el laboratorio.
Reaccionar razonadamente en caso de un accidente en el laboratorio.
Cuestionario previo
1. Busca la definición de los siguientes términos:
2. ¿Sabrías ubicar en el laboratorio los siguientes equipos de protección? Marca la casilla correspondiente en cada caso.
3. ¿Cuál es el equipo de protección personal de uso obligatorio que debes utilizar en cualquier laboratorio?
_______________________________________________________________________________________________________
4. ¿Qué tipos de guantes se pueden utilizar en un laboratorio de docencia o de investigación?, ¿Cuáles son sus principales usos y diferencias?
_______________________________________________________________________________________________________
5. Investiga los principales accidentes que pueden ocurrir en un laboratorio. Enuméralos.
6. En caso de ocurrir un accidente, ¿conoces dónde se encuentran las enfermerías de la Facultad de Química? Busca y anota en tu bitácora el contacto de Protección Civil.
_______________________________________________________________________________________________________
7. Busca las fichas de seguridad de los siguientes compuestos:
Procedimiento experimental
Durante la práctica deberás portar completo el equipo de protección personal (lentes de seguridad, bata de algodón y guantes de látex). En esta práctica trabajarás con ácidos y bases concentrados, por lo que deberás tener cuidado y seguir las indicaciones de tu profesor.
1. Protección y seguridad de los guantes de látex y nitrilo
Clasifica las sustancias como ácidos y bases.
Corta con las tijeras los dedos de los guantes de látex y de nitrilo.
Agrega 10 mL de cada sustancia en los vasos de precipitados.
Sumerge un pedazo de guante de látex y otro de nitrilo en cada uno de los vasos de precipitados.
Cronometra 5 minutos y con ayuda de las pinzas retira los pedazos de guante y analiza. Después de analizado el guante, vuelve a sumergirlo en el vaso de precipitados.
Repite la operación cada 5 minutos hasta que se cumplan 40 minutos y anota tus observaciones en la bitácora.
Tratamiento de residuos
R1: Coloca las disoluciones de los disolventes utilizados en los recipientes dispuestos para ello.
Cuestionario
1. ¿Hay alguna diferencia con respecto a la respuesta a los ácidos y las bases en las condiciones de los guantes?
_______________________________________________________________________________________________________
2. ¿Cuál es el efecto de la concentración del ácido clorhídrico en las condiciones de los guantes con respecto al tiempo?
_______________________________________________________________________________________________________
3. ¿El tiempo de exposición es una variable importante de acuerdo con tus observaciones?
_______________________________________________________________________________________________________
4. ¿En qué casos hay un comportamiento distinto al comparar los guantes de nitrilo y látex?
_______________________________________________________________________________________________________
2. Protección y seguridad de la bata de laboratorio
Corta con las tijeras los pedazos de bata en tres, de tal modo que tengas 3 pedazos de bata de algodón y 3 pedazos de bata sintética.
Con el mechero, quema un pedazo de cada una de las batas. Cronometra el tiempo que tarda en quemarse cada una de las batas y anota tus observaciones en tu bitácora.
Con cuidado agrega unas gotas de ácido sulfúrico concentrado en las batas de algodón y sintética, respectivamente. Cronometra el tiempo de exposición y anota en tu bitácora los efectos que produce el ácido en cada uno de los materiales.
Repite la operación con el hidróxido de sodio.
Tratamiento de residuos
R2: Coloca los trozos de bata en una bolsa de plástico cerrada y entrégasela al laboratorista.
Cuestionario
1. ¿Hay diferencias importantes respecto al tiempo qué tardan las batas en quemarse?
_______________________________________________________________________________________________________
2. Con respecto a las sustancias químicas, ¿cuál es el efecto del H2SO4 concentrado en las batas de algodón y sintética?, ¿cuál es el efecto del NaOH?
_______________________________________________________________________________________________________
3. Investiga el material de la bata sintética y propón una explicación de porqué su utilización es indebida en un laboratorio de docencia e investigación en química.
_______________________________________________________________________________________________________
3. Protección de los lentes de seguridad
Infla los globos de tal forma que puedas colocarles los lentes convencionales y de protección. Haz una marca con un plumón para mostrar donde estarían los ojos.
Con la piseta de agua destilada rocía ambos globos. Después retira los lentes y anota tus observaciones para cada caso.
Prende el encendedor y aproxima los dos tipos de lentes y los lentes de contacto. Anota tus observaciones.
En un vaso de precipitados de 25 mL, añade 2 mL de ácido sulfúrico concentrado.
Con ayuda de la pipeta Pasteur, toma un poco ácido sulfúrico concentrado y deja caer unas gotas sobre los dos tipos de lentes y los lentes de contacto. Anota tus observaciones.
Realiza el mismo experimento, pero esta vez con hidróxido de sodio.
Tratamiento de residuos
R3: Regresa al laboratorista los lentes de seguridad y los lentes convencionales secos y limpios que utilizaste en este experimento. Los lentes de contacto los puedes desechar.
Cuestionario
1. ¿Por qué el uso de lentes convencionales no es suficiente cuando se trabaja en el laboratorio?
_______________________________________________________________________________________________________
2. A partir de tus observaciones, describe la resistencia de los lentes de seguridad.
_______________________________________________________________________________________________________
3. ¿Qué sucede en cada caso con los lentes de contacto?
_______________________________________________________________________________________________________
4. Ordena de manera decreciente la resistencia al choque, la resistencia térmica y la resistencia química de los lentes de seguridad, los lentes convencionales y los lentes de contacto.
_______________________________________________________________________________________________________
4. Primero el agua, luego el ácido, de otro modo no será plácido
1. Agrega 25 mL de agua destilada al vaso de precipitados de 50 mL.
2. Agrega 10 mL de ácido sulfúrico concentrado al vaso de precipitados de 25 mL.
3. Mide la temperatura del agua contenida en el vaso de precipitados de 50 mL.
4. Con mucho cuidado, agrega el H2SO4 concentrado al agua.
5. Completa la siguiente tabla.
6. Repite el experimento, ahora con 15 mL de agua y 5 mL de ácido sulfúrico.
| Tiempo (min) | Temperatura (ºC) | Sustancias | Temperatura (ºC) | Sustancias |
|---|---|---|---|---|
| 0 | 25 mL H2O | 25 mL H2O | ||
| 1 | 25 mL H2O y 10 mL H2SO4 conc. | 15 mL H2O y 5 mL H2SO4 conc. | ||
| 2 | ||||
| 3 | ||||
| 4 | ||||
| 5 | ||||
| 6 | ||||
| 7 | ||||
| 8 | ||||
| 9 | ||||
| 10 |
Tratamiento de residuos
R4: Coloca las disoluciones utilizadas en los recipientes dispuestos por el laboratorista, estas se neutralizarán más tarde para poder desecharlas.
Cuestionario
1. ¿Cuál es el efecto del ácido sulfúrico concentrado en la temperatura de la disolución?
_______________________________________________________________________________________________________
2. Este es un ejemplo de reacción ¿endotérmica o exotérmica?
_______________________________________________________________________________________________________
3. Escribe la ecuación química balanceada que da cuenta del fenómeno que observaste.
_______________________________________________________________________________________________________
4. Investiga las densidades del agua y del ácido sulfúrico y, con base en estas, propón una explicación de porqué el adagio “primero el agua, luego el ácido, de otro modo no será plácido”.
_______________________________________________________________________________________________________
5. Simulacro: saber reaccionar ante un accidente.
Lee los siguientes textos y responde en cada caso a las preguntas.
Cuestionario final
1. ¿Qué colores aparecen y qué significado tiene en el rombo de seguridad de las sustancias químicas?
_______________________________________________________________________________________________________
2. ¿Qué significa SGA (en inglés y en español) y para que se utiliza?
_______________________________________________________________________________________________________
3. A grandes rasgos, ¿qué información contiene una hoja de seguridad?
_______________________________________________________________________________________________________
4. Investiga cómo se clasifican, se disponen y se eliminan los residuos químicos en los laboratorios de Química General I de la Facultad.
_______________________________________________________________________________________________________
Documento para el profesor
Respuestas a las preguntas y discusión de la práctica
La práctica se compone de seis actividades, la primera corresponde al cuestionario previo que el alumno debe realizar antes de llevar a cabo la práctica. A continuación, hay tres actividades experimentales más una cuarta en torno a los riesgos y accidentes que pueden ocurrir en un laboratorio de docencia o de investigación y finalmente un cuestionario final para redondear la práctica y también para ir más allá en el conocimiento. Con respecto al cuestionario previo, es importante que el estudiante identifique la diferencia entre riesgo y accidente o entre precaución y prevención. También que, desde el punto de vista del lenguaje, se familiarice con los términos corrosivo, inflamable, tóxico y explosivo. Las definiciones de acuerdo con la Real Academia Española de la lengua se enlistan en la Tabla 1.
Tabla 1 Definiciones de los términos preguntados en la pregunta 1.
| Seguridad: Cualidad de seguro. Libre y exento de riesgo. Lugar libre de todo peligro. | Riesgo: Contingencia o proximidad de un daño, situación en la que el individuo está expuesto a una situación de peligro. |
| Accidente: Suceso eventual que altera el orden regular de las cosas. Suceso eventual o acción de que resulta daño involuntario para las personas o las cosas. | Precaución: Reserva o cautela para evitar o prevenir los inconvenientes, dificultades o daños que pueden temerse. |
| Prevención: Acción y efecto de prevenir. Preparación y disposición que se hace anticipadamente para evitar un riesgo o ejecutar algo. | |
| Corrosivo: Que corroe o tiene la propiedad de corroer. Desgastar lentamente algo como royéndolo. | Inflamable: Dicho de una sustancia que se enciende fácilmente y desprende llamas. |
| Tóxico: Perteneciente o relativo a una sustancia tóxica, que contiene o produce envenenamiento. | Explosivo: Dicho de una sustancia que hace o puede hacer una explosión. |
Las preguntas 2 y 3 tienen por objetivo que el alumno reflexione acerca de la importancia de conocer las salidas de emergencias, así como los equipos de protección del laboratorio (como la regadera, el lavaojos, las mantas anti-fuego y los extintores), y también personales (lentes de seguridad, bata de algodón debajo de la rodilla, guantes según convenga, la utilización de calzado cerrado y apropiado, careta y chaquetas especiales). Además, como parte de esta pregunta, el alumno deberá saber que no pueden usarse lentes de contacto ni considerar los lentes de vista como lentes de protección, blusas escotadas, o tener el cabello suelto, y si hay algún equipo faltante, deberá reflexionar con sus compañeros y luego con la guía del profesor acerca de esa situación.
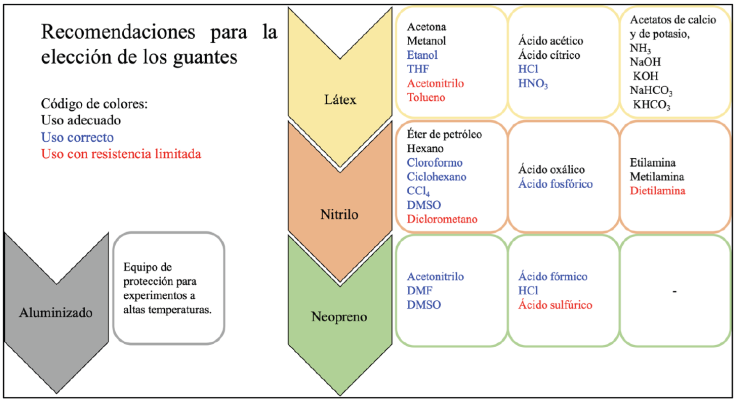
Con respecto a la pregunta 4, se pueden utilizar hasta cuatro tipos diferentes de guantes en un laboratorio de docencia o de investigación en química:
Las recomendaciones para la elección adecuada de los guantes se encuentran descritas en la Figura 1. Durante la sesión experimental se trabajará únicamente con los guantes de látex y nitrilo pues son los más comunes en los laboratorios de docencia a nivel universitario y en los laboratorios de investigación básica.
El objetivo de la pregunta 5 es concientizar a los estudiantes de los diversos tipos de accidentes que pueden ocurrir en un laboratorio. A continuación, se enumeran dichos accidentes:
Derrames
Quemaduras químicas
Quemaduras térmicas
Quemaduras químicas y térmicas
Inhalación de vapores de gases
Incendios
Debido a un sismo pueden ocurrir ciertos accidentes
Los estudiantes que cursen cualquier laboratorio de química deben estar al tanto de los lugares en los que se puede atender una emergencia. En el caso de la Facultad de Química de la UNAM, hay dos enfermerías; la primera situada en el Edificio A, Planta Baja, pasillo de entrada al laboratorio de Tecnología Farmacéutica (Servicio de 8:30 a 21:00 horas), y la segunda en el Edificio D, Planta Baja, pasillo de laboratorios, último cubículo a la izquierda (Servicio de 8:30 a 14:30 horas). Igualmente, que conozcan el teléfono de la Coordinación de Protección Civil de la Universidad (5622-3899 ext. 44023).
La pregunta 7 del cuestionario previo tiene la finalidad de que los estudiantes busquen y se familiaricen con la búsqueda, lectura y comprensión de las fichas de seguridad. En este caso, todas las sustancias que se van a utilizar, ya sea de forma experimental o con fines didácticas, durante la práctica. A continuación, se discuten los resultados más relevantes de las cuatro actividades a realizarse durante la sesión experimental.
1. Protección y seguridad de los guantes de látex y nitrilo
Los guantes de nitrilo son más efectivos que los de látex cuando se trata de sustancias más corrosivas. En cualquier caso, tanto la concentración como el tiempo de exposición a las sustancias es crucial para mantenerse fuera de peligro.
2. Protección y seguridad de la bata de laboratorio
Se debe recomendar a los estudiantes el uso obligatorio de una bata de algodón en vez de aquellas fabricadas con materiales sintéticos, pues estas últimas pueden inflamarse con cierta facilidad y en ellas se pueden llevar a cabo reacciones químicas.
3. Protección de los lentes de seguridad
El uso de los lentes de seguridad es indispensable para garantizar la protección de los ojos. A diferencia de los lentes convencionales, protegen un área del rostro mayor y evitan que las proyecciones químicas alcancen los ojos. Por su parte, los lentes de contacto deben estar completamente prohibidos en el laboratorio puesto que además de su menor resistencia impiden el lavado correcto de ojos en caso de un accidente.
4. Primero el agua, luego el ácido, de otro modo no será plácido
La reacción química balanceada que se lleva a cabo se representa por la siguiente ecuación química:
Se trata de una reacción exotérmica, en la que se detecta un aumento importante de la temperatura.
Se debe concientizar a los estudiantes de que, si la reacción en el orden correcto es de por sí riesgosa, cuando ocurre en el orden incorrecto puede ser muy peligrosa. Debido a las densidades del agua y del ácido, cuando se agrega primero el ácido y luego el agua, la reacción química ocurre en la interfaz ácido-agua produciendo violentas salpicaduras.
5. Simulacro: saber reaccionar ante un accidente
Es importante que los estudiantes de los primeros semestres de la carrera de química y afines comprendan los riesgos y consecuencias de no adoptar las medidas de seguridad e higiene básicas para realizar las prácticas de laboratorio. Igualmente deben comprender que, incluso tomando todas las precauciones posibles, los laboratorios son lugares donde los riesgos existen y los accidentes por mucho que intenten prevenirse, pueden ocurrir.
La campana de extracción es un equipo de protección colectiva que cuenta con ventilación local y que está diseñada para limitar la exposición a sustancias químicas. Las campanas de extracción evitan malos olores, inhalación de sustancias tóxicas, incendio, explosiones, derrames y salpicaduras, y permiten trabajar con sustancias volátiles.
Cuestionario final
1. ¿Qué colores aparecen y qué significado tiene en el rombo de seguridad de las sustancias químicas?
Los rombos de seguridad de las sustancias químicas se componen de cuatro colores: amarillo, azul, blanco y rojo que significan reactividad, salud, riesgos especiales e inflamabilidad, respectivamente.
2. ¿Qué significa SGA (en inglés y en español) y para que se utiliza?
SGA significa Sistema Globalmente Armonizado de clasificación y productos químicos; en inglés GHS, Global Harmonized System. Se trata de un sistema integral de comunicación de riesgos, cuyo cumplimiento es obligatorio en el ámbito laboral y académico. El sistema SGA se basa en pictogramas que describen los peligros de las sustancias químicas (Figura 2). Los riesgos se enumeran a continuación:
Daños al medio ambiente
Corrosivo
Explosivo
Comburente
Gas a presión
Daños a la salud
Inflamable
Tóxico
Peligros particulares

Figura 2 El sistema SGA se basa en pictogramas que describen los peligros de las sustancias químicas.
3. A grandes rasgos, ¿qué información contiene una hoja de seguridad?
Las hojas de seguridad se componen de 16 puntos que sirven principalmente para orientar al usuario sobre las medidas que se deben tomar para el uso correcto de sustancias químicas. Entre estas medidas destaca la información sobre estabilidad y reactividad, así como las indicaciones que se deben tomar en caso de ingesta, inhalación y derrames accidentales, además de las medidas contra incendios y la información toxicológica más relevante. Asimismo, las hojas de seguridad contienen la principal información fisicoquímica de cada compuesto, como la densidad o la solubilidad en agua, por ejemplo.
4. Investiga cómo se clasifican, se disponen y se eliminan los residuos químicos en los laboratorios de Química General I de la Facultad.
Los estudiantes en equipo deberán informarse acerca de la clasificación, disposición y eliminación de los residuos que emiten. De esta forma podrán igualmente conocer más a fondo el laboratorio en el que trabajan.
Conclusiones
A través de esta práctica se espera que los estudiantes de los primeros semestres de la carrera de Química y afines aprendan la importancia del uso correcto del equipo de protección obligatorio (bata de algodón, guantes de nitrilo y lentes de seguridad), a identificar los principales peligros que representa trabajar en un laboratorio de docencia o investigación, así como a adoptar las medidas de precaución y conocer las acciones a emprender en caso de un accidente. Se espera que los estudiantes comprendan empíricamente porqué las medidas de seguridad son fundamentales. De igual manera, que adopten actitudes de prevención y de reacción ante los diferentes riesgos presentes en un laboratorio de química.











 nueva página del texto (beta)
nueva página del texto (beta)