Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Educación química
versión impresa ISSN 0187-893X
Educ. quím vol.23 supl.2 Ciudad de México may. 2012
Áreas emergentes de la educación química
[Naturaleza de la química: historia y filosofía de la química]
De la construcción del conocimiento científico a su enseñanza. Distintas explicaciones sobre la estructura del benceno
From scientific knowledge construction to teaching. Several explanations about benzene structure
Andrea Soledad Farré1 y María Gabriela Lorenzo1,2
1 Centro de Investigación y Apoyo a la Educación Científica (CIAEC). Facultad de Farmacia y Bioquímica. Universidad de Buenos Aires.
2 Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). Junín 956 (1113). Ciudad Autónoma de Buenos Aires. Argentina. Correo electrónico: glorenzo@ffyb.uba.ar
Resumen
La revisión de la evolución histórica para representar cierto compuesto, en este caso benceno, pone de manifiesto las diferentes teorías que pugnaron por dar las mejores explicaciones, mostrando una visión dinámica acerca de la construcción del conocimiento científico. Los principales factores que han influido sobre el conocimiento acerca de la estructura del benceno son la composición elemental y el establecimiento de la fórmula empírica, el reconocimiento de isómeros, la reactividad química, la disponibilidad de nuevos dispositivos tecnológicos y las teorías de enlace químico (teoría estructural, teorías atómicas, teoría de enlace de valencia y la teoría de orbitales moleculares). Este trabajo podrá ser de utilidad para la capacitación de profesores y tal vez eche luz sobre algunas dificultades de aprendizaje de los estudiantes. También, resulta un modelo útil para que los profesores puedan desarrollar futuras investigaciones junto con sus estudiantes, incluyendo activamente al conocimiento meta-científico en sus prácticas de aula.
Palabras clave: estructura del benceno, conocimiento meta-científico, química orgánica, construcción del conocimiento científico, enseñanza universitaria.
Abstract
Reviewing the historical development to represent a compound, in this case benzene, displays the different theories that struggled to give the best explanations, showing a dynamic vision for the scientific knowledge construction. The elemental composition and the establishment of the empirical formula, the recognition of isomers, the chemical reactivity, the availability of new technological devices and chemical bond theories (the structural theory, atomic theories, valence bond theory and molecular orbital theory) are the main factors that influenced knowledge about the structure of benzene. This work can be useful in teachers' training and perhaps enlightens on some students learning difficulties. This also is a useful model for future research that teachers can develop with their students including the meta-scientific knowledge actively in the classroom.
Keywords: benzene structure, meta-scientific knowledge, organic chemistry, scientific knowledge construction, university teaching.
¿Qué aporta la historia de la química a su enseñanza?
Resulta promisorio que los saberes metacientíficos como la epistemología, la historia y la filosofía de la ciencia hayan comenzado a captar el interés de los docentes de química dado que los diversos modos de construcción del conocimiento disciplinar no suelen ser discutidos en la formación de profesores (Quintanilla y otros, 2007). Existen motivos conceptual-científicos y epistemológico-metacientíficos (Lombardi, 2009) que revelan el carácter cambiante y perfectible de la ciencia como actividad humana (Erduran, 2001), que justifican su inclusión en las clases de química.
No obstante, los profesores suelen detenerse principalmente en el aspecto motivacional-psicológico para convertir las clases en un espacio más estimulante y emplean los libros de texto, como recurso central para introducir la historia en el aula. Pero dado que, en su amplia mayoría dichos textos desatienden el desarrollo de la ciencia, emplean una retórica de conclusiones (Niaz, 2005), y combinan diferentes programas de investigación en sus explicaciones, no siempre de manera explícita usando modelos híbridos (Justi y Gilbert, 1999), no se favorece una visión contextualizada que considere simultáneamente las dimensiones temporoespaciales, políticas y socioculturales, resultando contraproducente al reforzar los estereotipos de sentido común sobre la ciencia y el trabajo de los científicos (de Rezende y Silva, 2007). Es por ello que la incorporación de los saberes metacientíficos a las clases debe necesariamente responder a criterios didácticos que reflexionen sobre los contenidos, su surgimiento, su validación y su inclusión en la enseñanza a lo largo del tiempo (Erduran y otros, 2005), planteando un trabajo conjunto entre la investigación en didáctica de la ciencia y la docencia (Farré y Lorenzo, 2010). De este modo se contribuye a la toma de conciencia sobre las diversas transformaciones que fueron sufriendo los contenidos que hoy se enseñan y, por tanto, es esperable que repercuta en un mejor aprendizaje para los estudiantes. Sin embargo, aún es una tarea pendiente en todos los niveles del sistema educativo y especialmente en el ámbito universitario, como por ejemplo en la química orgánica superior.
La química reúne una pluralidad de tradiciones que les permiten a los químicos llevar adelante su trabajo (Schummer, 1998). Una de las más importantes es el uso de símbolos para la comunicación de sus ideas, ya sea al planificar una investigación o al reflexionar sobre unos resultados, originando el lenguaje químico. Este lenguaje está constituido por un complejo sistema de representación en permanente interacción con los modelos teóricos de la química. Es un valioso instrumento para pensar, crear y explicar lo que ya se sabe, pero también es un sistema de recursos para la creación de nuevos significados (Weininger, 1998) debido a la inextricable relación entre los símbolos químicos para representar sustancias y las sustancias mismas (Jacob, 2001). Así, la visión epistemológica viene dada porque el modo como se representan los conceptos en ciencias, evidencia el carácter evolutivo del pensamiento sobre ellos. Por tanto, cuando se desarrollan determinados contenidos se emplea un lenguaje especificado por el modelo teórico que explícita o implícitamente se adopta. Por eso, revisar el camino recorrido para representar un compuesto, en este caso el benceno, permite revelar las diferentes teorías que pugnaron por dar las mejores explicaciones, las marchas y contramarchas en la construcción del conocimiento científico, y tal vez echar luz sobre ciertas dificultades que poseen los estudiantes para su aprendizaje (Garritz, 2010).
Una fórmula química ¿esconde más de lo que muestra?
A finales del siglo XVIII comienza a hacerse evidente la necesidad de comunicación de datos e ideas para asegurar la continuidad de los procesos encontrados exitosos y no invertir esfuerzos y recursos en aquellos problemas que ya hubieran sido resueltos por otros. Así, los químicos instituyeron diversos símbolos para referirse a objetos microscópicos como los átomos y las moléculas creando un verdadero sistema representacional.
Los sistemas de representación químicos están basados en un pequeño repertorio de símbolos, fundamentalmente de dos tipos: por una lado, aquellos que representan a los átomos y, por otro, los que representan enlaces químicos (Weininger, 1998). Las fórmulas químicas para representar sustancias son parte esencial de este lenguaje. Debe quedar claro entonces que el grado de refinamiento de una fórmula química depende del refinamiento de las reglas sintácticas, basado en el trabajo experimental y la introducción de las leyes generales de la química y sus teorías. Por ello, el uso de un tipo particular de fórmulas condiciona el tipo de análisis que puede hacerse, ya que cada tipo de representación conlleva una información diferente.
El siglo XIX marca el origen de la química orgánica como ciencia. Alrededor de 1850, los químicos se preguntaban sobre la constitución y propiedades de los compuestos orgánicos, muy diferentes a los provenientes del mundo mineral. Numerosos químicos durante este período comenzaron a pensar en la forma de traducir las evidencias macroscópicas del trabajo en el laboratorio en el mundo invisible de átomos y moléculas haciendo uso de representaciones. Esta traducción de observaciones empíricas implicaba forzosamente el convencimiento de la existencia de ese submicromundo que serviría de hipótesis para la interpretación de los nuevos datos experimentales en una época signada por el predominio de las ideas positivistas. Si bien el uso de símbolos para representar compuestos químicos ya era una práctica habitual, persistían severas limitaciones para el caso de los compuestos orgánicos (Rocke, 2010).
Por aquel entonces comenzaba a gestarse la idea de que el arreglo particular de los átomos, al que Butlerov (1828-1886) había denominado estructura química, era el responsable de las propiedades físicas y químicas de los compuestos orgánicos, dando origen a la teoría estructural que logró imponerse a la teoría dualista-electroquímica. Sólo el desarrollo de las concepciones sobre la estructura molecular permitió una expansión en paralelo sobre los recursos representacionales. Por eso, debido a que la nomenclatura disponible resultaba insuficiente para abarcar los conceptos esenciales de la nueva teoría, las fórmulas estructurales tuvieron que desarrollarse en forma simultánea a la teoría estructural (Weininger, 1998). Así, el sistema de las fórmulas estructurales desarrollado en la química orgánica desde 1860 hasta nuestros días es, en cierto modo, una aproximación a la teoría molecular, tan útil, que parece representar a las moléculas mismas. Además, este sistema permite representar relaciones químicas entre sustancias y entre clases de sustancias (Schummer, 1998).
Hoy en día para quienes trabajan con sustancias químicas (bioquímicos, farmacéuticos, ingenieros, químicos) existe una correlación entre las fórmulas químicas y las sustancias. En ellas pueden reconocerse tres tipos de relaciones: a) Relación cuantitativa: indica en qué proporción se unen los átomos de cada clase en una molécula (fórmula molecular) o en una mínima unidad estructural (fórmula empírica); b) Relación cualitativa: La fórmula ofrece la pauta de unión entre los átomos, evidenciando la conectividad entre ellos, y c) Relación espacial: Informa sobre el arreglo espacial de los átomos con referencia a otros átomos de la misma molécula o a la molécula como un todo.
A medida que se avanza de un tipo de relación a otra, el nivel siguiente incluye al anterior, o sea que contiene mayor información. Simultáneamente, la forma de representar sobre el papel cada una de dichas relaciones se modifica según el nivel al cual hace referencia. Pero, para alcanzar este grado de refinamiento en las relaciones representadas fue necesario un largo proceso de construcción del conocimiento en la que participaron numerosos científicos como veremos más adelante.
Al abrigo de este amplio marco de referencia, en este artículo analizamos el recorrido histórico en el desarrollo del concepto estructura del benceno con el propósito de reflexionar y cuestionar los siguientes supuestos:
1. La consulta de fuentes primarias y secundarias ofrece una visión dinámica y contextualizada de la ciencia.
2. La reconstrucción del desarrollo histórico de un concepto ayuda a instalar una visión epistemológica de la disciplina.
3. La incorporación de los conocimientos metacientíficos sobre tópicos específicos incrementa el conocimiento pedagógico del contenido (CPC) de los profesores (Garritz y Trinidad, 2004).
4. La conjunción de los supuestos de uno a tres, ofrece mejores y mayores oportunidades de aprendizaje a los estudiantes.
En este artículo centraremos nuestra atención en el ámbito universitario, por estar poco explorado (Bodner y Waver, 2008). A pesar de ser instituciones de investigación, la incorporación de los saberes metacientíficos en las universidades debe superar los obstáculos de la rigidez de la tradición curricular, la falta de formación pedagógica de la mayoría de los profesores y la alta especificidad y complejidad de los contenidos que se abordan en este nivel, como por ejemplo los que pertenecen al ámbito de la química orgánica de nivel superior.
Metodología
Para estudiar el desarrollo evolutivo del concepto estructura del benceno, inicialmente realizamos un análisis de fuentes primarias y secundarias para delimitar los modelos históricos sobre la estructura del benceno surgidos de las distintas concepciones de unión entre átomos. En una segunda etapa analizamos las páginas correspondientes al tema elegido de cinco libros de texto universitarios de química orgánica de uso frecuente entre nuestro alumnado (cuadro 1), en sus ediciones en español disponibles en las bibliotecas de la Universidad de Buenos Aires, para examinar la presencia de ese desarrollo histórico en sus explicaciones.

Resultados
Bajo el nombre de bencina primero y luego de benzol, el benceno era ya conocido desde 1825 como una sustancia presente en el gas de alumbrado, que también podía obtenerse a partir de la esencia de benjuí. El interés en esta sustancia creció debido a su importancia comercial e industrial lo que motivó un incremento de las investigaciones. Sin embargo, pasados unos años se convirtió en un problema para la comunidad de químicos porque no lograban explicar adecuadamente la naturaleza de sus propiedades. Los datos empíricos obtenidos del arduo trabajo experimental, resultaban anómalos o al menos difíciles de interpretar con los conocimientos de la época. Fueron necesarios muchos años para que los químicos dieran con una explicación que permitiera comprender las propiedades de este compuesto.
Como ya hemos mencionado, a partir del desarrollo de la teoría estructural en 1861 surgen las fórmulas estructurales originadas en el trabajo de tesis de Alexander Crum Brown (1838-1922) que luego fueron popularizadas en los libros de texto de químicos influyentes del momento (Jensen, 2009). Es importante resaltar que para la mayoría de los científicos que trabajaban dentro del programa estas fórmulas solamente representaban los átomos constituyentes sin mostrar una relación espacial entre ellos (Rocke, 2010).
Entre los factores que influyeron sobre el conocimiento acerca de la estructura del benceno pueden reconocerse la determinación de su composición elemental y el establecimiento de su fórmula empírica, el reconocimiento de la existencia de isómeros, las propiedades químicas particulares, la disponibilidad de nuevos dispositivos tecnológicos aplicados a la investigación química (desde el análisis elemental hasta la cristalografía y los métodos espectroscópicos) y el desarrollo de diversas teorías para explicar el enlace químico: la teoría estructural, las teorías electrónicas y las derivadas de la mecánica cuántica (teoría de enlace de valencia -TEV) y teoría de orbitales moleculares -TOM). A continuación presentaremos a estos factores en interacción en un relato cronológico, que de ningún modo pretende ser exhaustivo, sobre la construcción del conocimiento acerca de la estructura del benceno desde sus comienzos hasta nuestros días.
La estructura del benceno en la segunda mitad del siglo XIX
Durante el período de apogeo de la teoría estructural se propusieron distintas explicaciones sobre la estructura del benceno (figura 1). Dadas las limitaciones de espacio, nos centraremos en los trabajos de Kekulé (1829-1896).
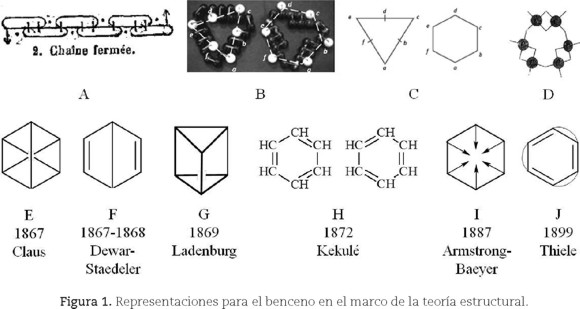
En el artículo fundacional publicado en 1858 (cuadro 1-I), Kekulé planteaba por vez primera la tetravalencia del átomo de carbono y la posibilidad de unión entre átomos de carbono (atomicidad) formando cadenas, posicionándose a la vanguardia de la teoría estructural.1 Esto implicaba necesariamente la aceptación de los átomos como unidades estructurales de los compuestos y de su capacidad de combinación o valencia. En 1865 propone una estructura cíclica para el benceno constituida por seis carbonos formando una cadena cerrada que en total poseía seis valencias insaturadas dispuestas de manera conjugada, 1/1; 2/2; 1/1; 2/2; etc., que podía representarse con una fórmula tipo salchicha (figura 2-A). Poco después, el propio Kekulé le otorgó propiedades geométricas a la estructura cíclica del benceno postulando las formas de un triángulo o de un hexágono2 seguramente surgidas de la forma que adquirían sus modelos moleculares al ser dibujados sobre un papel. Es interesante observar la estrecha relación entre la propuesta teórica planteada, la necesidad de representar las ideas gráficamente y el importante rol desempeñado por los modelos moleculares utilizados en sus clases (figuras 1-B3 y 1-C).
Un año más tarde, las investigaciones lo llevaron a incorporar el carácter simétrico de la estructura en el arreglo hexagonal4 (figura 1-D) (Rocke, 1985, 2010). Sin embargo, la existencia de un único isómero orto-disustituido5 daba serias dificultades de interpretación y ninguna de las propuestas de la teoría estructural podía explicar la diferencia de reactividad del benceno con los alquenos. Estos problemas llevaron a procurar otras explicaciones plausibles para la estructura del benceno (figuras 1-E y 1-J). Entre ellas, las que tuvieron mayor consenso fueron las planteadas por Kekulé en 1872 (figura 1-H), conocida como hipótesis oscilante, que entendía al benceno como una estructura dinámica en donde los enlaces dobles y simples cambiaban de posición en el tiempo (Gero, 1954), la planteada por Armstrong y retomada por Baeyer (figura 1-I), que tuvo cierta popularidad entre 1890 y 1900, y la de Thiele (figura 1-J) que tuvo gran aceptación hacia finales del siglo XIX y principios del XX (Brush, 1999a).
La estructura del benceno a partir de las primeras teorías atómicas
A pesar de los esfuerzos experimentales, la teoría estructural no pudo explicar la estructura del benceno; sin embargo, todos aceptaban al benceno como un ciclo hexagonal de seis carbonos tetravalentes. Hasta 1910 casi 1300 trabajos se habían publicado tratando de resolver el problema pero sin éxito (Saltzman, 1974).
A partir del reconocimiento del electrón como partícula componente del átomo, surgieron diferentes modelos atómicos cuyo principal aporte consistió en la redescripción del concepto de valencia, lo que permitió revisar las fórmulas propuestas por la teoría estructural, resignificar algunas y descartar otras.
En el marco del modelo atómico del "budín de pasas" de Thomson (1856-1940) se interpretaba a la valencia como la habilidad de los átomos para trasferir electrones; por tanto, los enlaces químicos se consideraban como uniones polares (Brock, 1998). Aplicando este modelo a la constitución del benceno, Harry Fry (1878-1949) reinterpretó las fórmulas estructurales y en 1921 propuso una estructura iónica (figura 2-A).
A partir de la propuesta del modelo atómico de Bohr (1885-1962), Gilbert Lewis (1875-1946), presentó su reconocida teoría en la cual el enlace podía deberse a la transferencia de electrones o también a la capacidad de compartirlos que poseen los átomos. Entre 1920 y 1930 este concepto se extendió a la formulación de los compuestos orgánicos y, por tanto, al benceno; algunos lo atribuyen a los trabajos de Robert Robinson (1886-1975) (Saltzman, 1974; Brush, 1999a, Russell, 2004) y otros a los de Ernest Crocker (1888-1964) en su trabajo de 1922, Aplicación de la teoría del octeto a compuestos aromáticos de un solo anillo (figura 2-B) (Kikuchi, 1997; Balaban y otros, 2005). Ambos plantearon una relación causal entre las propiedades especiales del benceno con el sexteto aromático (Robinson) o con los seis electrones aromáticos (Crocker).
Por su parte, en 1926 Linus Pauling (1901-1994) supo aplicar la teoría de Lewis para postular una explicación para la estructura del benceno (figura 2-E) tomando como punto de partida la propuesta anterior de Claus (figura 2-E) considerando a los enlaces covalentes simples como un par de electrones orbitando dos núcleos atómicos, y sugiriendo que su alta estabilidad se debiera probablemente a su semejanza con los arreglos electrónicos del neón o el argón.
Asimismo, Christopher Ingold (1893-1970), retomando una perspectiva dinámica, postuló una combinación de las estructuras de Kekulé y de Dewar en equilibrio para el benceno (figura 2-C), llamando a esta descripción estado mesomérico6 (Brock, 1998).
La estructura del benceno en el marco de la mecánica cuántica
Las primeras teorías electrónicas de enlace tampoco pudieron dar cuenta de una estructura para el benceno a partir de la cual se pudieran explicar sus propiedades químicas. con el surgimiento de la mecánica cuántica, el benceno empezó ser estudiado bajo dos programas de investigación competidores, la teoría de enlace de valencia (TEV) y la teoría de orbitales moleculares (TOM), que una vez más redescribieron y resignificaron el concepto de valencia y las fórmulas estructurales.
En 1931 Eric Hückel (1896-1980), utilizando tanto la TEV como la TOM concluyó que el mejor tratamiento cuantitativo para explicar el sexteto aromático era la TOM debido a que de acuerdo con esta teoría estos electrones podían ser interpretados como una capa cerrada, análoga a la de los gases nobles y así poder entender la estabilidad que presenta. A partir de este trabajo dedujo su famosa regla (de Hückel), con la cual se podía entender el hecho de que una molécula cíclica con dobles enlaces conjugados como el ciclooctatetraeno no tuviera las mismas propiedades químicas que el benceno (Kikuchi, 1997). A partir de sus investigaciones desarrolló un programa reduccionista según el cual la química orgánica podía ser interpretada desde la mecánica cuántica. Sin embargo, sus publicaciones, basadas en fórmulas matemáticas y sin ilustraciones, resultaban demasiado técnicas, y tal vez por ello los químicos no prestaron atención a sus aportes y, en 1937 Hückel terminó abandonando este tipo de investigaciones (Simões, 2008a).
En 1933, Pauling y Wheland (1907-1972) analizaron la estabilidad de los electrones ϖ del benceno en el marco de la TEV, y concluyeron que era el resultado de la resonancia de cinco estructuras canónicas, de las cuales las estructuras de Kekulé eran las que más contribuían (figura 3). En ese trabajo se presentaban como seguidores de una tradición de químicos orgánicos citando al comienzo de su publicación algunos de los intentos que la teoría estructural clásica había realizado para explicar las propiedades de los compuestos aromáticos, destacando la hipótesis oscilante de Kekulé de 1872 y exponiendo que a través de la mecánica cuántica finalmente se llegaba a la solución del problema de la estructura del benceno:
..."se ha vuelto evidente para los trabajadores de este campo (la mecánica cuántica) que la resonancia del benceno entre las dos estructuras equivalentes de Kekulé fue una característica esencial de la estructura de esta molécula, que da cuenta de la simetría hexagonal del anillo y de su destacable estabilidad, y parece probable que el tratamiento mecánico cuántico a las moléculas aromáticas nos conducirá a una completa y satisfactoria explicación de la existencia y características de estas propiedades." (p. 363).
En esta publicación se refieren a los complejos tratamientos cuánticos que había propuesto Hückel para la estructura del benceno, pero dada su dificultad, ellos proponían un método mucho más simple que podía extenderse incluso al naftaleno.
En sus publicaciones posteriores Pauling intentó explicar el concepto de resonancia sin matematizarlo,7 lo cual fue bien recibido por la comunidad británica de químicos, especialmente por Ingold, asimilando su mesomerismo con la resonancia (Park, 1999; Brush, 1999a, 1999b). Si bien la teoría de Pauling y Wheland obtuvo un fuerte apoyo por los químicos de la época, luego de la Segunda Guerra mundial, la TEV tuvo una disminución de los adherentes con un aumento de los científicos a favor de la TOM debido a: a) tenía mayor poder explicativo para algunos datos experimentales relacionados con la espectroscopía y las propiedades magnéticas del benceno; b) la versatilidad de las nuevas computadoras, y c) el entusiasmo de Charles Coulson (1910-1974) como defensor de la TOM, así como lo había sido antes Pauling para la TEV (Brush, 1999b; Simões, 2008a, 2008b).
Coulson, también recurría a gráficos y diagramas en sus explicaciones. En la primera edición de su libro Valencia, de 1952, los utilizó para representar a los orbitales σ y ϖ correspondientes a las dos estructuras de Kekulé, y la famosa fórmula doughnut (figura 4). Asimismo, propuso cambiar el término energía de resonancia por energía de deslocalización para referirse a la energía que estabiliza a este tipo de compuestos.
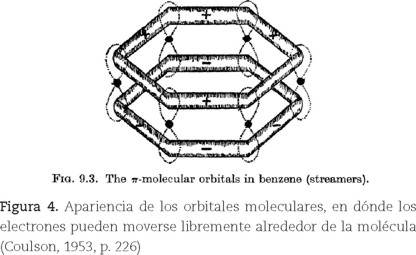
La habilidad de Coulson para presentar a la TOM como parte de una tradición facilitó su aceptación. En lugar de imponer una visión rupturista, argumentó a favor de la TOM recurriendo a la comparación con la TEV de modo de resaltar las ventajas de la primera sobre la segunda (Brush, 1999b, Simões, 2008b).
Tanto Pauling como Coulson evitaron caer en posiciones reduccionistas intentando marcar las diferencias entre los campos de trabajo y los pensamientos de los químicos y los físicos (Simões, 2008b). Sin embargo, la competencia surgida en la década de 1950 entre la TEV y la TOM ha variado con el tiempo, y hoy en día se propone una complementariedad entre ellas. Para el caso del benceno y en los casos donde existen descripciones de electrones deslocalizados, y para moléculas grandes, la funciones de onda de la TOM son más compactas mientras que las de los cálculos de la TEV son mucho más dificultosos (Hoffmann y otros, 2003).
La estructura del benceno en los libros de texto actuales: los modelos híbridos
Las influencias de Pauling y Coulson pueden reconocerse en todos los libros analizados (cuadro 1) aunque carecen de mención explícita. Todos presentan el tema siguiendo la misma lógica utilizada por Coulson. Sus exposiciones comienzan haciendo mención a Kekulé, continúan con los aportes de la resonancia y finalizan con el tratamiento de orbitales moleculares con diverso grado de extensión, siendo muy breve en L-1. Si bien L-4 no menciona a Kekulé sigue el mismo patrón temático que los otros.
Siguiendo la tradición inaugurada por Pauling, todos los libros analizados recurren a una profusión de fórmulas y representaciones del benceno (Kekulé, resonancia, Coulson, modelos moleculares, mapa del potencial electrostático) y de sus orbitales moleculares.
En el siguiente párrafo de L-2 se acepta en forma implícita la propuesta de Pauling y Wheland (1933) sobre las ideas de Kekulé:
"La representación por resonancia del benceno es una extensión de la hipótesis de Kekulé. En una estructura de Kekulé, los enlaces sencillos C-C tendrían que ser más largos que los enlaces dobles. Los métodos espectroscópicos indican que el anillo del benceno es plano y que todos sus enlaces tienen la misma longitud (1,397Å). Como el anillo es plano y todos los átomos están situados a la misma distancia, las dos estructuras de Kekulé sólo difieren en el posicionamiento de los electrones pi.
El benceno es un híbrido de resonancia de las dos estructuras de Kekulé. Esta representación implica que los electrones pi están deslocalizados (...)" (Wade, 2004, p. 680.)
En tanto, en L-5 se retomaron las ideas presentadas por Coulson al decir que:
"(...) Así, la teoría de orbitales moleculares y las estructuras resonantes son dos maneras distintas de demostrar que los electrones ϖ en el 1,3,5-hexatrieno están deslocalizados." (Bruice, 2008, pp. 309-310)
Ni L-2 ni L-5, distinguen claramente entre los dos programas de investigación de la mecánica cuántica, más bien se los tomó como visiones complementarias tal como habían indicado Hoffmann y otros (2003) y en L-5 se presenta a la TOM, a semejanza de lo realizado por Coulson, como un método más preciso:
"La visualización del benceno como un híbrido de resonancia de dos estructuras de Kekulé no puede explicar por completo la estabilidad inusual del anillo aromático. Como se ha visto con otros sistemas conjugados, la teoría de orbitales moleculares proporciona la clave para entender la aromaticidad y predecir qué compuestos tendrán la estabilidad de un sistema aromático." (Wade, 2004, p. 683).
A pesar de indicar que la resonancia y los orbitales moleculares resultan descripciones alternativas del benceno, L-4 los engloba bajo el título Estructura y estabilidad del benceno: teoría del orbital molecular, lo que puede llevar al lector a inferir que el enfoque de la TEV sobre el benceno es parte de la TOM.
L-2, L-3 y L-5 incluyen una introducción histórica, aunque en todos los casos resultó ser anacrónica y con diversas connotaciones en frases como: Kekulé estaba equivocado (L-3), los fallos de la estructura de resonancia (L-2) o la estructura de Kekulé casi era correcta (L-5) o se reconstruyeron desde las ideas del presente las propuestas del pasado por ejemplo asignando longitudes de enlaces a la propuesta de Kekulé de 1872 (L-5).
Sin embargo, L-3 se destaca por su especial interés en los aportes de la historia, acercándose a visiones más recurrentes (chamizo, 2007). Además incluye los nombres de químicos prominentes y recomienda bibliografía adicional.
No puede pasar inadvertido el corrimiento del eje del problema original sobre la estructura del benceno al actual problema sobre la representación del benceno (L-1 y L-4):
"El compuesto base de esta familia es el benceno, una molécula que es difícil describir por medio de representaciones de enlace valencia con pares de electrones localizados entre átomos adyacentes." (Fox y Whitesell, 2000, p. 64.)
"(...) Ninguna forma por sí misma es correcta; la verdadera estructura del benceno está en algún lugar entre las dos formas resonantes pero es imposible dibujarla con nuestras convenciones usuales.
A veces los químicos representan las dos formas resonantes del benceno utilizando un círculo para indicar la equivalencia de los enlaces carbono-carbono; sin embargo, este tipo de representación debe utilizarse con cuidado debido a que no indica el número de electrones ϖ en el anillo (¿cuántos electrones representa un círculo?)." (Mc Murry, 2008, pp. 521-522.)
Conclusiones e implicaciones
Al intentar responder a la pregunta sobre cuál es la relación entre la fórmula utilizada para representar una molécula de benceno y su estructura química, surge de manera indiscutible la estrecha relación entre las representaciones gráficas y el pensamiento científico. Las distintas fórmulas propuestas han ayudado, pero también condicionado un tipo particular de conocimiento en torno a la estructura. Los ejemplos seleccionados han dado cuenta de las diversas transformaciones que fue sufriendo el concepto estructura del benceno a lo largo del desarrollo de diversas teorías para explicar el enlace químico y los diversos recursos representacionales y tecnológicos disponibles para la comunidad científica. Así, propuestas que fueron descartadas en un tiempo fueron retomadas por la teoría siguiente para ser redescriptas bajo una nueva perspectiva.
Esta redescripción se realizó valederamente por los científicos al estar convencidos y sostener visiones nuevas desde las nuevas teorías de enlace, pero también implicó un recurso retórico para que sus ideas se impusieran sobre otras. De hecho, la influencia de esta retórica fue tal, que en nuestros días se pueden descubrir sus rastros de modo que, los libros de texto, atrapados en las convenciones del lenguaje que utilizan no pueden representar fácilmente la estructura esquiva del benceno.
No obstante, los libros de nivel universitario, a diferencia de los textos de otros niveles, tienen la peculiaridad de que sus autores pertenecen a la comunidad científica sobre la que escriben. Esto les permite acercarse a los desarrollos científicos desde un lugar epistemológico particular que se pone de manifiesto al acercarnos a ellos desde una mirada didáctica que contemple los saberes metacientíficos en la construcción del conocimiento.
Por último, la investigación sobre la evolución histórica de un determinado tópico puede resultar en una actividad formativa altamente provechosa en la capacitación de profesores, sobre todo para los de nivel universitario. El trabajo aquí presentado, más allá de aportar información relevante a los profesores de química orgánica, puede servir como modelo para futuras investigaciones que pueden realizar los propios docentes en las que pueden participar sus estudiantes como un modo de incluir los saberes metacientíficos de una manera activa en el trabajo en el aula.
Agradecimientos
Este trabajo fue realizado en el marco de los Proyectos UBACYT B-20020100100010 y PIP (2010-2012): 11220090100028 CONICET.
Referencias bibliográficas
Balaban, A., Schleyer, P., y Rzepa, H., Crocker, Not Armit and Robinson, begat the six aromatic electrons, Chemical Reviews, 105(10), 3436-3447, 2005. [ Links ]
Bodner, G., y Weaver, G., Research and practice in chemical education in advanced courses, Chemistry Education Research and Practice, 9(2), 81-83, 2008, consultada por última vez en marzo 8, 2012, de la URL: http://pubs.rsc.org/en/content/articlepdf/2008/rp/b806596a [ Links ]
Brock, W., Historia de la química, madrid: Alianza, 1998. [ Links ]
Brush, S., Dynamics of theory change in chemistry: Part 1. The benzene problem 1865-1945, Studies in History and Philosophy of Science, Part A, 30 (1), 21-79, 1999a. [ Links ]
Brush, S., Dynamics of theory change in chemistry: Part 2. The benzene problem 1945-1980, Studies in History and Philosophy of Science, Part A, 30(2), 133-145, 1999b. [ Links ]
Chamizo, J. A., Teaching modern chemistry through 'Recurrent historical teaching models', Science & Education, 16(2),197-216, 2007. [ Links ]
de Rezende, C., y Silva, C., History and nature of science in brazilian physics textbooks: some findings and perspectives, Ninth IHPST Conference, Calgary, 2007. Consultada por última vez en marzo 8, 2012, en la URL: http://www.ucalgary.ca/ihpst07/proceedings/iHPST07%20papers/2122%20Silva.pdf [ Links ]
Erduran, S., Philosophy of chemistry: An emerging field whith implications for chemistry education. En: F. G. Bevilacqua (ed.), Science education and culture: The role of history and philosophy of science (pp. 165-177). Dordrecht: Kluwer Academic Publisher, 2001. [ Links ]
Erduran, S., Adúriz-Bravo, A., y Mamlok-Naaman, R., Developing epistemologically empowered teachers: Examining the role of Philosophy of chemistry in teacher education, 8th International History, Philosophy and Science Teaching Conference, Leeds, 2005, consultada por última vez en marzo 8, 2012, en la URL: http://www.ihpst2005.leeds.ac.uk/papers/Erduran_Aduriz_mamlok.pdf [ Links ]
Farré, A. S. y Lorenzo, M. G., La historia y la epistemología en los libros de texto: Un recurso para la capacitación de profesores de ciencias. En: Quintanilla, M. y Merino, C. (eds.), Formando sujetos competentes en ciencias para los desafíos de un mundo en transformación. volumen I (pp. 114-115). Santiago de chile: Ediciones G.R.E.C.I.A., 2010, consultada por última vez en marzo 8, 2012, en la URL: http://www.uc.cl/sw_educ/educacion/grecia/plano/html/pdfs/destacados/MemoriasEnQui.pdf [ Links ]
Garritz, A., La historia como herramienta para promover el aprendizaje, Educ. quím., 21(4), 266-269, 2010. [ Links ]
Garritz, A. y Trinidad Velasco, R., El conocimiento pedagógico del contenido, Educ. quím., 15(2), 2-6, 2004. [ Links ]
Gero, A., Kekulé's Theory of Aromaticy, Journal of Chemical Education, 31(4), 201-202, 1954. [ Links ]
Hoffmann, R., Shaik, S., y Hiberty, P., A conversation on VB vs MO Theory: A never-ending rivalry?, Accounts of Chemical Research, 36(10), 750-756, 2003. [ Links ]
Jacob, C., Analysis and synthesis. Interdependent operations in chemical language and practice, HYLE, An International Journal for Philosophy of Chemistry, 7(1), 31-50, 2001, consultada por última vez en marzo 8, 2012, en la URL: http://www.hyle.org/journal/issues/7/jacob.htm [ Links ]
Jensen, W. B., What is the origin of bond lines?, Journal of Chemical Education, 86(7), 791, 2009. [ Links ]
Justi, R., y Gilbert, J., A cause of ahistorical science teaching: Use of hybrid models, Science Education, 83, 163-177, 1999. [ Links ]
Kikuchi, S., A history of the structural theory of benzene-the aromatic sextet rule and Hückel's rule, Journal of Chemical Education, 74(2), 194-201, 1997. [ Links ]
Lombardi, O., El papel de la historia en la enseñanza de ciencias: Diferentes aspectos significativos, Educación en la Química, 15(1), 33-40, 2009. [ Links ]
Niaz, M. ¿Por qué los textos de química general no cambian y siguen una 'retórica de conclusiones'?, Educ. quím., 16(3), 410-415, 2005. [ Links ]
Park, B., chemical translators: Pauling, Wheland and their Strategies for teaching the theory of resonance, The British Journal for the History of Science, 32(1), 21-46, 1999. [ Links ]
Quintanilla, M., izquierdo, M., y Adúriz-Bravo, A., Discusión en torno a una propuesta para introducir la historia de la ciencia en la formación inicial del profesorado de ciencias. En: M. izquierdo, A. Caamaño, y M. Quintanilla (eds.), Investigar en la enseñanza de la química. Nuevos horizontes: contextualizar y modelizar (pp. 173-196). Bellaterra: Universitat Autónoma de Barcelona, 2007. [ Links ]
Rocke, A., Hypothesis and experiment in the early development of Kekulé's Benzene theory, Annals of Science, 42(4), 355-381, 1985. [ Links ]
Rocke, A., Image and Reality. Kekulé, Kopp, and the Scientific Imagination. Chicago: The University of Chicago Press, 2010. [ Links ]
Russell, C., Advances in Organic Chemistry over the Last 100 Years, Annual Reports Section "B" (Organic Chemistry), 100, 3-31, 2004. [ Links ]
Saltzman, m., Benzene and the triumph of the octet theory, Journal of Chemical Education, 51(8), 498-502, 1974. [ Links ]
Schummer, J., The chemical core of chemistry I: A conceptual approach, HYLE, An International Journal for the Philosophy of Chemistry, 4(2), 129-162, 1998, consultada por última vez en marzo 8, 2012, en la URL: http://www.hyle.org/journal/issues/4/schumm.htm [ Links ]
Simões, A., Chemical physics and quantum chemistry in the twentieth century. En: M. J. Nye (ed.), The Cambridge History of Science. The Modern Physical and Mathematical Sciences (Vol. V, pp. 394-412). Cambridge: Cambridge University Press, 2008a. [ Links ]
Simões, A., A quantum chemical dialogue mediated by textbooks: Pauling's The nature of the chemical bond and Coulson's valence, Notes & Records of the Royal Society, 62(3), 259-269, 2008b. [ Links ]
Weininger, S. J., contemplating de finger: Visuality and the semiotics of chemistry, HYLE, An International Journal for Philosophy of Chemistry, 4(1), 3-27. 1998, consultada por última vez en marzo 8, 2012, en la URL: http://www.hyle.org/journal/issues/4/weinin.htm [ Links ]
Notas
1 La labor de Kekulé estuvo grandemente influenciada por el trabajo y las ideas de sus colegas Charles Gerhardt (1816-1856), Auguste Laurent (1807-1853), Charles Adolphe Wurtz (1817-1884), Alexander Williamson (1824-1904) y William Odling (1829-1921) (Rocke, 2010).
2 Notar que los vértices corresponden a átomos de hidrógeno en lugar de átomos de carbono.
3 Los modelos moleculares que utilizaba Kekulé se encuentran en el Museo de Historia de las Ciencias de la Universidad de Ghent. La imagen se obtuvo de la página del Dr. Robert K. Wismer de la Universidad de Millersville: http://www.millersville.edu/chemistry/faculty/wismer/wismer.php
4 No mencionaremos aquí la forma en que Kekulé visualizó al benceno como de un ciclo de seis carbonos porque muchas veces se ha utilizado la anécdota del sueño para mostrarlo como un genio y no como a un hombre de ciencia que fue construyendo sus ideas en la medida que trabajaba en su laboratorio (Rocke, 1985).
5 Este hecho había sido corroborado por tres de sus estudiantes: Albert Ladenburg (1842-1911), Wilhelm Körner (1839-1925) y Adolf Baeyer (1835-1917) en forma aparentemente independiente.
6 El análisis cristalográfico del hexametilbenceno realizado en 1928 por Kathleen Lonsdale (1903-1971), a pedido de Ignold, describió al benceno como un ciclo hexangonal, plano y con los ángulos de enlace de 120º.
7 El concepto de resonancia fue presentado en forma diferente en sus distintas publicaciones. En algunas de ellas, las menos matematizadas, la idea parecía más cercana a un equilibrio dinámico, mientras que en otras se explicaba como una combinación de las estructuras de Lewis (Park, 1999; Brush, 1999a, 1999b).














