Introducción
En México, el trigo se encuentra entre los cultivos básicos que forman parte de la dieta alimentaria. En 2019 la producción nacional estimada fue de 3.2 millones de toneladas obtenidas en una superficie sembrada de 598,233 ha. Destacan los estados de Baja California, Guanajuato, Michoacán, Sinaloa y Sonora como los de mayor producción en condiciones de riego (ciclo otoño-invierno) y Guanajuato, Estado de México, Oaxaca, Puebla y Tlaxcala en condiciones de temporal (ciclo primavera-verano) (SIAP, 2019). Del total de la producción, 40 % corresponde a trigo harinero (Triticum aestivum) y 60 % a trigo cristalino (T. durum). Sin embargo, en las últimas décadas la superficie sembrada se ha reducido en más de 50% , generando un déficit de trigo harinero y la importación del 75 % del volumen requerido para satisfacer la demanda nacional, estimada entre 6 y 7 millones de toneladas (SAGARPA, 2017).
Aunado a lo anterior, diferentes enfermedades amenazan la producción de trigo, entre las que destaca la mancha foliar del trigo (septoriosis o tizón foliar) por Zymoseptoria tritici (Mirdita et al., 2015), la cual puede ser devastadora en las regiones productoras de este cultivo (Villaseñor-Mir et al., 2018). En la Figura 1 se ilustran las regiones productoras de trigo y la distribución de la mancha foliar en México. En trigo de temporal se han registrado pérdidas de 7 a 30 % cuando las condiciones son favorables para el desarrollo de la enfermedad. El clima templado subhúmedo (precipitación de 650 mm y temperatura de 14 a 22 oC) favorece el desarrollo de infecciones naturales en la región productora del bajío (Guanajuato, Jalisco y Michoacán) y en los valles altos de México (Hidalgo, Estado de México y Tlaxcala) (Santa-Rosa et al., 2016; Villaseñor-Mir et al., 2018). Sin embargo, la mancha foliar también se ha presentado en zonas con clima semiseco semicálido y cálido subhúmedo del país (Santa-Rosa et al., 2016), lo que alerta sobre la adaptación biológica de Z. tritici a diferentes ambientes y del riesgo potencial que representa la enfermedad en esas regiones, donde es común la producción del trigo en monocultivo.
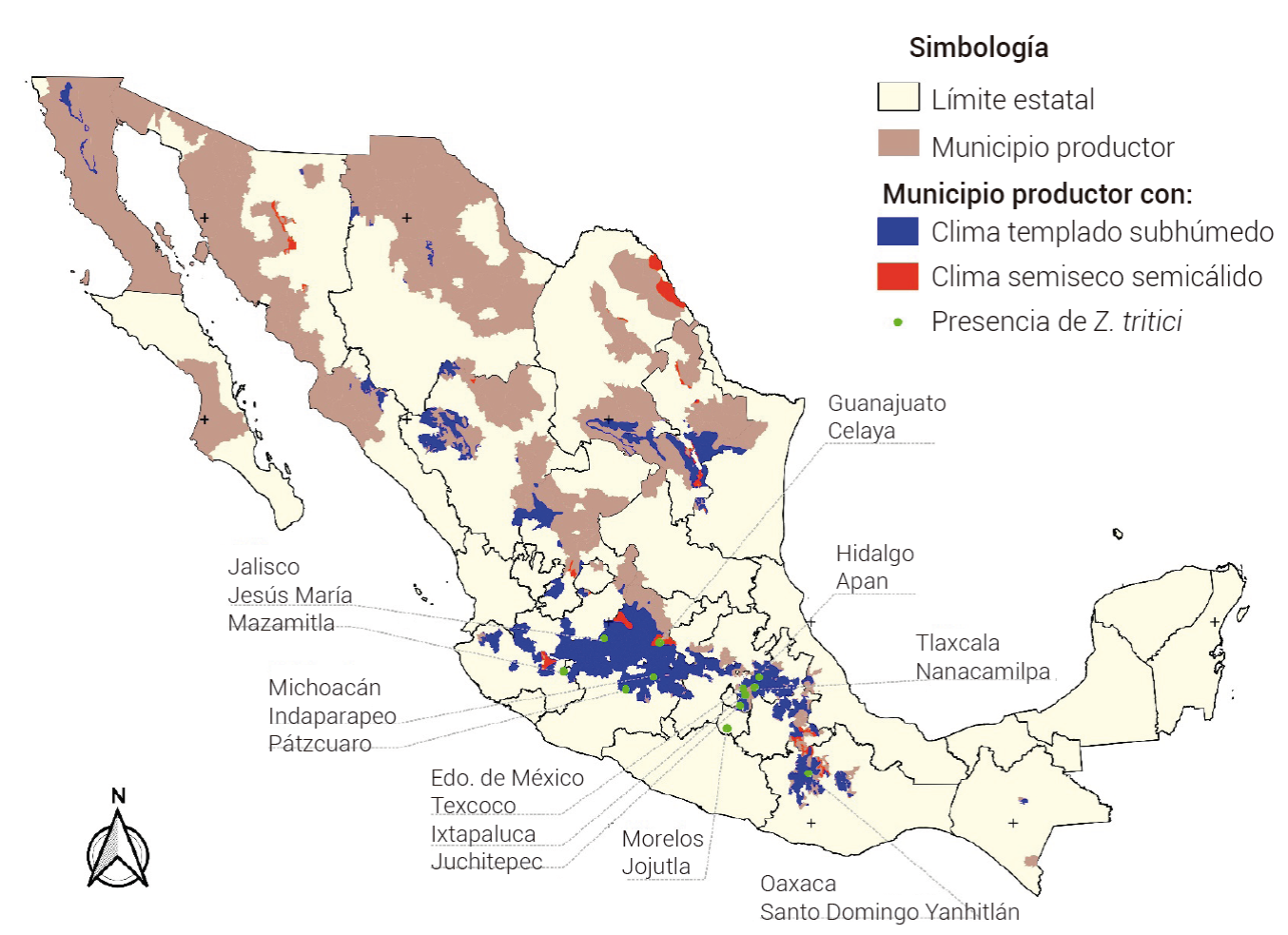
Figura 1 Mapa de las regiones productoras de trigo y distribución de Zymoseptoria tritici en México (INEGI, 2008; INEGI, 2018).
Aspersiones foliares de fungicidas, aunque efectivas, no han prevenido por completo el desarrollo de la mancha foliar; esto en parte, debido a la variabilidad genética de Z. tritici y a su capacidad de adaptación biológica a la presión selectiva de fungicidas (Heick et al., 2017b). Esto ha motivado la búsqueda de diversas fuentes genéticas para el desarrollo de variedades resistentes a la enfermedad, a través de proyectos de colaboración entre el Centro Internacional de Mejoramiento de Maíz y Trigo (CIMMYT), el Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP), la Secretaria de Agricultura y Desarrollo Rural (SADER), el Colegio de Postgraduados y la Universidad Autónoma Chapingo (UACh) (Piñera-Chavez et al., 2017), entre otras instituciones de investigación agrícola nacional. Por lo anterior, el objetivo de esta revisión es conocer la situación actual de la mancha foliar, para identificar líneas futuras de investigación que coadyuven al manejo de la enfermedad, de acuerdo con la condición que presenta en México.
Síntomas de la enfermedad
La mancha foliar afecta principalmente las hojas inferiores de las plantas sobre las cuales aparecen pequeñas lesiones cloróticas que se expanden formando lesiones irregulares a lo largo de las nervaduras. Con el tiempo, estas lesiones se transforman en manchas necróticas estrechas y alargadas. Si la humedad relativa (HR) es mayor a 50 %, la temperatura es de 10 a 20 oC y sin manejo de la enfermedad, el hongo puede atacar la hoja bandera y las glumas de la espiga afectando el llenado de grano (Castro et al., 2015; Simón et al., 2005). Las glumas infectadas desarrollan manchas café obscuro a púrpura y los granos se arrugan. Al final del ciclo de cultivo, en las manchas necróticas de las hojas se desarrollan estructuras de reproducción que se diferencian solo por la morfología de las esporas contenidas en ellas y la ausencia (picnidios) o presencia (seudotecios) de ascas bitunicadas (Keon et al., 2007; Ponomarenko et al., 2011) (Figura 2).
Agente causal y epidemiología de la enfermedad
El hongo Z. tritici presenta crecimiento biotrófico durante los primeros días después de la infección (de 2 a 12 días) y crecimiento necrotrófico conforme avanza la infección (Ponomarenko et al., 2011). Al inicio, las hifas crecen en la superficie de la hoja, penetran a través de estomas y colonizan el mesófilo alimentándose del tejido vía apoplasto; posteriormente se manifiestan los síntomas de la enfermedad y las estructuras de reproducción del hongo se desarrollan en el tejido necrótico de la hoja, para dar lugar al desarrollo de nuevos ciclos de infección (Keon et al., 2007; Rudd et al., 2015).
En campo, los hospedantes secundarios (pastos), plantas voluntarias (trigo que sobrevive entre períodos de cultivo), residuos de cosecha y rastrojo de trigo infectado son fuente importante de inóculo primario entre cada ciclo de cultivo (Fones y Gurr, 2015). Se considera que la semilla tiene poca importancia en la transmisión de la mancha foliar debido a que el aislamiento del hongo presenta baja frecuencia en ésta (Suffert et al., 2011). Durante el proceso epidemiológico de la enfermedad, las ascosporas producidas en seudotecios ocasionan las infecciones primarias en el trigo recién sembrado y los conidios generados en los picnidios provocan las infecciones secundarias en el dosel de la planta.
Zymoseptoria tritici produce macroconidios de cuatro a ocho células alargadas y microconidios de una célula, desarrolladas lateralmente por gemación en hifas o en los macroconidios (Rudd et al., 2015). La viabilidad y la capacidad de germinación de estos conidios están limitadas por la HR y la temperatura. En residuos de cosecha, la viabilidad de las esporas es por 150 (Wenham, 1959) ó 50 días a 35 y 55 % de HR, respectivamente. En hojas infectadas naturalmente y conservadas entre 5 y 15 oC la capacidad de germinación de las esporas es de 60 días, pero ésta se pierde entre 15 y 30 oC (Hilu y Bevee, 1957). Lo anterior es relevante para el manejo de la enfermedad en campo y para el uso de material vegetal infectado como fuente de inóculo.
Otros factores, como la labranza reducida (agricultura de conservación), el establecimiento de monocultivos y la producción comercial con variedades susceptibles, también constituyen un riesgo para un posible desarrollo de epidemias por la mancha foliar (Bankina et al., 2018). La agricultura de conservación se ha implementado en el cultivo de trigo para facilitar el reciclaje de fosfato, contribuir al uso eficiente de nitrógeno y mejorar las propiedades físicas, químicas y biológicas del suelo (Busari et al., 2015). Sin embargo, el rastrojo y los residuos de cosecha constituyen una fuente considerable de inóculo para el siguiente ciclo de cultivo, esto en condiciones favorables y si el inoculo primario está presente (Mcdonald y Mundt, 2016).
Manejo de la enfermedad
Entre las estrategias de manejo de la mancha foliar en trigo se encuentran las prácticas culturales, la aplicación de aspersiones foliares de fungicidas, el control biológico con especies de Trichoderma y Bacillus, así como el uso de variedades resistentes.
Prácticas culturales. En condiciones favorables para el desarrollo de la enfermedad, la rotación de cultivos (de 3 a 5 años) (Eyal et al., 1987) con soya (Glycine max L. Merr) (Krupinsky, 1999), colza (Brassica napus L.), canola (Brassica napus var. napus), chícharo (Pisum sativum L.) (Bailey et al., 2001) y lino (Linum usitatissimum L.) ha sido eficaz para disminuir su incidencia (Suffert et al., 2011). En sistemas convencionales, la destrucción y eliminación de plantas voluntarias, de paja y rastrojo infestado por incineración o enterramiento (a 22 ó 23 cm de profundidad) han reducido la severidad de la enfermedad en condiciones semiáridas (Bankina et al., 2015; Suffert et al., 2011). Mientras que, en sistemas de agricultura de conservación, la siembra de cultivos de cobertera con trébol (Trifolium spp.) y chícharo ha contribuido a reducir la dispersión del inóculo primario in situ, al funcionar como trampas de esporas producidas en el rastrojo infestado (Mcdonald y Mundt, 2016). Otras prácticas con relativa efectividad son la siembra tardía, la aplicación limitada de nitrógeno y el uso de mezclas de variedades de trigo (Berraies et al., 2013).
Control químico. La aplicación foliar de fungicidas preventivos (mancozeb) y con modo de acción específicos (benomil, propiconazol, tebuconazol y triadimefon) han reducido la severidad de la mancha foliar y la producción de esporas en el tejido vegetal, así como el efecto negativo de la enfermedad en el rendimiento de variedades susceptibles, en condiciones de alta presión de inóculo (Heick et al., 2017a). En las siembras de temporal en los valles altos de México es común la aplicación foliar con Folicur® (tebuconazol, 0.5 L ha-1) o de Sportak® (procloraz, 1 L ha-1) durante la floración, para prevenir y controlar la enfermedad e incrementar la productividad de grano en las variedades tolerantes Gema C2004, Juchi F2000 y Tlaxcala F2000 (Santa-Rosa et al., 2016; Villaseñor-Mir et al., 2012). Pero los altos costos de las aplicaciones, aunado al potencial de desarrollo de resistencia de Z. tritici, por el uso irracional de fungicidas en campo, han limitado su implementación en el manejo de la enfermedad (Estep et al., 2015). Solamente en el año 2015 en Europa se destinó el 70 % de los recursos [€1 x 1012 ($17.6 x 1012)] para el control químico de la mancha foliar del trigo (Torriani et al., 2015).
Control biológico. En sistemas de agricultura de conservación, la aplicación de agentes de control biológico o sus productos (biofungicidas), en el cultivo o rastrojo, ha sido efectiva en el control de la mancha foliar. La aplicación de la cepa MKB135 de Bacillus megaterium redujo hasta 80 % la severidad de la enfermedad en plántula y planta adulta (Kildea et al., 2008). Efecto similar se ha registrado con la aplicación foliar y el tratamiento a la semilla con Trichoderma harzianum y T. koningii, con reducción de 40 y 70 % de la incidencia y severidad, respectivamente (Perelló et al., 2009). Los polipéptidos micosubtilina, surfactina y fengicina, producidos por B. subtilis, han mostrado potencial para controlar a Z. tritici, debido a que activan mecanismos de defensa de la planta (Mejri et al., 2017). Con la aplicación de agentes biológicos o biofungicidas se pretende proteger tanto al cultivo como al ambiente, al reducir los niveles de residuos de los fungicidas aplicados.
Control genético. Los métodos anteriores por sí solos no previenen por completo el desarrollo de epidemias por Z. tritici, lo que ha motivado la búsqueda de fuentes genéticas de resistencia a la mancha foliar. En trigo se pueden encontrar dos tipos de resistencia: la monogénica (raza específica, vertical o cualitativa) y la poligénica (raza no específica, horizontal, cuantitativa o parcial) (Dreisigacker et al., 2015). Sin embargo, se ha observado que la resistencia cualitativa a Z. tritici es débil, compleja, de protección limitada e influenciada por el ambiente en etapas tempranas de la infección (Orton et al., 2017). En la última década se identificaron y caracterizaron 22 genes de resistencia Stb en diversas variedades y líneas de trigo resistentes, pero con efectividad contra pocos aislados virulentos del hongo (Brown et al., 2015). Solo los genes Stb6 y Stb19 controlan a los aislados más virulentos: al aislado holandés IPO323 y a los aislados australianos WAI332, WAI251 y WAI161 de Z. tritici, respectivamente (Kema et al., 2018; Yang et al., 2018). En contraste, la resistencia cuantitativa brinda mayor protección al cultivo al estar controlada por varios genes o loci de rasgo cuantitativo (QTL, por sus siglas en inglés) distribuidos en el genoma de la planta. Aunque estos genes o loci tienen poco efecto individual, su acción génica combinada es dominante, parcialmente dominante, epistática, recesiva, aditiva y no aditiva (Chartrain et al., 2009). Actualmente se han detectado 167 QTL en 19 poblaciones de mapeo biparentales y siete polimorfismos de un solo nucléotido (SNP, por sus siglas en inglés) en más de 500 variedades de trigo de primavera, los cuales contienen regiones genómicas que controlan la necrosis, el desarrollo de picnidios y el progreso de la enfermedad (Brown et al., 2015).
En México, instituciones nacionales de investigación agrícola como el Colegio de Postgraduados, INIFAP, SADER y la UACh, entre otras, en colaboración con el CIMMYT, han establecido proyectos para desarrollar variedades de trigo con resistencia a diversas enfermedades bióticas. Durante las últimas tres décadas, estas instituciones han liberado más de 10 variedades comerciales de trigo harinero para siembra de temporal con resistencia a la mancha foliar por Z. tritici, además a roya de la hoja (Puccinia triticina f. sp. tritici), roya amarilla (Puccinia striiformis f. sp. tritici), roya del tallo (Puccinia graminis f. sp. tritici) y roña de la espiga (Fusarium graminearum). Estas variedades, entre las que destacan Rebeca F2000 y Valles F2015 por su nivel de resistencia moderada a la mancha foliar (Cuadro 1), contienen genes Yr y Lr que confieren resistencia para roya amarilla y de la hoja, respectivamente, así como genes menores para tolerancia a Z. tritici. Se tiene la hipótesis de que esos genes menores pudieran estar asociados, ligados o cercanos a las regiones genómicas donde se encuentran los genes Stb o QTL. Se estima que el 45 % de las líneas resistentes o tolerantes a Z. tritici contienen el gen Yr18 y el 27 % los genes Yr30 y Lr34 (Cuadro 1).
Cuadro 1 Nivel de resistencia a Zymoseptoria tritici en variedades de trigo reportadas para regiones de temporal en México.
| Resistencia / Variedad | Altura (cm) / madurez (días) | Genes que controlan resistencia | Referencia |
| Moderadamente resistente | |||
| Rebeca F2000 | 97, tardía (153) | Yr18 † y tres genes menores de efecto aditivo para tolerancia a Septoria sp. | Rodríguez-Contreras et al., 2010 Santa-Rosa et al., 2016 |
| Valles F2015 | Porte alto, tardía (114) | Yr18, Yr29, Yr30, Lr †† 10, Lr17, Lr23 y genes complementarios Lr27+Lr31 | Villaseñor et al., 2018 |
| Moderadamente susceptible | |||
| Altiplano F2007 | 90, tardía (153) | Yr29, Yr30 y Lr46 | Villaseñor et al., 2018 |
| Batán F96 | 89, tardía (122) | dnr¶ | Rodríguez-Contreras et al., 2010 |
| Juchi F2000 | 93, tardía (127) | Yr18, Lr34 y tres genes menores de efecto aditivo para tolerancia mayor a Septoria sp. | Santa-Rosa et al., 2016 |
| Nana F2007 | 84, precoz (85) | Yr18, Yr30, Lr34 y un gen de efecto aditivo | Villaseñor et al., 2018 |
| Romoga F96 | 86, tardía (123) | dnr | Rodríguez-Contreras et al., 2008 |
| Temporalera M87 | 103, tardía (127) | dnr | Rodríguez-Contreras et al., 2008 |
| Náhuatl | 95, tardía (122) | dnr | Villaseñor et al., 2018 |
| Tlaxcala F2000 | 89, tardía (124) | Yr18, Lr34 y tres genes menores de efecto aditivo para tolerancia a Septoria sp. | Villaseñor et al., 2018 Santa-Rosa et al., 2016 |
†gen de resistencia a roya amarilla; ††gen de resistencia a roya de la hoja; ¶ dato no reportado.
Actualmente, el CIMMYT cuenta con un total de 1,092 líneas avanzadas que presentan buena resistencia, no solamente a las royas y roña mencionadas, sino también a la mancha foliar por Z. tritici. Por sus características de calidad de grano, estas líneas tienen alta posibilidad de ser liberadas después de un período de entre seis y ocho años de investigación. Para esto se requerirá la colaboración de las instituciones nacionales de investigación agrícola, así como la de productores de semilla y productores cooperantes (Piñera-Chavez et al., 2017). Con el uso de variedades resistentes se incrementa la productividad del trigo al reducir el inóculo secundario, retrasar la infección primaria y limitar la reproducción sexual del hongo (Arraiano et al., 2009; Berraies et al., 2014).
Factores que determinan la resistencia
El estado fenológico y los genes que determinan altura de planta, precocidad (días a espigamiento) y fotoperiodo, se han asociado con los genes que confieren resistencia a la mancha foliar en trigo.
Se ha observado que las plántulas expresan mayor resistencia a la enfermedad que las plantas adultas. Si bien, la resistencia en ambos casos está controlada por regiones genómicas similares, en plántula se expresa mayormente la resistencia cualitativa y en planta adulta la cuantitativa (Gerard et al., 2017).
En general, en las plantas de genotipos altos (119 cm de altura promedio) se presenta menor severidad de la enfermedad que en las de genotipos bajos (64 cm de altura promedio); es decir, a mayor altura de planta menor desarrollo de necrosis (Gerard et al., 2017; Kollers et al., 2013).
Variedades con floración tardía (aproximadamente 126 días a espigamiento) desarrollan menor severidad de la enfermedad (Arraiano et al., 2009; Kollers et al., 2013). En algunos genotipos, las regiones genómicas asociadas con resistencia a Z. tritici se encuentran en posiciones similares a la de marcadores relacionados con días a espigamiento (Gerard et al., 2017); sin embargo, ambas líneas, tardías y precoces, resisten la enfermedad, lo que se atribuye a un fenómeno de escape. En la práctica, las líneas tardías no se seleccionan, ya que el establecimiento de un cultivo de ciclo largo afectaría la siembra oportuna del próximo, en zonas con problema de helada o de calor (Arraiano y Brown, 2017).
Se ha observado también que la dirección y la calidad de la luz afectan el desarrollo de síntomas durante el proceso de infección por Z. tritici. En plantas crecidas bajo sombra se desarrollaron síntomas de la enfermedad entre los 7 y 13 días después de la inoculación y las mantenidas bajo iluminación entre los 13 y 17 días (Keon et al., 2007).
Adicional a los factores anteriores, es importante considerar que Z. tritici es un hongo que desarrolla poblaciones con gran diversidad genética (Berraies et al., 2013) y plasticidad evolutiva en su genoma, lo que le permite superar condiciones adversas durante el desarrollo del cultivo (Goodwin et al., 2011). La alta capacidad del hongo de producir esporas (300 conidios por picniodio y 200 ascosporas por seudotecio) favorece la aparición de nuevas cepas con potencial de especialización fisiológica y la pérdida de resistencia de las variedades de trigo (Fones y Gurr, 2015; Orton et al., 2017).
Conclusiones
Cambios en las prácticas culturales como la labranza mínima, aunadas al uso irracional de fungicidas y a la gran plasticidad genética y capacidad reproductiva de Z. tritici son responsables, en parte, del desarrollo de epidemias por la mancha foliar. Para el manejo de esta enfermedad se requiere de la implementación de diversas estrategias, entre las que se encuentran la rotación de cultivos, la remoción de residuos de cosecha y el uso de variedades resistentes, para hacer frente a los cambios rápidos en la conformación genética del hongo. México cuenta con algunas variedades comerciales de trigo harinero con resistencia moderada a la mancha foliar, pero se requieren nuevas variedades de trigo con mayor resistencia a esta enfermedad como parte de la estrategia para cubrir la demanda nacional de trigo harinero.











 nueva página del texto (beta)
nueva página del texto (beta)



