Introducción
La fenología es el estudio de los eventos biológicos acomodados a cierto ritmo periódico que ocurren en una especie, en relación con los cambios climáticos de su hábitat (Font-Quer, 1968; Johansson et al., 2015). Es considerada una ciencia ambiental integrativa que ha alcanzado una posición prominente en investigaciones acerca del cambio climático global, debido a la capacidad que ofrece para monitorear, entender y predecir el momento en que ocurren eventos biológicos como la floración, fructificación y crecimiento de las poblaciones de plantas (Rosenzweig et al., 2008). Los estudios fenológicos son importantes para analizar las interacciones ecológicas que se establecen entre las especies y resultan clave para entender la dinámica de los ecosistemas (Johansson et al., 2015).
La variabilidad fenológica de las plantas está determinada por factores ambientales como la precipitación, la humedad, la temperatura y la iluminación, siendo los dos últimos los más estudiados por estar directamente relacionados con la estacionalidad (Elzinga et al., 2007). Adicionalmente, la variabilidad fenológica puede estar influenciada por las respuestas individuales de las especies que conforman la comunidad, debido a diferencias entre individuos conespecíficos, según su estatus fisiológico o localización en determinados microhábitats, e incluso por el comportamiento desigual de las partes de un mismo individuo (Williams-Linera y Meave, 2002).
Varios estudios en la última década han abordado la fenología de cactáceas con diferentes fines (Munguía-Rosas y Sosa, 2010; Rojas-Sandoval y Meléndez-Ackerman, 2011; Barrios et al., 2014; Gudiño y De la Barrera, 2014; Giorgis et al., 2015; Matias-Palafox et al., 2017; Arroyo-Pérez et al., 2019; Salvatierra, 2020). La mayoría de dichas investigaciones poseen como enfoque principal la fenología reproductiva o floral y vinculan otros aspectos como el estudio de sistemas de cruzamiento, éxito reproductivo, sincronía floral, así como la relación del tamaño de las plantas con las fenofases. Solo algunos de estos estudios evalúan la relación existente entre variables ambientales y las fenofases, encontrándose las temperaturas medias y mínimas relacionadas positivamente con la presencia de botones, flores (Ruiz et al., 2000; Munguía-Rosas y Sosa, 2010; Rojas-Sandoval y Meléndez-Ackerman, 2011) y frutos (Salvatierra, 2020). Por otro lado, relaciones negativas han sido observadas entre la humedad relativa, con la producción de flores en Stenocereus griseus (Haw.) Buxb. (Ruiz et al., 2000) y frutos de Eulychnia acida Phil. (Salvatierra, 2020), así como entre la temperatura mínima y la producción de botones en Astrophytum ornatum (DC.) Britton & Rose (Matias-Palafox et al., 2017). Sin embargo, aún son escasos los estudios fenológicos en cactáceas donde se evalúen sistemáticamente el crecimiento (Rosello y Belmonte, 1999) o pérdida de los tallos (fenología vegetativa), así como los factores climáticos desencadenantes de las fenofases de cactáceas que habitan el sotobosque de bosques tropicales semideciduos.
Los bosques semideciduos constituyeron la formación vegetal más extendida en Cuba, que fue desbrozada en su mayor parte para la siembra de caña de azúcar (Funes, 2008). Actualmente se encuentran entre las formaciones vegetales con mayor número de especies amenazadas (González-Torres et al., 2016). Leptocereus scopulophilus Areces es una cactácea endémica de Cuba occidental con tres localidades conocidas; solo una se desarrolla en el sotobosque de un bosque semideciduo mesófilo (Barrios, 2014). Para dicha cactácea, González-Torres et al. (2012) evaluaron el crecimiento vegetativo durante un año y Barrios et al. (2014) la floración durante seis meses. En ambos estudios se considera el aumento de la luz que se produce en el sotobosque por la caída de las hojas durante el período seco, el factor desencadenante de ambas fenofases. Sin embargo, sus consideraciones se basaron en el conocimiento empírico y en el aporte de estudios realizados por Wycherley (1973), Van Schaik (1986) y Lepsch-Cunha y Mori (1999), donde se demuestra que las especies que habitan el sotobosque aumentan la productividad en las épocas con mayor iluminación.
El presente estudio tiene como objetivos principales (1) caracterizar la fenología de Leptocereus scopulophilus, (2) comparar el comportamiento interanual de las fenofases y (3) evaluar la relación de las fenofases (botones, flores, frutos, crecimiento y retroceso de las ramas) con las variables ambientales (precipitación, temperatura, humedad e iluminación) del bosque semideciduo donde se desarrolla la especie. Nosotros hipotetizamos que la iluminación es la variable ambiental más importante en el desencadenamiento de la floración y el crecimiento de los tallos de L. scopulophilus.
Materiales y Métodos
Área de estudio
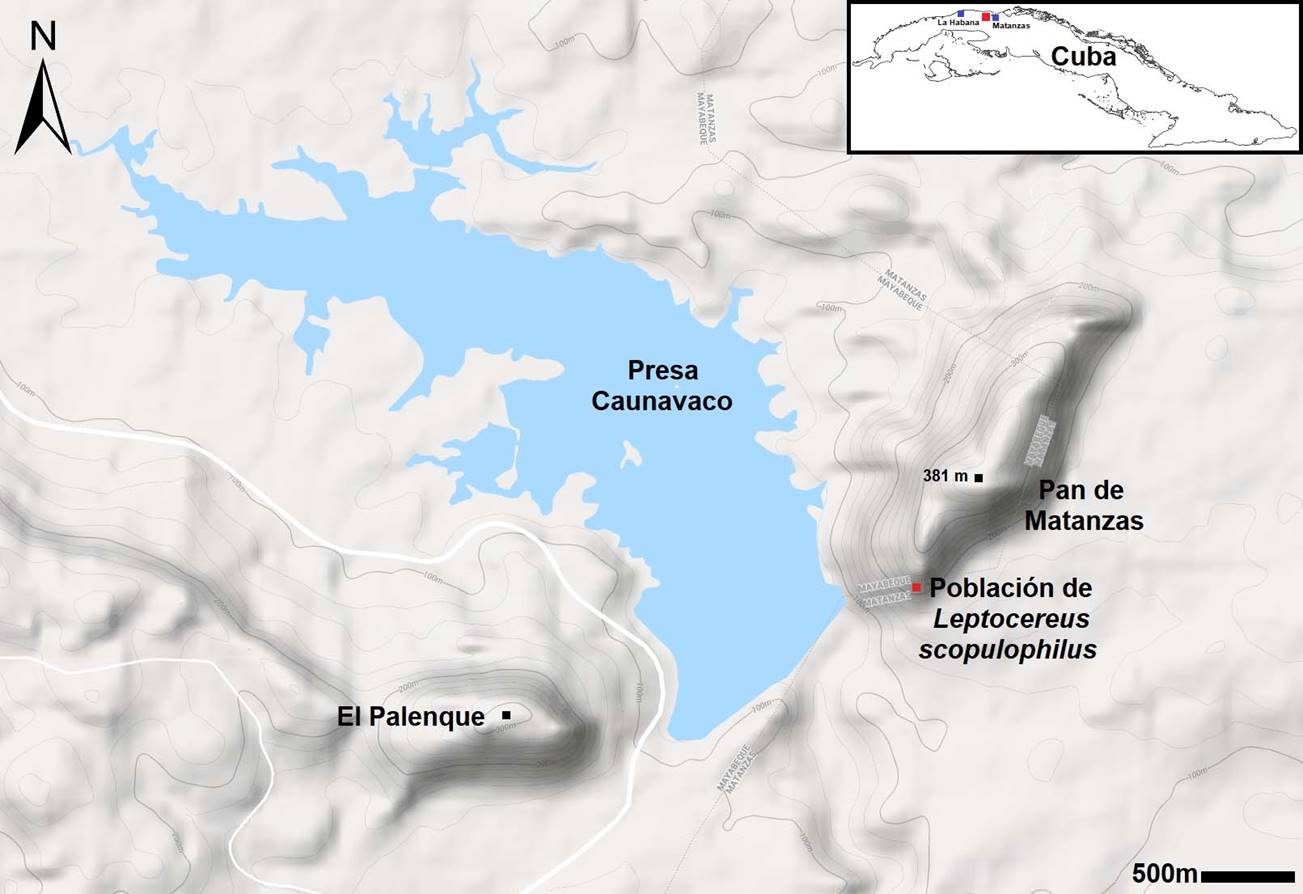
La población de Leptocereus scopulophilus se encuentra en el Pan de Matanzas (81°41'44.2'' longitud O y 23°01'30'' latitud N), cerro mogotiforme, ubicado a 11 km al oeste de la ciudad de Matanzas, Cuba (CNNG, 2000) (Fig. 1). En la ladera sureste de dicha elevación se desarrolla un bosque semideciduo mesófilo sobre un suelo rocoso de carbonato de calcio (González-Torres et al., 2007). La población de L. scopulophilus se localiza a una altura promedio de 212 m s.n.m. y en un área de 3500 m2 (Barrios et al., 2012a). El sitio posee un clima tropical estacional con la estación seca en invierno (noviembre-abril) y la lluviosa en verano (mayo-octubre). Las precipitaciones alcanzan 352 mm en la estación seca y un promedio de temperatura de 23.6 °C. Durante la estación lluviosa las precipitaciones llegan hasta 1070 mm y un promedio de temperaturas de 25.8 °C (González-Torres et al., 2012). La humedad relativa oscila entre 82% en la época de secas y 89.4 % en la época lluviosa (García-Beltrán et al., 2017).
Especie de estudio
Leptocereus scopulophilus es un cactus arborescente con un patrón de ramas difuso, de hasta 5 m de altura. Sus ramas principales son erectas, mientras que las más altas son muy ramificadas y tienen un crecimiento plagiótropo oblicuo, con 4-7 costillas aplanadas y crenadas, con espinas agrupadas en las depresiones. Las flores son nocturnas, hermafroditas, con un receptáculo verde, casi tubuloso y espinoso, con el estigma y los estambres exertos (Barrios et al., 2012b). Los individuos de la especie abren 1-3 flores por noche y algunos llegan a un máximo de 19. En la población del Pan de Matanzas existen tres morfotipos florales distinguibles por la coloración de los tépalos: salmón, pardo arenoso y magenta, con diferencias en el número de óvulos (Martínez, 2014). Los frutos son elíptico-globosos, verdes a verde amarillentos con areolas espinosas persistentes en la madurez (Areces, 1993) y pueden contener semillas vivíparas (Barrios et al., 2012a). Leptocereus scopulophilus es una especie xenógama auto-incompatible que necesita de polinizadores para la formación de frutos (Barrios et al., 2012b).
Fenología
Se seleccionaron al azar 50 individuos adultos previamente enumerados. En cada planta se registró mensualmente el número de botones, flores, frutos nuevos, frutos totales, así como el crecimiento vegetativo y el retroceso de una rama seleccionada al azar, la cual se marcó al inicio del estudio. El crecimiento vegetativo de la rama marcada se consideró como el crecimiento neto y se midió con una cinta métrica (±1 mm). El retroceso se midió en correspondencia a la longitud de la rama que se secó. Las ramas que se secaron completamente fueron sustituidas por otras, igualmente seleccionadas al azar. Se definió la actividad reproductiva como la frecuencia de individuos florecidos o con producción de frutos nuevos en un mes dado, de acuerdo con Barrios et al. (2014).
Variables ambientales
El porcentaje de iluminación que llega al sotobosque se evaluó en 16 individuos seleccionados al azar y distribuidos en el área que ocupa la población. En cada uno de ellos se fotografió entre las 09:00 y las 11:00 la cobertura del dosel con una cámara digital Samsung ES95 ubicada 30 cm al norte de la base de cada individuo. Las fotos fueron procesadas con el programa Adobe Photoshop CS3 (Adobe, 2007), donde el efecto de las nubes se corrigió manualmente antes de obtener una imagen binaria. El color negro representó la cobertura vegetal y el blanco las zonas sin cobertura vegetal en el dosel (iluminación). La imagen binaria del sistema RGB obtenida se convirtió a porcentaje de iluminación mediante la siguiente formula: %=Iluminación (RGB) × 100/255.
Con un Data Logger (Hobo U23 Pro v. 2, Bourne, EUA) se registraron la temperatura (±0.1 °C) y la humedad relativa (±1%) cada 30 minutos por día. Los datos de septiembre de 2016 a mayo de 2017 se perdieron por afectaciones al sensor producidas por roedores. Las precipitaciones mensuales se obtuvieron del pluviómetro ubicado en la base de la elevación perteneciente a la Empresa de Aprovechamiento Hidráulico “Embalse Caunavaco”. Las precipitaciones, la temperatura y la humedad relativa de un mes se consideraron como las ocurridas en el tiempo que transcurrió entre dos muestreos. Se calculó la oscilación térmica diaria como la diferencia que se establece entre la temperatura máxima y mínima en cada uno de los meses, tal como plantea WMO (1992). El estudio se realizó durante tres años consecutivos, desde enero de 2016 y hasta diciembre de 2018.
Análisis de datos
Se calculó la dirección del vector medio (ángulo medio, µ), su longitud (r) y la desviación estándar circular para la producción de botones, flores y frutos, el crecimiento vegetativo y el retroceso de las ramas. La longitud del vector medio varía entre 0 y 1, valores superiores a 0.5 indican la agrupación de las observaciones alrededor del ángulo medio y la muestra es unimodal. Adicionalmente, la unimodalidad de las observaciones se comprobó mediante pruebas de Rayleigh (Fisher, 1993; Zar, 1999). Para comparar la distribución de las muestras entre los años del estudio, se realizaron pruebas de Mardia-Watson-Wheeler (Fisher, 1993; Zar, 1999). La actividad reproductiva, la producción media de botones, flores y frutos, el crecimiento vegetativo y el retroceso de las ramas entre años se confrontaron mediante una prueba de Watson-Williams F, la cual contrasta los ángulos medios y las longitudes del vector medio (Fisher, 1993; Zar, 1999). Las comparaciones entre años realizadas mediante las dos últimas pruebas se realizaron por pares de años.
Los eventos fenológicos anteriores, la actividad reproductiva y las variables ambientales se ilustraron por medio de histogramas circulares, donde cada barra corresponde con el número de observaciones mensuales. Cada uno de los días muestreados se convirtió a un ángulo (α) de la escala circular mediante la fórmula α=(360°)(X)/k, donde X representa el día del mes en que ocurrió el muestreo y k el número total de días del año. Todos los análisis anteriores y los histogramas circulares se realizaron en el programa Oriana v. 4.02 (Kovach, 2011), tal como sugiere la metodología propuesta por Morellato et al. (2010) y se consideraron estadísticamente significativos para p<0.05.
Se comprobó la normalidad y homogeneidad de varianza de las variables mediante las pruebas de Kolmogorov Smirnov y Levene, respectivamente. La relación existente entre las variables ambientales y las fenofases se evaluó mediante una correlación de Spearman debido a que no cumplieron las premisas previamente evaluadas. La actividad reproductiva y vegetativa pueden tardar cierto tiempo antes de que se observe una respuesta. Por ello, para la correlación entre la iluminación y las fenofases reproductivas (botones, flores y frutos), los porcentajes de iluminación utilizados correspondieron al del mes previo, mientras que para la correlación entre la iluminación y las fenofases vegetativas (crecimiento y retrocesos), se utilizó la suma de los porcentajes de los dos meses anteriores. Para las correlaciones con el resto de las variables ambientales (temperatura, humedad y precipitaciones) se utilizaron los datos entre dos muestreos. Las correlaciones se realizaron en el programa Statistica v. 10.0. (StatSoft, 2011) y se consideraron estadística y biológicamente significativas para p<0.05 y r>0.5, respectivamente, de acuerdo con Morellato et al. (2010).
Resultados
Patrones fenológicos
La incorporación de los individuos de Leptocereus scopulophilus a la reproducción comenzó en enero de 2016 y 2017 (Fig. 2), con mayor cantidad de individuos activos en abril (38%) y marzo (36%), respectivamente. En 2018 la actividad reproductiva comenzó en febrero y la mayor cantidad de individuos activos se encontró en marzo y abril (28%) (Fig. 2).

Figura 2: Actividad reproductiva de Leptocereus scopulophilus Areces (n=50), en el Pan de Matanzas, Cuba, durante los años 2016 (A), 2017 (B) y 2018 (C). Los círculos de trazos finos delimitan el número de observaciones y las barras se corresponden con el número de individuos observados. La flecha indica el vector medio y el círculo negro el valor crítico de Rayleigh. La ausencia de observaciones en junio de 2017 y mayo de 2018 se debió a la pérdida de datos durante ambos meses.
Los botones y las flores presentaron un patrón unimodal (Cuadro 1), aunque pueden ocurrir esporádicamente durante todo el año (Fig. 3). La producción de botones tuvo su media en abril en los tres años del estudio (Cuadro 1), mientras que el máximo de producción se alcanzó en abril durante 2016 y en marzo durante 2017 y 2018 (Figs. 3A-C). La media de producción de flores en 2016 se alcanzó a inicios de mayo (Cuadro 1, Fig. 3D), y difirió significativamente (Cuadro 2) respecto a 2017 y 2018 (Cuadro 1). Durante los tres años la máxima de producción de flores se alcanzó en abril (Figs. 3D-F). Entre los tres años la distribución de botones y flores se comportó de forma diferente (Cuadro 3).
Cuadro 1: Producción de botones, flores, frutos nuevos, crecimiento vegetativo y retroceso de las ramas de Leptocereus scopulophilus Areces (n=50), en el Pan de Matanzas, Cuba, 2016-2018.
| 2016 | 2017 | 2018 | 2016 | 2017 | 2018 | 2016 | 2017 | 2018 | |
| Número de observaciones | Botones | Flores | Frutos nuevos | ||||||
| 255 | 295 | 160 | 265 | 350 | 68 | 346 | 218 | 175 | |
| Ángulo medio (µ) | 107.25° | 95.98° | 95.97° | 120.05° | 104.23° | 107.89° | 144.48° | 118.38° | 158.89° |
| Mes correspondiente a µ | abril | abril | abril | mayo | abril | abril | mayo | abril | junio |
| Longitud del vector medio (r) | 0.88 | 0.86 | 0.71 | 0.90 | 0.89 | 0.58 | 0.67 | 0.64 | 0.47 |
| Desviación Estándar Circular | 27.96° | 30.75° | 46.90° | 26.06° | 27.03° | 59.21° | 51.20° | 53.41° | 69.50° |
| Prueba de Rayleigh (Z) | 200.95 | 221.13 | 81.86 | 215.47 | 280.14 | 23.36 | 155.68 | 91.42 | 40.16 |
| Prueba de Rayleigh (p) | <1×10-12 | <1×10-12 | <1×10-12 | <1×10-12 | <1×10-12 | 7.12×10-11 | <1×10-12 | <1×10-12 | <1×10-12 |
| Ángulo medio (µ) | Crecimiento vegetativo | Retroceso de las ramas | |||||||
| 153.34° | 139.01° | 178.43° | 245.54° | 322.13° | 289.08° | ||||
| Mes correspondiente a µ | junio | mayo | junio | septiembre | noviembre | octubre | |||
| Longitud del vector medio (r) | 0.84 | 0.34 | 0.29 | 0.77 | 0.91 | 0.49 | |||
| Desviación Estándar Circular | 33.51° | 84.02° | 90.18° | 40.68° | 24.75° | 68.34° | |||
| Prueba de Rayleigh (Z) | 389.92 | 19.08 | 22.33 | 64.62 | 363.42 | 113.03 | |||
| Prueba de Rayleigh (p) | <1×10-12 | 5.13×10-9 | 2×10-10 | <1×10-12 | <1×10-12 | <1×10-12 | |||
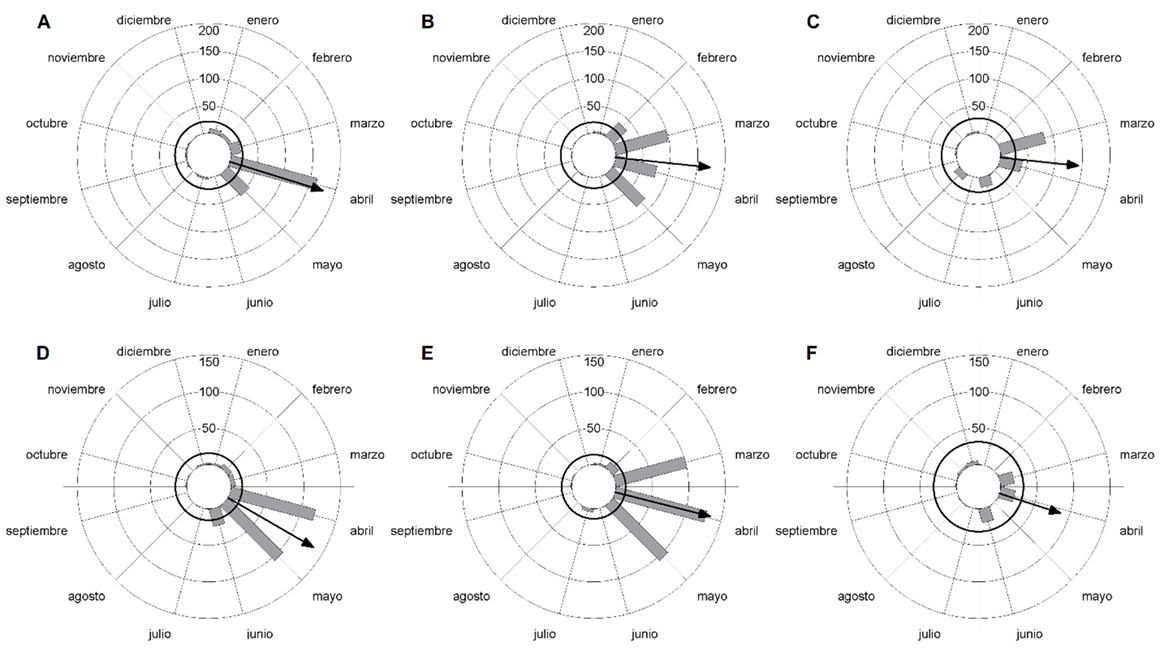
Figura 3: Producción de botones (A-C) y flores (D-F) de Leptocereus scopulophilus Areces (n=50), en el Pan de Matanzas, Cuba, durante los años 2016 (A y D), 2017 (B y E) y 2018 (C y F). Los círculos de trazos finos delimitan el número de observaciones y las barras se corresponden con el total de observaciones mensuales. La flecha indica el vector medio y el círculo negro el valor crítico de Rayleigh. La ausencia de observaciones en junio de 2017 y mayo de 2018 se debió a la pérdida de datos durante ambos meses.
Cuadro 2: Comparación por pares de años mediante la prueba de Watson-Williams F de la dirección del ángulo medio de la producción de botones, flores y frutos nuevos, así como el crecimiento vegetativo y el retroceso de las ramas de Leptocereus scopulophilus Areces (n=50), en el Pan de Matanzas, Cuba, 2016-2018.
| Años a comparar (cantidad de observaciones) | F | p | |
|---|---|---|---|
| Botones | 2016 (255)-2017 (295) | 0.05 | 0.82 |
| 2016 (255)-2018 (160) | 2.51 | 0.11 | |
| 2017 (295)-2018 (160) | 1.90 | 0.16 | |
| Flores | 2016 (265)-2017 (350) | 6.65 | 0.01 |
| 2016 (265)-2018 (68) | 5.19 | 0.02 | |
| 2017 (350)-2018 (68) | 1.49 | 0.22 | |
| Frutos nuevos | 2016 (346)-2017 (218) | 15.16 | 1.11×10-4 |
| 2016 (346)-2018 (175) | 1.90 | 0.16 | |
| 2017 (218)-2018 (175) | 15.97 | 7.66×10-5 | |
| Crecimiento vegetativo | 2016-2017 | 1.59 | 0.20 |
| 2016-2018 | 0.21 | 0.64 | |
| 2017-2018 | 1.03 | 0.30 | |
| Retroceso de las ramas | 2016-2017 | 466.35 | <1×10-12 |
| 2016-2018 | 57.29 | <1×10-12 | |
| 2017-2018 | 87.82 | <1×10-12 | |
Cuadro 3: Comparación por pares de años mediante la prueba de Mardia-Watson-Wheeler de la distribución de botones, flores, frutos nuevos, frutos totales, crecimiento vegetativo y retroceso de las ramas de Leptocereus scopulophilus Areces (n=50), en el Pan de Matanzas, Cuba.
| Años comparados (cantidad de observaciones) | W | p | |
|---|---|---|---|
| Botones | 2016 (255)-2017 (295) | 110.95 | <1×10-12 |
| 2016 (255)-2018 (160) | 80.24 | <1×10-12 | |
| 2017 (295)-2018 (160) | 78.32 | <1×10-12 | |
| Flores | 2016 (265)-2017 (350) | 14.25 | 8.04×10-4 |
| 2016 (265)-2018 (68) | 15.03 | 5.43×10-4 | |
| 2017 (350)-2018 (68) | 51.86 | 5.47×10-12 | |
| Frutos nuevos | 2016 (346)-2017 (218) | 122.40 | <1×10-12 |
| 2016 (346)-2018 (175) | 56.99 | <1×10-12 | |
| 2017 (218)-2018 (175) | 26.83 | 1.49×10-6 | |
| Frutos totales | 2016 (1005)-2017 (535) | 59.70 | <1×10-12 |
| 2016 (1005)-2018 (395) | 2.60 | 0.272 | |
| 2017 (535)-2018 (395) | 47.84 | 4.08×10-11 | |
| Crecimiento vegetativo | 2016 (255)-2017 (295) | 137.89 | <1×10-12 |
| 2016 (255)-2018 (160) | 45.03 | 1.66×10-10 | |
| 2017 (295)-2018 (160) | 47.70 | 4.38×10-11 | |
| Retroceso de las ramas | 2016 (265)-2017 (350) | 142.82 | <1×10-12 |
| 2016 (265)-2018 (68) | 74.73 | <1×10-12 | |
| 2017 (350)-2018 (68) | 50.29 | 1.2×10-11 | |
La producción de frutos nuevos resultó unimodal en 2016 y 2017, mientras que fue multimodal en 2018 (Cuadro 1, Fig. 4C), y ocurrió esporádicamente durante todo el año (Figs. 4A-C). La media de producción de frutos nuevos se alcanzó en meses diferentes en los tres años de estudio (Cuadro 1), mientras que el máximo de producción se obtuvo en mayo de 2016 y en abril durante 2017 y 2018 (Figs. 4A-C). La distribución de la producción de frutos nuevos difirió entre los tres años de estudio (Cuadro 3). Respecto a los frutos totales, en 2016 la mayor disponibilidad ocurrió en mayo, mientras en 2017 y 2018 fue en abril y junio, respectivamente (Figs. 4D-F). La disponibilidad de frutos totales difirió entre 2017 y el resto de los años de estudio (Cuadro 3).
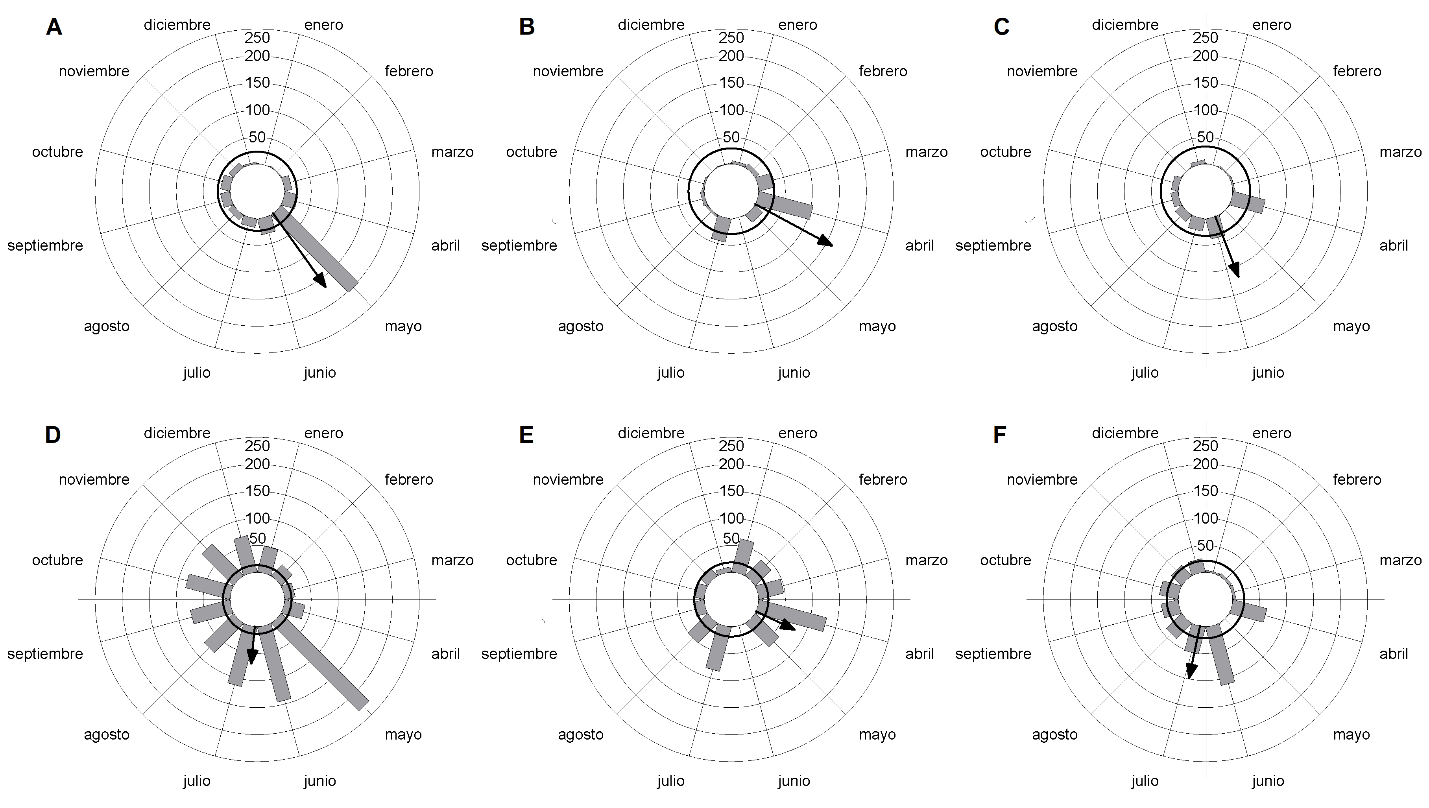
Figura 4: Producción de frutos nuevos (A-C) y frutos totales (D-F) de Leptocereus scopulophilus Areces (n=50), en el Pan de Matanzas, Cuba, durante los años 2016 (A y D), 2017 (B y E) y 2018 (C y F). Los círculos de trazos finos delimitan el número de observaciones y las barras se corresponden con el total de observaciones mensuales. La flecha indica el vector medio y el círculo negro el valor crítico de Rayleigh. La ausencia de observaciones en junio de 2017 y mayo de 2018 se debió a la pérdida de datos durante ambos meses.
El crecimiento de las ramas durante 2016 resultó unimodal, mientras en el resto de los años fue multimodal (Cuadro 1, Figs. 5A-C). La media de crecimiento en 2016 y 2018 se alcanzó en junio, lo cual no difirió respecto a 2017 (Cuadro 2) pese a que se alcanzó en mayo (Cuadro 1, Figs. 5A-C). El crecimiento máximo de las ramas (Figs. 5A-C) y la distribución (Cuadro 3) difirió entre los tres años de estudio.
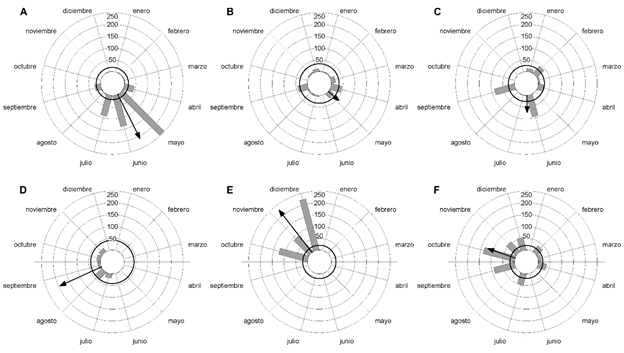
Figura 5: Crecimiento vegetativo (A-C) y retroceso de las ramas (D-F) de Leptocereus scopulophilus Areces (n=50), en el Pan de Matanzas, Cuba, durante los años 2016 (A y D), 2017 (B y E) y 2018 (C y F). Los círculos de trazos finos delimitan el crecimiento y el retroceso en cm. Las barras se corresponden con el crecimiento o retroceso en cm. La flecha indica el vector medio y el círculo negro el valor crítico de Rayleigh. La ausencia de observaciones en junio de 2017 y mayo de 2018 se debió a la pérdida de datos durante ambos meses.
El retroceso de las ramas fue unimodal durante 2016 y 2017, mientras que en 2018 resultó multimodal (Cuadro 1, Figs. 5D-F). La media de los retrocesos difirió entre los tres años de estudio (Cuadros 1, 2, Figs. 5D-F). El máximo de retroceso en los tres años se alcanzó en diciembre de 2017 (Figs. 5D-F). El retroceso de las ramas se distribuyó de modo diferente entre los tres años de estudio (Cuadro 3).
Variables ambientales
La máxima iluminación generalmente corresponde con la época de secas, de noviembre a abril (Figs. 6A-C). El porcentaje de iluminación que llega al dosel comenzó su ascenso en noviembre durante 2016 y 2018, sobrepasando 20%, cifra que se alcanzó ligeramente en diciembre de 2017. Durante los tres años el porcentaje de iluminación aumenta hasta marzo o abril (Figs. 6A-C).

Figura 6: Variables climáticas en el área que ocupa la población de Leptocereus scopulophilus Areces en el Pan de Matanzas, Cuba, durante los años 2016 (A, D, G), 2017 (B, E, H) y 2018 (C, F, I). Las barras se corresponden con la iluminación en % (A-C), precipitaciones en mm (D-F) y temperatura en °C (G-I). La zona sombreada representa la época lluviosa de acuerdo con Lecha et al. (1994). Las diferentes intensidades de gris en las barras de las figuras G-I representan la temperatura media (gris oscuro), máxima (negro) y mínima (gris claro) mensual. La ausencia de barras en junio de 2017 (B), mayo de 2018 (C), de septiembre a diciembre de 2016 (G) y de enero a mayo de 2017 (H) se debió a la pérdida de datos durante dichos meses.
El año con mayor cantidad de precipitaciones fue 2017 (Fig. 6E), con un total de 1715.2 mm; en 2016 y 2018 el total de precipitaciones alcanzado fue de 1203.4 y 1238.9 mm, respectivamente. El momento de mayores precipitaciones coincide con la época de lluvias, que ocurre desde mayo hasta octubre, aunque en 2016 y 2017 se observó un mes con altas precipitaciones en el periodo seco (Figs. 6D, E). Durante 2016 y 2018 el máximo de precipitaciones ocurrió en junio, mientras en 2017 fue en julio (Figs. 6D-F).
La temperatura media osciló entre 23-27 °C y de manera general los mayores valores de temperaturas ocurrieron en 2018, entre 29 y 39 °C (Figs. 6G-I). Los picos de temperatura máxima se concentraron principalmente durante el invierno en 2018 (Fig. 6 I), que corresponde con la época seca, aunque en 2016 las máximas fueron superiores durante la época lluviosa y en 2017 no se observó un patrón claro por la ausencia de datos en la mayor parte de los meses. Por otra parte, la humedad relativa media osciló entre 75 y 90%, mientras que las mayores variaciones se encontraron en la humedad relativa mínima, la cual varió entre 25 y 75% (datos no mostrados).
Relación entre las fenofases y las variables ambientales
La variable más correlacionada con las fenofases de Leptocereus scopulophilus fue la iluminación. Otras variables de temperatura y humedad relativa estuvieron correlacionadas solamente con una o dos fenofases en 2016 y 2018, que fueron los años donde se obtuvieron la mayoría de las correlaciones, debido a que en 2017 los datos perdidos correspondieron al periodo reproductivo. Las precipitaciones solo se correlacionaron con la producción de frutos en 2018 (Cuadro 4).
Cuadro 4: Matriz de correlación entre fenofases de Leptocereus scopulophilus Areces (n=50) y variables climáticas en el Pan de Matanzas, Cuba, 2016-2018. Se muestran los valores de coeficiente de correlación de Spearman (rs) para cada par de variables y se destacan en negritas aquellas estadísticas (p<0.05) y biológicamente (rs>0.5) significativas. La ausencia de datos se debe a su pérdida durante el año.
| Variables climáticas | Producción de botones | Producción de flores | Producción de frutos nuevos | Crecimiento vegetativo | Retroceso de las ramas | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2016 | 2017 | 2018 | 2016 | 2017 | 2018 | 2016 | 2017 | 2018 | 2016 | 2017 | 2018 | 2016 | 2017 | 2018 | |
| Iluminación | 0.64 | 0.80 | 0.53 | 0.88 | 0.86 | 0.61 | 0.31 | 0.69 | 0.01 | 0.67 | 0.66 | 0.33 | -0.60 | -0.20 | -0.61 |
| Precipitaciones | -0.22 | -0.35 | -0.02 | 0.00 | -0.34 | -0.25 | 0.17 | -0.28 | 0.58 | 0.06 | 0.27 | 0.08 | 0.00 | 0.17 | -0.17 |
| Temperatura mínima | -0.56 | -0.27 | -0.45 | -0.27 | 0.30 | 0.09 | 0.49 | -0.29 | 0.73 | 0.48 | |||||
| Temperatura media | -0.52 | 0.01 | -0.33 | 0.04 | 0.38 | 0.24 | 0.52 | -0.58 | 0.76 | 0.51 | |||||
| Temperatura máxima | 0.28 | 0.49 | 0.33 | 0.59 | 0.61 | -0.25 | 0.59 | -0.03 | 0.26 | 0.11 | |||||
| Oscilación térmica diaria | 0.79 | 0.45 | 0.50 | 0.44 | -0.14 | -0.25 | -0.32 | 0.02 | -0.48 | -0.10 | |||||
| Humedad relativa mínima | -0.37 | -0.60 | -0.13 | -0.65 | -0.04 | 0.20 | 0.01 | -0.04 | -0.21 | 0.18 | |||||
| Humedad relativa media | -0.22 | -0.44 | -0.30 | - | 0.53 | -0.28 | 0.30 | 0.20 | 0.13 | -0.21 | -0.08 | ||||
La iluminación se correlacionó positivamente con la producción de botones, flores, frutos y crecimiento de las ramas, y negativamente con el retroceso de las ramas durante 2016 y 2018 (Cuadro 4). Tanto la temperatura mínima como la media, de 2016, se correlacionaron positivamente con el retroceso de las ramas (Cuadro 4). La temperatura media en 2018 lo estuvo negativamente con el crecimiento vegetativo. La temperatura máxima se correlacionó solo con la producción de flores de 2018, mientras la oscilación térmica diaria en 2016 lo hizo positivamente con la producción de botones (Cuadro 4). La humedad relativa mínima y media mostró correlación negativa con la producción de botones y flores en 2018 (Cuadro 4).
Discusión
Actividad reproductiva
La actividad reproductiva de Leptocereus scopulophilus comprende mayormente la época seca, lo que concuerda con lo reportado por Barrios et al. (2014) para la especie. En contraste con dichos autores, nosotros registramos una actividad reproductiva de los individuos inferior a 40% (Fig. 2) en la época de mayor actividad (febrero-mayo), mientras que Barrios et al. (2014) reportan en la misma época valores entre 60-80%.
Varias causas podrían explicar las diferencias entre nuestros resultados y los de Barrios et al. (2014). Resulta poco probable que desde 2009 hayan sucedido cambios climáticos drásticos en el área de estudio, pues en 2008 (año previo) precipitaron 1556.4 mm y en 2009, 1351.4 mm (D. Barrios, datos no publicados), cantidades similares a las observadas durante 2016-2018. Probablemente la baja actividad reproductiva registrada esté relacionada con el envejecimiento poblacional, o las constantes pudriciones de las ramas que predominaron respecto al crecimiento durante 2017 y 2018. Otra explicación posible pudiera estar dada por el aumento o la constancia en el tiempo de los niveles de herbivoría reportados para la especie por Barrios (2008), Barrios et al. (2012c) y Martínez (2014), causando un efecto negativo sobre la producción de estructuras reproductoras.
Floración
La floración unimodal (Fig. 3) en Leptocereus scopulophilus durante el final de la época de secas y el inicio de la lluviosa (Figs. 6D-F) concuerda con lo referido para la especie por Areces (2003) y Barrios et al. (2014), así como con el patrón general de floración de la mayoría de las cactáceas cubanas (Barrios et al., 2015). Patrones de floración unimodal durante la época seca también han sido registrados en cactáceas de bosques secos como Pachycereus pringlei Britton & Rose (Fleming et al., 2001), Stenocereus queretaroensis (F.A.C. Weber ex Mathes.) Buxb. (Ibarra-Cerdeña et al., 2005), Pterocereus gaumeri Britton & Rose (Méndez et al., 2005) y Eulychnia acida (Salvatierra, 2020).
El retraso de la producción de botones y flores en 2016 respecto a 2017-2018 (Fig. 3) podría ser el resultado del comportamiento desigual de las condiciones climáticas durante los tres años analizados. Al inicio de 2016 (enero-febrero) ocurrió una ampliación de la época lluviosa, que se unió a las precipitaciones de los últimos meses de 2015 (datos no mostrados) (Fig. 6D), lo cual no ocurrió durante los primeros meses de 2017 y 2018 (Figs. 6E, F). Según Cutié et al. (2015), desde marzo de 2015 comenzaron a desarrollarse las condiciones oceánicas propias del evento El Niño-Oscilación del Sur (ENOS), lo que alcanzó su máximo desarrollo en diciembre del propio año y fue uno de los tres más intensos de las últimas seis décadas. La principal influencia del evento ENOS sobre Cuba ocurre en el período seco, donde el clima se torna lluvioso y en ocasiones tormentoso, como ocurrió en 2015 y 2016 (Cutié et al., 2015; 2016). Por ello, 2016 presenta las mayores precipitaciones en invierno respecto a 2017 y 2018 (Figs. 6D-F).
Según Barrios et al. (2014), durante la época seca en el Pan de Matanzas la mayoría de los árboles pierden sus hojas y muchas de las lianas mueren, lo que posibilita la llegada de mayor cantidad de luz y aumento de las temperaturas en el sotobosque. Ambos aumentos en iluminación y temperatura máxima (que dependen de la intensidad y duración de las lluvias previas) parecen actuar como disparadores de la floración en Leptocereus scopulophilus. Principalmente la iluminación se correlacionó positivamente con la producción de botones y flores (Cuadro 4), y concuerda con lo sugerido por González-Torres et al. (2012) y Barrios et al. (2014). Nuestros resultados muestran un posible umbral de iluminación alrededor de 20% para que se inicie la floración. Por ejemplo, en 2016, se alcanzó 20% en febrero (Fig. 6A), por lo que pudo ser el causante del retraso de la floración respecto a 2017 y 2018 (Fig. 3).
Tal dependencia entre el nivel de luz que atraviesa el dosel y el comienzo de la floración concuerda con el criterio de Adams et al. (1999), quienes consideran que la floración se incrementa linealmente con el aumento de la iluminación y la temperatura. De igual modo, Wycherley (1973), Van Schaik (1986) y Lepsch-Cunha y Mori (1999) demostraron que la productividad aumenta cuando hay mayor luminosidad en especies tropicales del sotobosque. Taiz y Zeiger (2002) consideran que esta relación se debe a la acumulación de recursos durante los días con mayor iluminación, los cuales son utilizados para la floración. Por ello, Leptocereus scopulophilus aprovecha el aumento de la iluminación y florece en la época seca (Fig. 3).
El año con menor floración fue 2018, pese a presentar precipitaciones similares a 2016 y niveles de iluminación similares en 2017. Esta situación podría estar relacionada con que previo a la floración de 2018, los retrocesos ocurridos en 2017 fueron los mayores durante los tres años de estudio (Fig. 5E), donde el balance entre crecimiento y retroceso fue negativo. Tales retrocesos, que fueron máximos en diciembre de 2017 (Fig. 5E), probablemente empeoraron el estado fitosanitario de los individuos, afectando así en 2018 la actividad reproductiva.
Fructificación
La concentración de la floración hacia los meses previos a la época lluviosa permite la posterior maduración de los frutos, dispersión de las semillas y el establecimiento de las plántulas en la época de lluvias (Bustamante y Búrquez, 2005). Dicho fenómeno podría aumentar las probabilidades de supervivencia en un momento del año donde el estrés hídrico es mínimo, tal como sugieren Barrios et al. (2014) y García-Beltrán (2014). En regiones tropicales con clima estacional, la disponibilidad de agua en el suelo constituye el principal factor que limita la germinación de las semillas y el establecimiento de las plántulas (Franco, 2002; Baskin y Baskin, 2014). Por ello, en tales ecosistemas la germinación al inicio de la temporada lluviosa es crucial para el reclutamiento de las plantas, permitiendo que las semillas desarrollen un sistema radicular eficiente o almacenen suficientes recursos para sobrevivir a la siguiente temporada seca (Franco, 2002; Oliveira, 2008).
En los dos primeros años del estudio ocurre una caída abrupta de los frutos entre los meses de mayo-junio y abril-mayo, respectivamente. Ello pudiera responder al aborto de los frutos inmaduros producto de las lluvias. Según Vílchez et al. (2008), las precipitaciones pueden dañar o desprender las estructuras reproductoras durante tormentas de lluvias y vientos asociados. El aborto de botones asociado a eventos de lluvias fuertes ha sido observado en Stenocereus griseus (Petit, 2001) y Harrisia portoricensis Britton (Rojas-Sandoval y Meléndez-Ackerman, 2011), y concuerda con la tendencia observada que presentaron la mayoría de las fenofases de correlacionarse negativamente con las precipitaciones (Cuadro 4).
Crecimiento vegetativo y retroceso de las ramas
El crecimiento vegetativo (Figs. 5A-C), simultáneo a la floración (Fig. 3) y la fructificación (Fig. 4) en Leptocereus scopulophilus, contrasta con una de las características más extendidas en las cactáceas columnares. En este grupo de cactus, el crecimiento vegetativo ocurre durante la época seca, pero no durante la reproducción para alcanzar un mayor ajuste a las limitaciones de agua (Pimienta-Barrios y Nobel, 1995, 1998; Pimienta-Barrios et. al., 2004). El crecimiento vegetativo en L. scopulophilus ocurre cuando la temperatura promedio y las precipitaciones descienden durante la época de secas, al igual que Pimienta-Barrios et al. (2004) encontraron para Stenocereus queretaroensis. De acuerdo con Oliveira (2008), el crecimiento durante la época de reproducción puede ser ventajoso debido a que potencia la producción de recursos fotosintéticos durante los primeros estadios del proceso reproductivo. Por tanto, el crecimiento vegetativo simultáneo a la reproducción podría constituir una adaptación de L. scopulophilus para aprovechar la alta iluminación, tal como lo demuestran las correlaciones entre crecimiento e iluminación (Cuadro 4).
El alto número de retrocesos de los tallos registrados (Figs. 5D-F) podría estar influenciado por las precipitaciones, debido a que ocurren principalmente durante o posterior a la época de lluvias. Aunque las retrogresiones se contabilizan cuando la rama se seca, su efecto ocurre un tiempo antes, pues el proceso de pudrición tarda aproximadamente un mes. Ello concuerda con la correlación positiva existente entre el retroceso de las ramas y las temperaturas mínima y media durante 2016 (Cuadro 4) y la correlación negativa existente entre la iluminación y el retroceso de las ramas en 2016 y 2018 (Cuadro 4). Esta situación se debe a que los retrocesos ocurren durante la época de lluvias, correspondientes con el verano, donde las temperaturas mínima y media tienden a ascender, y la iluminación es mínima.
Conclusiones
Leptocereus scopulophilus presenta un patrón reproductivo unimodal, con variaciones interanuales, influenciado por las variables ambientales que inciden en el área. La iluminación es la variable más correlacionada con sus fenofases reproductivas y se encuentra modulada por la duración e intensidad de las precipitaciones de los meses previos. El crecimiento vegetativo ocurre generalmente de forma aleatoria. Se inicia durante la época seca y de forma simultánea a la reproducción, lo cual podría constituir una adaptación de la especie para aprovechar la alta iluminación y compensar los retrocesos que ocurren durante la época de lluvias. Adicionalmente, el retroceso de las ramas es unimodal y ocurre principalmente a finales de la época lluviosa y se extiende hasta inicios del periodo seco, afectando de forma negativa la actividad reproductiva de L. scopulophilus.











 nova página do texto(beta)
nova página do texto(beta)