Introducción
Las especies del género Trichoderma Pers. representan un grupo de hongos filamentosos que pertenecen al Reino Fungi, División Ascomycota, Subdivisión Pezizomycotina, clase Sordariomycetes, orden Hypocreales y familia Hypocraceae (Index Fungorum, 2017). Este género incluye especies con distribución mundial; son eficaces competidores y colonizadores exitosos, debido a su alto potencial para sintetizar y liberar enzimas como celulasas, xilanasas y quitinasas, las cuales, además, se han aprovechado en procesos industriales (Verma et al., 2007; Kubicek et al., 2008). Pueden producir metabolitos secundarios (Brian, 1944; Di Pietro et al. 1993; Dodd et al., 2003; Vinale et al., 2008; Mukherjee et al., 2012), así como hormonas de crecimiento (Kleifeld y Chet 1992; Chowdappa et al., 2013) y se les considera de gran importancia económica como agentes de control biológico (Hjeljord y Tronsmo, 2002; Harman et al., 2004; Schmoll et al., 2016). Se caracterizan por predominar en ambientes terrestres desde suelos agrícolas, pastizales, bosques y desiertos (Zhang et al., 2005). A pesar de la importancia de este género, aún desconocemos su diversidad en las selvas altas perennifolios. Igualmente se ignora la respuesta de este grupo de hongos a las perturbaciones que sufren este tipo de ecosistemas.
Las selvas tropicales se han modificado a umbrales a partir de los cuales la diversidad, distribución, abundancia y adecuación de distintos grupos biológicos pueden verse afectadas (Fahrig, 2003; Noss et al., 2006). El estado de Tabasco ha perdido más de 95% de sus selvas, esto debido a la implementación del plan Chontalpa (agrícola) y el plan Balancan-Tenosique (ganadero) en los años 60 del siglo 20, así como al auge de la industria petrolera (Tudela, 1990; Castillo y Zavala, 1996; Bray y Klepeis, 2005).
Derivado de esta situación se han decretado áreas naturales protegidas de jurisdicción estatal y federal, convirtiéndose estos en los únicos remanentes de ecosistemas naturales nativos. Un ejemplo de esto es el Parque Estatal Agua Blanca (PEAB) que fue declarado Área Natural Protegida en el 1987 (Vargas, 2002). Sin embargo, este parque se encuentra afectado por actividades antropogénicas, como la fragmentación por expansión de la frontera agrícola.
Existen algunos estudios que confirman que los disturbios en el suelo influyen sobre la distribución y composición de las comunidades fúngicas (Setälä y McLean, 2004; Fryar et al., 2005; Chaverri y Vilchez, 2006); sin embargo, los efectos de los disturbios sobre la comunidad de Trichoderma han sido poco estudiadas. Así, se planteó este estudio con la finalidad de evaluar la diversidad de Trichoderma dentro del PEAB en sitios con diferente grado de perturbación.
Materiales y métodos
Área de estudio
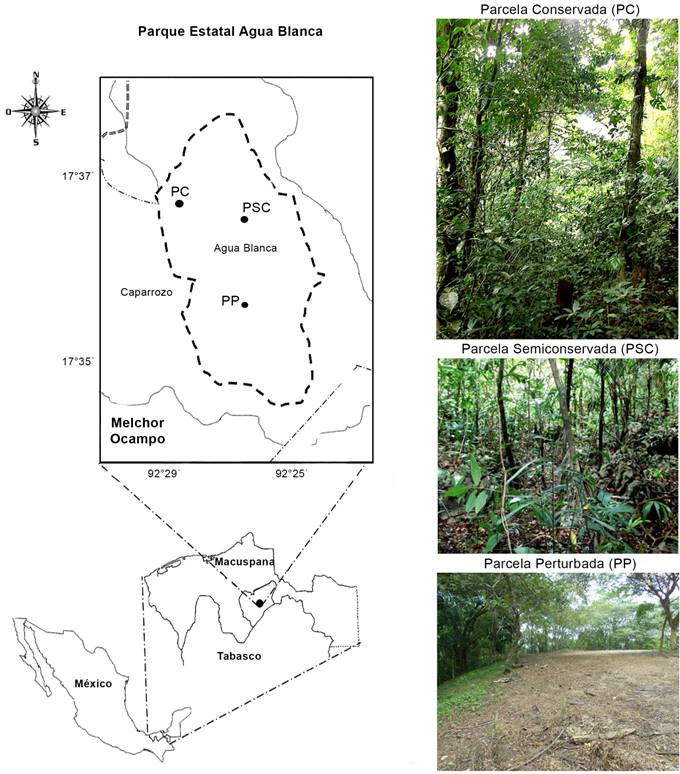
El Parque Estatal Agua Blanca (PEAB) es un Área Natural Protegida (ANP) en el estado de Tabasco (Fig. 1). Se localiza en el ejido Las Palomas, municipio Macuspana, en la porción oeste y noroeste de la Región Sierra de Tabasco, entre los paralelos 17°35' y 17°37' de latitud norte y entre los meridianos 92°25' y 92°29' de longitud oeste, entre 100 y 200 m s.n.m. (INEGI, 2005). El PEAB comprende 2025 ha de selva alta perennifolia, generalmente dominada por árboles de más de 30 m de altura con abundantes bejucos y plantas epífitas. Los árboles que dominan son canshan (Terminalia amazonia (J.F. Gmel.) Exell), ramón (Brosimum alicastrum Sw.), palo mulato (Bursera simaruba (L.) Sarg.), guapaque (Dialium guianense (Aubl.) Sandwith), caoba (Swietenia macrophylla King), zapote mamey (Pouteria sapota (Jacq.) H.E. Moore & Stearn), ceiba (Ceiba pentandra (L.) Gaertn.), botoncillo (Rinorea guatemalensis (S. Watson) Bartlett) entre otros. Esta área presenta remanentes de la vegetación natural en la región (Miranda y Hernández, 1963; INEGI, 2005). Los suelos son derivados de la desintegración de rocas calizas y se clasifican como rendzinas, son delgados y con presencia de un horizonte “A” de color oscuro, rico en nutrientes, el cual está localizado arriba de un horizonte “C” o roca madre (Castillo y Zavala, 1996). El clima es cálido húmedo con lluvias todo el año, Af (m)w''(i)g, la temperatura promedio anual fluctúa entre 23 y 26 ºC, mientras que la precipitación pluvial anual promedio oscila entre 2100 y 3200 mm (García, 1988; INEGI, 2005).
Muestreos
Se realizaron siete muestreos entre octubre 2014 y junio 2015. El área de muestreo fue de 2050 ha, dividido en tres parcelas de 100 × 100 m, que se categorizaron como Conservada (C), Semiconservada (SC) y Perturbada (P), de acuerdo al método de Martorell y Peters (2005). Para esta clasificación, se utilizaron los criterios de presencia/ausencia de actividades humanas (cambio de uso del suelo por actividad agrícola y ganadera, incendios y cercanía de poblaciones y caminos), cobertura vegetal (densa o fragmentada) y la presencia de residuos sólidos. En cada parcela se trazaron tres transectos y se tomaron 10 g de suelo del horizonte “A”. Las muestras de suelo fueron trasladadas al laboratorio bajo condiciones ambientales donde fueron mezclados para obtener una muestra compuesta de cada parcela. El suelo se secó a temperatura ambiente en bandejas previamente desinfectadas con alcohol al 96%, para evitar contaminación, y se almacenó durante 2 semanas a 5 ºC hasta su procesamiento para el aislamiento de los hongos. Los datos de las variables ambientales de los tres sitios de estudio fueron tomados de Sánchez (2015).
Parcela conservada (PC)
En la parcela conservada no se registró actividad agrícola, el dosel es denso, 92.37% de cobertura vegetal. Esta área cuenta con abundantes palmas y árboles de más de 25 m de alto, característicos de vegetación primaria de la selva. El contenido de materia orgánica es 12% y de carbono 7.1%. El pH registrado para el sitio es neutro (7). La temperatura del suelo es 23.4 ºC y la humedad ambiental 81.24%. La acumulación de hojarasca en el suelo es de 3.4 cm de espesor.
Parcela semiconservada (PSC)
Esta zona de muestreo se encuentra poco conservada, debido a la presencia de actividad agrícola abandonada. El dosel tiene 80% de cobertura vegetal. Hay presencia de vegetación secundaria. El contenido de materia orgánica es 9.66% y de carbono 7%. El pH registrado para el sitio es neutro (7). La temperatura del suelo es 23 ºC y la humedad ambiental 80.5%. La cantidad de hojarasca acumulada en el suelo es de 3.6 cm de espesor.
Parcela perturbada (PP)
Esta área se encuentra perturbada con presencia de actividad agrícola y cacería. El dosel es de 72.22% de cobertura vegetal. Hay presencia de vegetación secundaria. El contenido de materia orgánica es 12.61% y de carbono 7.5%. El pH registrado para el sitio es neutro (7). La temperatura del suelo es 24 ºC y la humedad ambiental 80%. La cantidad de hojarasca acumulada en el suelo es de 2.6 cm de espesor.
Aislamientos e identificación de Trichoderma
Las cepas fueron aisladas mediante la técnica de lavado de partículas de suelo de acuerdo a Bills y Polishook (1994). De cada una de las muestras se lavó 1 g de suelo a través de una serie de micro tamices con mallas (1 mm, 250 µm y 105 µm de abertura, sostenidas cada uno en una malla de 2 mm) conectados a una bomba de vacío. El lavado se efectuó con agua purificada hasta completar 2 litros de agua. Las partículas contenidas en el tamiz inferior (malla de 105 µm) se transfirieron a placas Petri con medio de cultivo DBRC (rosa de bengala con dicloran y clorafenicol OXOID). Este medio reduce el crecimiento de las colonias fúngicas y facilita su cuantificación. Las placas de Petri con las partículas se incubaron en la oscuridad a 25 °C durante 15 días. A partir del tercer día todas las colonias de Trichoderma emergentes de las partículas fueron transferidas a tubos con medio de cultivo papa dextrosa agar (PDA). Posteriormente las colonias se agruparon de acuerdo con sus características morfológicas como color, tipo de micelio, forma de crecimiento, tipo de margen, exudados, tinción del medio, entre otras. Para cada especie se cuantificó su abundancia. Previo a la identificación, las colonias se sembraron en placas de Petri con papa dextrosa agar (PDA), extracto de malta agar (EMA) y harina de maíz agar (CMA), los cuales son útiles para su propagación, diferenciación y para promover su esporulación. Además, para cada una de las especies se realizaron preparaciones permanentes en alcohol polivinílico y semipermanentes en ácido láctico. En todos los casos, se elaboraron microcultivos para observar el tipo de conidiogénesis, el cual es un carácter importante para la identificación.
Las preparaciones se revisaron bajo un microscopio compuesto (Nikon Eclipse 80i con interfase Nomarski,Tokyo, Japón). La identificación taxonómica se realizó con la ayuda de claves taxonómicas y bibliografía especializada para el género Trichoderma (Domsch et al., 1980; Gams y Bissett, 1998; Samuels et al., 2002, 2009; Chaverri et al., 2003; Park et al., 2006; Samuels e Ismaiel, 2009; Bisset et al., 2015).
Procesamiento de los datos
Para cada uno de los muestreos y las parcelas se evaluaron las siguientes variables utilizando el software PAST ver. 1.84 (Hammer et al., 2001).
La riqueza de especies (S) es el número total de especies presentes en una parcela.
La abundancia de colonias es el número total de colonias de Trichoderma aisladas a partir de 1 g de suelo seco.
La frecuencia total de ocurrencia (Fr%) es el número de veces que aparece una especie dividido entre 21 (número total de los siete muestreos en las tres parcelas), multiplicado por 100.
La diversidad se calculó mediante el índice de Shannon Wiener (H´).
La dominancia de especies se determinó mediante la prueba de asociación de Olmstead-Tukey. Esta prueba se realiza utilizando el logaritmo natural de las abundancias y sus frecuencias de aparición. Con estos datos se obtiene una gráfica de dispersión que se divide en cuadrantes, utilizando las medianas de ambos parámetros para trazar los ejes. La clasificación se estableció según el cuadrante en el que se ubicaron. Dominantes (abundancia y frecuencia de aparición alta), ocasionales (abundancia alta y frecuencia de aparición baja), constantes (abundancia baja y frecuencia de aparición alta) y raras (abundancia y frecuencia de aparición baja).
Para identificar diferencias en la abundancia (colonias), en la riqueza y en el índice de diversidad de Trichoderma entre las parcelas, se llevaron a cabo análisis de varianza de una vía. Mediante un análisis de regresión lineal simple, se exploró la relación entre las variables abundancia, riqueza y diversidad con las variables ambientales (cobertura vegetal, contenido de materia orgánica, carbono, pH, temperatura, humedad ambiental y cantidad de hojarasca acumulada en el suelo).
Resultados
Composición taxonómica
Se obtuvieron un total de 209 aislamientos a partir de 21 muestras de suelo, de las cuales se identificaron 13 especies diferentes (Fig. 2). Trichoderma piluliferum J. Webster & Rifai presentó una mayor frecuencia de ocurrencia (76.19%), seguida de T. asperellum Samuels, Lieckf. & Nirenberg y T. atroviride Bissett (71.43%). Trichoderma citrinoviride Bissett tuvo una baja frecuencia de ocurrencia (28.57%) al estar presente únicamente en seis de 21 muestras (7 muestreos × 3 parcelas=21) (Cuadro 1).
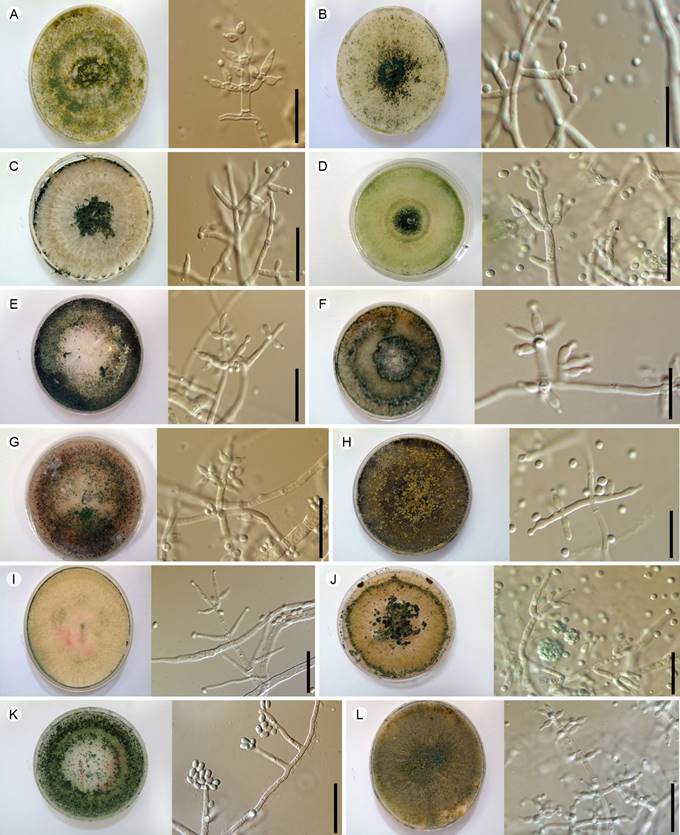
Figura 2: Especies de Trichoderma Pers. registradas. Colonias en EMA a los 7 días de crecimiento. Conidióforos, células conidiógenas y conidios en EMA. A. Trichoderma asperellum Samuels. Lieckf. & Nirenberg; B. Trichoderma atroviride Bissett; C. Trichoderma aureoviride Rifai; D. Trichoderma citrinoviride Bissett; E. Trichoderma harzianum Rifai; F. Trichoderma koningii Oudem; G. Trichoderma koningiopsis Samuels, Carm. Suárez & H.C. Evans; H. Trichoderma longibrachiatum Rifai; I. Trichoderma parceramosum Bissett; J. Trichoderma piluliferum J. Webster & Rifai; K. Trichoderma vinosum Samuels; L. Trichoderma virens (J.H. Mill., Giddens & A.A. Foster) Arx. Escalas A-L=20 µm.
Cuadro 1: Abundancia de colonias (A) y la frecuencia de ocurrencia (Fr%) de las especies de Trichoderma Pers. aisladas durante siete muestreos en las parcelas seleccionadas en el Parque Estatal Agua Blanca (PEAB).
| Especies/muestreos | Conservada | Semiconservada | Perturbada | Abundancia | Fr(%) | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | total | total | |
| Trichoderma asperellum Samuels, Lieckf. & Nirenberg | 1 | 0 | 1 | 1 | 1 | 0 | 2 | 0 | 1 | 0 | 0 | 0 | 2 | 2 | 3 | 1 | 1 | 1 | 3 | 2 | 3 | 25 | 71.43 |
| Trichoderma atroviride Bissett | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 1 | 0 | 1 | 1 | 2 | 0 | 1 | 1 | 2 | 3 | 2 | 2 | 21 | 71.43 |
| Trichoderma aureoviride Rifai | 3 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 3 | 0 | 0 | 2 | 0 | 1 | 0 | 3 | 2 | 3 | 22 | 57.14 |
| Trichoderma citrinoviride Bissett | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 2 | 7 | 28.57 |
| Trichoderma harzianum Rifai | 0 | 0 | 1 | 0 | 1 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 2 | 0 | 0 | 1 | 1 | 10 | 38.10 |
| Trichoderma koningii Oudem. | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 1 | 2 | 1 | 3 | 1 | 1 | 1 | 0 | 12 | 42.86 |
| Trichoderma koningiopsis Samuels, Carm. Suárez & H.C. Evans | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 2 | 0 | 0 | 1 | 1 | 0 | 3 | 0 | 2 | 2 | 0 | 2 | 0 | 2 | 19 | 57.14 |
| Trichoderma longibrachiatum Rifai | 1 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 0 | 1 | 1 | 0 | 2 | 1 | 0 | 1 | 13 | 57.14 |
| Trichoderma parceramosum Bissett | 1 | 2 | 0 | 2 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 2 | 1 | 1 | 2 | 1 | 1 | 1 | 17 | 57.14 |
| Trichoderma piluliferum J. Webster & Rifai | 2 | 1 | 1 | 0 | 1 | 2 | 1 | 0 | 1 | 1 | 0 | 0 | 1 | 2 | 1 | 1 | 0 | 1 | 1 | 3 | 2 | 22 | 76.19 |
| Trichoderma vinosum Samuels | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 2 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 1 | 0 | 0 | 2 | 12 | 42.86 |
| Trichoderma virens (J.H. Mill., Giddens & A.A. Foster) Arx | 1 | 1 | 0 | 0 | 1 | 0 | 2 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 2 | 1 | 0 | 1 | 0 | 11 | 42.86 |
| Trichoderma viride Schumach. | 1 | 1 | 0 | 0 | 0 | 1 | 1 | 0 | 2 | 2 | 1 | 0 | 1 | 0 | 0 | 2 | 2 | 1 | 1 | 1 | 1 | 18 | 61.90 |
Riqueza, abundancia y diversidad
La parcela perturbada tuvo valores mayores en el número de especies (13), en la abundancia de colonias (101) y en el índice de diversidad (2.48), mientras que la parcela conservada tuvo los valores menores de riqueza (12) e índice de diversidad (2.43) (Cuadro 2).
Cuadro 2: Riqueza, abundancia total y diversidad de especies (Índice de Shannon Wiener (H´)) de Trichoderma Pers. aisladas en las parcelas seleccionadas del Parque Estatal Agua Blanca (PEAB). Datos totales obtenidos a partir de siete muestreos. Letras idénticas en las columnas indican que no existen diferencias significativas entre las parcelas.
| Riqueza | Abundancia | Diversidad (H´) | |
|---|---|---|---|
| Conservada | 12 a | 59 a | 2.43 a |
| Semiconservada | 13 a | 49 a | 2.43 a |
| Perturbada | 13 a | 101 b | 2.48 b |
En los análisis estadísticos, se encontraron diferencias significativas en los valores de abundancia e índice de diversidad de Shannon entre los sitios de estudio (P>0.05).
Sin embargo, en la riqueza específica no se detectaron diferencias significativas entre las parcelas (P<0.05).
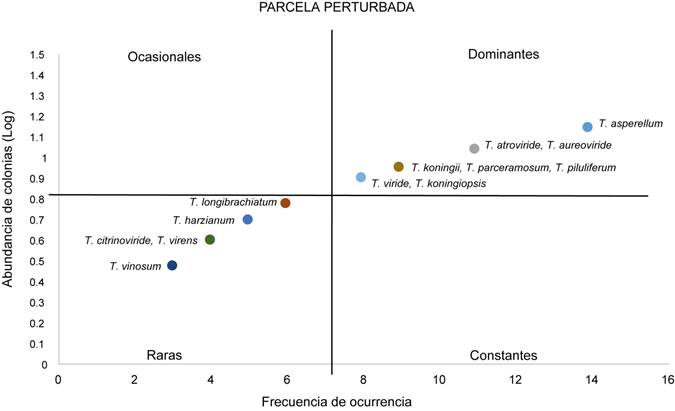
Dominancia de especies
El mayor número de especies dominantes se detectó en la parcela conservada (11), seguida de la perturbada (8) y finalmente la semiconservada (6).
De acuerdo a la prueba no paramétrica Olmstead-Tukey; Trichoderma asperellum, T. atroviride, T. koningiopsis Samuels, Carm. Suárez & H.C. Evans, T. piluliferum y T. viride Schumach fueron dominantes en los tres sitios de muestreo. Trichoderma citrinoviride apareció como raras en las tres áreas. En la conservada se presentó el menor número de especies raras (1) mientras que en la perturbada cinco y en la semiconservada seis. Trichoderma aureoviride Rifai se reveló como ocasionales exclusivamente en la semiconservada. No se detectaron especies constantes en ninguna de las zonas exploradas (Figs. 3, 4, 5).

Figura 3 Diagrama de Olmstead-Tukey donde se representa las categorías de raras, ocasionales, dominantes y constantes para las especies de Trichoderma Pers. en la parcela Conservada.
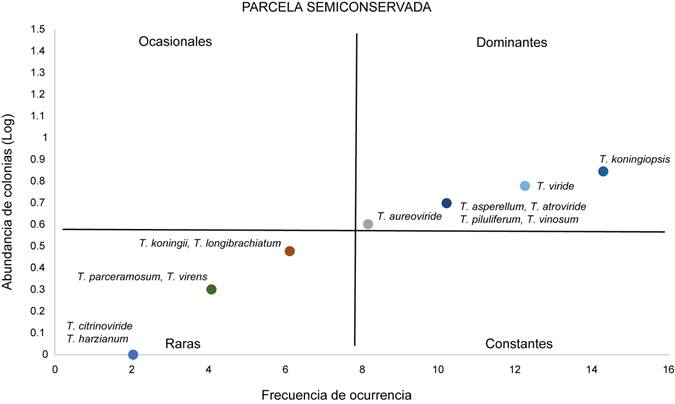
Figura 4 Diagrama de Olmstead-Tukey donde se representa las categorías de raras, ocasionales, dominantes y constantes para las especies de Trichoderma Pers. en la parcela Semiconservada.
Relación entre la abundancia, riqueza y diversidad con las variables ambientales
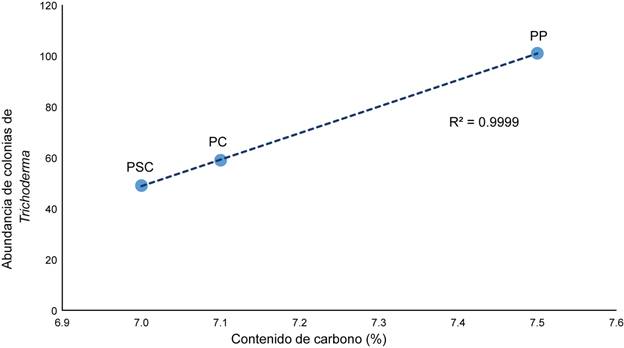
Según los resultados estadísticos, no se detectaron relaciones significativas entre las variables ambientales (cobertura vegetal, contenido de materia orgánica, carbono, pH, temperatura, humedad ambiental y cantidad de hojarasca acumulada en el suelo) con la abundancia, riqueza y la diversidad de Trichoderma. Solamente se detectó una relación significativa (p=0.0005) entre la abundancia de colonias vs. el contenido de carbono (Fig. 6).
Discusión
En los estudios cuantitativos sobre hongos saprobios microscópicos del suelo, el número y tipo de micromicetos detectados depende en gran medida de la técnica empleada (Gams, 1992). En el método de diluciones seriadas, la mayoría de las colonias recuperadas se desarrollan a partir de esporas, las cuales pueden venir de cepas con alto potencial para esporular o bien de esporas que llegan por algún factor físico (aire o lluvia), y que no corresponden a la micobiota activa del suelo. Además, esta técnica favorece el desarrollo de colonias de rápido crecimiento que inhiben el desarrollo de otras (Davet y Rouxel, 2000).
Por su parte, la técnica de lavado de partículas, utilizada en este estudio, excluye las esporas de las especies de rápido crecimiento y permite el desarrollo de los hongos que requieren un mayor tiempo para germinar. Así mismo, favorece el desarrollo de los micromicetos que se encuentran como hifas asociados a las partículas del suelo y, por lo tanto, se considera que están en forma activa (Bills et al., 2004). De esta manera se puede considerar que las especies detectadas en este trabajo son componentes activos de la micobiota edáfica en esta Área Natural Protegida.
A pesar de que la caracterización morfológica ha sido el método más utilizado para la identificación de las especies de Trichoderma (Druzhinina et al., 2005), se recomienda complementarla con herramientas moleculares debido a la homoplasia de los caracteres morfológicos y fenéticos que tiene este género (Druzhinina et al., 2006). El uso de herramientas moleculares en la taxonomía presenta una gran ventaja sobre las caracterizaciones morfológicas ya que la estructura del ADN permanece estable con las etapas fisiológicas, y no depende de las condiciones de cultivo (Druzhinina et al., 2006).
De las 13 especies que se reportan en este trabajo, Trichoderma asperellum, T. aureoviride, T. citrinoviride, T. harzianum Rifai, T. koningiopsis, T. longibrachiatum Rifai, T. parceramosum Bisset y T. virens (J.H. Mill., Giddens & A.A. Forest) Arx ya se habían registrado en agroecosistemas de cacao en el estado de Tabasco (Torres de la Cruz et al., 2015). Trichoderma aureoviride, T. citrinoviride, T. harzianum, T. longibrachiatum, T. parceramosum y T. virens fueron reportadas anteriormente en plantaciones de plátano (Olmo-Ruiz et al., 2010). De acuerdo con lo anterior, T. atroviride, T. koningii Oudem., T. piluliferum y T. vinosum Samuels se registran por primera vez para Tabasco.
Los estudios de Trichoderma en el trópico son reducidos debido a que la mayoría de los estudios de comunidades fúngicas del suelo se han realizado en zonas templadas (Christensen, 1962; Bissett y Parkinson, 1980; Jaklitsch, 2011; Jaklitsch y Voglmayr, 2015) y en suelos agrícolas (Hagn et al., 2003; Sariah et al., 2005; Okoth et al., 2007; Jiang et al., 2016).
Dado que la agricultura es un segmento vital de la economía, la mayoría de las investigaciones sobre especies de Trichoderma se han enfocado en sus actividades de control biológico contra fitopatógenos (Hoyos-Carvajal y Bissett, 2011) y para mejorar y estimular el crecimiento de los cultivos (Resende et al., 2004; Bae et al., 2009; Hoyos-Carvajal et al., 2009).
Trabajos que aborden la diversidad de Trichoderma en México son limitados. En los Altos Sur de Jalisco, Sánchez y Rebolledo (2010), en un agroecosistema de Agave tequilana Weber, obtuvieron cuatro especies de Trichoderma a partir de 66 aislados con un índice de diversidad de 0.71. Torres de la Cruz et al. (2015), en un agroecosistema de cacao, obtuvieron nueve cepas de Trichoderma a partir de 96 aislamientos con un índice de diversidad de 1.75. En un área de selva en Quintana Roo, Hoyos-Carvajal et al. (2009) registraron cuatro especies de Trichoderma. Arias y Heredia (2014), en seis fincas cafetaleras y un área bosque mesófilo de montaña en Veracruz, reconocieron 13 cepas diferentes de Trichoderma. Los resultados aquí expuestos (diversidad=2.48) revelan la gran diversidad que alberga el PEAB, y la importancia de realizar estos estudios, para preservar hábitats como las selvas tropicales como un reservorio de biodiversidad de Trichoderma.
La distribución de estos hongos en la región estudiada es amplia, se observó que 61% de las especies estuvieron presentes en la mayoría de los muestreos y sitios. Esto puede ser el resultado de la gran cantidad de restos vegetales que recubre el suelo de las parcelas (materia orgánica: PC=12%, PSC=9.6% y PP=12.61%) y por la presencia de herbáceas y pastos que funcionan como depósitos de celulosa. La amplia distribución en las parcelas de T. piluliferum (Fr=76.19%) es de gran importancia, ya que se reconoce que este hongo tiene una alta tolerancia a agroquímicos con pentaclorofenol (Argumedo-De Lira et al., 2009). Además, se conoce su actividad nematicida contra Meloidogyne incognitaThienhirum, de manera que resulta trascendental realizar estudios in vitro sobre el potencial de este microorganismo nativo para el control biológico de enfermedades de la región.
Los valores altos de la abundancia y de diversidad en el sitio con mayor grado de perturbación se relacionaron con el alto contenido de carbono (corroborado mediante la regresión lineal r2=99.9). Si bien las especies de Trichoderma se encuentran ampliamente distribuidas de manera natural en diferentes tipos de vegetación, ocurren principalmente en aquellos que contienen altas cantidades desechos vegetales en descomposición (Esposito y da Silva, 1998). Es importante señalar que en la parcela perturbada, proliferan una gran cantidad de gramíneas en el estrato herbáceo, siendo estas una fuente de carbono. Muchas plantas invasoras provocan un aumento de la productividad primaria en los sitios con disturbios, por lo que existe una mayor entrada de biomasa en el suelo (Allison y Vitousek, 2004).
Los disturbios antropogénicos (actividad agrícola y ganadera) de esta zona no mostraron un efecto sobre la abundancia y la diversidad en la comunidad de micromicetos del género Trichoderma. Esto puede atribuirse a la alta capacidad de estos micromicetos para recuperarse después de los disturbios (Persiani et al., 1998). Es probable que la formación de estructuras de resistencia, la producción de abundantes propágulos (fragmentos de micelio y esporas) y los ciclos de vida corta les permiten a las especies de Trichoderma una respuesta dinámica y eficiente para dispersarse y recolonizar ambientes después de eventos de perturbación.
Mediante las curvas de abundancia-dominancia, se pudo apreciar una mayor equidad en la parcela conservada que en las parcelas semiconservada y perturbada, donde es evidente la dominancia de una o dos cepas y un mayor número de especies raras. En el sitio conservado, T. piluliferum fue dominante, en el semiconservado lo fueron T. koningii y T. virens, y en el perturbado T. aureviride, T. atroviride y T. asperellum. En general los resultados obtenidos muestran un recambio de los hongos Trichoderma dominantes. Esta variación pudiera ser debido a la heterogeneidad de los espacios que forman micro-nichos, lo que permite una colonización heterogénea de los micromicetos de este género. Así mismo las interacciones (amensalismo, parasitismo, competencia y depredación) que ocurren en el suelo entre la mesofauna (artrópodos, las lombrices, y los nematodos) y macrofauna (termitas, ácaros, hormigas) son factores que seguramente están regulando a la comunidad de las especies de Trichoderma.
A pesar de que T. harzianum se considera una especie cosmopolita (Blaszczyk et al., 2011; Druzhinina et al., 2011), se puede inferir que tiene una alta sensibilidad a la perturbación, ya que su dominancia se restringió a la zona conservada y se presentó en la categoría de rara en la semiconservada y perturbada. Hagn et al. (2003) mencionan que T. harzianum es sensible a cambios en la composición vegetal. Suarez y Momo (1995), por su parte, observaron que la presencia de herbicidas o compuestos químicos tiene un efecto negativo en el crecimiento de T. harzianum. La importancia de la detección de un mayor número de especies raras o sensibles a la perturbación radica en que pueden ser empleadas como indicadoras de salud ambiental y ser utilizadas en estudios rápidos de diversidad para conocer el estado de un ecosistema (Jonsell y Nordlander, 2002).
El PEAB alberga una alta diversidad de especies del género Trichoderma. A través de este estudio, se puede inferir que la actividad agrícola en esta área no influye significativamente sobre la diversidad y el número de colonias de Trichoderma. Sin embargo, los disturbios de la zona tienen un efecto sobre su dominancia.
Dada la gran importancia económica que posee este género por sus múltiples aplicaciones biotecnológicas, resulta de interés estudiar su diversidad en México. Por lo tanto, es necesario obtener y preservar cepas que posean características deseables, es imperante realizar estudios más puntuales de cepas de Trichoderma nativas para comprobar su potencialidad biotecnológica.
Contribución de autores: LSH y ERG idearon y diseñaron el estudio, aislaron las cepas de Trichoderma. LSH y RMA identificaron las especies de Trichoderma, realizaron los análisis estadísticos, interpretaron los resultados y escribieron el manuscrito. CJPF participó en la selección y categorización de los sitios de estudio. Todos los autores contribuyeron a la revisión y aprobación del manuscrito final.
Financiamiento: Este estudio fue apoyado por el proyecto PFI “Evaluación de la diversidad fúngica en vegetación con diferentes grados de perturbación en el Parque Estatal Agua Blanca, Macuspana, Tabasco” con clave UJAT-2012-IB-14; CONACyT (706472) a través de la beca otorgada en el programa de Maestría en Ciencias Ambientales de la Universidad Juárez Autónoma de Tabasco. Así mismo por la beca mixta CONACyT otorgada para realizar una estancia de investigación en el Instituto de Ecología, A.C., Xalapa (LSH).











 nueva página del texto (beta)
nueva página del texto (beta)