INTRODUCCIÓN
México es el cuarto país productor de cítricos en el mundo (Miranda-Salcedo et al., 20121) y segundo lugar de limón. El cultivo de limón mexicano (Lm) se desarrolla principalmente en las costas del pacífico mexicano (González-Sánchez y Echevarria, 2003), con una producción que superó las 2.5 millones de toneladas para 2017 (SIAP, 2019). En la actualidad esta actividad agrícola se ve amenazada por la enfermedad denominada HLB (Sánchez-Borja et al., 2010), cuyo agente causal es Candidatus Liberibacter asiaticus (CLas) (Kim et al., 2008). CLas es una bacteria fastidiosa, Gram negativa y cuyo hábitat es el floema presentando una distribución irregular en el árbol (Robles et al., 2010). Su sintomatología se caracteriza por el desarrollo de un ataque sectorial, apareciendo en una sola rama y las hojas presentan manchas cloróticas difusas (jaspeado), posteriormente estas se amarillentan y caen. Finalmente, los árboles mueren al cabo de algunos años (Armenta-Cardenas et al., 2010).
El estado de nutrición de las plantas genera resistencia a las enfermedades, la cual influye en la comunidad microbiológica de la rizosfera, que en consecuencia contribuye al cambio de la composición del floema induciendo resistencia sistémica a bacterias u hongos endófitos (Shen et al., 2013). El estado nutrimental de las plantas puede ser afectado químicamente por productos agrícolas aplicados a ellas de manera artificial o por la utilización de microorganismos benéficos (Santillano et al., 2019). Referente a esta última, se encuentran los hongos micorrízicos arbusculares (HMA). Los HMA fueron descritos por primera vez a principios de la década de 1880, cuando el patólogo forestal alemán A. B. Frank, acuñó el término mykorhiza, haciendo referencia a la interacción entre una especie de hongo y la raíz de una especie vegetal (Andrade-Torres, 2010). En esta interacción, la planta le proporciona carbohidratos (azúcares, producto de su fotosíntesis) y un microhábitat al hongo para completar su ciclo de vida; el hongo le proporciona a la planta una mejor captación de agua, minerales de baja disponibilidad (P, N, K, Ca, Mg, Fe, Zn y Mn) e induce la defensa contra patógenos (Sarabia et al., 2010; Camargo-Ricalde et al., 2012; Trinidad et al., 2017). Los HMA generan una respuesta diferente dependiendo de la planta hospedera y no son específicos a una especie o a un grupo vegetal en particular (Hernández-Cuevas et al., 2003), no pueden desarrollar su ciclo sin un hospedero (son obligados), y crecen solo en raíces de plantas hospederas (Hernández-Cuevas et al., 2003). Por otra parte, también se encuentran las bacterias promotoras de crecimiento vegetal (BPCV), las cuales pueden incrementar el crecimiento y productividad vegetal sin dañar o contaminar el suelo (Loredo-Osti et al., 2004). Las BPCV pueden solubilizar fosfatos, producir hormonas o f ijar nitrógeno, lo que afecta directamente a las plantas de una forma benéfica, incrementando el fluido del agua y minerales, mejorando el desarrollo radicular y aumentando la actividad enzimática de la planta; incluso algunas tienen la capacidad de control bilógico, las cuales promueven el crecimiento de la planta al suprimir los fitopatógenos que la atacan (De-Bashan et al., 2007). Entre las BPCV más conocidas están las especies que pertenecen a los géneros Rhizobium, Pseudomonas, Azospirillum y Bacillus. El análisis de las poblaciones de microorganismos de la rizósfera puede reflejar las condiciones y la diversidad microbiana encontrada, así como la salud de un ecosistema; sin embargo, existen varios factores que pueden alterar las poblaciones de microorganismos tal es el caso de la temperatura, radiación ultravioleta, radiación ionizante, humedad, pH, potencial REDOX, ácidos orgánicos, sales y gases tales como nitrógeno y oxígeno (Calvo et al., 2008). No existen trabajos previos sobre la dinámica poblacional de bacterias y hongos de la rizósfera de plantas de Lm infectadas por CLas. Su estudio puede abrir un panorama sobre el control y manejo de la enfermedad relacionada a este fitopatógeno. El objetivo del trabajo fue aislar y determinar la abundancia de bacterias (B) y hongos filamentosos (HF) totales en muestras de sustrato de plantas de limón infectadas con CLas y tratadas con Bacillus subtilis (BS) o Funneliformis mosseae (FM).
MATERIALES Y MÉTODOS
El experimento tuvo una duración de un año bajo condiciones de invernadero en las instalaciones de la Unidad Zapopan del CIATEJ (20.700861, -103.473855). Consistió en un diseño completamente al azar con seis tratamientos utilizando árboles certificados de Citrus aurantifolia injertados sobre Citrus macrophylla de un año y medio, provenientes de Tecomán Colima en bolsas de 2 kg de sustrato. Los árboles de limón mexicano (Lm) se infectaron con Candidatus Liberibacter asiaticus (Clas) vía injerto de yema, utilizando varetas de árboles sintomáticos provenientes de huertos de Lm de Tecomán Colima, el injerto se hizo ocho meses previo al trasplante a macetas de 20 L y al comienzo del experimento. Los árboles se regaron a capacidad de campo por lo menos una vez por semana. La descripción de los tratamientos es mostrada en el Cuadro 1, al momento del trasplante se aplicó Funneliformis mosseae a la raíz de los árboles. La primera aplicación de tratamientos con B. subtilis, nutrición química y nutrición orgánica se inició a los 30 días posteriores de la inoculación con F. mosseae. A los tratamientos que recibieron nutrición química (Q) se les aplicó urea (46% de N) y triple 16 (16-16-16% de N-P-K) cada tres meses (cuatro veces) sumando una dosis total de 150-18-18 (12.8 g de urea más 2.6 g de triple 16 por unidad experimental). A los dos tratamientos que recibieron nutrición orgánica (O), se les suministró lombricomposta líquida de manera mensual (Cuadro 1). El sustrato empleado en el experimento fue una mezcla suelo:arena:agrolita:turba (Sunshine Mix® No. 3) (50:30:10:10, v/v/v/v). Previo a la esterilización del sustrato en autoclave (120 °C, 1.05 kg cm-2, 6 h) se realizó el conteo de B y HF totales. Se emplearon recipientes de plástico negro con capacidad de 20 L como macetas para cada planta de limón, en cada maceta se colocaron 16 kg de la mezcla esterilizada. La mezcla esterilizada presentó una textura franca, pH neutro en agua (6.52), contenido de materia orgánica de 13.5%, conductividad eléctrica de 3.31 dS m‑1, contenido de N, P, K, Ca y Mg de 51, 184, 445, 3348 y 712 mg kg-1 respectivamente, estos análisis fueron realizados por el Laboratorio de Análisis Agrícola de la empresa Fertilab® de Celaya Guanajuato (fertilab.com.mx) de acuerdo a los procedimientos descritos en la Norma Oficial Mexicana (NOM-021-RECNAT-2000, 2002). Posteriormente de la aplicación de cada uno de los tratamientos se realizaron cuatro muestreos rizosféricos a 70, 140, 210 y 280 días después de la primera aplicación (ddpa) así como un muestreo al final del experimento (368 ddpa), utilizando un tubo de PVC de 1.27 cm de diámetro y 35 cm de alto, introduciéndolo en cuatro puntos alrededor de la planta (Norte, Sur, Este y Oeste) a tres diferentes profundidades (5, 15 y 30 cm), posteriormente éstas muestras fueron homogenizadas y se almacenaron a 4 °C hasta su procesamiento. Se analizaron cinco repeticiones por tratamiento. Una unidad experimental consistió en una maceta con un árbol de limón mexicano. Para el conteo de bacterias totales se utilizó el medio de cultivo agar nutritivo (AN, 213000 DIFCO®), mientras para la determinación de hongos totales se empleó el medio agar papa dextrosa (PDA, 213400 DIFCO®), a pH de 5.5, 3.3 mL L-1 de rosa de bengala al 1% (198250 SIGMA®) y 40 µg mL-1 de estreptomicina (S9137, SIGMA®). La cuantificación de las unidades formadoras de colonia (UFC) se realizó por medio de diluciones decimales seriadas en cada muestra siguiendo lo propuesto por Camacho et al. (2009), con algunas modificaciones. Para lo cual se determinó el peso seco de las muestras a analizar, posteriormente para cada uno de los tratamientos se tomaron 10 g de muestra y se le añadieron 90 mL de agua destilada para obtener la dilución 10-1, prosiguiendo a tomar 1 mL de la dilución 10-1 y disolverla en 9 mL de agua destilada para obtener la dilución 10-2. Repitiendo sucesivamente los pasos mencionados anteriormente hasta la dilución 10‑5.
Cuadro 1: Diseño de tratamientos para evaluar el efecto de aplicación de microrganismos benéficos en las poblaciones de bacterias y hongos de la rizosfera de plantas de limón mexicano enfermo con HLB. Table 1: Design of treatments performed to evaluate the effect of the application of beneficial microorganisms over populations of bacteria and fungi from the rhizosphere of Mexican lime plants infected with HLB.
| Tratamiento | Condiciones de aplicación | ||||
|---|---|---|---|---|---|
| Clave | Descripción | CLas | Concentración | Total | Periodicidad |
| FmCLas | Funneliformis mosseae+FQ | Con | 5 esporas g-1 inóculo | 100 g | Inicio |
| BsCLas | Bacillus subtilis+FQ | Con | 2.5×108 UFC mL-1 | 100 mL | Cada 30 días |
| QCLas | Fertilización química (kg ha-1) | Con | 37.5-4.5-4.5 | 150-18-18 | Cada 90 días |
| Q | Fertilización química (kg ha-1) | Sin | 37.5-4.5-4.5 | 150-18-18 | Cada 90 días |
| OCLas | Fertilización orgánica | Con | 47000 mg kg-1 | 100 mL | Cada 30 días |
| O | Fertilización orgánica | Sin | 47000 mg kg-1 | 100 mL | Cada 30 días |
FQ = fertilización química: urea (46% N), triple 16. Fertilización orgánica = lombricomposta líquida. CLas= Candidatus Liberibacter asiaticus.
FQ = chemical fertilization: urea (46% N), triple 16. Organic fertilization = liquid vermicompost. CLas = Candidatus Liberibacter asiaticus.
Los datos obtenidos se procesaron mediante un análisis de varianza de una vía y mediante la comparación múltiple de medias de Tukey, ambos a un nivel de significancia del 5% (P ≤ 0.05) mediante el programa estadístico Statgraphics® Centurion XV versión 15.2.06 (StatPoint Inc. 2005). Los resultados obtenidos a partir del análisis estadístico se presentan de la manera siguiente: 1) el efecto producido en las poblaciones de B y HF totales, por la inoculación de F. mosseae (FmCLas) y B. subtilis (BsCLas) en contraste con el tratamiento QCLas dado que los tratamientos FmCLas y BsCLas tuvieron fertilización química; 2) el comparativo poblacional de B y HF totales, en los tratamientos QCLas y Q; y 3) el contraste poblacional de B y HF totales obtenido de los tratamientos OCLas y O con respecto a los tratamientos QCLas y Q con el fin de determinar el efecto de distintas formas de fertilización. Con este análisis se comprende el fenómeno biológico ocurrido al aplicar los microorganismos benéficos, así como la nutrición orgánica contra la química en las plantas de Lm infectadas con CLas.
Para determinar la presencia de CLas en los árboles de limón inoculados con el patógeno se realizó una PCR punto final. La extracción de ADN de realizó a partir de las nervaduras centrales de las hojas utilizando el protocolo CTAB (cetyltrimethylammonium bromide) a 3% de acuerdo a Zhang et al. (1998). Para la reacción PCR punto final, se amplificó la secuencia parcial del gen ribosomal 16S ADNr (1160 pb) con los oligonucleótidos específicos OI1 (5’-GCGCGTATGCAATACGAGCGGCA-3’) y OI2c (5’-GCCTCGCGACTTCGCAACCCAT-3’) (Jagoueix et al., 1994), empleando las siguientes condiciones: 94 °C por 5 min; 35 ciclos de 45 s a 94 °C, 45 s a 68 °C, 60 s a 72 °C; un ciclo final a 72 °C por 10 min (Lou et al., 2012). La reacción de PCR se migró por electroforesis (90 V por 40 min) en geles de agarosa a 0.8% y se observó en un transiluminador con GelRed® (1X).
RESULTADOS Y DISCUSIÓN
Infección de los Árboles de Limón Mexicano con el Agente Causal del HLB (CLas)
Las plantas de limón que fueron infectadas con Candidatus Liberibacter asiaticus (Clas) por medio del injerto de yema se enfermaron con HLB. La extracción de ADN fue efectiva utilizando el método de CTAB (Zhang et al., 1998) (Figura 1A) y se amplificó la secuencia parcial del gen ribosomal 16S ADNr de la bacteria CLas (1167 pb) con los oligonucleótidos específicos OI1 y OI2c (Lou et al., 2012) (Figura 1B). Esto demuestra que las plantas de limón fueron infectadas con CLas a través del injerto de yema.
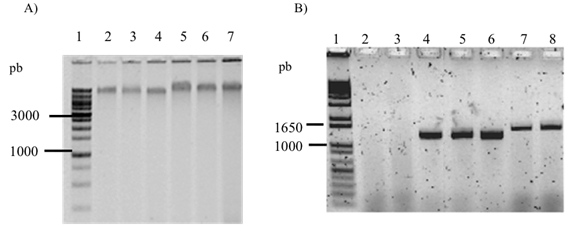
Figura 1: Determinación de la presencia de Candidatus Liberibacter asiaticus (Clas) en plantas de limón mexicano inoculadas con la bacteria fitopatógena Candidatus. A) Extracción de ADN de plantas de limón mexicano, utilizando el protocolo de CTAB a 3%. Carril 1: 1 Kb Leadder Plus (Invitrogen); carril de 2 al 7: ADN de plantas de limón con y sin inoculación de CLas. B) Determinación de la presencia de CLas en árboles de limón mediante PCR punto final (1167 pb) de plantas injertadas con varetas de árboles enfermos con HLB. Carril 1: 1 Kb Leadder Plus (Invitrogen); carril 2: plantas no inoculadas con CLas y con tratamiento de fertilización química (Q); carril 3: plantas no inoculadas con CLas y con tratamiento de fertilización orgánica (O); carril 4: plantas inoculadas con CLas y con tratamiento de fertilización química (QCLas); carril 5: plantas inoculadas con CLas y con tratamiento de fertilización orgánica (OCLas); carril 6: plantas inoculadas con CLas y con inoculación de Bacillus subtilis (BsCLas); carril 7: plantas inoculadas con CLas y con inoculación de Funneliformis mosseae (FmCLas); carril 8: plásmido con ADN de CLas. Figure 1: Determination of Candidatus Liberibacter asiaticus (CLas) in Mexican lime plants inoculated with the phytopathogenic bacterium Candidatus. A) DNA extraction from Mexican lime plants using the protocol CTAB. Lane 1: 1 Kb Ladder Plus (Invitrogen); lane 2 to 7: DNA from Mexican lime with and without inoculation of CLas. B) Determination of CLas in Mexican lime trees by endpoint PCR (1167 pb) of plants grafted with spikes of trees infected with HLB. Lane 1: 1 Kb Ladder Plus (Invitrogen); lane 2: plants without inoculation with CLas and treated with chemical fertilization (Q); lane 3: plants without inoculation with CLas and treated with organic fertilization (O); lane 4: plants inoculated with CLas and treated with chemical fertilization (QCLas); lane 5: plants inoculated with CLas and treated with organic fertilization (OCLas); lane 6: plants inoculated with CLas and Bacillus subtilis (BsCLas); lane 7: plants inoculated with CLas and Funneliformis mosseae (FmCLas); lane 8: plasmid with CLas DNA.
Efecto de la Aplicación de Microorganismos Benéficos en las Poblaciones de Bacterias y Hongos Filamentosos Totales en Plantas de Limón Infectadas con CLas
Las poblaciones de microorganismos están altamente influenciadas por los exudados radicales que incluyen aminoácidos, ácidos grasos, nucleótidos, ácidos orgánicos, fenoles, reguladores de crecimiento, poliamidas, esteroles, azúcares y vitaminas (Wang et al., 2018; Ramírez et al., 2013), los cuales pueden ser modificados a través de la interacción de las plantas con los microorganismos promotores de crecimiento vegetal (González y Fuentes, 2017).
Al sustrato inicial se le determinó el número de UFC g-1 de sustrato de bacterias y hongos filamentosos totales, constatando su presencia previa al experimento, presentando 1.56 × 105 UFC g-1 de sustrato de bacterias y 1400 UFC g-1 de sustrato de hongos filamentosos totales.
En tres de los cinco muestreos los conteos de UFC de bacterias totales para el tratamiento QCLas fueron inferiores con respecto a los tratamientos inoculados con los microorganismos benéficos (Cuadro 2). La inoculación de F. mosseae (FmCLas) y B. subtilis (BsCLas) influye positivamente en la población de los microorganismos de la rizosfera (Cuadro 2), mostrando diferencias significativas en comparación con el tratamiento infectado (QCLas). Todos los muestreos presentaron un incremento en la población de bacterias en comparación con el conteo inicial (1.56 × 105 UFC g‑1 de sustrato).
Cuadro 2: Dinámica poblacional de bacterias totales después de la primera aplicación de microorganismos benéficos en árboles de limón mexicano bajo condiciones de invernadero. Table 2: Population dynamics of total bacteria after the first application of beneficial microorganisms in Mexican lime trees under greenhouse conditions.
| Tratamiento | Días después de la primera aplicación (106 UFC g-1 sustrato) | ||||
|---|---|---|---|---|---|
| 70 | 140 | 210 | 280 | 368 | |
| FmCLas | 5.37c | 5.00a | 2.50b | 0.76b | 0.46a |
| BsCLas | 3.40b | 4.83a | 3.00d | 0.62b | 0.65ab |
| QCLas | 0.56a | 13.50b | 0.45a | 0.37a | 0.74b |
| Q | 0.55a | 6.87a | 2.63c | 0.65b | 2.67c |
Letras distintas en la misma columna indican diferencias significativas, según la prueba de Tukey (P ≤ 0.05).
Different letters in the same column indicate significant differences according to the Tukey’s test (P ≤ 0.05).
La inoculación con F. mosseae a los 70 y 140 ddpa presentó su mayor incremento en la población de bacterias totales (5.37 × 106 y 5 × 106 UFC g-1 de sustrato respectivamente; (Cuadro 2), en contraste con el conteo inicial (1.56 × 105 UFC g-1 de sustrato). Con respecto al aumento del conteo de UFC, Gui et al. (2017) mencionan que los HMA pueden impactar en las comunidades bacterianas de la rizósfera, produciendo nichos para su crecimiento, además de mejorar la actividad de éstas asociándolo con la disponibilidad de N. Posteriormente, la población de bacterias totales disminuyó a partir de los 280 ddpa hasta su mínimo conteo de 4.6 × 105 UFC g-1 de sustrato a los 368 ddpa (Cuadro 2), el cual fue además estadísticamente diferente (P ≤ 0.05) al tratamiento QCLas. Cui et al. (2018), mencionan que los HMA además de participar en la regulación de las defensas de las plantas pueden también mantener la estabilidad del microecosistema del suelo. Gui et al. (2017), reportan aumento en la abundancia de los f ilos Actinobacteria y Thermoleophilia, así como un aumento en las etapas tempranas de Alphaproteobacterias para posteriormente observar una disminución de estas mismas en muestras de sustrato forestal inoculadas con F. mosseae. Reportando por otra parte la disminución de la abundancia de Acidobacterias y Gammaproteobacterias, en todos los muestreos realizados.
La inoculación con B. subtilis presentó una dinámica poblacional similar al tratamiento inoculado con el HMA, con conteos de 3.40, 4.83 y 3 × 106 UFC g‑1 de sustrato a los 70, 140 y 210 ddpa respectivamente. Denotando una disminución a los 280 y 368 ddpa (Cuadro 2). El aumento en el conteo de UFC en los tres primeros muestreos fue un efecto esperado, ya que B. subtilis se inoculó de manera mensual (Cuadro 2). Con respecto a la disminución de la población subsecuente, se ha reportado que B. subtilis tiene una excelente habilidad de colonización radicular, produce antibiosis, lisis celular, competición por espacio y nutrientes (Wang et al., 2018), generando competencia con las bacterias de la rizósfera.
La dinámica de población de hongos filamentosos totales (Cuadro 3) mostró un comportamiento similar en los tres tratamientos infectados con CLas. La inoculación de F. mosseae y B. subtilis generó una estabilidad en el conteo de UFC de hongos filamentosos, manteniendo el conteo de UFC entre un intervalo de 1-1.77 × 103 UFC g-1 de sustrato, presentando solamente en un muestreo diferencias estadísticas (Tukey, P ≤ 0.05) (280 ddpa). El tratamiento infectado con CLas (CLasQ) mostró un comportamiento similar a los tratamientos inoculados con los microorganismos benéficos. Siendo en la mayoría de los tratamientos estadísticamente iguales (Cuadro 3).
Cuadro 3: Dinámica poblacional de hongos filamentosos totales después de la primera aplicación de microorganismos benéficos en árboles de limón mexicano bajo condiciones de invernadero. Table 3: Population dynamics of total filamentous fungi after the first application of beneficial microorganisms in Mexican lime trees under greenhouse conditions.
| Tratamiento | Días después de la primera aplicación (103 UFC g-1 sustrato) | ||||
|---|---|---|---|---|---|
| 70 | 140 | 210 | 280 | 368 | |
| FmCLas | 1.27a | 1.00a | 1.47a | 1.03a | 1.33a |
| BsCLas | 1.63a | 1.00a | 1.07a | 1.77b | 1.77a |
| QCLas | 1.87a | 3.67b | 1.00a | 1.77b | 3.93ab |
| Q | 2.13a | 1.50a | 1.03a | 1.83b | 5.27b |
Letras distintas en la misma columna indican diferencias significativas, según la prueba de Tukey (P ≤ 0.05).
Different letters in the same column indicate significant differences, according to the Tukey’s test (P ≤ 0.05).
Efecto de CLas en las Poblaciones de Bacterias y Hongos Filamentosos Totales en Árboles de Limón
En contraste con las plantas que crecen en condiciones de asepsia en el laboratorio, las plantas sanas en la naturaleza, forman asociaciones con comunidades microbianas benéficas o incluso interacciones con microorganismos fitopatógenos pertenecientes a diversos reinos (Hacquard et al., 2017). Para conocer como CLas influye sobre la dinámica de población de microorganismos presentantes en la rizosfera de plantas de limón, observando solo los resultados para los tratamientos QCLas y Q, se muestra que al comparar el tratamiento infectado (QCLas) con el tratamiento sin infectar (Q), la dinámica poblacional de bacterias totales es modificada (Cuadro 2). A 70 ddpa, el conteo de UFC entre el tratamiento Q y QCLas no muestra diferencias estadísticas (Tukey, P ≤ 0.05) entre sí, pero si a los tratamientos inoculados con microrganismos benéficos (Cuadro 2). Los tratamientos Q y QCLas a 140, 210, 280 y 368 ddpa muestran diferencias estadísticas (Tukey, P ≤ 0.05) entre sí, siendo para el tratamiento Q el conteo de UFC mayor en tres de cuatro muestreos (Cuadro 2). Además, en 3 de los 4 muestreos el conteo de UFC fue mayor en el tratamiento Q. A partir de 210 ddpa el conteo de UFC g‑1 de sustrato para el tratamiento QCLas disminuyó, en contraste al tratamiento Q que incluso el conteo de UFC va en aumento. Indicando que, posiblemente CLas inhibe el crecimiento de microorganismos presentes en la rizósfera, aunque, se debe tener en cuenta que CLas es un fitopatógeno que se aloja en el floema de los cítricos. A 368 ddpa el tratamiento Q mostró el mayor conteo de UFC con respecto a los tres tratamientos infectados con CLas (Cuadro 2). Hacquard et al. (2017) mencionan que organismos patógenos adaptados a sus hospederos pueden manipular el sistema inmune de la planta para su propio beneficio, pero también en formas que tienen consecuencias para otros microorganismos. Agler et al. (2016), observaron que el patógeno oomiceto perteneciente al género Albugo, tiene efectos en la colonización de bacterias epifitas y endófitas, disminuyendo la diversidad de las α-bacterias y estabilizando la diversidad de las β-bacterias. Por otra parte, Wang et al. (2017) mencionan que CLas causa cambios dramáticos en el metabolismo y el sistema regulatorio de los cítricos, afectando la composición de los exudados radicales e indirectamente la microbiota de la rizósfera. CLas también afecta el sistema de defensa de los cítricos que en consecuencia impacta en la microbiota de la rizósfera (Wang y Trivedi, 2013). La abundancia del microbioma de la rizósfera de plantas de cítricos infectadas con CLas es menor en comparación con el de plantas de cítricos sanas, así mismo se ve afectado la composición taxonómica disminuyendo la abundancia de los géneros Burkholderia y Pseudomonas y aumenta la proporción de Acidobacteria, Actinobacteria, Firmicutes y Bacillus (Trivedi et al., 2012).
En contraste, el conteo de hongos filamentosos totales (Cuadro 3) que solamente en el muestreo realizado a 140 ddpa se observó un conteo mayor en las UFC g-1 de sustrato correspondiente al tratamiento QCLas con respecto al tratamiento Q. Pudiendo decir que la infección de limón con CLas, no induce cambios en la dinámica de población en la rizósfera de hongos filamentosos. Cabe resaltar que el conteo de hongos filamentosos aumentó a 368 ddpa con respecto a los muestreos anteriores, efecto contrario a la población de bacterias totales, la cual va decreciendo con el tiempo.
Influencia de la Nutrición Orgánica en las Poblaciones de Bacterias y Hongos Filamentosos Totales en Plantas de Limón Infectadas con CLas
Con el fin de evaluar el efecto de la nutrición orgánica en la dinámica de microorganismos de la rizósfera en limón infectado con CLas se incluyeron dos tratamientos a los que se les varió la nutrición de química a orgánica. Los resultados demostraron que para el caso de las bacterias totales a 71 ddpa no existe diferencia estadística (Tukey, P ≤ 0.05) entre los tratamientos (Figura 2). A 140 ddpa el conteo de bacterias totales aumentó significativamente llegando tener hasta 1.35 × 107 UFC g-1 de sustrato para el tratamiento QCLas y un mínimo de 2.57 × 106 UFC g-1 de sustrato para el tratamiento O (Figura 2). No obstante, a partir de 210 ddpa se aprecia un decremento en el conteo de UFC de bacterias totales, teniendo a 368 ddpa un conteo máximo de 2.67 × 106 UFC g-1 de sustrato para el tratamiento Q (Figura 2). En el conteo de UFC de los hongos filamentosos totales se observa un decremento a 70 ddpa en los tratamientos que recibieron nutrición orgánica y un aumento en las UFC en los tratamientos que recibieron nutrición química en comparación con las UFC del sustrato inicial; sin embargo, no mostraron diferencias significativas (Tukey, P ≤ 0.05) entre ellos (Figura 3). El comportamiento de la dinámica de población de los hongos filamentosos totales con nutrición orgánica se puede considerar estable, ya que su población se mantuvo entre 1000 y 2000 UFC g-1 de sustrato (Figura 3). En contraste con los tratamientos con nutrición química cuya población fue de 1000 UFC g‑1 de sustrato a un poco más de 5000 UFC g‑1 de sustrato a 368 ddpa, mostrando una tendencia al aumento de la población de hongos filamentosos tanto para el tratamiento QCLas y Q (Figura 3).
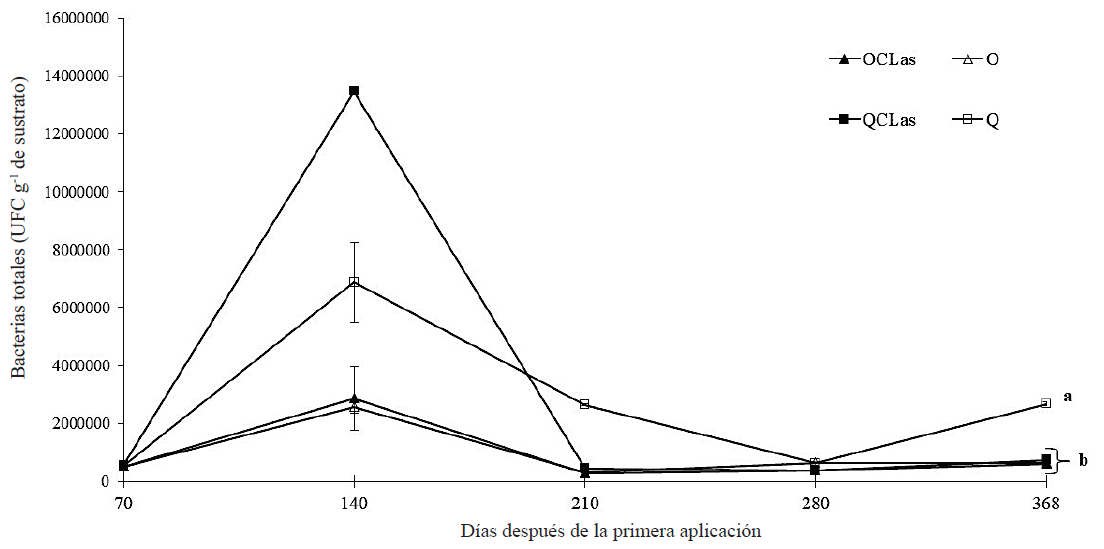
Figura 2: Dinámica de las poblaciones bacterianas totales después de la primera aplicación de nutrición orgánica en árboles de limón mexicano bajo condiciones de invernadero. Fertilización orgánica (O), química (Q), CLas = inoculación con Candidatus Liberibacter asiaticus. Las barras en cada punto de muestreo indican ± error estándar. Letras distintas al final del experimento indican diferencias significativas, según la prueba de Tukey (P ≤ 0.05). Figure 2: Population dynamics of total bacteria after the first application of organic nutrition in Mexican lime trees under greenhouse conditions. Organic fertilization (O), chemical (Q), CLas = inoculation with Candidatus Liberibacter asiaticus. Bars in each sampling point indicate ± standard error. Different letters at the end of the experiment indicate significant differences, according to the Tukey’s test (P ≤ 0.05).
Las poblaciones de bacterias se mantuvieron en un intervalo de 105 a 106 UFC g-1 de sustrato (Figura 2). Siendo reportado por Calvo et al. (2008) un conteo de bacterias totales en un intervalo de 107 y 108 UFC g-1 de sustrato en muestras de rizósfera de cultivo de papa. Bolaños et al. (2013) reportaron conteos de bacterias totales de 106 UFC g-1 de sustrato en muestras de rizósfera de palma aceitera (Elaeis guineensis Jacq) con riego y sin riego, cultivada en campo abierto. En cuanto a los hongos filamentosos estos se mantuvieron en un intervalo de 103 UFC g-1 de sustrato (Figura 3). Calvo et al. (2008) reportaron conteos de hongos filamentosos en un intervalo de 104 a 105 UFC g-1 de sustrato. Bolaños et al. (2013) reportaron conteos de hongos totales de 103 UFC g-1 de sustrato en parcelas con riego y de 104 UFC g-1 de sustrato en parcelas sin riego. En general se observa una disminución de la carga bacteriana total en los tratamientos de plantas de limón infectadas con CLas. Sin embargo, esta disminución fue notoria también para las plantas sanas, es decir, para aquellas que no fueron infectadas. El fenómeno anterior se puede justificar debido a la alta competencia entre los microorganismos que se desarrolla en la rizósfera por adquirir los nutrimentos encontrados en los exudados radicales (Yagüe y Gutiérrez-Correa, 1982). Además, los exudados radicales fungen como atrayentes y repelentes químicos en la rizósfera y su zona de influencia regulando las comunidades microbianas del suelo (Torres-Guerrero et al., 2013). Lo que deja abierto el análisis de los exudados radicales en plantas de limón infectadas con CLas y su influencia en la dinámica poblacional bacterias y hongos filamentosos. El crecimiento en la población de microorganismos en el suelo puede estar influenciado por varios factores desde la materia orgánica disponible para su crecimiento hasta cambios de pH por cuestiones biológicas y bioquímicas. Sin embargo, la inoculación con los microorganismos benéficos como Funneliformis mosseae y Bacillus subtilis no aumentaron las poblaciones de bacterias totales. Sino al contrario, estas disminuían conforme avanzaba la enfermedad.
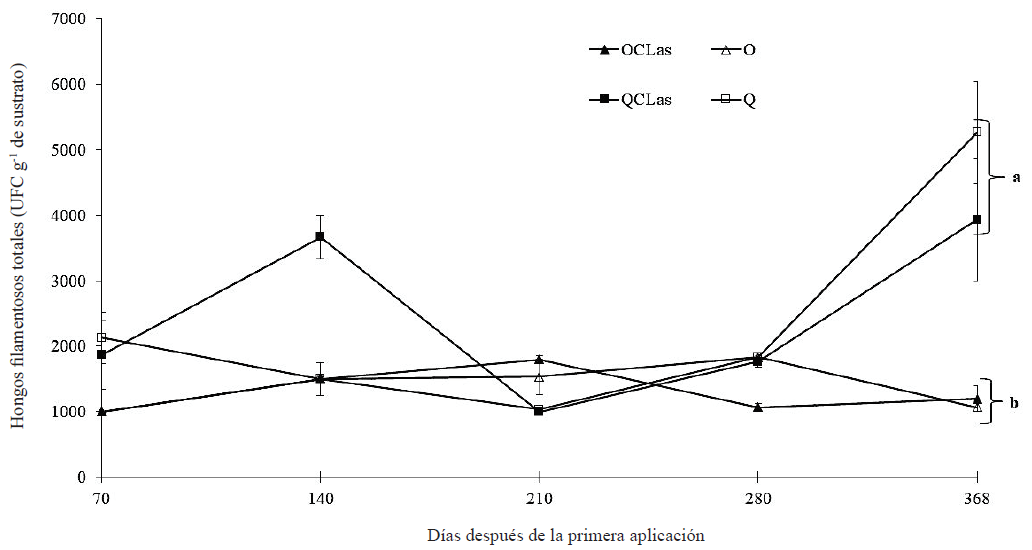
Figura 3: Dinámica de poblaciones de hongos filamentosos totales después de la primera aplicación de nutrición orgánica en árboles de limón mexicano bajo condiciones de invernadero. Fertilización orgánica (O), química (Q), CLas = inoculación con Candidatus Liberibacter asiaticus. Las barras en cada punto de muestreo indican ± error estándar. Letras distintas al final del experimento indican diferencias significativas, según la prueba de Tukey (P ≤ 0.05). Figure 3: Population dynamics of total filamentous fungi after the first application of organic nutrition in Mexican lime trees under greenhouse conditions. Organic fertilization (O), chemical (Q), CLas = inoculation with Candidatus Liberibacter asiaticus. Bars in each sampling point indicate ± standard error. Different letters at the end of the experiment indicate significant differences, according to the Tukey’s test (P ≤ 0.05).
CONCLUSIONES
Con el comportamiento observado entre las poblaciones de bacterias y hongos filamentos totales, en muestras de sustrato de plantas de limón mexicano infectadas con Candidatus Liberibacter asiaticus (Clas), se encontró que la aplicación de microorganismos benéficos como Funneliformis mosseae y Bacillus subtilis aumentan las poblaciones de bacterias y hongos filamentosos totales en plantas infectadas con CLas y las mantienen estables hasta 210 días después de iniciado el experimento. La aplicación de nutrición orgánica no influye en la dinámica de población de bacterias totales en plantas de limón mexicano infectadas con CLas; en cambio, la aplicación de nutrición orgánica mantiene estables las poblaciones de hongos filamentosos a lo largo del tiempo tanto en el tratamiento infectado como el tratamiento sin CLas. La aplicación de microorganismos benéficos y la nutrición orgánica hacen sinergia en la estabilización de hongos filamentosos totales en plantas de limón mexicano infectadas con CLas. Se encontraron diferencias estadísticas en el tratamiento infectado con CLas y que recibió nutrición química en comparación con el tratamiento sin infectar, lo que demuestra que la infección con CLas en plantas de limón influye negativamente en el desarrollo poblacional de bacterias totales presentes en la rizósfera.











 nova página do texto(beta)
nova página do texto(beta)



