Introducción
El Se, al igual que el S, tiene varios estados de oxidación como selenuro (Se2-), selenio elemental (Se0), selenito (Se4+) y selenato (Se6+). Las formas oxidadas del selenio (Se4+ y Se6+) son absorbidas por las plantas debido a su alta solubilidad, mientras que el Se0 y el Se2- son insolubles, por lo cual difícilmente son absorbidas por las plantas (Broadley et al., 2006). Las formas oxidadas de Se se encuentran en suelos alcalinos y las formas reducidas en suelos ácidos y aguas continentales y marinas.
En la mayoría de los suelos del mundo la concentración de selenio es baja, de 0.01 a 2.0 mg kg-1 con una media de 0.4 mg kg-1, aunque pueden encontrarse concentraciones ≥1200 mg Se kg-1, en suelos denominados seleníferos (Fordyce, 2005). En algunas partes de México el selenio en el suelo es bajo con concentraciones de hasta 0.05 mg kg-1 (Ramírez-Bribiesca et al., 2001). En sedimentos en Sonora, García-Hernández et al. (2000) reportaron valores de selenio de 0.8-1.8 mg kg-1, lo cual se considera adecuado para cultivos como Lolium perenne y Lactuca sativa (Hartikainen et al., 2000; Xue et al., 2001).
En el ambiente, el selenio puede liberarse por procesos naturales o inducidos por la actividad humana e incorporarse al suelo y agua (Fordyce, 2005; White et al., 2004).
Cuando el selenio se encuentra en forma de selenato +6 parece ser movilizado a las células vegetales a través de un proceso de transporte primario acoplado a una H+-ATPasa, posiblemente por medio de un transportador de sulfato (Terry et al., 2000) o de silicio (Zhao et al., 2010). La absorción de selenito +4 ocurre por un mecanismo diferente a la del selenato (Terry et al., 2000), posiblemente a través de un transportador de fosfato (Zhao et al., 2010). Una vez absorbido, el selenato tiende a detectarse en los tejidos radicales en forma inorgánica, mientras que el selenito parece formar rápidamente compuestos orgánicos (De Souza et al., 1998; Cartes et al., 2006). En general se considera que el selenio se relaciona con el metabolismo antioxidante (Rayman, 2008) y se sabe que el selenito induce más efectivamente a esta actividad que el selenato (Cartes et al., 2005).
Morris y Levander (1970), encontraron que la mayor parte de los frutos y vegetales desarrollados en suelos no seleníferos mostraron concentraciones de selenio menores de 0.01 μg g-1. La baja concentración de selenio en frutos y vegetales parece ser la situación normal en muchos lugares (Rayman, 2002, 2008; Fordyce, 2005; Broadley et al., 2006).
Casi todos los cultivos, entre ellos el tomate, son del tipo denominado no acumulador de selenio, es decir, son plantas para las cuales más de 25 μg de selenio/1 g de peso seco de raíces y hojas resulta en toxicidad (White et al., 2004). Esta puede manifestarse a través de estrés oxidativo considerando la habilidad pro-oxidante del selenio o por sustitución competitiva del azufre en las proteínas (Hartikainen et al., 2000).
La trasferencia del selenio del suelo y del agua a los humanos se lleva a cabo por medio de los productos agrícolas y pecuarios; la cantidad de selenio en los alimentos es un reflejo del contenido de este elemento en los suelos (Rayman, 2002, 2008; Hira et al., 2003). En humanos la ingesta puede variar de 10 μg por día en áreas con bajo contenido de selenio en el suelo, a 5000 μg diarios en donde se tienen suelos seleníferos. El valor de referencia de consumo de selenio es de 60 a 75 μg por día según datos de 1980 del US Food and Nutrition Board (Broadley et al., 2006), si bien puede elevarse a 300-600 μg por día (Aaseth, 1993; Combs, 2001). En general, se considera que la concentración de Se en la dieta en muchos países es bajo (Combs, 2001; Rayman, 2002, 2008). En el caso de los países más industrializados la disminución en la ingesta de harinas y carnes puede asociarse con el menor consumo de selenio (Broadley et al., 2006), lo cual permite considerar el posible beneficio de elevar el contenido de selenio en frutas y vegetales.
Los objetivos de este trabajo fueron determinar la magnitud del enriquecimiento en el selenio del fruto de tomate con el aporte de selenito de sodio (Na2SeO3) en la solución fertilizante y por aspersión foliar, así como el efecto de los mismos tratamientos en: la acumulación de selenio en raíces, hojas y tallos; la generación de biomasa; el crecimiento de la planta, la producción de frutos; y el estado antioxidante total de estos últimos.
Materiales y métodos
Etapas Realizadas Durante el Experimento
Etapa 1. El trabajo fue realizado en un invernadero en Saltillo, Coahuila, México. Se utilizó tomate (Lycopersicon esculentum Mill.) de la variedad cultivada Río Grande (de la semillera EDENA) con hábito de crecimiento determinado. Las semillas se sembraron el 9 de abril de 2010 en dos charolas de poliestireno de 200 cavidades, utilizando como sustrato peat moss y perlita (75:25). Las plántulas se trasplantaron 31 días después de la siembra (DDS) en macetas de polietileno de color negro de 20 L con tres tipos de sustrato: suelo agrícola, peat moss y perlita. La concentración de selenio basal en dichos sustratos fue de 1.484, 0.016 y 0.175 mg kg-1.
A las plantas en cada sustrato se les aplicaron los siguientes tratamientos: riego con solución nutritiva (Steiner, 1984), como testigo, y riego con la misma solución nutritiva más 10 y 20 mg L-1 de Se, usando como fuente selenito de sodio grado reactivo (Na2SeO3, Sigma-Aldrich). Este compuesto se disolvió en agua destilada para obtener una solución madre y se colocó en un frasco ámbar de 3 L. De ésta se fue tomando el volumen necesario para adecuar la concentración de los tratamientos de 10 y 20 mg L-1 de Se, los cuales se aplicaron desde 15 hasta 120 DDT. El total de tratamientos fue de nueve. Se utilizó un diseño experimental completamente al azar, con arreglo factorial A × B, donde los factores fueron los sustratos (A) y las concentraciones de selenio (B), con 15 unidades experimentales. Los sistemas de riego para la aplicación de cada tratamiento de solución nutritiva y selenio fueron totalmente independientes para evitar la posibilidad de contaminación.
Las macetas se establecieron en un invernadero tipo túnel, con cubierta rígida de policarbonato y ventilación activa a través de extractores y pared húmeda. Las plantas se acomodoran en hileras, con una separación de 40 cm entre ellas. La solución nutritiva se fue adaptando según las etapas de desarrollo del cultivo al 30, 50, 75 y 100%, a los 5 - 30, 31-40, 41-70, 71-100 DDT, respectivamente; el pH de la solución se mantuvo en 6.5, utilizando ácido sulfúrico. A los diez DDT se aplicaron, en promedio, 0.5 L de solución por maceta día-1; a los 30 DDT se aumentó a 0.8 L dia-1 y se llegó a aplicar 1.2 -1.8 L dia-1, después de 71 DDT. La antesis se presentó 95 DDT y la cosecha de fruto finalizó 120 DDT cuando se alcanzó el tercer racimo. Las plantas en suelo y en peat moss recibieron el mismo volumen de riego por planta. En el caso de las plantas en el sustrato perlita, por su baja retención de agua, recibieron mayor volumen de agua de riego por día, pero no mayor cantidad de fertilizante. Cuando se presentaron plagas o patógenos se aplicó imidacloprid, tiabendazol, metalaxil y captán, según lo recomendado por los fabricantes.
El experimento terminó 120 DDT. Los frutos se colectaron en bolsas de papel etiquetadas y se obtuvo el peso fresco de estos por planta. Diez días antes de llegar al tiempo de la cosecha, en la etapa de rayado, se colectaron diez frutos al azar de cada tratamiento. Después de obtener su peso fresco, se colocaron en un congelador a temperatura de -10 °C antes de usarlos en la determinación de la capacidad antioxidante total.
La raíz se separó de los tallos y hojas realizando un corte al ras del sustrato; después de pesar estas estructuras, para determinar el peso fresco, se colocaron en bolsas de papel y se introdujeron en una estufa de secado a una temperatura constante de 60 °C hasta obtener un peso seco constante. En el caso de los frutos, para obtener el peso seco, se seleccionaron al azar los obtenidos de 10 unidades experimentales; éstos se cortaron en rodajas finas, se colocaron sobre bandejas de papel aluminio y se introdujeron en la estufa de secado a 60 °C hasta obtener un peso constante. Con los datos de los pesos frescos y secos se calculó el contenido porcentual de materia seca (MS). Una vez secas, las muestras se molieron en un mortero de porcelana y luego se colocaron en recipientes de policarbonato para su posterior análisis.
Antes de la determinación del selenio en los tejidos las muestras se sometieron a digestión ácida con ácido nítrico y perclórico (3:1), utilizando una plancha de calentamiento a 100 °C de temperatura. Después la solución se filtró y aforó a una solución de trabajo de 100 mL con agua desionizada. El análisis se realizó con un Espectrómetro de Masa Acoplado a Inducción de Plasma (ICP-MS) marca THERMO JARELL ASH, Modelo IRIS Advantage, siguiendo el procedimiento 984.27 (Horwitz et al., 2000).
El análisis del estado antioxidante total (TAS) se realizó en los frutos que se congelaron. El valor de TAS se determinó usando el Total Antioxidant Status Kit Assay de Calbiochem®, el cual se basa en la técnica desarrollada por Miller et al. (1993) y consta de una solución amortiguadora de fosfato (pH 7.2), cromógeno (metmioglobina y ABTS® [catión radical 2,2-Azinobis-(3-etilbenzotiazolin-6-sulfonato)]), sustrato (peróxido de hidrógeno estabilizado) y, como estándar, TROLOX (6-Hidroxi-2, 5, 7, 8-tetrametilcroman-2-ácido carboxílico). Este último es un análogo de la vitamina E. Para la preparación de la muestra se tomaron al azar de cada tratamiento tres frutos congelados que presentaban coloración de maduración intermedia. Cada fruto se cortó en segmentos, los cuales se pasaron a un mortero de porcelana previamente congelado. A la muestra se le agregó nitrógeno líquido para su molienda y una vez terminado se tomaron 5 g de la muestra molida, se mezclaron en un tubo de vidrio con 10 mL de solución amortiguadora de fosfato pH 7.2 y se centrifugaron a 10,000 revoluciones por minuto durante 10 minutos. Del sobrenadante de cada muestra se tomaron 20 μL y se realizaron las lecturas de absorbancia en un espectrofotómetro a 600 nm. La concentración del estándar TROLOX utilizado fue 2.3 mM, de acuerdo con el kit utilizado. Se utilizó la fórmula siguiente:
Sobre los datos obtenidos se realizó un análisis de varianza (ANVA) y pruebas de separación de medias (Tukey P = 0.05).
Etapa 2. Fue parecida a la primera etapa, en cuanto a los procedimientos agronómicos y determinaciones realizadas. Las variantes fueron que el selenio se aplicó en menor concentración en la solución fertilizante y que los sustratos no incluyeron al peat moss. Se usaron semillas de la misma variedad y lote, sembradas el 5 de agosto de 2010. Se trasplantaron en condiciones, diseño y cuidados agronómicos similares a los de la etapa anterior, utilizando como sustrato suelo agrícola y perlita. Los tratamientos de fertilización, que se aplicaron de los 15 a los 140 DDT consistieron en riego con solución Steiner, como testigo y riego con la misma solución complementada con 2.5 y 5 mg L-1 de selenio aplicado como Na2SeO3 totalizando seis tratamientos. El experimento se cosechó 140 DDT. Se realizaron las mismas determinaciones de laboratorio y análisis estadísticos que en la etapa anterior.
Etapa 3. Se usaron semillas de la misma variedad y lote, se sembraron el 5 de agosto de 2010. Se trasplantaron en las condiciones, diseño y cuidados agronómicos similares a los de la etapa anterior, utilizando como único sustrato peat moss. La fertilización consistió en riego con solución Steiner, dosificado según los criterios utilizados para los tratamientos testigo de las etapas anteriores. El selenio se aplicó por aspersión foliar. Se estudiaron tres tratamientos, los cuales consistieron en aspersiones con agua destilada como tratamiento testigo y soluciones de 10 y 20 mg L-1 de selenio, en forma de Na2SeO3, cada 20 días. El experimento se cosechó 140 DDT. Las determinaciones de laboratorio realizadas en esta etapa fueron similares a las descritas en las dos etapas anteriores.
Los análisis estadísticos de la etapa 2 y 3 fueron los mismos que la Etapa 1.
Resultados y discusión
Crecimiento y Productividad del Tomate
Los resultados de acumulación de peso fresco y seco, así como la materia seca de la raíz, hojas y tallo, y frutos de las plantas tratadas con diferentes concentraciones de selenio aplicado por medio del riego (Etapa 1 y 2) y por vía foliar (Etapa 3), se muestran en el Cuadro 1. Los distintos sustratos mostraron, en ausencia de selenio, un comportamiento diferencial para algunas variables. En la Etapa 1 el valor más alto de peso fresco y seco de tallos y hojas fue el de las plantas establecidas en peat moss, seguidas del suelo y perlita. No se encontró por otra parte diferencia en los pesos frescos y secos de fruto y raíz entre los distintos sustratos. Para la materia seca tampoco se encontró diferencia entre los sustratos, a excepción de la materia seca del fruto en donde las plantas establecidas en suelo mostraron el promedio más alto. En la Etapa 2 no existieron diferencias significativas entre los pesos de materia seca de las plantas establecidas en los sustratos suelo y perlita. Para los pesos frescos y secos del fruto no hubo diferencias entre las plantas de los diferentes sustratos, mientras que en el caso de la raíz el valor más alto se encontró en la perlita. En cuanto al peso fresco y seco de tallos y hojas el promedio más alto correspondió a las plantas en suelo (Cuadro 1).
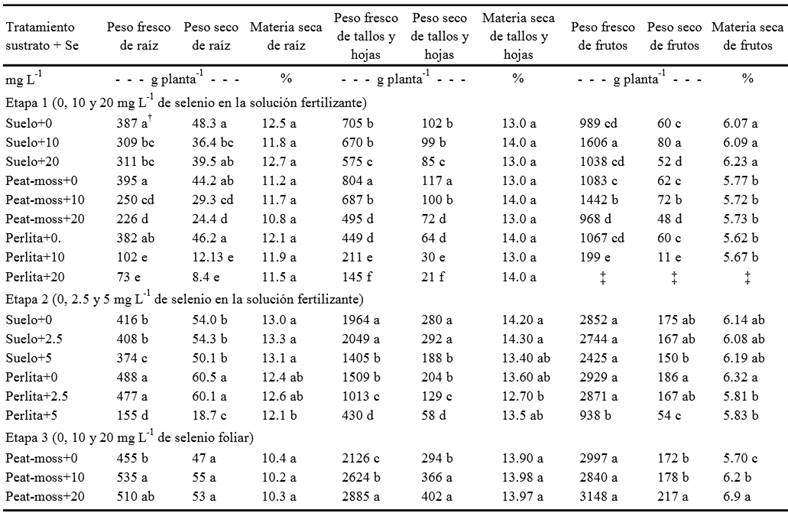
† Literales distintas en la misma columna en cada etapa indican diferencias significativas, según Tukey (P ≤ 0.05). ‡ No produjeron frutos.
Cuadro 1. Efecto de aplicaciones de selenio en la solución fertilizante (Etapas 1 y 2) de cultivo de tomate establecido en diferentes sustratos y vía foliar (Etapa 3), sobre la biomasa de la raíz, tallos y hojas, y frutos.
La adición de selenio en la solución fertilizante dio lugar a diferencias en la respuesta de las plantas de acuerdo al tipo de sustrato en donde crecieron, así como frente a las diferentes concentraciones del elemento utilizadas en las Etapas 1 y 2.
En las tres etapas del experimento la materia seca de la raíz, hojas y tallos no se vieron modificadas ni por la concentración de selenio, ni por la forma de aplicación de éste. La materia seca del fruto mostró respuestas distintas en cada etapa, la diferencia no fue atribuible al selenio y si al tipo de sustrato en la Etapa 1. En la Etapa 2 no se observó efecto del selenio en las plantas cultivadas en suelo, mientras que en las de perlita la aplicación del elemento disminuyó la materia seca de los frutos. En cambio, cuando se empleó la aspersión foliar, el selenio ejerció un efecto positivo sobre el contenido de materia seca del fruto (Cuadro 1).
Etapa 1. La aplicación de selenio tuvo un efecto negativo sobre el peso de la raíz, tallos y hojas, sobre todo en el sustrato perlita en donde las plantas tratadas mostraron de forma constante hojas cloróticas, un síntoma de intoxicación por selenio (Padmaja et al., 1989). El tomate se clasifica como una especie no acumuladora de selenio (White et al., 2004) por lo que se espera que más de 10 mg kg-1 en el suelo causen disminución en su crecimiento y metabolismo (Hartikainen et al., 2000). Lo anterior pudiera explicar la respuesta negativa descrita. Por otra parte, no todas las respuestas de la planta fueron negativas, el peso fresco de los frutos de las plantas desarrolladas en suelo y peat moss se incrementaron significativamente al aplicar 10 mg L-1 de selenio. En cambio, las plantas cultivadas en perlita mostraron producción de fruto disminuida con 10 mg L-1 de selenio y nula al aplicar la concentración de 20 mg L-1. Considerando que la perlita es un material inerte, es posible que el selenio estuviera totalmente disponible en este sustrato causando la intoxicación de las plantas. Los resultados parecen indicar que existió algún efecto de amortiguamiento del suelo y el peat moss sobre el selenio tal como fue descrito por White et al. (2004).
Etapa 2. No se observó diferencia en el peso fresco y seco de la raíz entre el testigo y el tratamiento con menor concentración de selenio (Cuadro 1). Sin embargo, al aplicar 5 mg L-1 de selenio en la solución fertilizante la masa radical disminuyó significativamente; el efecto fue mayor en el sustrato perlita. En el peso fresco y seco de tallos y hojas se observó un efecto parecido en las plantas desarrolladas en suelo entre el testigo y la dosis de 2.5 mg L-1, mientras que en perlita la aplicación de selenio causó un efecto negativo en ambas concentraciones. El Se aplicado al suelo no ejerció ningún efecto sobre la producción de fruto, mientras que en la perlita la concentración de 5 mg L-1 de Se en la solución fertilizante causó fuerte reducción (Cuadro 1). Al comparar la Etapa 1 con la Etapa 2 se apreció una mejora en la respuesta de la planta al disminuir la concentración de selenio en la solución. La concentración de Se en los frutos es similar tanto en la Etapa 1 como en la Etapa 2, pero en la primera la concentración de Se en los tallos y hojas alcanza valores mayores a los 25 mg de Se por kg de peso seco de tejido, concentración máxima que se reporta como tolerable para plantas no acumuladoras de selenio (White et al., 2004). Es posible suponer que esa diferencia pueda explicar la respuesta en el crecimiento y productividad de las plantas.
Etapa 3. La aplicación foliar de selenio en concentraciones de 10 y 20 mg L-1 no modificó la biomasa de la raíz (Cuadro 1). El efecto del selenio fue positivo para tallos y hojas así como para el peso seco y contenido de materia seca de los frutos. Este efecto sobre la biomasa del fruto también se ha reportado para Cucurbita pepo (Germ et al., 2005), así como para el crecimiento de la planta en Lolium perenne (Hartikainen et al., 2000), Lactuca sativa (Xue et al., 2001) y Solanum tuberosum (Turakainen et al., 2004).
Concentración de Selenio en los Tejidos de Tomate
Cuando el selenio se aplicó con la solución fertilizante los valores más altos del elemento se encuentraron en la raíz, seguidos de los tallos y hojas y, al final los frutos. Al aplicarse el selenio por aspersión foliar, la concentración en raíces, tallos y hojas tiende a igualarse, las concentraciones más bajas se presentaron en los frutos. Esta misma tendencia la describió Arvy (1993).
A continuación se presentan los resultados para cada grupo de estructuras.
Raíz. En el tratamiento testigo de la Etapa 1 se halló una concentración máxima de selenio de 2.61 μg g-1 en peso seco de plantas establecidas en suelo o peat moss y de 7.21 μg g-1 en perlita. En el suelo y el peat moss la concentración de selenio en la raíz aumentó de forma lineal (r = 0.83, P ≤ 0.01) al aumentar el selenio, hasta alcanzar un valor máximo de 18.32 μg g-1. En el sustrato perlita el tratamiento de 10 mg L-1 de selenio causó una acumulación promedio de 223 μg g-1, mientras que en el tratamiento de 20 mg L-1 se observó un promedio de 311.77 μg g-1 (Figura 1), concentraciones de selenio que podrían causar toxicidad (Terry et al., 2000). En un estudio con lechuga, usando como sustrato la vermiculita, Simojoki et al. (2003) reportó que el adicionar selenio en baja concentración causó que este elemento se concentrara en la raíz y, en menor medida, en las hojas y tallo. En cambio, al aumentar el suministro de selenio se elevó el contenido de este tanto en raíces como en hojas. Los resultados obtenidos en la presente investigación con cultivo de tomate indican que el comportamiento de las plantas fue diferente de acuerdo con el sustrato usado (suelo, peat moss y perlita).
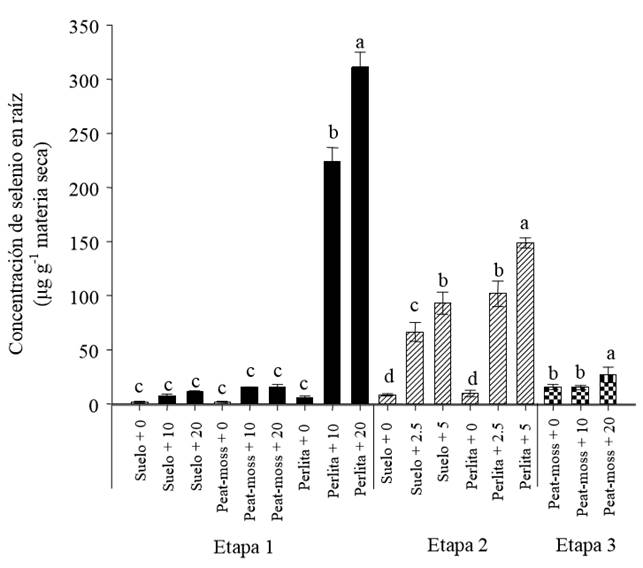
Literales distintas en la misma etapa experimental indican diferencias significativas, según Tukey (P ≤ 0.05). Las aplicaciones de selenio fueron: 0, 10 y 20 mg L-1, 0, 2.5 y 5 mg L-1 y 0, 10 y 20 mg L-1 acorde con cada una de las etapas en diferentes sustratos (suelo, peat moss y perlita) y aspersión foliar (sólo Etapa 3).
Figura 1. Efecto de la aplicación de selenito de sodio en la concentración de selenio en la raíz de plantas de tomate.
Durante la Etapa 2 ocurrió mayor acumulación de selenio en la raíz de las plantas establecidas en suelo en comparación con la Etapa 1. Las plantas cultivadas en perlita presentaron la mayor acumulación de selenio en la raíz (Etapa 2) pero en menor medida que lo visto en la Etapa 1. En la Etapa 3, cuando se aplicó selenio por aspersión foliar con una concentración de 20 mg L-1, existió un aumento estadísticamente significativo en la concentración de selenio en la raíz, de 15.58 a 26.90 μg g-1 peso seco. Kápolna et al. (2009), incrementaron la concentración radical de selenio de 0.045 a 2.0 μg g-1 en peso seco, al aplicar de 100 mg L-1 de selenio por aspersión foliar. Estos datos coinciden con los de Smrkolj et al. (2006) quienes indican la necesidad de llevar a cabo aspersiones repetidas si el objetivo es la acumulación de selenio.
Tallos y hojas. En el tratamiento testigo de la Etapa 1 se halló una concentración máxima de selenio de 15.74 μg g-1 peso seco en plantas cultivadas en suelo o peat moss y de 12.64 μg g-1 en perlita. En el suelo y el peat moss la concentración de selenio en los tallos y hojas se incrementó de forma lineal (r = 0.76, P ≤ 0.01) al aumentar el selenio en la solución, hasta alcanzar un valor máximo de 37.56 μg g-1 (Figura 2). Las plantas que crecieron en perlita, en la Etapa 1, presentaron clorosis, que se asocia con la intoxicación por selenio ya que se inhibe la síntesis de clorofila (Padmaja et al., 1989), así como posterior necrosis foliar, bajo crecimiento y muerte prematura. En las plantas no acumuladoras, el límite de concentración de este elemento en tallos y hojas, bajo condiciones naturales alcanza 25 μg g-1 peso seco, valor que puede variar de acuerdo con el suelo, la actividad microbiológica y la concentración de sulfato en la solución del suelo, entre otras condiciones (White et al., 2004).
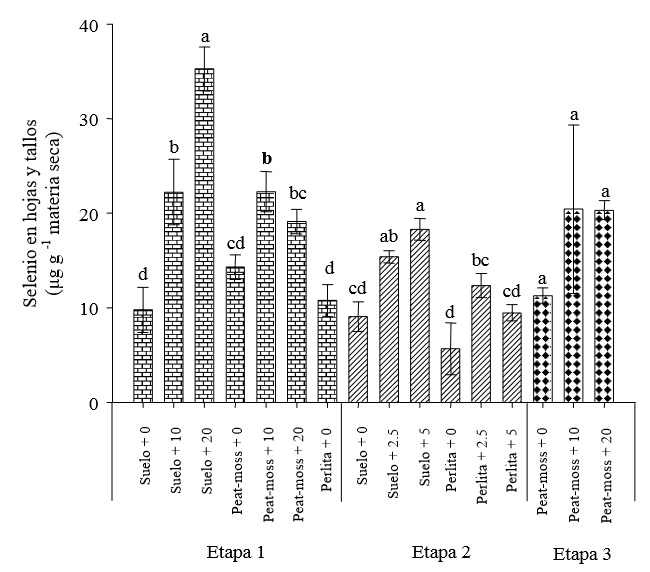
Literales distintas en la misma etapa experimental indican diferencias significativas según Tukey (P ≤ 0.05). La Etapa 1 se refiere a la aplicación de selenio en la solución fertilizante en concentraciones de 0, 10 y 20 mg L-1, usando tres sustratos: suelo, peat moss y perlita. La Etapa 2 se realizó aplicando selenio en la solución fertilizante en concentraciones de 0, 2.5 y 5 mg L-1 utilizando dos sustratos: suelo y perlita. La Etapa 3 se llevó a cabo aplicando 10 y 20 mg L-1 de selenio por aspersión foliar, utilizando sólo peat-moss como sustrato.
Figura 2. Efecto de la aplicación de selenito de sodio en la concentración de selenio en tallos y hojas de plantas de tomate.
Durante la Etapa 2 se observaron diferencias significativas entre los tratamientos y el testigo, pero sin alcanzar valores mayores de 20 μg g-1 de peso seco. En este caso, la respuesta conjunta de acumulación de selenio en la raíz, el tallo y las hojas es más parecida a la reportada por Simojoki et al. (2003), misma que no fue posible apreciar en la Etapa 1 al aplicar mayor concentración de selenio. En la Etapa 3, al aplicar el selenio por aspersión foliar, no se encontraron diferencias entre tratamientos.
Fruto. En el tratamiento testigo se halló una concentración máxima de selenio en el fruto de 9.07 μg g-1 peso seco en suelo o peat moss y de 6.17 μg g-1 en perlita. Las concentraciones de Se en el fruto de las plantas testigo son altos si se considera la concentración reportada (0.03 μg g-1) por Eurola et al., (1989), en tomate abonado con fertilizantes enriquecidos con selenio en Finlandia. Tanto la concentración de selenio en la solución, como la encontrada en la raíz, tallos y hojas, no mostraron correlación con el selenio en el fruto, situación diferente de la observada en los otros órganos de la planta. Los valores máximos para los frutos de las plantas tratadas con selenio en suelo y peat moss fueron 12.02 y 18.99 μg g-1, respectivamente. Los promedios de concentración de selenio en el fruto para los testigos y los tratamientos con este elemento mostraron diferencias significativas (Figura 3), lo cual indica la factibilidad del enriquecimiento con selenio del fruto de tomate en invernadero.
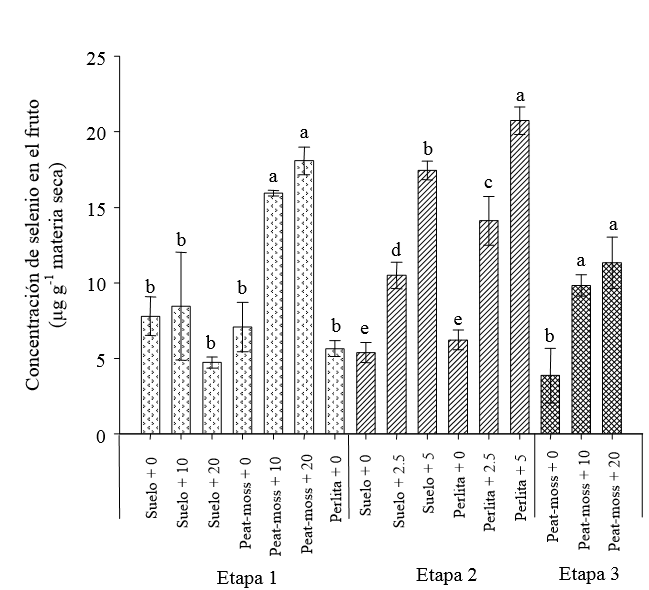
Literales distintas en la misma etapa experimental indican diferencias significativas según Tukey (P ≤ 0.05). La Etapa 1 se refiere a la aplicación de selenio en la solución fertilizante en concentraciones de 0, 10 y 20 mgL-1, usando tres sustratos: suelo, peat moss y perlita. La Etapa 2 se realizó aplicando selenio en la solución fertilizante en concentraciones de 0, 2.5 y 5 mg L-1 utilizando dos sustratos: suelo y perlita. La Etapa 3 se llevó a cabo aplicando 10 y 20 mg L-1 de selenio por aspersión foliar.
Figura 3. Efecto de la aplicación de selenito de sodio en la concentración de selenio en los frutos de tomate.
Durante la Etapa 2 se observó una mayor acumulación de selenio en los frutos de las plantas cultivadas en perlita (Figura 3). En la Etapa 3 los dos tratamientos de selenio fueron estadísticamente diferentes al testigo en cuanto al contenido de este elemento en los frutos. Cabe mencionar que la concentración promedio de selenio en los testigos de las tres etapas fue de 6.00 μg g-1 peso seco, equivalente en términos de consumo en la dieta a 34.2 μg de selenio por 100 g de fruto fresco. En cambio, el máximo valor de concentración de selenio (20.89 μg de selenio por gramo de peso seco), encontrado en el tratamiento con aplicación de 5 mg L-1 en la solución fertilizante en perlita, equivale a un consumo de 121.8 μg de selenio por cada 100 g de fruto fresco, valor por arriba del de referencia para el año 1980 del US Food and Nutrition Board (Broadley et al., 2006) y equivalente a un tercio de los niveles máximos de ingesta recomendados en la actualidad (Aaseth, 1993; Combs, 2001).
Estado Antioxidante Total (TAS) del Fruto de Tomate
En la Etapa 1 la aplicación de selenio con la solución fertilizante en 10 y 20 mg L-1 disminuyó en un promedio de 25% el estado antioxidante del fruto (Figura 4). Este resultado seguramente se debió a la acumulación de selenio en los tejidos vegetativos de la planta ya que, según reportan Nowak et al. (2004), el selenio en las plantas da lugar a un aumento en la condición antioxidante cuando la concentración del elemento no rebasa los 18 mg kg-1 de peso seco, mientras que en mayor concentración causa el efecto contrario.
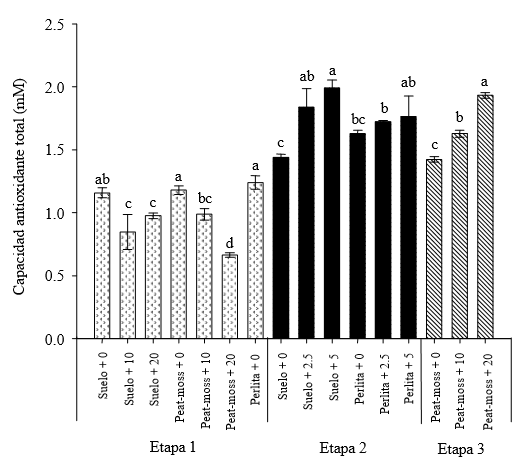
Literales distintas en la misma etapa experimental indican diferencias significativas según Tukey (P ≤ 0.05). La Etapa 1 se refiere a la aplicación de selenio en la solución fertilizante en concentraciones de 0, 10 y 20 mg L-1, usando tres sustratos: suelo, peat moss y perlita. La Etapa 2 se realizó aplicando selenio en la solución fertilizante en concentraciones de 0, 2.5 y 5 mg L-1 utilizando dos sustratos: suelo y perlita. La Etapa 3 se llevó a cabo aplicando 10 y 20 mg L-1 de selenio por aspersión foliar.
Figura 4. Efecto de la aplicación de selenito de sodio en el estado antioxidante total (TAS) de los frutos de tomate.
Hartikainen et al. (2000), encontraron que el selenio ejerce un efecto pro-oxidante al aplicarlo en el sustrato en concentración mayor a 10 mg kg-1, resultando en una disminución del estatus antioxidante de Lolium perenne, particularmente en la actividad de glutatión peroxidasa. En cuanto a los resultados del estudio con tomate, tomando en cuenta que la TAS no se refiere a un antioxidante o antioxidantes específicos, sino en general al potencial de cesión de electrones del total de compuestos en la muestra, no es posible saber si el efecto observado de la aplicación de selenio se refirió a enzimas antioxidantes específicas que contienen selenio como la glutatión peroxidasa (Combs, 2001) o bien si afectó actividades más generales como la producción de antioxidantes en los cloroplastos (Pennanen et al., 2002).
En las Etapas 2 y 3, al realizar las aplicaciones de selenio en menor concentración en la solución fertilizante, o por aspersión foliar, fue posible observar un efecto positivo sobre la capacidad antioxidante total (Figura 4). Un resultado análogo fue descrito por Pennanen et al. (2002), quienes reportaron una disminución significativa en la peroxidación de lípidos al aplicar selenio en plantas de lechuga expuestas a radiación UV-B y UV-C. Del mismo modo, Xue et al. (2001) encontraron que la aplicación de selenio en plantas de lechuga eleva la actividad de las enzimas antioxidantes superóxido dismutasa y glutatión peroxidasa, incrementando asimismo la acumulación de tocoferol y disminuyendo la peroxidación de lípidos.
Conclusiones
- Las aplicaciones de 5 mg L-1 de selenio en la solución fertilizante y 20 mg L-1 por aspersión foliar fueron las más efectivas en aumentar la concentración de este elemento en el fruto de tomate, determinándose 3.48 veces más selenio en comparación con el testigo en el fruto del tratamiento de 5 mg L-1 de selenio en la solución fertilizante.
- La concentración de selenio en raíces, tallos y hojas fue siempre más alta que la encontrada en los frutos, sobre todo al utilizar el sustrato perlita en donde causó toxicidad con todos los tratamientos.
- En los sustratos de suelo y peat moss la aplicación de 10 y 20 mg L-1 de selenio en la solución fertilizante disminuyó el peso de las plantas. En el sustrato suelo la concentración de 5 mg L-1 originó menor peso de las plantas, mientras que al aplicar 2.5 mg L-1 ya no se observó el efecto negativo. En cuanto a las aplicaciones foliares estas aumentaron el peso de las plantas.
- La producción de fruto fue muy baja o nula al aplicar 5 mg L-1 o más de selenio en el sustrato perlita. En suelo y peat moss se encontró un efecto positivo al añadir 10 mg L-1 de selenio en la solución nutritiva, sin embargo, en suelo la aplicación de 2.5 y 5 mg L-1 no fue diferente al testigo. Desde el punto de vista de la producción de fruto la aplicación foliar de selenio rindió mejores resultados.
- El estado antioxidante de los frutos disminuyó al aplicar el selenio en concentración de 10 y 20 mg L-1 en la solución fertilizante, pero aumentó al aplicarlo en concentración de 2.5 y 5 mg L-1. Las aspersiones foliares con 10 y 20 mg L-1 de selenio incrementaron el estado antioxidante total del fruto.
- Considerando el conjunto de respuestas de las plantas el mejor tratamiento de aplicación de selenio fue por la vía foliar.











 nueva página del texto (beta)
nueva página del texto (beta)



