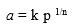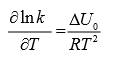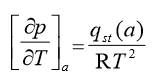Introducción
Dentro de los aspectos físicos, la textura o composición elemental de una muestra de suelo está limitada por las proporciones relativas de arena, limo y arcilla lo que le proporciona características distintivas (Soil Survey Staff 1995; Ingaramo et al., 2007). Determinar la porción de los componentes sólidos suministra datos de las propiedades agrícolas de los suelos para el mantenimiento de los cultivos, por su interacción con nutrimentos los cuales están relacionados con los espacios porosos del mismo (Vargas-Rodríguez et al., 2008). Los sistemas porosos clasificados por la IUPAC contemplan su amplitud (w) y se dividen en: microporos (w < 2nm), mesoporos (2 nm< w < 50nm) y macroporos (w > 50 nm) (Sing et al., 1985; Zdravkov et al., 2007). La superficie específica resultado de la presencia de diferentes tamaños de poro, condiciona la adsorción de sustancias a los adsorbentes (Zhu et al., 1996). La adsorción ideal de moléculas en sistemas porosos depende del carácter de sus poros con relación a su forma, tamaño y naturaleza química (Hernández et al., 2005; Hernández et al., 2009). Todos los sólidos tienen la propiedad de fijar o adsorber, en su superficie, moléculas, átomos o iones que se encuentren cercanos a él. En el área de la interfase gas-sólido es ampliamente difundido el uso de isotermas y la determinación de variables que miden la capacidad de adsorción del sustrato (adsorbato) en el adsorbente (expresado en mg de sustrato g-1 del adsorbente). Los puntos experimentales obtenidos se tratan mediante las ecuaciones de Freundlich y Langmuir (Subramanyam y Das 2009), para conocer las interacciones físicas o químicas entre la superficie de las partículas sólidas del suelo y las sustancias que se liberan por las plantas y bacterias. La cantidad de material adsorbido en un sistema depende de la temperatura y la presión o la cantidad del adsorbato, y el grado de adherencia puede estudiarse como función de la presión, con lo que se generan isotermas de adsorción. Siendo el suelo un sistema poroso asociado a las plantas, es en la rizósfera donde se tiene la mayor influencia por la presencia de las raíces vivas dónde se exudan compuestos orgánicos que estimulan o inhiben las poblaciones microbianas y sus actividades. El suelo de la superficie de la raíz o rizoplano también proporciona una base de nutrimentos favorables para muchas especies de bacterias (Brimecombe, 2001). Es en esos sitios donde existen los efectos más estudiados, como lo es, la secreción de ácidos carboxílicos de la raíz, demostrados al colocar un medio con indicador de pH para detectar la acidificación mediante un cambio de coloración (Sullivan, 2004). Los ácidos carboxílicos (CHO2) o sustancias orgánicas de bajo peso molecular se liberan al suelo por todo tipo de organismos (Jones, 1998), en el caso de las plantas representan una respuesta al estrés por nutrimentos (Chaffai et al., 2006). Los exudados orgánicos de las raíces de las plantas, proveen de alimento y energía a los microorganismos (Reyes y Valery, 2007). Algunos de esos ácidos son: cítrico, málico y succínico, entre otros (López-Bucio y Herrera-Estrella, 2000). La asimilación de fosfatos inorgánicos, se encuentra influenciada también por la presencia de bacterias de vida libre o asociativa que habitan la rizósfera y que pueden estimular el crecimiento de gramíneas como las que pertenecen a los géneros Azospirillum, Azotobacter, Klebsiella, Beijerinckia, Pseudomonas y Bacillus (Loredo-Osti et al., 2004). Dentro de los microorganismos importantes en asociación con las plantas, se pueden encontrar diversos géneros bacterianos como Pseudomonas, Enterobacter, Pantoea y Burkholderia, entre otras, cuya actividad productora de enzimas fosfatasas se acompaña en muchos de los casos de la producción de ácidos orgánicos (Espinosa-Victoria et al., 2009). Los ácidos orgánicos, pueden originarse de diferentes fuentes bióticas, como la descomposición de la materia orgánica, la exudación de las plantas, los hongos y diversas bacterias. Poco se conoce acerca de la interacción de ácidos carboxílicos generados como productos del metabolismo biológico de las plantas y bacterias en relación con el suelo agrícola. Por lo anterior, el objetivo del presente trabajo fue determinar la adsorción de los ácidos carboxílicos volátiles de origen vegetal y bacteriano al suelo agrícola de la rizósfera de Zea mays L.
Materiales y métodos
La zona de estudio se encuentra en la región centro-oeste del estado de Puebla, en el municipio de San Juan Atenco, Puebla, México, cuya localización geográfica corresponde a los paralelos 19° 04’ 37” y 19° 04’ 47” N y los meridianos 97° 31’ 29” y 97° 31’ 41” O a una altitud de 2425 m. Se obtuvieron las muestras de suelo asociado al cultivo de maíz, al que se le realizaron análisis físicos, químicos, biológicos y de superficie: textura, pH en relación 1:10 (w/v) suelo-agua; carbono orgánico y nitrógeno totales mediante el método semi-micro-Kjeldahl, fósforo disponible de acuerdo al método de Olsen (Soil Survey Staff, 1995).
Detección de Ácidos a Partir de Exudados Radicales de Maíz y Bacterias Asociadas
Para obtener exudados radicales de maíz, se propagaron plántulas a partir de semillas esterilizadas en la superficie, por medio de la inmersión en cloramina T al 1% durante cinco minutos y tres enjuagues con solución reguladora de fosfatos 0.025M pH 7 y agua destilada estéril. Después, las semillas fueron germinadas en cámara húmeda. Las plantas se regaron con solución nutritiva de Hoagland durante dos semanas. Se retiraron las plantas para obtener los exudados radicales que se ajustaron a pH 2.0 con HCl 0.1N y se llevaron a sequedad en estufa a 70 °C durante 24h. Los exudados radicales se concentraron en 1 mL con agua desionizada estéril (Altomare et al., 1999). Se seleccionaron bacterias asociadas a maíz del género Pseudomonas, las cuales presentaron la capacidad de modificar el pH del medio de cultivo, de neutro a ácido, y se propagaron en caldo nutritivo. La suspensión bacteriana se centrifugó a 3000 rpm, durante 20 min, para eliminar las células bacterianas. Finalmente, se determinó la presencia de ácidos carboxílicos, tanto de exudados radicales de maíz así como de los extractos bacterianos mediante la técnica de cromatografía en capa fina de alta resolución (HPTLC High Performance Thin Layer Chromatography) en placas de celulosa F de Merck como fase estacionaria y separados con la mezcla de solventes éter, ácido fórmico y agua (75:15:10) como fase móvil y comparados con ácidos orgánicos de referencia (Chaffai et al., 2006).
Caracterización de Propiedades de Superficie del Suelo
Porosidad del suelo. Se desgasificó a partículas de suelo de malla 60-80 a 623 K durante 20 h a una presión inferior a 1.3 10-4 Pa, la cual fue proporcionada por una bomba turbo-molecular del instrumento Quantachrome AutoSorb-AS1. Se construyeron isotermas de adsorción de N2 a la temperatura de 76 K (a las condiciones de altitud de Puebla, México) en el intervalo de presiones relativas, p/p0 = [10-5, 0.995]; la presión de saturación p0 se registró durante el curso de las medidas de adsorción (Hernández et al., 2003; Hernández et al., 2009), en el instrumento volumétrico automático de sorción.
Adsorción de ácidos carboxílicos en el suelo agrícola. Se determinaron las isotermas de adsorción de agua y los ácidos carboxílicos volátiles de uno a cuatro átomos de carbono (adsorbatos) en un suelo agrícola. En el intervalo de temperaturas superiores al punto de ebullición de los adsorbatos (398-523 K), con la técnica de cromatografía de gases, que aunque se encuentra por arriba de las temperaturas conocidas del suelo, son herramientas útiles para el estudio de procesos de sorción. Ácidos carboxílicos de alta pureza 99.99%, se usaron como adsorbatos: Ácido metanoico, ácido etanoico, ácido propanoico y ácido butanoico, los cuales se suministraron por SIGMA-ALDRICH. Los tiempos de retención se obtuvieron con ayuda de un cromatógrafo Shimadzu GC-14A, equipado con un detector de conductividad térmica. Los gases portadores fueron helio (He), aire e hidrogeno (H2) de alta pureza 99.998% adquiridos de INFRA® , los cuales se pasaron a través de un tamiz molecular 3A. Las columnas para la cromatografía de gases fueron de acero inoxidable y se empacaron con los adsorbentes a estudiar. Antes de realizar las corridas experimentales, los adsorbentes introducidos en las columnas se deshidrataron in situ en un flujo regulado de gas portador a 573 K, durante 8 h. Se midieron los flujos del gas portador He, de distinta velocidad, a la salida de la columna con un flujómetro automático. Se introdujeron inyecciones de distinto volumen de los adsorbatos a la columna cromatográfica (d.i.= 5 mm y longitud 50 cm). Los volúmenes inyectados correspondieron al orden de 10-8 cm3. El volumen muerto de la columna se determinó inyectando CH4 en forma simultánea con los adsorbatos. Los tiempos de retención del CH4 fueron prácticamente imperceptibles y similares a los del aire y no existió variación respecto a los incrementos de temperatura que sufrió la columna. Todos los picos cromatográficos registrados, no mostraron evidencias de conversión química de los adsorbatos. Las isotermas de adsorción de los diferentes adsorbatos a las temperaturas establecidas, fueron obtenidas utilizando el suelo de San Juan Acatenco, Puebla, México, a distintas temperaturas.
Los calores isostéricos de adsorción se obtuvieron a través de los datos de las isotermas de adsorción a las temperaturas estudiadas.
Métodos de cálculo. Todos los datos de adsorción de los ácidos carboxílicos se trataron con la ecuación de adsorción de Freundlich, en su forma lineal. Para todos los ácidos carboxílicos (adsorbatos) los datos de adsorción no se ajustaron al modelo de adsorción de Langmuir, indicando heterogeneidad de los sitios de adsorción como se ha reportado (Asnin et al., 2001). Esto es consistente con el hecho de que los datos de adsorción se ajustaron a la ecuación de adsorción de Freundlich. Aunque esta ecuación es empírica, es adecuada para tratar datos de adsorción en superficies heterogéneas con distribuciones de sitios de energía en bajas concentraciones de adsorbato. La Ecuación de adsorción de Freundlich (Choudhary y Mantri, 2000) es:
donde: n > 1, a (µmol g-1) es la cantidad de sustancia adsorbida, k es la constante de adsorción de Freundlich y 1/n es el exponente de la presión del adsorbato. La variación de k con la temperatura suministra los valores de la energía de adsorción estándar ∆U0 vía una ecuación Van’t Hoff (Ruthven y Kaul, 1998).
El calor isostérico o entalpia isostérica de adsorción -qst (kJ mol-1) del suelo como adsorbente a distintos grados de cobertura a se calculó a partir de los datos experimentales de las isotermas de adsorción, usando la Ecuación de Clausius-Clapeyron (Rudzinski y Everett, 1992)
donde: p y T son la presión de equilibrio y la temperatura en una zona específica de cobertura a y R es la constante universal de los gases, con el fin de conocer el grado de interacción de los compuestos producto del metabolismo de plantas y bacteriano con suelo agrícola.
Resultados y discusión
Caracterización de Suelo
El suelo agrícola de San Juan Atenco, Puebla, México, se clasificó tomando los criterios de Soil Survey Staff (1995) y presentó una textura franco-arcillo-arenosa, con un pH medianamente alcalino, muy bajo porcentaje de nitrógeno, medio en la cantidad de fósforo y muy bajo contenido de materia orgánica (Cuadro 1). Se determinó una actividad deshidrogenasa de 102.67 mg g-1 en el suelo y una población microbiana cultivable de 4.3 × 106 UFC (unidades formadoras de colonia) g-1 de suelo. El suelo de San Juan Atenco, Puebla, México, es pobre en nitrógeno, mediano a medianamente rico en potasio y con una concentración media de fósforo asimilable (Cuadro 1). La disponibilidad de nutrimentos necesarios para las plantas está determinada por factores físicos, químicos y biológicos del suelo, los cuales varían de acuerdo con el tipo de cultivo y las labores culturales (Schubert y Mengel, 1988).
Caracterización de la Capacidad de Sorción-Desorción de un Suelo Agrícola Usando como Modelo N2
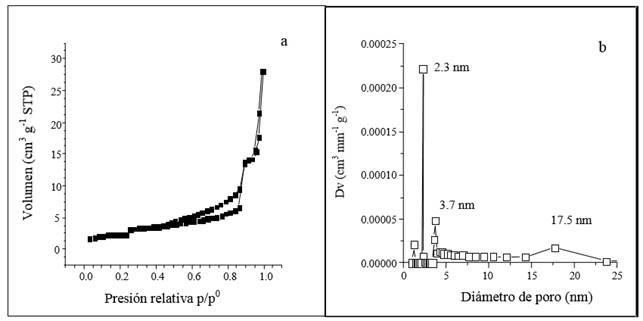
Las isotermas de adsorción-desorción de N2 a 76 K sobre el suelo estudiado se muestran en la Figura 1. Estos gráficos corresponden a las de Tipo II-IV de la clasificación de la IUPAC (Sing et al., 1985). Las propiedades texturales más relevantes de las muestras de suelo, calculadas a partir de las isotermas, (presión relativa, p/p0) contra volumen adsorbido (cm3 g-1 de suelo), en condiciones estándar de temperatura y presión (STP por sus siglas en inglés) de N2, se pueden ver en el Cuadro 1. Es evidente la estructura porosa del suelo, ya que la función de distribución de tamaño de poros (FDTP) de las muestras de suelo, obtenida por medio del método Barrett-Joyner-Hallenda (Sing et al., 1985), muestra que el suelo de estudio produce una distribución de tamaño de poro multimodal con predominio de tres grupos con valores de 2.3, 3.7 y 17.5 nm. Las isotermas de adsorción del suelo estudiado exhiben una forma rectilínea Tipo II, producto de una fuerte interacción entre la superficie del suelo y el gas (Hernández et al., 2010), por lo que debe existir competencia de los fluidos que invaden el suelo por los espacios porosos en diferente intensidad y su grado de interacción estará en función de la cantidad, tamaño y naturaleza de los poros.
Detección de Ácidos a Partir de Exudados Radicales de Maíz y Bacterias Asociadas
Se identificó la presencia de ácidos mono y di carboxílicos, mediante cromatografía en capa fina en la rizósfera de maíz en asociación con las bacterias estudiadas, los cuales fueron: ácido cítrico, ácido láctico, ácido tartárico, ácido succínico, ácido glucónico, ácido glutámico, ácido butanoico, ácido etanoico y ácido propanoico. Por ello se decidió usar ácidos carboxílicos volátiles de uno a cuatro carbonos como modelo de estudio en interacción con el suelo agrícola. La presencia de los ácidos carboxílicos, detectados en maíz coincide con lo reportado por Jones (1998), quien detectó ácidos orgánicos en maíz y lo comparó con ácidos orgánicos detectados en otras plantas. La Figura 2 muestra las diferencias estructurales mediante modelos moleculares elaborados en el programa Arguslab 4.0.1 para agua y ácidos orgánicos carboxílicos volátiles usados como adsorbatos en los ensayos de cromatografía de gases en el suelo agrícola estudiado. Se puede observar que uno de los hidrógenos de la molécula de agua está sustituido por radicales CHO2, donde el R tiende a incrementar de uno a cuatro carbonos, por lo que se relacionó la estructura molecular de cada adsorbato y sus propiedades fisicoquímicas (Cuadro 2), con la adsorción de un suelo agrícola.

Figura 2. Modelos moleculares de agua y ácidos carboxílicos usados en los ensayos: a) agua, b)ácido metanoico, c) ácido etanoico, d) ácido propanoico, e) ácido butanoico, color rojo) hidrógeno, color blanco) oxígeno y color gris) carbono. Modelos realizados en ArgusLab 4.0.1.
Isotermas de Adsorción de Ácidos Carboxílicos de un Suelo Agrícola
Se graficaron isotermas de adsorción de ácidos carboxílicos a diferentes temperaturas en muestras de suelo como adsorbente. Para todos los ácidos carboxílicos se generaron tres cromatogramas por temperatura ensayada (Figura 3), los datos se procesaron para obtener las isotermas de adsorción, mediante la integración de los cromatogramas para determinar la cantidad de sustancia adsorbida (a) en función de la presión en el equilibrio. Se construyó el grafico a contra p, 1/a contra 1/p y se estableció que el gráfico log a contra log p es lineal, como un indicador aceptable del cumplimiento de las ecuaciones evaluadas (Rudzinski y Everett, 1992). A medida que se incrementó la temperatura, la retención de adsorbatos por el suelo fue menor, lo cual coincide para sustancias orgánicas como tolueno y naftaleno, en muestras de suelo (Sleep y McClure, 2001).

Figura 3. Cromatogramas del ácido etanoico a diferentes temperaturas ensayado con suelo agrícola de San Juan Atenco, Puebla, México.
La Figura 3 muestra los resultados de la adsorción del ácido etanoico por medio de los cromatogramas obtenidos del suelo agrícola a temperaturas de 150 °C (423 K), 175 °C (448 K), 200 °C (473 K) y 225 °C (498 K). Donde es notable el comportamiento de los ácidos carboxílicos al interaccionar con el suelo agrícola sometido a temperaturas superiores a su punto de ebullición. La interpretación clásica usada en otros sistemas porosos menciona que a medida que se incrementa la temperatura disminuye de manera genérica la cantidad de sustancia adsorbida y se incrementa la presión (Gregg and Sing, 1982). Por otro lado, al comparar el comportamiento de las diferentes sustancias a una misma temperatura, al aumentar la masa molecular de la sustancia ácida, se incrementa la presión pero se disminuye la sustancia adsorbida. Los diferentes cromatogramas obtenidos se usaron en la interpretación de la cantidad de sustancia adsorbida contra la presión ejercida por el suelo y se aplicó el método gravimétrico, para construir las isotermas de adsorción para agua y los ácidos estudiados. Todos los ácidos (adsorbatos) se ensayaron a diferentes temperaturas (Figuras 4-5) y fueron tratados mediante los modelos de Freundlich, Langmuir y Henry. En estos estudios se nota una interacción favorable de los ácidos carboxílicos y el suelo agrícola. Los valores de las constantes de Freundlich, Langmuir y Henry se pueden observar en el Cuadro 3.
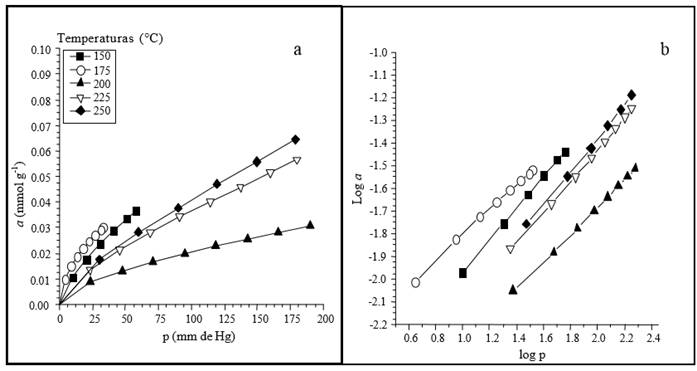
Figura 4. a) Isotermas de adsorción de ácido etanoico con suelo agrícola a diferentes temperaturas (°C) y b) forma lineal de la ecuación Freundlich.

Figura 5. a) Isotermas de adsorción de ácidos carboxílicos y agua con suelo agrícola a 473 K y b) forma lineal de la ecuación Freundlich.
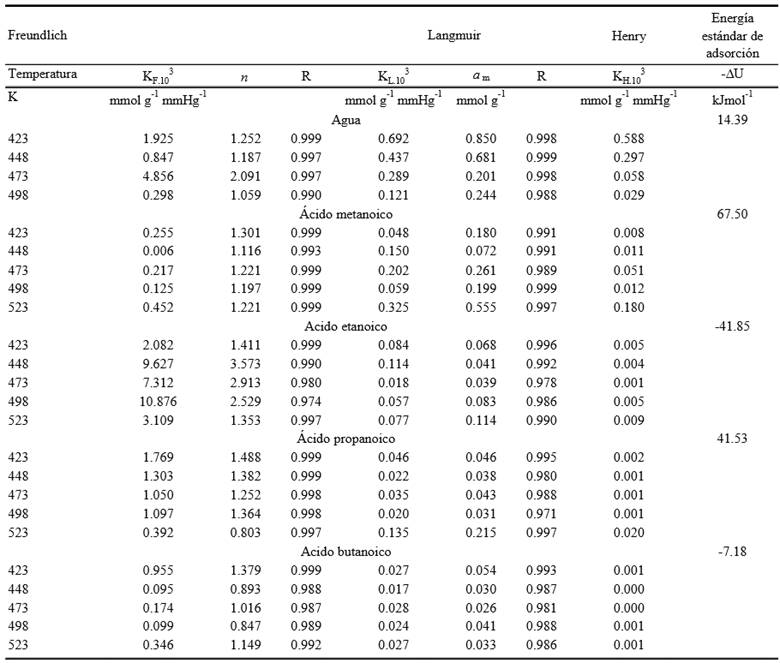
KF = constante de Freundlich; KL = constante de Langmuir; KH = constante de Henry; n y am = constantes empíricas; R = coeficiente de correlación. - ∆U = energía interna de adsorción.
Cuadro 3. Constantes de Freundlich, Langmuir y Henry para agua y ácidos carboxílicos en suelo agrícola de San Juan Atenco, Puebla, México.
Al determinar el coeficiente de correlación lineal de las ecuaciones evaluadas, se observó que para el caso del agua, no existen diferencias considerables en los ensayos con temperaturas disímiles (423-498 K), ya que tanto en la ecuación de Freundlich (log a contra log p) como en la de Langmuir (1/a contra 1/p), se tuvieron coeficientes de correlación (R) entre 0.997 y 0.999, lo cual no se repitió en las muestras de ácidos. Con los ácidos metanoico, etanoico, propanoico y butanoico, se obtuvieron mayores coeficientes de correlación con el tratamiento de Freundlich. Una particularidad de este comportamiento se presentó con el ácido acético, el cual tuvo mejor correlación con Langmuir a 498 K lo que podría estar relacionado con la interacción de los ácidos carboxílicos con la superficie del suelo, ya que la ecuación de Langmuir considera la interacción de las uniones unimoleculares y la de Freundlich es una ecuación empírica de interacción de la sustancia adsorbida con el adsorbente (suelo), lo que puede estar relacionado con la disposición de elementos en el suelo, como se ha demostrado previamente para fósforo y mercurio (Khan et al., 2009; Jinga et al., 2007), indicando que la presencia de ácidos genera la disponibilidad de esos elementos (Ferreira y Ferraciú, 2007).
Conclusiones
La estructura porosa del suelo agrícola se estimó por la adsorción de N2 a su temperatura de ebullición. Los valores obtenidos tanto de la superficie específica como del tamaño de poros, sugieren adsorciones preferenciales de los compuestos orgánicos volátiles. Se han determinado las isotermas de adsorción de los ácidos carboxílicos en suelo agrícola de San Juan Atenco mediante el método cromatográfico. Las ecuaciones de Langmuir y Freundlich fueron aplicadas con éxito, encontrándose que los mayores valores corresponden al agua seguida de los valores de los ácidos carboxílicos de menor a mayor masa molecular. La combinación de los métodos de adsorción de N2 y cromatografía de gases, son herramientas muy poderosas para estudiar y evaluar el grado de adsorción/interacción entre distintos adsorbatos y el suelo.











 nueva página del texto (beta)
nueva página del texto (beta)