Introducción
La fruticultura es una actividad agrícola muy importante, no obstante, en la mayoría de las zonas frutícolas de México el cultivo de papaya (Carica papaya L.) aun no ha alcanzado el desarrollo deseado a pesar de que su producción tiene un alto valor económico (2600 millones de pesos anuales) (SIAP, 2011), debido a los numerosos problemas que enfrenta. Entre los más relevantes están la baja productividad, causada por diversos factores entre los que sobresalen la fitosanidad (plagas y enfermedades), fisiológicos (semillas mejoradas, distribución de plantas femeninas y masculinas) y nutrimentales. Sin embargo, existe información que podría ayudar a enfrentar la problemática y proporcionaría solución a estas situaciones, por ejemplo, Mamatha et al. (2002) reportan que plantas de papaya en campo fertilizadas únicamente con la mitad de la dosis de fósforo e inoculadas con Glomus mosseae [(Nicol. & Gerde.) Gerdemann & Trappe] y Gl. caledonium [(Nicol. & Gerde.) Gerdemann & Trappe], mantienen un mismo crecimiento, lo cual podría implementarse en los huertos de papaya.
El uso excesivo de fertilizantes químicos para aumentar la productividad de los cultivos, a menudo, tiene como consecuencia la contaminación de suelos y aguas, lo que ocasiona degradación de estos recursos naturales. Diversos microorganismos, como las rizobacterias promotoras de crecimiento y los Hongos Micorrízicos Arbusculares (HMA), son componentes microbiológicos del suelo que pueden utilizarse como inoculantes para mejorar la salud y la nutrición de las plantas. Estudios con bacterias u hongos y nutrimentos han mostrado que los HMA pueden aumentar la absorción de elementos nutritivos por las plantas e incrementar la eficiencia en el uso de fertilizantes, tanto químicos como orgánicos. Con esta práctica, se puede eliminar o disminuir en gran proporción la cantidad de fertilizante aplicado al suelo (Adesemove y Kloepper, 2009). El fósforo (P) es uno de los macronutrimentos que los organismos necesitan para desempeñar funciones vitales. Éste es un elemento estructural de los ácidos nucleícos, fosfolípidos y diversas enzimas y coenzimas, además de estar involucrado en el metabolismo energético, activación de metabolitos intermedios, cascadas de transducción de señales y regulación de enzimas (Karandashov y Bucher, 2005). Lo anterior es fundamental en la nutrición vegetal y aunque la mayoría de los suelos contienen grandes cantidades, no está disponible para las plantas, debido a que se encuentra en forma insoluble o es inmovilizado por precipitación o adsorción debido a su alta reactividad con algunos complejos metálicos como Fe, Al y Ca (Igual et al., 2001; Gyaneshwar et al., 2002). Esto ocasiona la necesidad de adicionar a los suelos agrícolas, cantidades considerables de dicho elemento para la buena nutrición de los cultivos. En el suelo, el P puede estar presente tanto en forma inorgánica (Pi) como orgánica (Po), y su disponibilidad depende de factores como pH, humedad, profundidad y presencia de microorganismos. Por otra parte, las plantas han desarrollado estrategias para adquirir o hacer más eficiente el uso del P presente en el suelo, dichas adaptaciones incluyen modificaciones en la estructura y en la morfología de la raíz, así como, cambios bioquímicos a nivel de los exudados radicales y mecanismos moleculares que incluyen transportadores de P, conformados por proteínas especializadas (Plassard y Dell, 2010). La simbiosis con HMA es otra estrategia que la mayoría de las plantas utiliza para capturar y absorber mejor el P, las hifas extrarradicales del hongo simbiótico desempeñan un papel fundamental, al explorar el suelo hasta donde las raíces no son capaces de llegar. En algunos suelos, el Po constituye una fracción importante del P total; sin embargo, se ha mostrado que las hifas micorrízicas exploran grandes volúmenes de suelo para absorber el Pi. Koide y Kabir (2000) reportaron que los HMA pueden absorber el Po directamente, al ser capaces de secretar fosfatasas extracelulares. Para mostrarlo, dichos investigadores realizaron experimentos en un sistema zanahoria-micorriza in vitro, libre de otros microorganismos que pudieran hidrolizar el Po y liberarlo como Pi, lo que causaría interferencia en sus resultados. De esta manera, mostraron que las hifas extrarradicales del HMA Gl. intraradices (Schenck & Smith) pueden hidrolizar el Po y, por lo tanto, el Pi resultante puede ser absorbido y transportado hacia las raíces de la planta hospedera. Asimismo, existen estudios que señalan la presencia y activación de transportadores de Pi en hongos (Pi:H+ y Pi:Na+). En trabajos realizados con levadura se ha demostrado que estas proteínas transportadoras son codificadas por los genes PHO84 (Bun-Ya et al., 1991) y PHO89 (Martinez y Persson, 1998) y que su expresión se activa cuando las células detectan limitación de Pi externo (Persson et al., 2003). En los HMA, el primer transportador de P involucrado en la absorción de Pi por las plantas se identificó en Gl. versiforme [(Karsten) Berch], asociado con Medicago truncatula (Gaertn). Cuando en levadura se expresó un mutante PHO84 (transportador nombrado GyPT) del hongo, los resultados mostraron actividad para transportar Pi (Harrison y Van-Buuren, 1995). Otros transportadores de Pi de tipo GyPT se han identificado en los HMA Gl. mossae y Gl. intraradices. Los transcritos correspondientes a estos transportadores de Pi se localizaron en hifas extrarradicales e intrarradicales; estos transcritos aumentaron sus niveles de expresión cuando había baja disponibilidad de P (Maldonado-Mendoza et al., 2001; Benedetto et al., 2005). Dichos resultados muestran que las hifas de los HMA realizan transporte del exterior (suelo) hacia el interior de las raíces de las plantas y que la mayor actividad de los transportadores se realiza cuando el P del suelo es bajo. Por otro lado, algunos estudios sobre la interacción HMA, P y plantas de papaya indican un efecto positivo de la inoculación de HMA sobre las plantas sin embargo, la interacción con el P varía según la cantidad del elemento presente en el suelo, por ejemplo Martin et al. (1999) encontraron que en condiciones nutrimentales no limitantes, en sustrato orgánico, los HMA no estimulan el crecimiento de papaya, mientras que Mohandas (1992) y Rodríguez-Romero et al. (2011) mostraron que a niveles bajos de P la inoculación de HMA en papaya propicio un incremento en sus parámetros de crecimiento. Estos reportes muestran la capacidad de los HMA para capturar, solubilizar y transportar P del suelo hacia la planta. De acuerdo con los antecedentes anteriores el objetivo de esta investigación fue estudiar el efecto de un inoculante microbiano con base en HMA, sobre variables de crecimiento y productividad de plantas de papaya, además de observar como el establecimiento de la simbiosis HMA-papaya aumenta la disponibilidad de P para las plantas, dependiendo de la fuente y dosis empleadas.
Materiales y métodos
El experimento se realizó en el área de invernadero de la Unidad de Capacitación para el Desarrollo Rural (UNCADER), localizada en el municipio de Coatepec, Veracruz. El análisis micorrízico se hizo en la Facultad de Ciencias Agrícolas de la Universidad Veracruzana, Campus Xalapa. Los materiales biológicos utilizados fueron semillas de papaya (Carica papaya L.) y la cepa de Hongos Micorrízicos Arbusculares (HMA) Glomus sp. Zac-2, aislada, caracterizada e identificada en el Área de Microbiología, del Colegio de Postgraduados.
Selección, Tratamiento y Germinación de Semillas de Papaya
Las semillas de papaya utilizadas fueron de frutos totalmente desarrollados y maduros, con buenas características en tamaño, forma y color, provenientes de plantas madre sanas y vigorosas de un huerto de papaya del municipio Emiliano Zapata, Veracruz. Una vez extraídas y seleccionadas, las semillas se lavaron y se les eliminó por presión la capa mucilaginosa. Después se secaron a la sombra y se les aplicó Benomyl® en forma espolvoreada (5 g 100 semillas-1), para evitar su contaminación con hongos patógenos. La germinación de las semillas se realizó en charolas germinadoras de plástico, previamente desinfectadas con formol al 2%, utilizando como sustrato tezontle fino estéril (calor húmedo a 121 °C en autoclave a 1.3 kg cm-2 durante 4 h).
Preparación del Sustrato y Condiciones de Crecimiento de Plantas en Vivero
El sustrato consistió en una mezcla de suelo de un huerto de papaya del municipio Emiliano Zapata, Veracruz y arena de banco, en una proporción 2:1 v/v, respectivamente. La mezcla se trató con bromuro de metilo (907.2 g m-3) (Calderón, 1991; Quiñones-Aguilar et al., 1998). Las características del sustrato fueron: textura arena migajonosa, pH 6), contenido de materia orgánica 5.4%, contenido de N-P-K 0.24, 8.4 y 65.5 mg kg-1 respectivamente. Se utilizaron bolsas negras de polietileno para frutal con capacidad de 4 kg; éstas se perforaron en el fondo con 12 círculos de 6 mm de diámetro para permitir un buen drenaje. Cada bolsa se llenó con el sustrato dejando de 3 a 4 cm de espacio libre para el riego.
Fertilización Fosfatada
Como fuentes de P se emplearon superfosfato triple (SFT, P = 46%), superfosfato simple (SFS, P = 21%) y roca fosfórica (RF, P = 15-20%). El fertilizante se aplicó antes de la inoculación y el trasplante, de acuerdo a cada tratamiento; el sustrato se mezcló con su respectiva fuente y dosis de P.
Trasplante, Inoculación y Manejo de Plántulas en Vivero
Después de la germinación de las semillas, las plántulas con similar crecimiento, y cuando tenían dos hojas verdaderas, se trasplantaron a las macetas, previamente humedecidas (una plántula por contenedor). Al momento del trasplante y cuando lo requerían, de acuerdo con el tratamiento, cada plántula se inoculó en su sistema radical con 10 g de arena-inóculo con propágalos micorrízicos de Glomus sp. Zac-2, raíces con una colonización por el HMA de 80%, determinada por la técnica propuesta por Phillips y Hayman (1970) y aproximadamente nueve esporas por g de suelo. Al inicio del experimento, las plántulas se regaron con agua cada tercer día, (200 mL por maceta), a fin de mantenerlas húmedas. Posteriormente, los riegos se hicieron de acuerdo con las necesidades hídricas de las plantas, tratando de mantener el sustrato de los recipientes con suficiente humedad.
Diseño Experimental y Análisis Estadístico
Se estableció un arreglo factorial en un diseño completamente al azar. Los factores y niveles estudiados fueron: 1) inoculación con HMA (Glomus sp. Zac-2), con dos niveles, con y sin inoculación; 2) fuente de P, con tres niveles, SFT, SFS y RF; 3) dosis de fertilización fosfatada, con cuatro niveles, 0, 30, 60 y 90 mg kg-1. Se generó un experimento trifactorial mixto (2 × 3 × 4), con un total de 24 tratamientos y 10 repeticiones por cada uno; la unidad experimental fue cada contenedor con una planta. Las variables de respuesta se analizaron mediante análisis de varianza factorial con un nivel de significancia de P ≤ 0.05 y pruebas de separación de medias con Tukey (P ≤ 0.05) mediante el programa estadístico SAS (1988).
Variables de Respuesta
A los 90 días se determinaron las variables de respuesta: altura de planta (AP con una regla graduada en cm); diámetro del tallo (DT medido en mm con un vernier en la base del tallo); volumen radical (VR por volumen desplazado en probeta de acuerdo con tamaño de raíz en cm3); área foliar (AF) en cm2, mediante un integrador automático del área foliar (LI-3100); peso seco del follaje (PSF) y raíz (PSR) en g, previo secado en estufa (72 °C) hasta peso constante; porcentaje de colonización micorrízica (PCM), para lo cual las raíces fueron clareadas y teñidas mediante una combinación de las técnicas propuestas por Phillips y Hayman (1970) y Kormanik et al. (1980). Para estimar el PCM se utilizó la técnica propuesta por Mc.Gonigle et al. (1990).
Resultados y discusión
Efecto de la Inoculación con HMA en el Crecimiento de las Plantas de Papaya
De manera general, 90 días después de establecido el experimento las plantas inoculadas con HMA presentaron un mayor crecimiento que las plantas sin inocular, este efecto se confirmó con diferencias estadísticas significativas (Tukey, P ≤ 0.05) en todas las variables de respuesta analizadas (Cuadro 1). Se encontraron incrementos en el crecimiento de las plantas inoculadas con HMA, con respecto a sus testigos sin inocular, 486.51% para AP, 594.31% para DT, 1084.61% para AF, 6962.35% para VR, 13 591.43% para PSR y 4992.03% para PSF. En la Figura 1 se observan las diferencias contrastantes entre las plantas de papaya de la misma edad, con y sin inocular. Estos resultados muestran que las raíces de la papaya son capaces de asociarse y establecer una fuerte simbiosis con los HMA, lo que favorece su crecimiento y desarrollo. Efectos similares se han reportado para papaya y otros cultivos, Quiñones-Aguilar et al. (1998) reportaron que al inocular plantas de papaya con Glomus sp. Zac-2 y Gl. aggregatum (Schenck & Smith) FS-39 en suelo y en sustrato con humus de pulpa de café se obtuvieron incrementos en el crecimiento de las plantas desde 400 hasta 1000%; sin embargo, cuando el humus provenía de cachaza de caña no hubo diferencias significativas en el crecimiento de las plantas, probablemente debido al alto contenido de nutrimentos del sustrato. Por otro lado, Ferguson y Menge (1986) al determinar la respuesta en vivero de plantas de cítricos cultivadas en un sustrato fumigado e inoculadas con Gl. deserticola (Trappe, Bloss & J.A. Menge), encontraron que las plantas micorrizadas presentaron incrementos en crecimiento desde 366 hasta 586%. En el presente estudio, las diferencias significativas en crecimiento observadas en plantas inoculadas con Glomus sp. Zac-2 y no inoculadas muestran el efecto benéfico que los HMA proporcionan a las plantas en sus primeras etapas de crecimiento, como lograr un mejor aprovechamiento de los nutrimentos presentes en el suelo, además de proporcionarles una mejor captura y absorción de aquellos elementos nutritivos poco disponibles, como lo menciona Bolan (1991). Los resultados del presente estudio sugieren que en el sustrato los nutrimentos estuvieron más fácilmente disponibles para las plantas, debido al establecimiento de la simbiosis planta-HMA, ya que plantas sin micorrizar crecieron poco o incluso no lograron continuar su crecimiento, más allá del que presentaban cuando se trasplantaron. Esto muestra con claridad que las plantas por si solas no fueron capaces de adquirir los nutrimentos presentes en el sustrato donde se establecieron. Koide y Kabir (2000) mencionan que por medio de sus hifas y la secreción de fosfatasas extracelulares los HMA son capaces de capturar, transportar y solubilizar los elementos nutritivos poco disponibles en el suelo. Además de la presencia de transportadores de P en el hongo simbionte, los cuales se activan cuando en el medio el P es escaso (Karandashov y Bucher, 2005; Javot et al., 2007). Los resultados muestran que las plantas únicamente fertilizadas con P, no continuaron su crecimiento o tuvieron un crecimiento mínimo. Esto confirma que en sustratos tratados con sustancias microbicidas para eliminar microorganismos fitopatógenos también se eliminan todos los elementos biológicos benéficos del sistema edáfico, por lo que deberían tratarse con inoculantes microbianos para restituir la flora microbiana benéfica. El tratamiento de los sustratos con métodos de esterilización se realiza principalmente en viveros para evitar la transmisión de enfermedades por fitopatógenos del suelo. Actividad necesaria para impedir que las plantas propagadas mueran por infección o la porten al ser trasplantadas a campo; una alternativa es emplear HMA, los cuales, además de funcionar como biofertilizantes y acelerar el crecimiento de las plantas en vivero, evitarían el uso de otros fertilizantes. Diversos estudios han revelado que los HMA protegen a las plantas contra factores adversos como contaminación. Los HMA permiten la supervivencia de las plantas en presencia de contaminantes (Leyval y Binet, 1998); sequía, al incrementar el uso eficiente del agua en zonas secas (Augé, 2001); y enfermedades, donde además de protegerlas, actúan como agentes de biocontrol de algunos fitopatógenos (Fritz et al., 2006; Kapoor, 2008; Al-Askar y Rashad, 2010). En el presente estudio, además de las diferencias significativas mostradas en el crecimiento de las plantas inoculadas con las no inoculadas, estas últimas presentaron fuertes síntomas de enfermedades foliares, lo cual provocó en algunas plantas una defoliación completa (datos no mostrados).

HMA = hongos micorrízicos arbusculares. † Letras distintas en la misma columna indican diferencias significativas, según la prueba de Tukey (P ≤ 0.05). AP = altura de planta, DT = diámetro de tallo, AF = área foliar, VR = volumen radical, PSR = peso seco radical, PSF = peso seco de follaje.
Cuadro 1 Efecto de la inoculación con Hongos Micorrízicos Arbusculares (HMA) Glomus sp. Zac-2 en el crecimiento de plantas de papaya, 90 días después de establecido el experimento en invernadero.
Efecto de la Fuente y Dosis de Fósforo en el Crecimiento de las Plantas de Papaya
En el factor fuente de P se encontraron diferencias significativas (Tukey, P ≤ 0.05) para las variables de respuesta VR, PSR y PSF; la aplicación de SFT y SFS presentaron valores altamente significativos (Cuadro 2). El SFT y el SFS son fuentes de P más solubles en agua, debido a que su fosfato se encuentra en forma disponible y es de acción rápida; en cambio en la roca fosfórica, el fosfato insoluble es de liberación lenta (Tamhane et al., 1979). La roca fosfórica, sólo es soluble en suelos ácidos (Asmah, 1995; González-Chávez y Ferrera-Cerrato, 2000); ante esto, es conveniente señalar que el sustrato utilizado en este estudio presentó un pH ligeramente ácido (6.6). Probablemente por esta característica de acidez, en algunas de las variables evaluadas no hubo diferencias cuando se analizaron por fuente de P, como en el caso de AP y DT. La utilización de fuentes de P más económicas, como la roca fosfórica aunque poco solubles como la RF podrían utilizarse, siempre y cuando se usen sustratos ligeramente ácidos o en combinación con HMA que tienen la capacidad de solubilizar el P, por medio de las fosfatasas secretadas por dichos hongos simbióticos (Koide y Kabir, 2000). En este sentido Mohandas (1992) muestra que en plantas inoculadas con Gl. mossae y Gl. fasciculatum [(Thaxt.) Gerd. & Trappe] la actividad fosfatasa tanto ácida como alcalina en raíces de plantas de papaya, fue significativamente mayor que en plantas sin micorrizar, obteniéndose una mayor actividad enzimática en raíces de plantas inoculadas con Gl. mossae. Por lo que en este estudio, plantas inoculadas con Glomus sp. Zac-2 podrían tener buena actividad fosfatasa, permitiendo una mayor solubilización del P a partir de la roca fosfórica, razón por la cual en AP y DT no hubo diferencias estadísticamente significativas con respecto a SFT y SFS.
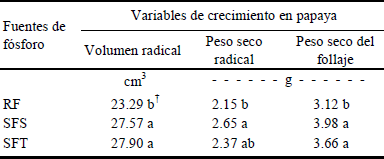
RF = roca fosfórica, SFS = superfosfato simple, SFT = superfosfato triple. † Letras distintas en la misma columna indican diferencias significativas, según la prueba de Tukey (P ≤ 0.05).
Cuadro 2 Efecto de la fuente de fósforo (P) en el crecimiento de las plantas de papaya, 90 días después de establecido el experimento en invernadero.
Con respecto al factor dosis de fertilización, resultaron diferencias significativas en todas las variables de respuesta evaluadas (Tukey, P ≤ 0.05) (Cuadro 3). En la mayoría de las variables, los valores más altos se obtuvieron con la aplicación de 90 mg kg-1 y decrecieron conforme al decremento de la dosis; los valores más bajos se obtuvieron cuando no se aplicó P. Sin embargo, para las variables de respuesta de la parte aérea de las plantas (AF y PSF) no se presentó esta tendencia. En este sentido, un adecuado suministro y absorción de P en las primeras etapas de crecimiento de la planta es importante para su fisiología, porque es en esta etapa donde el P juega un papel indispensable para el potencial desarrollo de las plantas. El P también se ha asociado con la madurez precoz de los cultivos y su carencia está acompañada por una marcada reducción del crecimiento de la planta; un buen suministro está siempre asociado con un incremento en el desarrollo de las raíces y con la resistencia a enfermedades, debido a que es un elemento esencial y constituyente en los procesos de transferencia de energía vitales para el crecimiento celular (Tisdale y Nelson, 1988). Esto manifiesta la trascendencia de la micorrización en el mejor aprovechamiento de los nutrimentos del suelo.
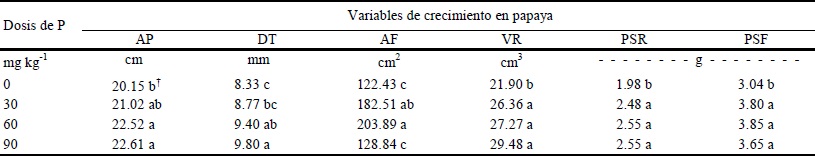
AP = altura de planta, DT = diámetro de tallo, AF = área foliar, VR = volumen radical, PSR = peso seco radical, PSF = peso seco de follaje. † Letras distintas en la misma columna indican diferencias significativas, según la prueba de Tukey (P ≤ 0.05).
Cuadro 3 Efecto de la dosis de fertilización fosfatada sobre el crecimiento de plantas de papaya, 90 días después de establecido el experimento en invernadero.
Efecto de la Interacción entre la Fuente de Fósforo y los HMA
Las principales interrogantes planteadas al inicio de este estudio fueron: el establecimiento de la interacción simbiótica entre Glomus sp. Zac-2 y las plantas de papaya, ¿mejora la nutrición de las plantas y se refleja en un mayor crecimiento vegetal? ¿Un aumento en el desarrollo de las plantas micorrizadas se debe a una mayor disponibilidad de P presente en el sustrato? La respuesta a ambas preguntas fue positiva, ya que las variables de crecimiento evaluadas, entre plantas inoculadas con HMA y fertilizadas con P, y plantas sin inocular y también fertilizadas, presentaron diferencias significativas (Cuadro 4). Esto demuestra que Glomus sp. Zac-2 está implicada en la captación, absorción y movilización del P hacia la planta y probablemente de los demás nutrimentos presentes en el sustrato empleado. Los resultados de este estudio son contundentes, dado que las plantas de papaya fertilizadas con P sólo fueron capaces de utilizarlo en presencia de los HMA, lo cual es claro al observar el desarrollo de las plantas en ambas condiciones (Figura 1).
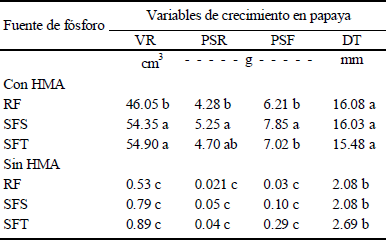
HMA = hongos micorrízicos arbusculares. VR = volumen radical, PSR = peso seco radical, PSF = peso seco de follaje, DT = diámetro de tallo, RF = roca fosfórica, SFS = superfosfato simple, SFT = superfosfato triple. † Letras distintas en la misma columna indican diferencias significativas, según la prueba de Tukey (P ≤ 0.05).
Cuadro 4 Efectos de la interacción entre los factores fuentes de fósforo (P) e inoculación micorrízica en variables de crecimiento en plantas de papaya, 90 días después de establecido el experimento en invernadero.
El crecimiento de las plantas de papaya se incrementó significativamente cuando éstas se inocularon y la intensidad de este efecto se modificó por la fuente de P empleada como fertilizante. Este resultado muestra una interacción significativa (Tukey, P ≤ 0.05) para las variables de respuesta VR, PSR, PSF y DT (Cuadro 4), sin embargo, para las demás variables evaluadas (altura de planta y área foliar), la interacción no fue significativa. Con las diferentes fuentes de P y en presencia de HMA, se observa que para VR, PSR PSF y DT los valores estadísticamente más altos se lograron con aplicación de SFS. Esto sugiere que la fuente de P modificó el efecto de los HMA. El SFS o SFT mostraron una tendencia de mayor impacto sobre las variables observadas, en comparación con la RF en presencia de HMA. Finalmente, en ausencia de HMA ninguna fuente de P para las diferentes variables evaluadas, mostró diferencias significativas, lo cual sugiere la poca capacidad de las plantas de papaya para absorber el P. Resultados similares reportaron Alarcón y Ferrera-Cerrato (2003), quienes mencionan que plantas de Citrus volkameriana Tanq & Pasq, inoculadas con el grupo micorrízica Glomus sp. Zac-19, presentaron una condición micotrófica obligada, la cual no permite que la adición de fertilizantes fosfatados al sustrato aporte mayor beneficio en el crecimiento de las plantas, a menos de que los HMA se inoculen, trabajos similares en papaya respecto al efecto positivo en parámetros del crecimiento de la planta por efecto de diversas especies de Glomus en condiciones variantes de P (desde 18 hasta 3680 mg kg-1) han sido reportados por Rodríguez-Romero et al. (2011) y Mohandas (1992). El P es un macronutrimento esencial para la vida, ya que es componente de varias moléculas clave, como los ácidos nucleícos, los lípidos y el ATP, además de estar involucrado en el control de reacciones enzimáticas y la regulación de rutas metabólicas (Karandashov y Bucher, 2005). En consecuencia, las plantas no pueden crecer sin el suministro adecuado de este elemento, hecho que se manifiesta en plantas sin micorrizar. Distintos reportes (Bolan, 1991; Marschner y Dell, 1994; Mohandas, 1992; Rodríguez-Romero et al., 2011) muestran que los HMA participan activamente en la captura y absorción de P por las plantas y que estos hongos son importantes, sobre todo en suelos pobres en Po y aun en suelos ricos, pero no disponible para las plantas. Carreón-Abud et al. (2007) encontraron que arbustos de mora (Rubus fruticosus var. Brazos) inoculados con HMA, presentaron una mayor concentración de P en la parte foliar, con respecto a moras sin micorrizar, a partir de los 30 días después de iniciado el experimento, condición que aumentó hasta en 80% al finalizar el experimento a los 120 días. Estos resultados ponen en claro que uno de los principales efectos de la inoculación con HMA en las plantas es el aumento en la capacidad de absorción de P, por la actividad directa del micelio extramatricial que permite la exploración de un mayor volumen de suelo.
Algunos reportes científicos muestran la existencia de transportadores de P, tanto en las plantas como en las hifas simbióticas de los hongos micorrízicos (Schachtman et al., 1998; Rausch y Bucher, 2002; Ezawa et al., 2002), sin embargo, en plantas micorrizadas, los transportadores de P localizados en el hongo simbiótico son mucho más eficientes que aquéllos presentes en la planta. Lo anterior lo demostraron Smith et al. (2003), quienes revelaron la existencia de dos vías para la absorción de P por plantas: la “vía directa”, que comprende la captación de P en la interface suelo-planta, a través de la epidermis de la raíz y de los pelos radicales, y la denominada “vía micorrízica”, donde la captación de P se lleva a cabo por medio del micelio del hongo. Cuando las plantas están micorrizadas, los transportadores de P, localizados en la planta pierden su función, dejando paso a los transportadores de P localizados en las hifas fúngicas. Dicha pérdida podría estar relacionada, entre otros factores, con los efectos de la interacción planta-hongo, lo que ocasiona cambios en la regulación de genes codificantes por los transportadores de P en las plantas (Liu et al., 1998; Rosewarne et al., 1999; Chiou et al., 2001; Smith et al., 2003). Por otro lado, la aplicación de P en gran proporción a suelos agrícolas es necesaria, debido a la baja disponibilidad del elemento; el uso de fuentes más económicas, como la roca fosfórica, ha sido una alternativa sobre todo en suelos ácidos, donde aumenta la solubilidad del P (Asmah, 1995; González-Chávez y Ferrera-Cerrato, 2000); considerando que las zonas papayeras mas importantes de México, Veracruz y Chiapas (SEDER, 2012), están ubicadas en regiones con problemas de suelos ácidos (Tosquy et al., 2008; Buerkert et al., 1990), el uso de RF podría ser una alternativa viable junto con la inoculación de HMA en el manejo agronómico del cultivo. De esta forma, el efecto en el crecimiento de las plantas puede variar, de acuerdo con la fuente de P, debido principalmente a la solubilidad que tenga el elemento, dependiendo de su origen, factor que puede reflejarse en la disponibilidad del nutrimento para las plantas.
Efecto de la Interacción entre la Dosis de Fósforo y los HMA
La simbiosis micorrízica arbuscular está centrada en el intercambio de nutrientes que existe entre el hongo y la planta; los HMA son simbiontes obligados por el carbono suministrado por las plantas, a cambio de esto, los HMA mejoran la nutrición mineral de éstas, en particular la adquisición de P (Smith y Read, 1997; Bonfante y Genre, 2010) y otros elementos nutritivos presentes en el suelo (Marschner y Dell, 1994; Parniske, 2008). La recíproca transferencia de nutrimentos es necesaria para el buen funcionamiento de la simbiosis. Algunos reportes indican que los HMA juegan un papel significativo sobre todo en suelos pobres en P o suelos con nutrimentos poco disponibles (Bolan, 1991; Marschner y Dell, 1994), en el cultivo de papaya se ha reportado la interacción negativa de los HMA con altas dosis de P (Constantino et al., 2010; Sangabriel et al., 2010) y la positiva con dosis bajas (Mohandas, 1992; Rodríguez-Romero et al., 2011), en consecuencia, se planteó la pregunta: ¿la dosis de P juega un papel significativo en la disponibilidad de P para las plantas micorrizadas? En el Cuadro 5 se presentan los resultados que dan respuesta a esta interrogante. En dicho cuadro se aprecian dos aspectos interesantes: 1) la ausencia de HMA influyó de manera negativa en las variables evaluadas y 2) el crecimiento de las plantas se acrecentó por la inoculación micorrízica; sin embargo, la dosis de fertilización influyó en la variación de dicha respuesta, se presentó interacción entre ambos factores para las variables VR, PSR y PSF (Tukey, P ≤ 0.05). No obstante, para las otras variables evaluadas (AP, DT, y AF), la interacción no fue significativa, por lo que el principal efecto se atribuye a la micorrización de las plantas.
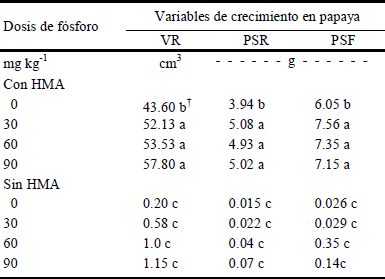
VR = volumen radical, PSR = peso seco radical, PSF = peso seco de follaje, HMA = hongos micorrízicos arbusculares. † Letras distintas en la misma columna indican diferencias significativas, según la prueba de Tukey (P ≤ 0.05).
Cuadro 5 Comportamiento de la interacción entre los factores dosis de fertilización e inoculación micorrízica en variables de crecimiento en plantas de papaya, 90 días después de establecido el experimento en invernadero.
Cuando las plántulas de papaya se inocularon su crecimiento se modificó por la acción concomitante tanto de la dosis de P como de la inoculación con HMA. Por otro lado, la dosis de fertilización con P no influyó en plantas sin inocular, ya que no hubo diferencias significativas para las variables de respuesta estudiadas. Es importante recalcar que papayos inoculados y sin fertilizar mostraron diferencias significativas con respecto a plantas únicamente fertilizadas. Esto demuestra que la inoculación de las plantas con dichos microorganismos puede tener implicaciones económicas importantes en el manejo agronómico del cultivo cuando se propaga en vivero y su posterior trasplante a campo, actividad que puede representar un beneficio económico al suprimir o disminuir la dosis de fertilización en esta etapa, aunado a una disminución de la estancia en vivero de las plántulas, lo cual economizaría espacio. La inoculación de plántulas de papaya al momento del trasplante a campo, podría ser una opción viable, sin embargo, la competencia con otros microorganismos del suelo, tanto fitopatógenos como benéficos por colonizar la raíz al mismo tiempo, significaría un riesgo sí éstas son infectadas. La utilización de recursos microbianos como biofertilizantes o como elementos de bioprotección vegetal representan un mayor respeto por el ambiente, al generarse una producción agrícola sustentable, conservar la fertilidad natural del suelo y evitar su contaminación, lo que tendría un impacto ambiental positivo. Además, un producto alimenticio con estas características podría tener una mejor oportunidad de comercialización en otros nichos de mercado como productos provenientes de la agricultura orgánica o biológica, los cuales tienen un sobreprecio promedio de entre 20 y 30% (Kolmans y Vásquez, 1999) respecto a los productos de la agricultura convencional.
Efecto de la Fuente y la Dosis de Fósforo en el Establecimiento de la Simbiosis Micorrízica
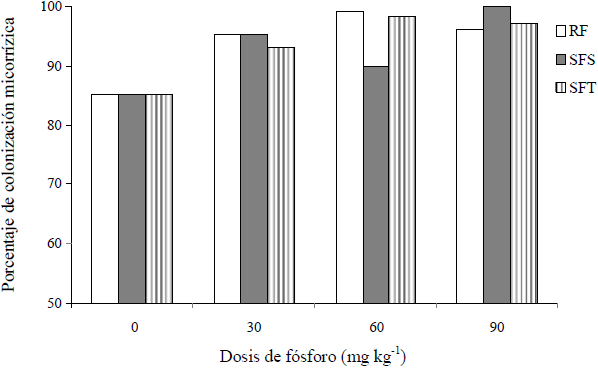
El porcentaje de colonización micorrízica (PCM) se determinó 90 días después de establecido el experimento, con la finalidad de conocer el efecto de la fuente y dosis de P en el establecimiento de la simbiosis planta-HMA. En la Figura 2 se observa el PCM generado por la cepa Glomus sp. Zac-2 en los distintos tratamientos. Estos resultados muestran que Glomus sp. Zac-2 es una cepa muy eficiente, ya que colonizó las raíces de las plantas de papaya y estimuló el crecimiento vegetal mejorando la adquisición de P del suelo. Los PCM fueron en todos los casos, arriba de un 85%; el mayor se presentó cuando se adicionaron 90 mg kg-1 de SFS, seguido por 60 mg kg-1 de SFT, esto sugeriría que la colonización de las raíces de papaya por Glomus sp. Zac-2 se favorece por la adición de P en dosis relativamente altas (90 mg kg-1), sin embargo, a dosis mayores de 400 kg ha-1 (aproximadamente 3600 mg kg-1) no existe colonización de papaya en campo (Sangabriel et al., 2010). Por el contrario, porcentajes de colonización menores a 85% fueron observados en plantas inoculadas sin adición de P. Esto pareciera contradictorio, ya que diversos autores (Constantino et al., 2010; Sangabriel et al., 2010) reportan que la adición de P en dosis altas en papaya afecta el desarrollo de la micorrización, con lo cual se reduce la proporción de raíz colonizada, por otro lado Koide (1991) indica esto mismo en otras especies vegetales. Aunque se han propuesto diversas hipótesis, el mecanismo no es claro, este efecto pareciera depender de la interacción endófito-hospedante. Sieverding y Howeler (1985) encontraron ciertas especies de HMA nativos que son diferentes en cuanto a la tolerancia a altos niveles de P, como Gl. manihotis (R.H. Howeler, Sieverd. & N.C. Schenck), el cual incrementó el porcentaje de colonización al aumentar los niveles de P en el suelo. Dicho resultado indica la existencia de HMA tolerantes al fósforo o que se ven favorecidos por este elemento. Por otro lado, Timmer y Leyden (1980) mencionan que el porcentaje de colonización y número de esporas micorrízicas en el suelo, no son afectados por el suministro de P. La concentración de P del sustrato empleado en este estudio fue baja (8.4 mg kg-1); al respecto, Sieverding (1991) indica que al aplicar P a razón de 50 kg ha-1 (aproximadamente 450 mg kg-1) mejora la actividad micorrízica en suelos con bajo contenido de este elemento. Baon et al. (1983) mostraron que la presencia de los HMA en suelos pobres en P fue importante para que las plantas pudieran absorber el P presente en el sustrato. Este resultado tiene aplicaciones inmediatas en agronomía, dado que suelos pobres en P podrían inocularse con HMA, para aumentar la capacidad del cultivo para aprovechar el elemento presente, sin necesidad de aplicar fertilizantes fosforados.
Conclusiones
La inoculación de las plantas de papaya con hongos micorrízicos arbusculares (HMA) estimula significativamente su crecimiento, presentando diferencias significativas en comparación con aquellas sin inocular. Estos resultados indican la importancia de inocular a las plantas cuando se cultivan en vivero, sobre todo cuando el sustrato utilizado para su propagación está libre de microorganismos. La micorrización favorece un menor uso de fertilizantes, lo que conduce a reducir la contaminación y degradación de los suelos, y tiempo de estancia de las plantas en vivero, debido a un mayor crecimiento en menor tiempo, que se refleja en un menor costo de producción. Además de la obtención de plantas provenientes de un sistema de producción orgánica, lo que les confiere un valor agregado. La fuente de fósforo y la dosis de fertilización influyen en el crecimiento de las plantas de papaya, no obstante, este efecto no es comparable con el proporcionado por la inoculación micorrízica, debido a que las hifas del hongo son capaces de captar, solubilizar y transportar el fósforo hacia las plantas en suelos pobres o sin fertilizar.











 nova página do texto(beta)
nova página do texto(beta)