Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Perinatología y reproducción humana
versión On-line ISSN 2524-1710versión impresa ISSN 0187-5337
Perinatol. Reprod. Hum. vol.26 no.2 Ciudad de México abr./jun. 2012
CASOS CLÍNICOS
El papel de la genética en la restricción del crecimiento intrauterino
The role of genetics in fetal growth restriction
Rosalba Sevilla-Montoya,* Patricia Grether-González,* Mónica Quintana-Palma,‡ Alejandro Martínez-Juárez,* Mónica Aguinaga-Ríos*
* Médico Genetista.
‡ Bióloga Citogenetista.
Departamento de Genética, Instituto Nacional de Perinatología Isidro Espinosa de los Reyes.
Correspondencia:
Mónica Aguinaga Ríos
Montes Urales 800,
Col. Lomas Virreyes, 11000
Correo electrónico: aguinagamonica09@gmail.com
Recibido: 30 de marzo de 2012
Aceptado: 12 de junio de 2012
RESUMEN
Se define como restricción del crecimiento intrauterino (RCIU) a la alteración en el crecimiento fetal que determina un peso por debajo de la percentila 10 para la edad gestacional. Las causas genéticas de RCIU pueden dividirse en: cromosómicas, alteraciones de la epigenética o impronta y síndromes génicos. Se presenta el caso de una paciente con RCIU referida por sospecha de displasia ósea, en la que se descartó disfunción vascular placentaria por ultrasonido prenatal, infecciones, patología materna y displasias óseas por estudio radiológico normal. Se realizó cariotipo en el cordón umbilical y en tres diferentes sitios de la placenta por la posibilidad de un mosaico placentario, obteniéndose un resultado normal. Al nacimiento presentó peso y talla por debajo de la percentila 3, cráneo dolicocéfalo con frontal prominente, fontanela anterior amplia, cara pequeña, triangular con mentón en punta y clinodactilia bilateral. A los dos meses de edad se observó asimetría de extremidades inferiores y se refirió reflujo gastroesofágico. Con base en los criterios clínicos y resultados obtenidos se realizó el diagnóstico de síndrome de Silver-Russell.
Palabras clave: Restricción del crecimiento intrauterino, mosaicismo placentario, síndrome de Silver-Russell.
ABSTRACT
Intrauterine growth restriction (IUGR) is an alteration in fetal development in which the fetal weight is below the 10th percentile for gestational age. The genetic causes of IUGR can be classified as: chromosomal, epigenetic and other imprinting disorders and monogenic syndromes. We report a patient with IUGR referred to our hospital with the prenatal diagnosis of achondroplasia. Vascular malfunction of the placentae, maternal pathology, and skeletal dysplasia were discarded. A karyotype in umbilical cord and in three different placental spots was performed, with a normal result in all of them, ruling out placentae mosaicism. At birth, the weight and height were below the 3th percentile. Physical examination showed: dolicocephaly, frontal prominence, large fontanels, small and triangular face, pointed chin and incurved bilateral fifth fingers. Two months later a lower limb asymmetry was noticed and gastroesophageal reflux was referred. With these clinical abnormalities and the studies performed the diagnosis of Silver-Russell syndrome was established.
Key words: Intrauterine growth restriction, placental mosaicism, Silver-Russell syndrome.
Introducción
El crecimiento fetal depende de la interacción de determinantes genéticos, factores epigenéticos, ambiente materno y factores placentarios.1
Se define como restricción del crecimiento intrauterino (RCIU) a la alteración en el crecimiento fetal, que determina un peso por debajo de la percentila 10 para su edad gestacional.2 Recientemente, algunos autores proponen el término de Restricción de Crecimiento Fetal en lugar de RCIU.1,2 En la mayoría de los casos, la RCIU se debe a una insuficiencia placentaria, la cual a su vez, puede estar ocasionada por patologías maternas (40-60%), factores genéticos (5-20%) y alteraciones directas en el proceso de placentación.3 En el cuadro I se especifican las principales alteraciones relacionadas con la RCIU.

Las causas genéticas de la RCIU se pueden clasificar en tres grupos: a) cromosómica, b) génica y c) epigenética. Los pacientes con RCIU de origen cromosómico manifiestan, generalmente, el retardo en el crecimiento antes de las 26 semanas de gestación. Las principales anomalías cromosómicas que cursan con RCIU son la triploidía y las trisomías 13 y 18, así como algunos rearreglos complejos.4 En ocasiones, la alteración cromosómica no se identifica en las células fetales, pero se encuentra confinada a la placenta en forma de mosaico (presencia de dos líneas celulares provenientes del mismo cigoto), lo cual tiene un efecto determinante en su función y en el crecimiento fetal.5 Se estima que entre 16-21% de los casos con mosaicismo placentario tendrá RCIU idiopático,6 por lo que se recomienda prestar particular atención a la placenta en búsqueda de zonas de hipoplasia o atrofia y tomar muestras de estas zonas para estudio citogenético, en tres sitios diferentes de la cara fetal placentaria.5 La aneuploidía confinada a la placenta más frecuentemente reportada en la RCIU es la trisomía 16.
En los últimos años, diferentes genes han sido implicados en la RCIU, sometidos a intrincadas relaciones entre sí y cuyos efectos están modificados por factores ambientales.1
Los cambios epigenéticos son todos aquellos que modifican la estructura de la cromatina y alteran la expresión génica sin modificar la secuencia del DNA. Las marcas epigenéticas más estudiadas son los cambios de metilación del DNA en las islas CpG, un residuo dinucleótido de citosina que se encuentra en promotores, transposones y regiones de impronta.7 Estos cambios epigenéticos pueden presentarse en los casos de madres con una pobre nutrición, en donde los nutrientes pueden afectar la expresión estructural de los genes directamente,8 actuando como factores de transcripción, o indirectamente, modulando vías de señalización y el metabolismo de diferentes sustancias. Estos cambios pueden originar un cambio de la programación embrio-fetal para lograr una adaptación al medio ambiente.9
Las diferencias en la expresión génica entre el alelo heredado de la madre y el heredado del padre son el resultado de la impronta genómica.10 Existe un gran número de genes dependientes de estas marcas de impronta y algunas alteraciones en éstos se pueden reflejar como RCIU. Un ejemplo de este mecanismo, se presenta con la disomía uniparental (DUP) en donde ambos alelos provienen de uno de los padres.11 La RCIU ha sido descrita en pacientes con alteraciones en la expresión de algunos genes localizados en los cromosomas: 6, 7, 11, 14, 15, 16 y 20.10 Dentro de éstos, encontramos entidades bien definidas que se deben de buscar intencionadamente ante la presencia de una RCIU de origen idiopático. El síndrome de Silver-Russell se considera una de las entidades genéticas más comunes de RCIU y puede deberse a una DUP materna del cromosoma 7.10 Hasta el momento, se han reportado más de 80 genes susceptibles de impronta, un gran número están involucrados en la regulación del crecimiento, entre ellos, se encuentran: p57, IGF2 y H19 , entre otros.12
Presentación del caso
Paciente femenina de 29 años, primigesta, referida al Instituto Nacional de Perinatología Isidro Espinosa de los Reyes (INPer), con un embarazo de 35.1 semanas de gestación y un feto con diagnóstico de probable acondroplasia. Padre de 38 años, aparentemente sano, sin consanguinidad ni endogamia. Sin antecedentes heredofamiliares de importancia, ni exposición a tabaquismo o drogas. La paciente tuvo un adecuado control prenatal fuera del instituto durante su embarazo y no presentó alguna patología materna. Se realizó ultrasonido de segundo nivel a las 35.1 semanas de gestación (sdg) por fecha de última menstruación en el que se observó un diámetro biparietal correspondiente a 33.1 sdg, circunferencia cefálica de 32.3 sdg, circunferencia abdominal de 29 sdg, longitud femoral de 29.3 sdg, longitud tibial de 28 sdg, peso aproximado: 1,457 gramos y fetometría promedio de 31 sdg, por lo que se diagnosticó RCIU asimétrico (IP 2.25). El USG descartó insuficiencia placentaria por flujo Doppler normal. Se realizó perfil TORCH a la madre, el cual no mostró datos de infección activa. A las 36.4 semanas se decidió la interrupción del embarazo por vía abdominal. Se obtuvo un recién nacido femenino de 36 semanas de gestación por Capurro, peso de 1,490 gramos (< percentila 3), talla de 40 cm (< percentila 3), perímetro cefálico de 32 cm (percentila 10), Apgar 8/9 y Silverman-Andersen 2.
La valoración genética al nacimiento mostró el cráneo dolicocéfalo con frontal prominente, fontanela anterior amplia, cara pequeña, triangular, con mentón en punta y clinodactilia bilateral. Las radiografías de cráneo, columna y extremidades mostraron una desproporción cráneo-cara; no se observó alteración en el tamaño, densidad o forma de los huesos tubulares ni cuerpos vertebrales, con lo que se descartó una displasia ósea. Se reportó un pobre reflejo de succión y se solicitó ultrasonido transfontanelar, renal, potenciales evocados auditivos, visuales y estudio de poligrafía.
Se tomaron muestras de tres regiones diferentes de la placenta y del cordón umbilical para el estudio citogenético. Los fragmentos de tejido se procesaron por la técnica de explante y se sembraron dos cultivos primarios por cada región placentaria. De igual manera, se sembraron dos cultivos primarios de cordón umbilical por la técnica de explante. Cuando los cultivos llegaron a semiconfluencia fueron subcultivados a cubreobjetos de 22 x 22 mm en cajas de Petri para su cosecha y tinción.
El estudio citogenético con bandas GTG mostró un complemento cromosómico 46,XX en 20 células cultivadas de cordón umbilical. En 100 células de las tres regiones cultivadas de placenta se observó también un cariotipo 46,XX lo que se interpreta como femenino normal. Con estos hallazgos se descartó razonablemente la presencia de un mosaico cromosómico.
La paciente fue revalorada a los dos meses de edad, el peso y la talla se mantuvieron por debajo de la percentila 3, perímetro cefálico en percentila 50 y la madre refirió la presencia de reflujo gastroesofágico controlado médicamente. Su tamiz metabólico no reportó alteraciones. Se realizaron potenciales evocados visuales a los dos meses de vida que reportaron retardo en la conducción de la vía visual derecha. Los potenciales evocados auditivos fueron anormales, con una alteración conductiva periférica de la vía auditiva izquierda. Los resultados del ultrasonido transfontanelar, renal y estudio poligráfico fueron normales.
A la exploración física persistió con las dismorfias faciales descritas al nacimiento, observándose además asimetría de extremidades inferiores (pierna derecha 18.5 cm, pierna izquierda 17 cm). En las figuras 1 y 2 se muestran las características craneofaciales de la paciente y la asimetría en extremidades inferiores a los dos meses de edad.
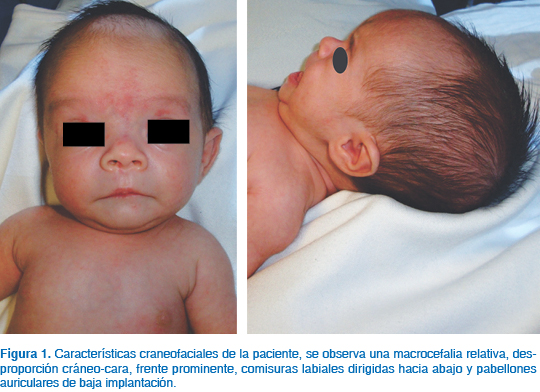
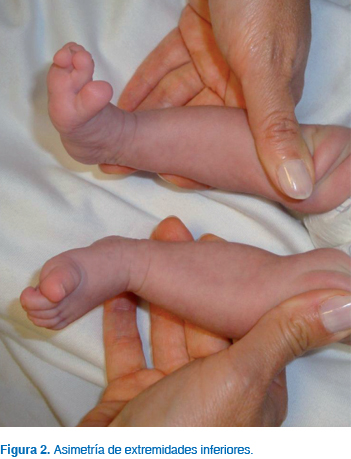
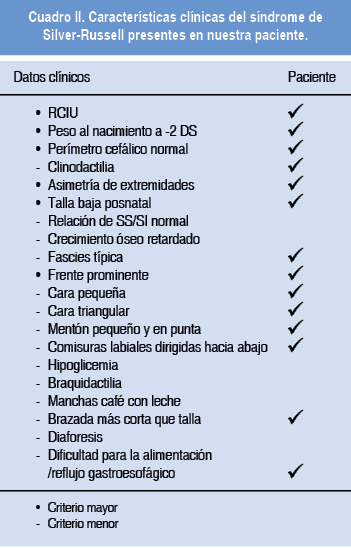
Con los datos clínicos referidos y los resultados de estudios citogenéticos y radiológicos se integró el diagnóstico de síndrome Silver-Russell (Cuadro II).
Revisión de la literatura
El diagnóstico prenatal de la RCIU representa uno de los principales retos en el cuidado materno. La RCIU es una condición compleja que resulta de la interacción de condiciones maternas, placentarias, hormonales y genéticas.1,13
Se describe el caso de una paciente con RCIU asimétrica detectada en el tercer trimestre de la gestación, referida por sospecha de displasia esquelética.
La valoración de un paciente con RCIU idiopático debe ser multidisciplinaria. La valoración de un médico genetista es importante ya que en hasta 20% de los casos la etiología es genética.1,14 La detección prenatal del mismo, permite realizar algunos estudios para conocer su etiología y planear la realización de estudios al nacimiento. La RCIU simétrica tiene mal pronóstico cuando es severa y de instalación precoz porque se asocia con alteraciones cromosómicas, malformaciones e infecciones congénitas fetales o patología materna grave.15 Desde el punto de vista genético, la clasificación de RCIU en simétrica y asimétrica continúa siendo de utilidad. La primera causa de RCIU asimétrica es la insuficiencia placentaria, ésta puede ser diagnosticada con USG con flujo Doppler.15,16 Nuestra paciente fue referida tardíamente; sin embargo, esta causa pudo ser descartada. En todo paciente con RCIU de causa inexplicable está indicado realizar cariotipo prenatal; en este caso, se realizó al nacimiento debido a la edad gestacional a la que fue valorada la paciente.
Las displasias esqueléticas se presentan generalmente como RCIU asimétrica, y pueden usualmente detectarse durante el ultrasonido estructural de segundo nivel, entre las 18 y 22 sdg. La displasia no letal más común es la acondroplasia, en la que se observa acortamiento rizomélico de extremidades y platispondilia. La valoración al nacimiento y el estudio radiológico descartó esta posibilidad diagnóstica, así como otro tipo de displasias óseas neonatales.
Algunas infecciones como citomegalovirus, toxoplasmosis, sífilis, rubeola y virus de la inmunodeficiencia humana pueden ocasionar RCIU;3,6,13,14 en la paciente, los estudios de TORCH, VDRL y VIH fueron negativos. La paciente no presentó defectos congénitos sugestivos de alteración cromosómica; sin embargo, en todo paciente con RCIU idiopático debe realizarse un estudio citogenético.
El mosaicismo cromosómico confinado a la placenta se presenta en 20% de pacientes con RCIU; en esta paciente se descartó esta posibilidad por un resultado normal en tres diferentes sitios de la placenta. Este estudio es importante indicarlo previo al nacimiento y se requiere de personal capacitado para la toma adecuada de las muestras.
El estudio patológico de la placenta reportó una placenta hipotrófica de 270 gramos. En el síndrome de Silver-Russell diferentes alteraciones placentarias como hipotrofia, arteria umbilical única e inserción velamentosa de cordón han sido descritas.17
Para establecer el diagnóstico de síndrome de Silver-Russell se deben cumplir al menos tres de los siguientes criterios clínicos al nacimiento, además del antecedente de RCIU:12 1. Retraso del crecimiento postnatal, 2. Macrocefalia relativa o perímetro cefálico 1.5 DS por arriba de la percentil de peso y talla. 3. Frente prominente durante la infancia, 4. Asimetría corporal, 5. Dificultades para la alimentación o índice de masa corporal bajo. En nuestro caso, la paciente presentó RCIU, retraso del crecimiento postnatal, frente prominente, asimetría corporal y reflujo gastroesofágico. El diagnóstico de esta entidad es clínico11,12 aunque se pueden realizar estudios moleculares para conocer la etiología7 y poder brindar un adecuado asesoramiento genético.
El síndrome de Silver-Russell (OMIM 180860) es una entidad heterogénea de un amplio espectro clínico caracterizada por RCIU, talla baja, facies típica, asimetría corporal, clinodactilia, sindactilia en los dedos de los pies y déficit del lenguaje. Al nacimiento pueden presentar hipoglicemia, mancha café con leche y diaforesis. Se presenta con una frecuencia de 1 en 3,000 a 5,000 nacidos vivos y debe ser sospechado en todo paciente con RCIU de origen desconocido y dismorfias faciales características de la entidad. En la mayoría de los casos se presenta de forma esporádica, aunque existen casos familiares con diferentes modelos de herencia.
El pronóstico es bueno, no habiéndose demostrado asociación alguna con otras patologías o retraso mental,18 aunque algunos pacientes pueden presentar dificultad del aprendizaje. La talla final es baja y el tratamiento es ortopédico y nutricional. Su desarrollo sexual no se ve afectado.
Este síndrome se ha asociado a DUP materna del cromosoma 7 en un 10% y a alteraciones en la impronta de la región cromosómica 11p15 en un 60%.19 La DUP del 7 fue descrita inicialmente como una isodisomía (dos cromosomas 7 de origen materno) en pacientes con síndrome de Silver-Russell. Recientemente, se ha encontrado que existen dos regiones de impronta relacionadas con la patología dentro de las cuales se encuentra el gen GRB10 , que codifica para una proteína con función de receptor de factores de crecimiento como IR (receptor de insulina), IGFIR (receptor del factor de crecimiento 1 similar a insulina) y EGFR (factor de crecimiento epidérmico).7,11 En cuanto a los cambios de impronta, se ha detectado en 11p15 un conjunto de genes que juegan un papel fundamental en el crecimiento fetal y placentario. Esta región incluye dos dominios de control de impronta, cada uno con su centro regulador. Esta región cromosómica incluye genes con expresión paterna como IGF2 y KCNQIOT1 y genes con expresión materna como CDKN1C y H19 . La interacción y regulación temporal de estos genes permiten un crecimiento y desarrollo embrio-fetal y placentario normal. La falta de expresión paterna o la expresión materna de estos genes puede relacionarse con RCIU.11
Schonherr y cols. (2006) reportaron que los pacientes con cuatro de los cinco criterios clínicos descritos, presentaban una pérdida de metilación de ICR1 (centro de control de impronta 1) en el control de impronta de IGF2 y H19 , con pérdida de la expresión paterna de IGF2. Consideramos que esta alteración molecular podría ser la causa de la enfermedad en nuestra paciente. La evaluación de un paciente con antecedente de RCIU idiopática debe ser multidisciplinaria, es importante conocer las diferentes causas genéticas de la misma y establecer un plan de manejo y seguimiento para poder integrar un diagnóstico preciso y otorgar un asesoramiento genético adecuado a los padres.
REFERENCIAS
1. Maulik D. Fetal growth restriction: the etiology. Clin Obstet Gynecol 2006; 49: 228-35. [ Links ]
2. Hasegawa J, Arakawa K, Nakamura M, Matsuoka R, Ichizuka K, Katsufumi O, Sekizawa A Okai T. Analysis of placental weight centiles is useful to estímate cause of fetal growth restriction. J Obstet Gynaecol Res 2011; 37:1658-65. [ Links ]
3. Monk D, Moore GE. Intrauterine growth restriction-genetic causes and consequences. Semin Fetal Neonatal Med 2004; 9: 371-8. [ Links ]
4. Snijders RJM, Sherrod C, Gosden CM, Nicolaides KH. Fetal growth retardation: Associated malformations and chromosomal abnormalities. Am J Obstet Gynecol 1993; 168: 547-55. [ Links ]
5. Kalousek D, Vekemans M. Confined placental mosaicism. J Med Genet 1996; 13: 529-33. [ Links ]
6. Loughna P. Intrauterine growth restriction: Investigation and management. Curr Obstet Gynecol 2006; 16: 261-6. [ Links ]
7. Schonherr N, Meyer E, Eggermann K, Ranke MB, Wollmann HA, Eggermann T. (Epi)mutations in 11p15 significantly contribute to Silver-Russell syndrome: but are they generally involved in growth retardation? Eur J Med Gent 2006; 49: 414-8. [ Links ]
8. Barker DJ. The fetal and infant origins of disease. Eur J Clin Invest 1995; 25: 457-63. [ Links ]
9. Barker DJ, Eriksson JG, Forsen T, Osmond C. Fetal origins of adult disease: strength of effects and biological basis. Int J Epidemiol 2002; 31: 1235-9. [ Links ]
10. Robinson WP. Mechanisms leading to uniparental disomy and their clinical consequences. Bioessays 2000; 22: 452-9. [ Links ]
11. Eggerman T. Russell-Silver syndrome. Am J Med Genet 2010; 154C: 355-64. [ Links ]
12. Price SM, Stanhope R, Garrett C, Preece MA, Trembath RC. The spectrum of Silver-Russell syndrome: a clinical and molecular genetic study and new diagnostic criteria. J Med Genet 1999; 36: 837-42. [ Links ]
13. Sankaran S, Phillipa MK. Etiology and pathogenesis of IUGR. Best Pract Res Clin Obstet Gynaecol 2009: 765-77. [ Links ]
14. Hendrix N, Berghella V. Non-placental causes of intrauterine growth restriction. Semin Perinat 2008; 32: 161-5. [ Links ]
15. Scifres C, Nelson M. Intrauterine growth restriction, human placental development and trophoblast cell death. J Physiol 2009; 587: 3453-8. [ Links ]
16. Murphy VE, Smith R, Giles WB, Clifton VL. Endocrine regulation of human fetal growth: the role of mother, placenta, and fetus. Endocr Rev 2006; 27: 141-69. [ Links ]
17. Sagot P, David A, Talmant C, Pascal O, Winer N, Boog G. Russell-Silver syndrome: an explanation for discordant growth in monozygotic twins. Fetal Diagn Ther 1996; 11: 72-8. [ Links ]
18. Terán MC, Terán EC, Villaroel AP. Síndrome de Russell-Silver, reporte de un caso. Rev Soc Bol Ped 2007; 46: 33-5. [ Links ]
19. Wakeling EL, Abu-Amero S, Alders M, Bliek J, Forsythe E, Kumar S et al. Epigenotype-phenotype correlations in Silver-Russell syndrome. J Med Genet 2010; 47: 760-8. [ Links ]














