Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de neurociencias (México, D.F.)
versión On-line ISSN 1028-5938versión impresa ISSN 0187-4705
Arch. Neurocien. (Mex., D.F.) vol.10 no.3 Ciudad de México jul. 2005
Artículo a revisión
Neuropatología quirúrgica. Parte III. Patología celular básica
Surgical neuropathology part III basic celular pathology
Daniel Rembao–Bojórquez, Rosalba Vega–Orozco, Citlaltepetl Salinas–Lara
*Departamento de Neuropatología. Instituto Nacional de Neurología y Neurocirugía.
Correspondencia:
Daniel Rembao B.
Departamento de Neuropatología. Instituto Nacional de Neurología y Neurocirugía.
Insurgentes Sur 3877. Col. La Fama.
14269. México, D.F.
E–mail: jdrb2002@yahoo.com.mx
Recibido: 18 abril 2005.
Aceptado: 3 mayo 2005.
RESUMEN
La patología literalmente es el estudio del dolor. Para ser precisos, es una disciplina que une a la práctica clínica con la ciencia básica, identificando cambios macroscópicos o microscópicos en las células, tejidos, y órganos enfermos. De manera tradicional, a la patología se le divide en patología básica o general y patología especial o sistémica. Los cuatro aspectos del proceso de la enfermedad en los cuales se enfoca la patología son la causa de la enfermedad, los mecanismos mediante los cuales se desarrolla, la vía mediante la cual ocurren los cambios estructurales o morfológicos y las consecuencias funcionales.
Palabra clave: práctica clínica, lesión celular, alteraciones estructurales, necrosis.
ABSTRACT
Pathology is literally the study of suffering. More specifically, it is a bridging discipline involving both basic science and clinical practice and is devoted to the study of the structural and functional changes in cells, tissues, and organs that underlie diseases. Traditionally, the study of pathology is divided into general pathology and special or systemic pathology. The four aspects of a disease process that form the core of pathology are its cause, the mechanisms of its development, the structural alterations, and the functional consecuences.
Key words: clinical practice, cell injury, structural changes, necrosis.
En la práctica médica actual de súper especialidades, es importante recordar, y entender conceptos de patología básica, entendiéndola como parte integral de la medicina y no exclusivamente como descripciones o hallazgos morfológicos.
Para establecer el diagnóstico y orientar la terapéutica, en la práctica clínica los anatomopatólogos típicamente identifican cambios en el aspecto macroscópico o microscópico (morfología) de las células y tejidos. Cuando el caso lo amerita, también emplean las técnicas moleculares, microbiológicas e inmunológicas pertinentes. El enfoque científico de la patología se centra sobre la causa de la enfermedad, los mecanismos mediante los cuales se desarrolla y la vía mediante la cual ocurren los cambios morfológicos. Estos sucesos fundamentales ocurren a los niveles molecular y celular. Las células participan de manera activa en su medio ambiente, ajustando continuamente su estructura y función para adaptarse al cambio de las demandas y a las agresiones extracelulares. Las células tienden a preservar su entorno inmediato y su medio intracelular dentro de unos límites relativamente estrechos de parámetros fisiológicos: mantienen la homeostasia normal. Cuando se enfrentan a sobrecargas fisiológicas o estímulos patológicos, se adaptan y alcanzan un nuevo estado de equilibrio, conservando su viabilidad, y cuando esta capacidad de adaptación resulta superada, aparece la lesión celular. Dentro de ciertos márgenes, la lesión es reversible y las células vuelven a una situación basal estable; sin embargo, cuando la agresión es intensa y persistente, la lesión se hace irreversible y la célula afectada muere. Ciertamente, las células que componen al sistema nervioso central (SNC) no escapan a estos fenómenos y es necesario revisar como responde a los diferentes estímulos nocivos.
DEFINICIONES
Necrosis. Se refiere a una secuencia de cambios morfológicos que siguen a la muerte de una célula en un tejido viviente (un tejido en un fijador está muerto pero no necrosado) posterior a lesión exógena irreversible. Su manifestación más común es la necrosis coagulativa, caracterizada por tumefacción de la célula, desnaturalización de las proteínas citoplasmáticas y fragmentación de los organelos celulares. El aspecto morfológico de la necrosis es por lo tanto, resultado de dos procesos esencialmente concurrentes: 1. digestión enzimática de la célula y 2. desnaturalización de proteínas. Las enzimas hidrolizantes pueden derivarse de las propias células muertas, en cuyo caso la digestión se conoce como autólisis, o de los lisosomas de células inflamatorias invasoras; denominada heterólisis. En el caso de digestión enzimática dominante, el resultado es la necrosis licuefactiva, característica de infecciones bacterianas focales o a veces de infecciones micóticas puesto que estos microorganismos constituyen un estímulo poderoso para la acumulación de leucocitos. Por razones aún no aclaradas, la muerte de las células por hipoxia dentro del SNC también da como resultado una necrosis licuefactiva. La necrosis caseosa es una forma distintiva de necrosis observada con mayor frecuencia en focos de infección tuberculosa. Desde el punto de vista microscópico, el foco necrosado se compone de desperdicios granulares amorfos sin estructura encerrados dentro de un anillo distintivo de inflamación granulomatosa. A diferencia de la necrosis coagulativa, la arquitectura del tejido está completamente obliterada.
Apoptosis. Es un proceso más regulado, ocurre en la muerte de una población celular específica en condiciones fisiológicas, como la embriogénesis y también en varios estados patológicos. Los datos actuales sugieren que la apoptosis tal vez se centra sobre la síntesis, activación o ambas cosas de algunas proteasas citosólicas. De manera habitual implica células únicas o grupos de células que aparecen en forma de masas redondeadas u ovales con citoplasma intensamente eosinofílico la cromatina nuclear se condensa y se agrega en la periferia, por último ocurre cariorrexis, lo que se refleja como fragmentación del DNA en pedazos del tamaño de nucleosomas, presumiblemente a travéz de la activación de endonucleasas. La apoptosis no genera respuesta inflamatoria, dificultando aún más su identificación.
La mayor parte de las causas de lesión celular se pueden agrupar en las siguientes categorías: hipoxia, o deficiencia de oxígeno, incide sobre la respiración oxidativa aerobia y es una causa común y sumamente importante de lesión y muerte celular. Debe distinguirse de la isquemia que es una pérdida del riego sanguíneo por obstáculo al flujo arterial o reducción del drenaje venoso en un tejido. Agentes físicos. Traumatismo, temperaturas extremas, radiación, choque eléctrico y cambios súbitos en la presión atmosférica, todos tienen efectos muy pronunciados sobre las células. Sustancias químicas y fármacos. Prácticamente cualquier agente químico puede causar lesión; alterando el ambiente osmótico, alterando la permeabilidad de la membrana, o la integridad de una enzima o un cofactor.
Agentes microbiológicos, estos agentes varían desde los virus submicroscópicos hasta los platelmintos de varios metros de largo, cada uno con su manera particular de causar lesión. Las reacciones inmunológicas como una reacción anafiláctica a una proteína extraña es un ejemplo primario, y reacciones a autoantígenos son causa de varias enfermedades autoinmunitarias. Complementan las causas de lesión celular los defectos genéticos, el desequilibrio nutricional y el envejecimiento. Ahora, en relación a mecanismos de lesión celular, sabemos que algunos están bien definidos; sin embargo, es necesario hacer algunas generalizaciones:
• La respuesta celular al estímulo nocivo depende del tipo de lesión, duración y gravedad.
• Las consecuencias de un estímulo nocivo también dependen del tipo de célula lesionada, su estado en ese momento (nutricional, hormonal, etc.), y su capacidad de adaptación.
• Determinar con precisión el sitio celular lesionado, puede ser difícil, pero cuatro sistemas intracelulares son en particular vulnerables: 1. integridad de la membrana celular, decisiva para la homeostasis celular iónica y osmótica; 2. respiración aerobia, importante para generar los almacenes de energéticos de ATP; 3. síntesis de proteínas, y 4. integridad del aparato genético.
Considerable evidencia es el daño a la membrana celular como factor central en la patogenia de lesión celular irreversible. La pérdida de la regulación del volumen, aumento de la permeabilidad a moléculas extracelulares (principalmente calcio) y los defectos ultraestructurales demostrables en la membrana plasmática ocurren incluso desde las primeras etapas de la lesión irreversible. Los cambios de adaptación en el crecimiento y diferenciación celular son en particular importantes en situaciones patológicas. Estos incluyen atrofia (disminución del tamaño de la célula), hipertrofia (incremento del tamaño de la célula), hiperplasia (incremento en el número de células) y metaplasia (cambio en el tipo de célula).
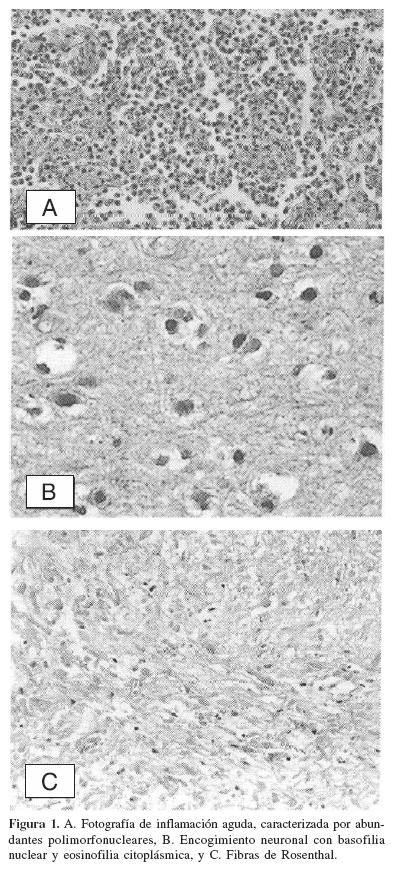
En tanto que varios estímulos exógenos y endógenos pueden causar lesión celular directa, el mismo estímulo también induce una reacción compleja llamada inflamación en los tejidos conectivos vascularizados. La respuesta inflamatoria diluye, destruye o aisla el agente causal y pone en marcha la secuencia de sucesos que habrán de cicatrizar y reconstruir el tejido dañado. La inflamación se presenta en dos formas básicas. Inflamación aguda de duración en cierta forma breve, que persiste desde unos cuantos minutos hasta varios días, se caracteriza por exudación de líquido y proteínas del plasma y por acumulación de leucocitos predominan los neutrófilos (figura 1A). Inflamación crónica, de mayor duración (días o años), que en forma histológica se manifiesta por acumulación de linfocitos y macrófagos, por destrucción y reparación del tejido; esta última se relaciona con proliferación vascular y fibrosis. La reparación se inicia al principio del proceso de la inflamación e implica dos procesos por separado: 1. regeneración del tejido lesionado por células parenquimatosas del mismo tipo, y 2. sustitución por tejido conectivo (fibroplasia), que produce una cicatriz permanente. La proliferación celular es regulada principalmente por factores bioquímicos producidos en el microambiente local que pueden estimular o inhibir el crecimiento de las células. El control más importante es inducir a las células en reposo (en Go) para que entren en el ciclo celular. Ahora, es necesario recordar que las células del cuerpo se dividen en tres grupos con base en su capacidad regenerativa y su relación con el ciclo celular. Células lábiles, que prosiguen a través del ciclo celular de una mitosis a la siguiente y proliferan durante toda la vida, reemplazando a las células que mueren en forma continua. En este grupo se incluyen a las células epiteliales y células hemato–poyéticas de la médula ósea. Las células en reposo (estables) por lo general muestran un bajo nivel de replicación , en la basal se les considera en estado Go, pero luego de pérdidas celulares pueden entrar en Gl mediante un estímulo apropiado que produce un rápido incremento en la división y reconstrucción del tejido. En esta categoría se incluyen a las células del hígado, páncreas, riñon, células endoteliales vasculares y fibroblastos. Las células que no se dividen (permanentes) salen del ciclo celular en algún punto del desarrollo intrauterino y no pueden desarrollar nuevas divisiones mitóticas en la vida posnatal. Esto incluye a las células nerviosas y a los miocitos cardiacos, en donde una lesión irreversible siempre produce una cicatriz (glial o fibrosa)1.
PATOLOGÍA ESPECIAL DEL SNC
Las enfermedades del SNC casi siempre se consideran más complejas o enigmáticas que las de otros sistemas orgánicos, sin embargo, cuando se consideran las características estructurales y celulares del mismo, los procesos neuropatológicos pueden entenderse en el contexto de la patología básica.
Para dar explicación a las particularidades del SNC es conveniente revisar algunas de las características de su composición celular. El parénquima cerebral se compone de neuronas sostenidas por un armazón (estroma) de células guales (astrocitos, oligodendrocitos y ependimarias), vasos sanguíneos y microglia. Las prolongaciones de estas células se combina para formar una delicada red fibrilar denominada neurópilo. Cualquier proceso patológico produce daño al parénquima cerebral con reacciones secundarias en sus elementos celulares y en las estructuras de apoyo (meninges, tejido conectivo y vasos sanguíneos). Aunque los principales cambios que ocurren en las neuronas, la glia, tejido conectivo y estructuras vasculares van a ser descritas por separado, es necesario enfatizar la fuerte interdependencia funcional de estos elementos celulares y estructurales, ante los diferentes estímulos nocivos1.
Patología especial de las neuronas. Las neuronas pueden presentar varias alteraciones morfológicas; una de las más comunes es la necrosis. El proceso de necrosis coagulativa con preservación de la arquitectura general del tejido es característico de la muerte celular por hipoxia en todos los tejidos, excepto en el cerebro. Sin embargo, como en otros sitios, la necrosis neuronal se caracteriza por eosinofilia citoplásmica y cambios nucleares, como contracción (picnosis), fragmentación (cariorrexis) y ausencia de tinción (cariólisis) (figura 1B). Es de mayor importancia recordar que dentro del SNC ciertas regiones y poblaciones celulares son más susceptibles que otras a la lesión isquémica–hipóxica. Por ejemplo, las neuronas son más vulnerables a la lesión isquémica que las células guales. Entre los elementos neuronales ciertas subpoblaciones, como las células piramidales del hipocampo y las células de Purkinje del cerebelo, son en particular sensibles a la anoxia y con frecuencia son sitios de lesión selectiva. Ante una lesión del tipo isquémica–hipóxica, el cerebro puede parecer normal tanto macroscópica como microscópicamente en el periodo inmediato posterior a la misma. En pacientes que sobreviven la lesión aguda, el cerebro se reblandece y edematiza antes de 24 a 48 horas. Aparecen manchas moteadas irregulares a menudo visibles en la sustancia gris; en algunas áreas como las zonas arteriales limítrofes se observan áreas hemorrágicas. La superficie de la corteza puede estar interrumpida por una línea irregular de reblandecimiento y color anormal; este patrón que se denomina necrosis cortical laminar, refleja la vulnerabilidad de capas corticales específicas a la lesión hipóxica (III, IV y V capas neuronales). Recordar que la necrosis cortical aguda también se encuentra en otros procesos patológicos agudos, incluyendo hipoglucemia y contacto con cantidades excesivas de neurotransmisores excitotóxicos.
La cromatólisis central está caracterizada morfológicamente por edema del cuerpo celular; desaparecen los cuerpos de Nissl, con aplanamiento y desplazamiento periférico del núcleo. Este fenómeno lo podemos observar en lesiones axonales (degeneración retrógrada) de neuronas motoras inferiores. Su interpretación en neuronas superiores es más difícil y dentro del SNC sólo se observa como un tipo de atrofia "simple".
Atrofia neuronal es la descripción que se le da a una gran variedad de daños neuronales irreversibles que causan muerte celular relativamente lenta. Esta atrofia neuronal se caracteriza. Por retracción del cuerpo celular, basofilia difusa del citoplasma, picnosis e hipercromasia del núcleo en ausencia de una reacción inflamatoria. Se presenta en muchos trastornos degenerativos que comprometen a varios sistemas neuronales interconectados (atrofia olivopontocerebelar, ataxia de Friederich y esclerosis lateral amiotrófica). La atrofia neuronal no debe ser confundida con "neuronas oscuras", artefacto visto en biopsias cerebrales fijadas en formol por inmersión y se distinguen por encogimiento del citoplasma y por el núcleo de forma irregular e hipercromático.
Neuronas y neurópilo vacuolados son observados en enfermedad de Creutzfeldt–Jakob, en estados hipóxicos e incluso en encefalitis virales. En algunas situaciones raras se encuentran las llamadas "neuronas fenestradas" que son el resultado de degeneración transináptica, y como ejemplo tenemos a la hipertrofia olivar. Neuronal binucleadas, esta característica es poco común y regularmente está asociada a lesiones focales y antiguas como aquellas causadas por fenómenos displásicos y de malformación, como la esclerosis tuberosa y en ciertas neoplasias como los que se originan en células ganglionares. Acumulación de lipofuscina es un cambio neuronal característico, relacionado con la edad y es un ejemplo de las enfermedades por almacenamiento. Degeneración neurofibrilar tipo Alzheimer es vista tanto en la demencia del mismo nombre, así como en tejido cerebral de pacientes con edad avanzada. Las marañas neurofibrilares se observan dentro del citoplasma neuronal como estratos de fibrillas engrosadas y tortuosas, en forma de flama en células piramidales, grandes y globosas en ganglios básales y en tallo cerebral. En los estadios finales de la enfermedad de Alzheimer las marañas se observan como "fantasmas de marañas". La degeneración gránulo–vacuolar se encuentra principalmente en las astas de Ammon y puede ser vista en los cambios degenerativos asociados a la edad, así como en la enfermedad de Alzheimer y enfermedad de Pick.
Los cuerpos de inclusión intraneuronales (intracitoplasmáticos o intranucleares) son indicadores muy importantes de daño neuronal. Pueden presentarse en enfermedades degenerativas, metabólicas y virales y para su diagnóstico es necesario apoyarse en técnicas de inmunocitoquímica y/o microscopia electrónica (hallazgos ultraestructurales). Los cuerpos de Pick son inclusiones intracitoplasmáticas, redondas y homogéneas. Son características de la enfermedad de Pick y pueden ser vistas en las neuronas piramidales, células granulares del hipocampo y en regiones afectadas de la neocorteza. Los cuerpos de Lewy son inclusiones cuya apariencia varía de acuerdo al sitio en el que se encuentra: pericarion, corteza, tallo cerebral o ganglio simpático. Su forma clásica es esférica irregular, núcleo eosinofílico y rodeado por un "halo" claro. Su presencia determina a varias condiciones conocidas como "trastornos por cuerpos de Lewy" de los cuales el más conocido es la enfermedad de Parkinson. Los cuerpos de Hirano son intrácito–plasmáticos, de forma elíptica y brillantemente eosinofílicos, se encuentran de manera importante en la región CAI del hipocampo y son en particular numerosos en la enfermedad de Alzheimer y en la enfermedad de Pick. Los cuerpos de Bunina también son intracitoplasmáticos, eosinofílicos y pueden ser vistos en neuronas motoras de casos familiares o esporádicos de esclerosis lateral amiotrófica. Los cuerpos de Marinesco se localizan intranuclear y principalmente en neuronas del tallo cerebral que contienen melanina. No se les conoce significado patológico; sin embargo, hay inclusiones parecidas en degeneraciones espino–cerebelosas y enfermedad de Huntington. Cuerpos de Lafora son estructuras redondas compuestas de poliglucosanos (polímeros de polisacaridos sulfatados ) y son similares a los cuerpos amiláceos en composición química y características de tinción (positivos con el ácido periódico de Schiff –PAS–). Se pueden encontrar un gran número en SNC con epilepsia mioclónica (en especial en el núcleo dentado) y en ciertos tejidos periféricos como el de las glándulas sudoríparas, hígado y músculo esquelético. Un apartado muy especial son las inclusiones virales, que regularmente son intranucleres, eosinofílicas, ocupando en mayor o menor proporción el área del núcleo y rodeada por un halo claro. Los ejemplos más claros son en la infección por herpes virus (en particular en la encefalitis necrotizante causada por herpes virus simple) y la panencefalitis esclerosante subaguda. También puede presentarse como inclusiones intracitoplasmáticas (cuerpos de Negri asociados con rabia) y en casos raros, inclusiones en ambas estructuras (p.ej. infección por citomegalovirus). La mayoría de las inclusiones virales son inmunorreactivas con anticuerpos antivirus específicos, lo que permite diagnósticos específicos.
Patología especial de astrositos, oligodendrocitos, células de la microglia y células ependimarias. De las respuestas astrocíticas a diferentes estímulos nocivos la gliosis (astrogliosis) o proliferación de astrocitos, es el mejor indicador de que una anormalidad microscópica es de significado patológico. Puede ser vista en procesos agudos o crónicos y los cambios morfológicos asociados incluyen expansión y arborización de las prolongaciones citoplasmáticas de los astrocitos. Las figuras de mitosis son en ocasiones vistas en el tejido gliótico. Dependiendo de la localización, estado de evolución y naturaleza del proceso patológico la gliosis puede asumir una de las formas siguientes:
Fibrilar (acompañada por astrocitos gemistocíticos) o gliosis fibrilar isomórfica (en condiciones degenerativas de evolución lenta). En enfermedades crónicas y degenerativas lentas los astrocitos también pueden disminuir en tamaño y variar en forma. La Glia Alzheimer tipo 11 se puede observar en estados de hiperamonemia como ocurre en los casos de enfermedad de Wilson y en falla hepática, contienen numerosas mitocondrias. Las fibras de Rosenthal se pueden observar redondas, ovales o alargadas, homogéneas y brillantemente eosinofílicas con microscopio óptico, teniendo un tamaño variable de 10 mi hasta 40 mi (figura 1C). Las podemos identificar en varios estados patológicos que tienen en común intensa gliosis de tipo fibrilar de larga evolución, tal es el caso de su disposición alrededor de placas de esclerosis múltiple, en la médula espinal en la siringomelia, alrededor de craneofaringiomas, en ciertas neoplasias (astrocitoma pilocítico del cerebelo o hipotálamo) y en la enfermedad de Alexander.
La acumulación de lipofuscina relacionada con la edad, también ocurre en los astrocitos, así como la acumulación de lípidos en enfermedades por almacenamiento del mismo elemento. La proteína tau, principal componente de las marañas neurofibrilares también puede acumularse en los astrocitos, en particular en la degeneración corticobasal. En el caso de las inclusiones virales, también se encuentran en los astrocitos, en particular en la panencefalitis esclerosante subaguda y en la infección por citomegalovirus. Existen estructuras esféricas, basofilicas, PAS–positivas de 1µm a 5µm de diámetro que se encuentran predominantemente en los procesos astrocíticos, aunque en ocasiones ocurren dentro de los axones. Estos cuerpos amiláceos aumentan su número en relación a la edad, de manera importante en las regiones subpiales y subependimarias.
Con respecto a lesiones de los oligodendrocitos, estos, al igual que las neuronas y los astrocitos pueden ser asiento de inclusiones intranucleares de tipo viral en la leucoencefalopatía multifocal progresiva o almacenamiento de lípidos (leucodistrofia metacromática). Los "cuerpos enrollados o en espiral", son acumulaciones de proteína tau en los oliogodendrocitos y se encuentran en la degeneración corticobasal, y en la enfermedad de granulos argirofilicos alrededor de los núcleos.
Cuando hablamos de activación de la microglia, se presenta en condiciones inflamatorias del SNC y en tres condiciones especiales: a. con el aumento de la entrada de monocitos hematógenos dentro del mismo SNC, b. proliferación de microglia residente, y c. ante la expresión o secreción de un rango amplio de proteínas, la mayoría de las cuales se relacionan con antígenos de presentación e inflamación.
En las células ependimarias, las reacciones al daño están limitadas; en el SNC del adulto, los ependimocitos no proliferan en respuesta a la lesión o pérdida celular. Cuando hay destrucción de células ependimarias, ésta se acompaña de proliferación de astrocitos subependimarios y los ependimocitos que sobreviven pueden ser cubiertos por la reacción astrocítica y aparecen como nidos de túbulos inmerso dentro del foco proliferativo. Al igual que las otras células guales mencionadas, las infecciones virales, tales como el citomegalovirus, pueden producir cuerpos de inclusión23.
CONCLUSIÓN
En la práctica médica actual es común olvidar y no revisar los conceptos básicos de lesión celular. Debemos saber distinguir entre tipo de lesión celular y mecanismo de lesión celular, o bien las características de los diferentes tipos de necrosis. Del mismo modo, conocer las diferencias entre inflamación aguda e inflamación crónica, mecanismos de reparación y adaptación celular. Como pudimos analizar de manera resumida, las respuestas por parte de las células del SNC a diferentes estímulos nocivos, son variadas. Al igual que cualquier otro órgano o sistema, en el SNC la dificultad que a menudo se plantea para identificar a una célula dañada, surge del hecho de que esta célula no se caracteriza por nuevos tipos de vías metabólicas, sino sólo por un aumento, disminución o desaparición de las actividades ya existentes en la célula intacta. Muchas veces esta situación hace que la detección de alteraciones funcionales y estructurales en las células y tejidos se convierta en un sutil y difícil desafío intelectual.
REFERENCIAS
1. Kumar–Abbas–Fausto. Robbins ando Cotran. Pathologic Basis of Disease. 7th edition. Chapter, 2005. [ Links ]
2. Francoise Gray, Umberto De Girolami, Jacques Poirier. Manual of Basic Neuropathology. Fourth Edition. Chapter 1; 1–20.2004. [ Links ]
3. David I Graham, Peter LLantos. Greenfield's Neuropathology. Sixth Edition.Chapter 3; 85–379. 1997. [ Links ]














