Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de micología
versión impresa ISSN 0187-3180
Rev. Mex. Mic vol.42 Xalapa dic. 2015
Originales
Producción de enzimas hidrolíticas y actividad antagónica de Trichoderma asperellum sobre dos cepas de Fusarium aisladas de cultivos de tomate (Solanum lycopersicum)
Production of hydrolytic enzymes and antagonic activity of Trichoderma asperellum on two strains of Fusarium isolated from tomato crop (Solanum lycopersicum)
Harold Alexander Vargas-Hoyos1* y Elizabeth Gilchrist-Ramelli2
1 Instituto de Biología, Universidad de Antioquia, Calle 67 Número 53-108, Medellín, Antioquia, Colombia.
2 Corporación Universitaria Lasallista, Carrera 51 Número 118 Sur-57, Caldas, Antioquia, Colombia.
*Autor para correspondencia:
Harold Alexander Vargas-Hoyos barharold@hotmail.com
Recibido: 08/09/2014.
Aceptado: 15/04/2015.
Resumen
El género Trichoderma presenta distribución mundial. Se han descrito diversas estrategias biológicas asociadas a su alta tasa de supervivencia en diferentes ambientes. En el control de microorganismos fitopatógenos, el antagonismo y la producción de enzimas degradoras de pared celular son las más destacadas. El objetivo de este trabajo fue determinar la capacidad antagónica de la cepa de Trichoderma asperellum T109 contra dos aislamientos nativos del hongo fitopatógeno Fusarium sp. (M2Raíz, M3Tallo) y evaluar el efecto de diferentes fuentes de carbono (almidón, pared celular de Rhizoctonia solani -PCRS-, quitina coloidal y laminarina) en la producción de glucanasas y quitinasas. La cepa T109 evidenció buena capacidad antagónica contra ambos aislamientos fitopatógenos, ya que se observó disminución en su capacidad de crecimiento del 60 y 40% para M2Raíz y M3Tallo, respectivamente. Se obtuvo producción de las enzimas líticas en todas las fuentes de carbono evaluadas. La actividad glucanasa fue mayor en el sustrato adicionado de PCRS. La actividad quitinasa no presentó diferencia significativa en todos los sustratos evaluados. Con los resultados obtenidos se pudo confirmar la capacidad antagónica in vitro de T. asperellum T109 contra dos cepas de Fusarium sp. aisladas de la planta del tomate y se estableció que dicha cepa es buena productora de enzimas hidrolíticas, particularmente glucanasas, en medio mínimo suplementado con PCRS.
Palabras clave: hongos fitopatógenos, control biológico, antagonismo in vitro, glucanasas, quitinasas.
Abstract
The soil fungi genera Trichoderma presents global distribution. There are different biological strategies associated to its high rate of survival on different environments. To control phytopathogenic fungi the most featured strategies are the antagonistic and the production of cell wall degrading enzymes. The aim of this work was to determine the antagonism capacity of the strain T109 of T. asperellum against two native isolates of Fusarium sp. (M2Root, M3Stem) and to evaluate the effect of different carbon sources (starch, cell wall of Rhizoctonia solani -PCRS-, colloidal chitin and laminarin) on the production of glucanases and chitinases. Trichoderma asperellum T109 showed good antagonistic activity against both phytopathogen isolates, shown a reduction in growth mycelial of 60% and 40% for M2Root and M3Stem, respectively. Both lytic enzymes were detectated on all evaluated carbon sources. The glucanase activity was higher on the substrate added with PCRS. Chitinase activity was not significantly different in all substrates evaluated. These results confirm the antagonist activity in vitro of T. asperellum T109 against phytopathogens presents on tomato crop, and it was determined that T109 strain is a good producer of glucanases especially in minimum media added with PCRS.
Keywords: phytopathogenic fungi, biological bontrol, in vitro, antagonism, glucanases, chitinases.
Introducción
La amplia gama de estrategias empleadas para la colonización, establecimiento y subsistencia, favorecen la adaptación de las especies del género Trichoderma, en casi cualquier ambiente (Samuels, 2006). La velocidad de crecimiento y producción de propágulos (Steyaert et al., 2010), colonización de la rizosfera (Benítez et al., 2004; Verma et al,. 2007), antibiosis (Harman y Lumsden, 1990; Paulitz y Belanger, 2001), producción de metabolitos y enzimas líticas (Antal et al., 2000; Vinale et al., 2008; Marcello et al., 2010) son algunos de los mecanismos que emplea este hongo para garantizar su presencia en el suelo, por lo que es considerado como el más prevalente de los microorganismos que interactúan en la rizósfera con diferentes plantas (Harman y Shoresh, 2007).
Los productos bioformulados de Trichoderma spp. han exhibido alto nivel de rendimiento como antagonistas de fitopatógenos (Benítez et al, 2004; Harman et al, 2004; Wijesinghe et al., 2010). A nivel mundial, la mayoría de los bioformulados de Trichoderma spp. se preparan a base de las especies T. viride, T. virens y en mayor proporción de T. harzianum (Benítez et al., 2004), siendo esta última especie la más evaluada (Harman et al., 1991; Taylor et al., 1991; De Marco et al., 2004; López-Mondéjar et al., 2012). En las regiones tropicales de Sur América, la especie prevalente de Trichoderma es T. asperellum (Hoyos-Carvajal et al., 2009b), sin embargo, es la menos estudiada (Marcello et al., 2010).
Básicamente, la evaluación del efecto de Trichoderma sp. se ha concentrado en dos modos de acción: 1) el control y/o disminución de la población de fitopatógenos en el suelo mediante el micoparasitismo, la competencia y la antibiosis (Elad, 2000; Avis et al, 2008; Chacón et al, 2007; Hoyos-Carvajal et al., 2009a) y, 2) el estímulo en la nutrición de la planta (Altomare et al., 1999). Durante el proceso de micoparasitismo, Trichoderma sp. emplea enzimas que disuelven la pared celular de los hongos que parasita, siendo las más conocidas las quitinasas y glucanasas (Antal et al., 2000; Cao et al., 2009). La competencia se desarrolla cuando en un mismo espacio confluyen especies del antagonista y de algún patógeno, ambos con necesidades nutritivas similares y donde la velocidad de crecimiento favorecerá el desarrollo de uno de los dos hongos (Avila-Miranda et al., 2006), la antibiosis ocurre cuando el hongo antagonista libera diferentes compuestos que afectan directamente al patógeno (Bailey et al., 2008; Vinale et al., 2008). A su vez, la planta puede recibir estímulo por medio de la colonización radicular para mejorar su nutrición y la liberación de compuestos que incrementan su crecimiento, como las auxinas (Harman et al., 2004), y por la inducción de resistencia sistémica al ataque de fitopatógenos que involucra dos mecanismos: resistencia sistémica adquirida (RSA) o resistencia sistémica inducida (RSI) (De Souza et al., 2008).
El tomate es el segundo cultivo vegetal de la clase magnoliópsida más importante a nivel mundial después de la papa (Solanum tuberosum) (Nzanza et al., 2012), con una producción global de aproximadamente 160 millones de toneladas para el año 2011 (Vos et al, 2014). En 2012, China fue el mayor productor con cerca de 50 millones de toneladas (FAOSTAT, 2014). De los principales microorganismos fitopatógenos que pueden causar pérdidas considerables en el cultivo del tomate se encuentra Fusarium sp. agente causal de la pudrición del cuello y la raíz del tomate. Se sabe que las especies de Fusarium poseen alta capacidad de adaptación a condiciones desfavorables de temperatura, nutriente y pH, entre otras (Michel, 2001). Dichas características favorecen su reproducción e invasión a diferentes hospederos, por lo que su erradicación en algunos casos resulta muy difícil. Para detener la acción de este patógeno se han evaluado métodos de control físico, cultural, químico y biológico.
Los microorganismos más usados en el control biológico han sido bacterias y hongos: en el caso de las bacterias, los géneros Pseudomonas spp., Bacillus spp. y Paenibacillus son los más comunes; para el caso de los hongos se destaca Trichoderma spp. (González et al., 2004). Se ha sugerido que especies del genero Trichoderma poseen buenas cualidades para el control de enfermedades en plantas causadas por el hongo patógeno Fusarium sp. (Suárez et al. 2008).
Teniendo en cuenta todo lo anterior, el objetivo de este trabajo fue evaluar la capacidad antagónica de Trichoderma asperellum contra aislamientos del hongo fitopatógeno Fusarium sp. asociados al tomate de mesa (Solanum lycopersicum) en medios de cultivo conteniendo diferentes fuentes de carbono y determinar la producción de enzimas hidrolíticas (específicamente glucanasas y quitininasas) durante el proceso de confrontación de los cultivos.
Materiales y Métodos
Cepa y condiciones de almacenamiento
Se utilizó el producto comercial Triderma® a base de Trichoderma asperellum (Hoyos-Carvajal et al., 2009b), suministrado por la empresa Biotropical S.A. Los aislamientos de fitopatógenos fueron obtenidos de raíz y tallo de cultivos de tomate que presentaron los síntomas de la enfermedad asociada a la infección por Fusarium sp., dichas cepas fueron nombradas como M2Raíz y M3Tallo. Triderma® y las cepas se mantuvieron en medio de Papa Dextrosa Agar (PDA, Bioxon) a 4°C en oscuridad, hasta su uso en las pruebas.
Pruebas de antagonismo in vitro
Se colocó un disco de 5 mm de diámetro de los fitopatógenos aislados del cultivo del tomate (Solanum lycopersicum) en cajas de Petri con PDA con 5 a 8 días de inoculados; en la misma caja se sembró un disco de 5 mm de diámetro del cultivo de Trichoderma asperellum (Triderma® con 8 días de crecimiento). La distancia entre los discos fue de 3 cm. Se prepararon 10 réplicas por enfrentamiento, además de los controles para el antagonista y para el fitopatógeno. Los cultivos se incubaron a 26°C por 8 días.
Determinación del Porcentaje de Inhibición (PI)
El porcentaje de inhibición del fitopatógeno se determinó en base al crecimiento del radio micelial (RI) de los controles (sin el antagonista) con respecto a los que estuvieron en presencia de los antagonistas. El RI se calculó de la siguiente manera:
RI=100 * (Rc-Ri)/Rc
Donde:
Ri (radio influenciado): es el radio de crecimiento micelial del patógeno, medido en la dirección del inóculo hacia el antagonista.
Rc (radio control): es el radio de crecimiento micelial del patógeno, medido en la dirección del radio máximo sin presencia del antagonista.
La toma de datos para determinar la actividad antagónica se realizó diariamente por 8 días. El experimento se repitió 2 veces.
Inducción y evaluación de las actividades enzimáticas del ingrediente activo del bioformulado Triderma®
El bioformulado de Triderma® fue sembrado en medio MYG (Marcello et al., 2010), que contiene; 0.5% extracto malta, 0.25% extracto de levadura, 1% glucosa y 2% de agar, incubándose a 26°C por 8 días. Las conidias fueron recolectadas por raspado de la superficie y resuspendidas en agua destilada estéril para ser centrifugadas a 2 000 rpm y se realizaron dos lavados, el pellet fue sembrado en medio TLE (Bara et al., 2003; Marcello et al., 2010) que contiene 0.1% de bactopeptona, 0.03% urea, 0.2% KH2PO4, 1.4% (NH4)2SO4, 0.03% MgSO4 7H2O, 0.03% glucosa y 0.5% pared celular de Rhizoctonia solani. El micelio obtenido fue sembrado en Medio Mínimo (MM) suplementado con una fuente de carbono única y diferente para cada cultivo: almidón (MM + A), pared celular de Rhizoctonia solani (MM + PCRS), quitina coloidal (MM + Q) y laminarina (MM + L). Los diferentes medios inoculados fueron incubados a 28°C durante 24 h, con una agitación de 140 rpm. La biomasa obtenida fue separada por filtración al vacío (BUCCHI V-700, controlador BUCCHI V-850) con un papel filtro con tamaño de poro de 0.45 pm (Millipore) a una presión de 130 mbar. El medio filtrado se congeló a -20°C para su posterior liofilización.
Las muestras liofilizadas fueron resuspendidas en solución buffer de acetato de sodio (50 mM, pH 5) para la determinación de las actividades de quitinasa y glucanasa. La actividad enzimática se evaluó siguiendo la metodología propuesta por Bara et al. (2003), modificada por Marcello et al., (2010), que consiste en mezclar 50 pl de la muestra resuspendida con 100 pl de la solución buffer de acetato de sodio suplementado con 0.25% de laminarina para el caso de las β-1, 3 glucanasas y 0.25% de quitina coloidal para el caso de las quitinasas. Las muestras fueron incubadas en baño maría a 40°C durante 30 min. La producción de azucares fue determinada por el método descrito por Miller (1959) utilizando N-acetil-D-glucosamina (GlcNAc) como estándar. Una unidad de actividad enzimática (UAE) fue definida como la cantidad de enzima que produce 1 μmol de glucosa por mL de extracto diluido por minuto bajo las condiciones descritas.
Análisis estadístico
Los tratamientos se compararon utilizando un análisis de varianza (ANOVA, p<0.05) seguida de la comparación de medias de Tukey. Se realizaron evaluaciones de homocedasticidad y normalidad de los datos utilizando los test de Levene y Kolmogorov-Smirnov, respectivamente.
Resultados
El crecimiento de los aislamientos fitopatógenos en presencia del antagonista disminuyó a partir del día 3, alcanzando para el día 8 un diámetro de 2.42 cm para M2Raíz y 260 cm para M3Tallo (Figura 1). Al comparar el crecimiento de los fitopatógenos en presencia del antagonista con sus respectivos controles, se observaron diferencias significativas a partir del día 4 (Figura 1).
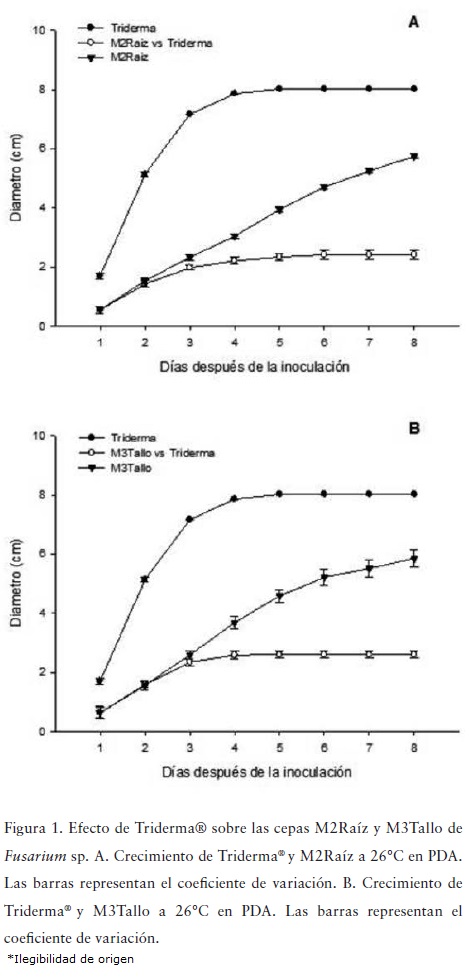
La velocidad de crecimiento fue significativamente diferente entre el control del Triderma® y los controles de ambos fitopatógenos (Figura 1). El valor máximo de crecimiento de Triderma® (8.02 cm) se encontró al día 5. Los controles de los fitopatógenos M2Raíz y M3Tallo presentaron un crecimiento continuo hasta el final del experimento (día 8 con 5.75 y 5.85 cm, respectivamente).
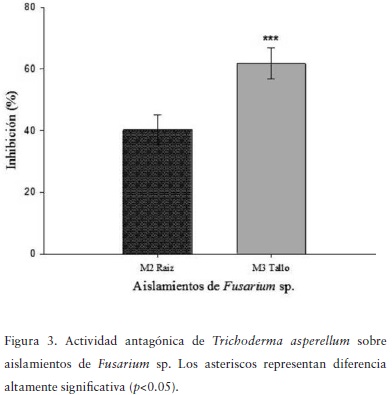
El aislamiento de Trichoderma asperellum presente en el bioformulado Triderma® evidenció capacidad antagónica contra hongos fitopatógenos aislados del cultivo del tomate (Figura 2). Los aislamientos fitopatógenos M2Raíz y M3Tallo presentaron disminución en su capacidad de crecimiento en presencia del antagonista del 60 y 40%, respectivamente (Figura 3).
Durante la evaluación de las diferentes fuentes de carbono utilizadas como sustrato en la producción de β-1, 3 glucanasas y quitinasas por parte de T. asperellum, se obtuvo producción de ambas enzimas líticas en todas las fuentes evaluadas, pero con variación dependiendo de la fuente de carbono evaluada (Figura 4). La mayor actividad de β-1,3 glucanasas fue detectada en los cultivos que contenían MM+PCRS (455.96 UAE), seguido de MM+Almidón (387.81 UAE), sin detectarse diferencias significativas entre ambos sustratos. En MM+Quitina (302.50 UAE) y MM+Laminarina (283.46 UAE) se observaron diferencias significativas con MM+PCRS y MM+Almidón (p<0.05) (Figura 4).
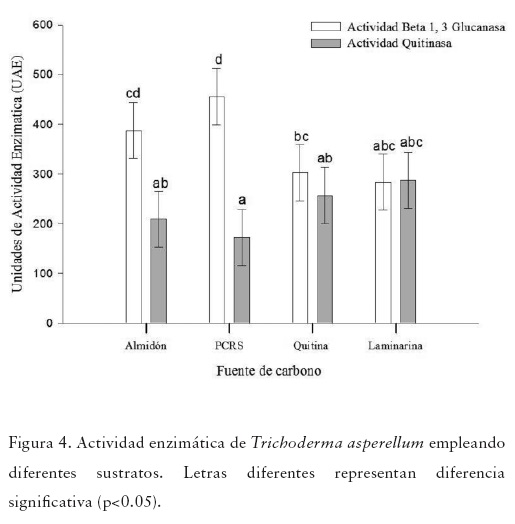
Para la producción de quitinasas, no se observaron diferencias significativas entre los sustratos evaluados. La mayor actividad β-1,3 glucanasa se obtuvo al utilizar MM+Laminarina (287.49 UAE), un 10% menos al utilizar MM+Quitina (256.90 UAE), un 27% menos al utilizar MM+Almidón (209.83 UAE) y finalmente un 40% menos al emplear MM+PCRS (172.43 UAE) (Figura 4).
Al comparar la producción de ambas enzimas hidrolíticas en cada sustrato, se encontraron diferencias significativas para MM+Almidón y MM+PCRS, en donde la mayor actividad enzimática se correspondió a β-1, 3 glucanasa, siendo casi 2 veces más que la actividad de quitinasa. Cuando se emplearon los sustratos MM+Quitina y MM+Laminarina no se observaron diferencias entre las actividades enzimáticas, especialmente en el último sustrato (Figura 4), lo que supone la presencia de complejos enzimáticos activos en estos aislamientos.
Discusión
La curva de crecimiento del antagonista refleja una típica forma exponencial, llegando a su fase estacionaria al día 5, lo cual confirma la habilidad de este microorganismo de adaptarse a condiciones de crecimiento in vitro y de colonizar rápidamente un espacio determinado (Hoyos-Carvajal et al., 2008; Vargas-Hoyos et al., 2012; Singh et al., 2014; Ruano-Rosa et al., 2014) lo que favorece la inhibición del crecimiento de los hongos fitopatógenos, hecho que se evidenció desde los primeros días del enfrentamiento (Figura 1).
El aislamiento de la especie T. asperellum presente en el bioformulado evaluado (Triderma®), mostró tener actividad biológica in vitro contra aislamientos de Fusaruim sp. aislados del cultivo de tomate , lo cual coincide con evaluaciones previas de Benítez et al., (2004); Marcello et al., (2010) y Vargas-Hoyos et al., (2012) quienes concluyeron que, entre varias especies evaluadas, T. asperellum presentó la mejor capacidad inhibitoria.
Las evaluaciones de cultivo dual evidenciaron sobrecrecimiento de T. asperellum sobre los aislamientos de Fusarium sp., coincidiendo con lo reportado por Michel (2001), quien describe que de 25 cepas de Trichoderma spp., 21 crecieron sobre el fitopatógeno Fusarium oxysporum. En este mismo trabajo se reporta que 23 de las cepas evaluadas detuvieron el crecimiento de Fusarium subglutinans y F. oxysporum.
Se ha descrito que las especies de Fusarium sp. poseen gran capacidad de adaptación a diferentes ambientes y un amplio intervalo de hospederos, además de tolerar gran cantidad de factores desfavorables (Michel, 2001). Con los resultados de las evaluaciones in vitro del presente trabajo, se puede sugerir que los aislamientos de este género poseen cierta afinidad específica con las parte de la planta de tomate que infectaron, para el caso del aislado obtenido de la raíz de las plantas del tomate (M2Raíz), éste debió estar sometido a mayor estrés ecológico y de interacción con diferentes microorganismos dentro de los cuales posiblemente estaba Trichoderma sp., lo que le permite soportar la presión por espacio nutrientes en condiciones particulares. Por su parte, el aislado de tallo de plantas de tomate está en un tejido más estable y alejado de otros microorganismos del suelo que puedan competir por nutrientes, haciéndolo más susceptible al estar en contacto con otros cultivos.
La actividad enzimática de hongos del género Trichoderma ha sido ampliamente evaluada y reportada (Busto et al., 1996; Rana et al., 2003; Djonovic et al., 2007; Lopes et al., 2012), asimismo, se ha descrito el papel que esta desempeña en la propiedad micoparasítica de este microorganismo (Bara et al., 2003; Grün et al., 2006; Marcello et al., 2010). Durante el proceso de micoparasitismo, Trichoderma sp. secreta gran cantidad de enzimas degradadoras de pared celular las cuales actúan directamente sobre los hongos fitopatógenos facilitando la entrada del microorganismo antagonista, quién obtiene los nutrientes y degrada el microorganismo invadido (Almeida et al., 2007; Ramada et al., 2010). Se ha encontrado que las quitinasas y glucanasas están directamente relacionadas en los mecanismos de micoparasitismo de las especies de Trichoderma sp. (Kubicek et al., 2001; Harman et al., 2004; Silva et al., 2012).
Los resultados del presente estudio mostraron la fuente de carbono afectó la producción total de glucanasas (Figura 4), determinándose una mayor actividad enzimática en el medio mínimo suplementado con pared celular de Rhizoctonia solani (MM+PCRS), lo que coincide con Bara et al., (2003) y Silva et al., (2012), quienes evaluaron la actividad β-1,3 glucanasa de aislamientos de Trichoderma asperellum en diferentes sustratos y encontraron la mayor actividad enzimática cuando se empleó PCRS. En ambos trabajos, las tres mayores actividades enzimáticas fueron halladas en orden decreciente en los medios suplementados con PCRS, Almidón y Quitina, esto coincide completamente con los hallazgos obtenidos en este trabajo (Figura 4) y muestra un patrón de comportamiento similar en el aislado de T. asperellum presente en el bioformulado Triderma®.
Los glucanos unidos por enlaces β-1-3 son los componentes más abundantes de las paredes celulares de los hongos (Harman, 2000). Reportes anteriores sugieren que bajo la inducción de PCRS, el tipo de productos de hidrólisis producido por T. asperellum requiere de exo-β-glucanasas (Bara et al., 2003) específicamente de dos 1,3-β-D-glucanasas extracelulares. Sin embargo, aún es poco lo que se conoce de estas enzimas, sólo que se controlan mediante una represión catabólica y que cada aislamiento con diferente fuente de carbono, puede presentar un perfil de producción particular.
Los resultados obtenidos para determinar la actividad quitinasa mostraron que no existió diferencia significativa para los diferentes sustratos evaluados (Figura 4). En todos los casos se encontró actividad, lo cual coincide con López-Mondejar et al., (2012), quienes al evaluar un aislamiento de T. harzianum en diferentes sustratos, encontraron actividad quitinolítica en todo los casos, siendo mayor al utilizar quitosán. Por otro lado Almeida et al. (2007), evaluaron 15 aislamientos de Trichoderma sp. y en todos ellos observaron actividad quitinolítica al inducir con PCRS. En nuestro caso, los aislamientos cultivados en esta fuente de carbono presentaron la actividad enzimática más baja, sin embargo no fue significativamente diferente al resto de los sustratos evaluados.
Se sabe que durante el proceso de micoparasitismo y posterior contacto de Trichoderma sp. con el micelio del fitopatógeno, se libera un complejo de enzimas hidrolíticas en las cuales confluyen entre otras, las glucanasas y quitinasas (Michel, 2005; Silva et al., 2012) resultando en una actuación sinérgica y más eficiente para ejercer biocontrol (Almeida et al., 2007). Por los resultados obtenidos, el aislamiento de T. asperellum presentó ambos tipos de actividad, por lo cual se convierte en una buena fuente de enzimas hidrolíticas con potencial biotecnológico. Por ello, resulta primordial ahondar en este tipo de conocimientos básicos que permitirán profundizar en el entendimiento de la biología de los aislamientos antagonistas y de esta manera potenciar su efectividad contra microorganismos fitopatógenos.
En este trabajo se confirmó la capacidad antagónica in vitro de aislados de Fusarium sp. del cultivo del tomate y una cepa de Trichoderma asperellum T 109. Se determinó que el aislamiento de T. asperellum presente en el bioformulado Triderma® produce enzimas hidrolíticas, particularmente glucanasas, involucradas en su capacidad antagónica in vitro. Los sustratos empleados para la evaluaciones in vitro, sugieren la existencia de rutas comunes de activación de las funciones enzimáticas, pero se requiere realizar investigaciones futuras en las cuales se pueda dilucidar el mecanismo particular llevado a cabo para cada enzima hidrolítica, con el fin de seleccionar el mejor sustrato y maximizar la producción de compuestos bioactivos.
Agradecimientos
Los autores agradecen el apoyo logístico a la Corporación para Investigaciones Biológicas, a la directora del laboratorio Central de Servicios, Gabriela Jaramillo. A la empresa Biotropical S.A. por el acompañamiento en el proceso investigativo y por permitir el uso de su formulado. Este trabajo se realizó gracias al soporte financiero de Colciencias: Proyecto # 221350227265 Contrato 521 de 2011.
Literatura citada
Almeida, F.B., F.M. Cerqueira, R.N. Silva, C.J. Ulhoa, A.L. Lima, 2007. Mycoparasitism studies of Trichoderma harzianum strains against Rhizoctonia solani: Evaluation of coiling and hydrolytic enzyme production. Biotechnology Letters 29: 1189-1193. [ Links ]
Altomare, C., W.A. Norvell, T. Björkman, G.E. Harman, 1999. Solubilization of phosphates and micronutrients by the plant-growth-promoting and biocontrol fungus Trichoderma harzianum Rifai 1295-22. Applied and Environmental Microbiology 65: 2926-2933. [ Links ]
Antal, Z., L. Manczinger, G. Szakacs, R.P. Tengerdy, L. Ferenczy, 2000. Colony growth, in vitro antagonism and secretion of extracellular enzymes in cold-tolerant strains of Trichoderma species. Mycological Research 104: 545-549. [ Links ]
Avila-Miranda, M.E., H.A. Estrella, P.J.J. Cabriales, 2006. Colonization of the rhizosphere, rhizoplane and endorhiza of garlic ( Allium sativum L.) by strains of Trichoderma harzianum and their capacity to control allium white-rot under field conditions. Soil Biology and Biochemistry 38: 1823-1830. [ Links ]
Avis, T.J., V. Gravel, H. Antoun, R.J. Tweddell, 2008. Multifaceted beneficial effects of rhizosphere microorganisms on plant health and productivity. Soil Biology and Biochemistry 40: 1733-1740. [ Links ]
Bailey, B.A., H. Bae, M.D. Strem, J. Crozier, S.E. Thomas, G.J. Samuels, B.T. Vinyard, K. A. Holmes, 2008. Antibiosis, mycoparasitism, and colonization success for endophytic Trichoderma isolates with biological control potential in Theobroma cacao. Biological Control 46: 24-35. [ Links ]
Bara, M.T., A.L. Lima, C.J. Ulhoa, 2003. Purification and characterization of an exo-β-1,3-glucanase produced by Trichoderma asperellum. FEMS Microbiology Letters 219: 81-85. [ Links ]
Benítez, T., A.M. Rincón, M.C. Limón, A.C. Codón, 2004. Biocontrol mechanisms of Trichoderma strains. International Microbiology 7: 249-260. [ Links ]
Busto, M.D., N. Ortega, M. Perez-Mateos, 1996. Location, kinetics and stability of cellulases induced in Trichoderma reesei cultures. Bioresource Technology 57: 187-192. [ Links ]
Cao R., X. Liu, K. Gao, K. Mendgen, Z.J. Kang, Gao, Y. Dai, X. Wang, 2009. Mycoparasitism of endophytic fungi isolated from reed on soil borne phytopathogenic fungi and production of cell wall-degrading enzymes in vitro. Current Microbiology 59: 584-592. [ Links ]
Chacón, M.R., O. Rodríguez-Galán, T. Benítez, S. Sousa, M. Rey, A. Llobell, J. Delgado-Jarana, 2007. Microscopic and transcriptome analyses of early colonization of tomato roots by Trichoderma harzianum. International Microbiology 10: 19-27. [ Links ]
De Marco, J.L., M.C. Valadares-Inglis, C.R. Felix, 2004. Purification and characterization of an N-acetylglucosaminidase produced by a Trichoderma harzianum strain which controls Crinipellis perniciosa. Applied Microbiology and Biotechnology 64: 70-75. [ Links ]
De Souza, J.T., B.A. Bailey, A.W.V. Pomella, E.F. Erbe, C.A. Murphy, H. Bae, P.K. Hebbar, 2008. Colonization of cacao seedlings by Trichoderma stromaticum a mycoparasite of the witches' broom pathogen, and its influence on plant growth and resistance. Biological Control 46: 36-45. [ Links ]
Djonovic, S., G. Vittone, A. Mendoza-Herrera, C.M. Kenerley, 2007. Enhanced biocontrol activity of Trichoderma virens transformants constitutively coexpressing β-1,3- and β-1,6-glucanase genes. Molecular Plant Pathology 8: 469-480. [ Links ]
Elad, Y., 2000. Biological control of foliar pathogens by means of Trichoderma harzianum and potential modes of action. Crop Protection 19: 709-714. [ Links ]
FAOSTAT, 2014. http://faostat3.fao.org/home/S, agosto 2104.
González, R., J. Montealegre, R Herrera, 2004. Control biológico de Fusarium solani en tomate mediante el empleo de los bioantagonistas Paenibacillus lentimorbus y Trichoderma spp. Ciencia e Investigación Agraria 31: 21-28. [ Links ]
Grun, C.H., N. Dekkerb, A.A. Nieuwlanda, F.M. Klisc, J.P. Kamerlinga, J.F.G. Vliegentharta, F. Hochstenbach, 2006. Mechanism of action of the endo-(1-3)β-glucanase MutAp from the myco-parasitic fungus Trichoderma harzianum. FEBS Letters 580: 3780-3786. [ Links ]
Harman, G.E., R.D. Lumsden, 1990. Biological disease control. In: Lynch J.M. (ed.), The rhizosphere. John Wiley and Sons Ltd, London, pp. 259-280. [ Links ]
Harman, G.E., X. Jin, T.E. Stasz, G. Peruzzotti. A.C. Leopold, A.G. Taylor, 1991. Production of conidial biomass of Trichoderma harzianum for biological control. Biological Control 1: 23-28. [ Links ]
Harman, G.E., 2000. Myths and dogmas of biocontrol: changes in perceptions derived from research on Trichoderma harzianum T-22. Plant Disease 84: 377-393. [ Links ]
Harman, G.E., C.R. Howell, A. Viterbo, I. Chet, M. Lorito, 2004. Trichoderma species-opportunistic, a virulent plant symbionts. Nature Reviews: Microbiology 2: 43-56. [ Links ]
Harman, G.E., M. Shoresh, 2007. The mechanisms and applications of symbiotic opportunistic plant symbionts. In: Vurro, M., J. Gressel (eds.), Novel biotechnologies for biocontrol agent enhancement and management. Springer, Heidelberg, pp. 131-155. [ Links ]
Hoyos-Carvajal, L., G. Duque, S. Orduz, 2008. Antagonismo in vitro de Trichoderma spp. sobre aislamientos de Sclerotinia spp. y Rhizoctonia spp. Revista Colombiana de Ciencias Hortícolas 2: 76-86. [ Links ]
Hoyos-Carvajal, L., S. Orduz, J. Bisset, 2009a. Growth stimulation in bean ( Phaseolus vulgaris L.) by Trichoderma. Biological Control 51: 409-416. [ Links ]
Hoyos-Carvajal, L., S. Orduz, J Bisset, 2009b. Genetic and metabolic biodiversity of Trichoderma from Colombia and adjacent neo-tropic regions. Fungal Genetics and Biology 46: 615- 631. [ Links ]
Kubicek, C.P., R.L. Mach, C.K. Peterbauer, M. Lorito, 2001. Trichoderma: from genes to biocontrol. Journal of Plant Pathology 83: 11-23. [ Links ]
Lopes, F.A.C., A.S. Steindorff, A.M. Geraldine, R.S. Brandao, V.N. Monteiro, M.L. Junior, A.S.G. Coelho, C.J. Ulhoa, R.N. Silva, 2012. Biochemical and metabolic profiles of Trichoderma strains isolated from common bean crops in the Brazilian Cerrado, and potential antagonism against Sclerotinia sclerotiorum. Fungal Biology 116: 815-824. [ Links ]
López-Mondéjar, R., M. Ros, J.A. Pascual, 2012. Mycoparasitismrelated genes expression of Trichoderma harzianum isolates to evaluate their efficacy as biological control agent. Biological Control 56: 59-66. [ Links ]
Marcello, C.M., A.S. Steindorff, S.P. Silva, R.N. Silva, L.A.M. Bataus, C.J. Ulhoa, 2010. Expression analysis of the exo-β-1,3-glucanase from the mycoparasitic fungus Trichoderma asperellum. Microbiological Research 165: 75-81. [ Links ]
Michel, A.C., 2001. Cepas nativas de Trichoderma spp. (Euscomycetes: Hypocreales), su antibiosis y micoparasitismo sobre Fusarium subglutinans y F. oxysporum (Hyphomycetes: Hyphales). Universidad de Colima. Tesis de doctorado, Tecoman, 162 p. [ Links ]
Michel, A.C., M.A. Otero, O. Rebolledo, R. Lezama, M.E. Ochoa, 2005. Producción y efecto antagónico de quitinasas y glucanasas por Trichoderma spp., en la inhibición de Fusarium subglutinans y F. oxysporum in vitro. Revista Chapingo; Serie Horticultura 11: 273-278. [ Links ]
Miller, G.L., 1959. Use of dinitrosalicylic acid reagent for the determination of reducing sugar. Analitical Chemistry 31: 426-428. [ Links ]
Nzanza, B., D. Maraisa, P. Soundy, 2012. Yield and nutrient content of tomato (Solanum lycopersicum L.) as influenced by Trichoderma harzianum and Glomus mosseae inoculation. Scientia Horticulturae 144: 55-59. [ Links ]
Paulitz, T.C., R.R. Belanger, 2001. Biological control in greenhouse systems. Annual Review of Phytopathology 39: 103-133. [ Links ]
Ramada, M.H.S., F.A.C. Lopes, C.J. Ulhoa, R.N. Silva, 2010. Optimized microplate β-1,3-glucanase assay system for Trichoderma spp. screening. Journal of Microbiological Methods 81: 6 -10. [ Links ]
Rana, D.S., K. Theodore, G.S.N. Naidu, T. Panda, 2003. Stability and kinetics of β-1,3-glucanse from Trichoderma harzianum. Process Biochemistry 39: 149-155. [ Links ]
Ruano-Rosa, D., F.M. Cazorla, N. Bonilla, R. Martín-Pérez, A. De Vicente, C .J. López-Herrera, 2014. Biological control of avocado white root rot with combined applications of Trichoderma spp. and rhizobacteria. European Journal of Plant Pathology 138: 751-762. [ Links ]
Samuels, G.J., 2006. Trichoderma: Systematics, the sexual state, and ecology. Phytopathology 96: 195-206. [ Links ]
Silva, R., A.S. Steindorffb, M.H. Soller, S.J. Linhares de Siqueirab, C.J. Ulhoa, 2012. Biochemical characterization of a 27 kDa 1,3 β-D-glucanase from Trichoderma asperellum induced by cell wall of Rhizoctonia solani. Carbohydrate Polymers 87: 1219-1223. [ Links ]
Singh, R.K., P. Kumar, N.N. Tiwari, S.P. Singh, A.K. Tiwari, S.K. Vishwakarma, A. Singh, A. Kumar, 2014. Role of endochitinase gene and efficacy of Trichoderma against Colletotrichum falcatum Wen, causing red rot disease in sugarcane. Sugar Technology 16: 180-188. [ Links ]
Steyaert, J.M., R.J. Weld, A. Stewart, 2010. Isolate-specific conidiation in Trichoderma in response to different nitrogen sources. Fungal Biology 114: 179-188. [ Links ]
Suárez, C.L., R.J. Fernandez, N.O. Valero, R.M. Gamez, A.R. Paéz, 2008. Antagonismo in vitro de Trichoderma harzianum Rifai sobre Fusarium solani (Mart) Sacc., asociado a la marchitez en maracuyá. Revista Colombiana de Biotecnología 10: 35-43. [ Links ]
Taylor, A.G., T.G. Min, G.E. Harman, X. Jin, 1991. Liquid coating formulation for the application of biological seed treatments of Trichoderma harzianum. Biological Control 1: 16-22. [ Links ]
Vargas-Hoyos, H.A., E.A. Rueda-Lorza, E. Gilchrist-Ramelli, 2012. Actividad antagónica de Trichoderma asperellum (Fungi: Ascomycota) a diferentes temperaturas. Actualidades Biológicas 34: 103-112. [ Links ]
Verma, M., S.K. Brar, R.D. Tyagi, R.Y. Surampalli, J.R. Valero, 2007. Antagonistic fungi, Trichoderma spp.: Panoply of biological control. Biochemical Engineering Journal 37: 1-20. [ Links ]
Vinale, F., K. Sivasithamparam, E.L. Ghisalberti, R. Marra, M.J. Barbetti, H. Li, S.L. Woo, M. Lorito, 2008. A novel role for Trichoderma secondary metabolites in the interactions with plants. Physiological and Molecular Plant Pathology 72: 80-86. [ Links ]
Vos, C.M., Y. Yang, B. De Coninck, B.P.A. Cammue, 2014. Fungal (-like) biocontrol organisms in tomato disease control. Biological Control 74: 65-81. [ Links ]
Wijesinghe, C.J., R.S. Wilson Wijeratnam, J.K.R.R. Samarasekara, R.L.C. Wijesundera, 2010. Biological control of Thielaviopsis paradoxa on pineapple by an isolate of Trichoderma asperellum. Biological Control 53: 285-290. [ Links ]














