Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de micología
versión impresa ISSN 0187-3180
Rev. Mex. Mic vol.37 Xalapa jun. 2013
Contribuciones
Caracterización de los extractos metanólicos de poda de vid y paja de trigo y su oxidación por enzimas extracelulares de Lentinula edodes
Characterization of methanolic extracts of vineyard pruning and wheat straw and its oxidation by extracellular enzymes from Lentinula edodes
Rosina Cabrera1, Elisa M. Valenzuela-Soto1, Yolanda Reyes-Vidal1, Martín Esqueda2, Ali Asaff 1
1 Coordinación de Ciencia de los Alimentos.
2 Coordinación de Tecnología de Alimentos de Origen Vegetal, Centro de Investigación en Alimentación y Desarrollo A.C., Carretera a La Victoria Km 0.6, C.P. 83304, Hermosillo, Sonora, México.
* Autor para correspondencia:
Ali Asaff asaff@ciad.mx
Recibido 19 de octubre 2011;
Aceptado 5 de junio 2013.
Abstract
Lentinula edodes is a mushroom of commercial interest which can be grown on several lignocellulosic substrates, such as vineyard pruning and wheat straw. In this study we obtained methanolic extracts from both of these substrates, and crude enzymatic extract from L. edodes. The methanolic extracts were analyzed and characterized by thin layer chromatography and spectrophotometry finding that vineyard pruning extracts contained at least six UV light-active fractions; the three most polar fractions (Rf< 0.5) were easily oxidized by the fungal extract with for without ABTS intermediary. In contrast, the methanolic extract of wheat straw showed only three fractions dimly revealed to UV light, which were not oxidized by the enzymatic extract even using ABTS. The presence of a higher number or subfractions in vineyard pruning methanolic extract, their possible higher concentration and the easily with which some of them were transformed by the fungus extracellular enzymes would explain in part because vineyard pruning is an excellent substrate for mushroom cultivation regarding to other substrates.
Key words: shiitake, laccases, agricultural wastes, oxidation.
Resumen
Lentinula edodes es un hongo de interés comercial que puede ser cultivado sobre diversos residuos lignocelulósicos, como poda de vid y paja de trigo. En el presente trabajo se obtuvieron los extractos metanólicos de poda de vid y paja de trigo y el extracto enzimático crudo de L. edodes. Los extractos metanólicos fueron analizados y caracterizados por cromatografía de capa fina y espectrofotometría encontrando que el extracto de poda de vid contiene al menos 6 fracciones claramente visibles a la luz UV y que las 3 de mayor polaridad (Rf< 0.5) son fácilmente oxidables por el extracto enzimático del hongo, con o sin el uso del mediador ABTS. Por su parte, el extracto metanólico de paja de trigo mostró solo tres fracciones tenuemente reveladas a la luz UV, no oxidables por el extracto enzimático aun empleando al mediador ABTS. La presencia en el extracto de poda de vid de un mayor número de subfracciones, su posible mayor concentración y la facilidad con que algunas de ellas son transformadas por las enzimas extracelulares del hongo contribuyen a explicar parcialmente porque la poda de vid es un mejor sustrato para el cultivo de L. edodes que la paja de trigo.
Palabras clave: shiitake, lacasas, residuos agrícolas, oxidación.
Introducción
Lentinula edodes (Berk.) Pegler, conocido como shiitake, es un hongo que pertenece al grupo de los hongos que causan la pudrición blanca. Su producción es de gran interés comercial, pues sus cuerpos fructíferos son comestibles y contienen sustancias bioactivas con propiedades medicinales (Chang, 1996). Este hongo tiene la capacidad de crecer sobre residuos lignocelulósicos, por lo que se cultiva en pajas y salvados de trigo, cebada, arroz y residuos de algodón con rendimientos aceptables (Sánchez y Royse, 2001).
También se ha reportado que la poda de vid es un excelente sustrato para el cultivo de L. edodes, ya que reduce el tiempo de fructificación, incrementa la bioconversión del sustrato (Fragoso et al., 2004; Gaitán-Hernández et al., 2006) y aumenta la actividad de sus principales enzimas ligninolíticas (Harris-Valle et al., 2007). La reducción en el tiempo de fructificación se relaciona con un aumento en la velocidad específica de crecimiento en relación a la obtenida con paja de trigo (Cabrera, 2010).
El crecimiento de L. edodes sobre material lignocelulósico se debe a su capacidad de producción de enzimas hidrolíticas (celulasas y hemicelulasas) y oxidativas (ligninolíticas), que catalizan reacciones de óxido-reducción para degradar los componentes poliméricos en moléculas de bajo peso molecular, que pueden ser asimiladas como nutrientes por el organismo (Leatham, 1985). Entre las enzimas oxidativas que participan directa o indirectamente en la degradación de la lignina se encuentran las familias de lignina peroxidasa (LiP), manganeso peroxidasa (MnP) y lacasa (Kersten y Cullen, 2007).
En años recientes las lacasas, un tipo de fenoloxidasas, también han sido utilizadas para la oxidación de compuestos no fenólicos mediante la acción de sustancias co-oxidantes denominadas mediadores (Bourbonnais et al., 1998). El ácido 2,2'-azino-bis (3-etilbenzotiazolina-6 sulfónico) (ABTS) es el mediador de lacasa más estudiado debido a su alta estabilidad y su conocida química redox (Collins et al., 1998).
El objetivo del presente trabajo fue caracterizar los extractos metanólicos de poda de vid y paja de trigo a través de cromatografía de capa fina y espectros de absorción y evaluar la oxidación del material contenido por el complejo enzimático extracelular de L. edodes.
Materiales y métodos
Obtención de los extractos metanólicos
Se obtuvieron los extractos metanólicos de poda de vid y paja de trigo por maceración. Las muestras se trituraron en un molino mecánico hasta un tamaño de partícula homogénea de 0.5 mm, se dejaron reposar en ausencia de luz durante 16 días a 25°C. Los extractos se concentraron eliminando el solvente con un rotavapor.
Los extractos se caracterizaron por cromatografía en capa fina (TLC). Se utilizó como fase estacionaria placas de aluminio (sílicagel 60F254), como fase móvil la mezcla cloroformo-metanol-ácido fórmico (85:15:1) y se reveló con luz UV (λ=260nm).
Microorganismos y medios de cultivo
Se utilizó la cepa IE-105 de Lentinula edodes donada por el Cepario de Hongos del Instituto de Ecología, Xalapa, Veracruz. La cepa se mantuvo en cajas de Petri conteniendo agar papa dextrosa (PDA), refrigeradas a 4°C. El inóculo se preparó creciendo la cepa durante 16 días en cajas de Petri conteniendo glucosa-peptona agar (GPA) a 25°C y cortando discos de 6 mm de diámetro de la periferia con desarrollo micelial reciente.
Para la obtención del extracto enzimático extracelular crudo, la cepa se creció en matraces Erlenmeyer conteniendo 30 mL de un medio de composición químicamente definida, descrito por Kirk et al. (1976), conteniendo 2 g de KH2PO4, 0.5 g de MgSO4 7H2O, 0.1 g de CaCl2, 2 g de NH4NO3 y 5 g de carboximetilcelulosa (CMC), pH 4.5. Los matraces se inocularon con 6 discos, manteniéndolos a 25 °C y una agitación de 150 rpm durante 14 días.
Obtención del extracto enzimático crudo
Primeramente se separó el micelio del medio de cultivo por filtración con una membrana de nitrocelulosa (0.45 μm). El filtrado se empleó para obtener las proteínas extracelulares por precipitación con acetona, manteniendo una relación de 15 mL de acetona por cada 3 mL de filtrado. El extracto obtenido se colocó a -20 °C durante 6 h, para después centrifugar a 5000 rpm por 10 min.
El precipitado se resuspendió en un volumen de solución amortiguadora de acetato de sodio 50 mM y KCl 10 mM, pH 4.0 y 250 μM de fenil-metil-sulfonil fluoruro como inhibidor de proteasas que representaba el 1% del volumen utilizado en la precipitación. Las muestras se conservaron a -80 °C hasta su utilización para los ensayos de actividad enzimática (Harris-Valle et al., 2007).
Ensayo de actividad de oxidorreductasa
La actividad oxidasa se cuantificó midiendo la oxidación de 2,2'-azino-bis (3-etil-benzotiazolina-6-sulfonato) (ABTS) 0.3 mM en una solución de malonato de sodio 5 mM, pH 4.5, monitoreando la absorbancia a 420 nm en un espectrofotómetro (Ultrospec 4000, Pharmacia) y utilizando un coeficiente de extinción molar de 36 000 M-1cm-1 (Zhao et al., 1996).
Interacción extracto enzimático/secretoma-extractos metanólicos (con o sin ABTS)
Se obtuvieron espectros de absorción en un rango de longitud de onda de 200-900 nm. Las mediciones se hicieron en un espectrofotómetro (Ultrospec 4000, Pharmacia) colocando 40 μL de extracto crudo y 960 μL de mezcla de reacción (buffer malonato de sodio 5 mM, pH 4.5; ABTS 0.3 mM; extracto metanólico en una concentración final de 2 mg/mL).
El extracto de poda de vid se solubilizó en acetona-agua (relación 3:1 en volumen) y se centrifugó a 8000 rpm durante 6 min para eliminar la fracción insoluble y recuperar la porción soluble, con la cual se realizaron los ensayos.
Los estudios de interacción de oxidorreductasas con las fracciones separadas de los extractos metanólicos por cromatografía de capa fina fueron realizados directamente sobre las placas. Para el efecto, las placas eluidas con la fase móvil cloroformo-metanol-ácido fórmico (85:15:1) fueron secadas hasta eliminar la fase, luego asperjadas con una solución de ABTS al 0.2%. De la periferia del inóculo cultivado en cajas de Petri se cortaron pequeños discos de 6 mm de diámetro con desarrollo micelial reciente del hongo y conteniendo su secretoma. Estos discos fueron puestos a lo largo de las placas de cromatografía en los lugares que contenían alguna fracción del extracto (marcados luego de revelar con luz UV). Finalmente el sistema fue depositado en cajas Petri de vidrio, conteniendo algodón húmedo para evitar la desecación de los discos de agar con el hongo, mantenidas a 28°C durante 48 h, al cabo de las cuales se observaron los cambios de color.
Resultados y discusión
En la Figura 1 se presentan las placas de cromatografía de capa fina de los extractos metanólicos de paja de trigo (Figura 1A) y poda de vid (Figura 1B). En el caso del extracto de paja de trigo se observaron 3 subfracciones tenuemente reveladas por luz UV, mientras que el extracto de poda de vid (EMPV) mostró la presencia de al menos seis subfracciones de diferente intensidad. De las fracciones del EMPV, al menos 4 tuvieron Rf menores a 0.5 lo que indica, de acuerdo a las fases utilizadas, que son compuestos polares, posiblemente de naturaleza ácida. Justamente estas subfracciones, que además se observan como las más abundantes o altamente activas a la luz UV, promovieron la pigmentación parda de discos de agar, conteniendo el secretoma de L. edodes, que fueron depositados sobre las cromatoplacas luego de su aspersión con ABTS (Figura 1C). De manera diferente, los discos depositados sobre las fracciones con Rf >0.5, desarrollaron un color azul característico del radical catiónico ABTS+, indicando que el secretoma únicamente logró la oxidación del ABTS. Aunque no se presenta en la Figura 1, la placa cromatográfica del extracto de paja de trigo sometida a una prueba similar promovió únicamente la pigmentación azul de los discos de agar. Existen estudios realizados con hongos de la pudrición café o moderadamente ligninolíticos, en donde se ha observado el desarrollo de una pigmentación café del sustrato ocasionado por una oxidación parcial de la lignina (Martínez et al., 2005).
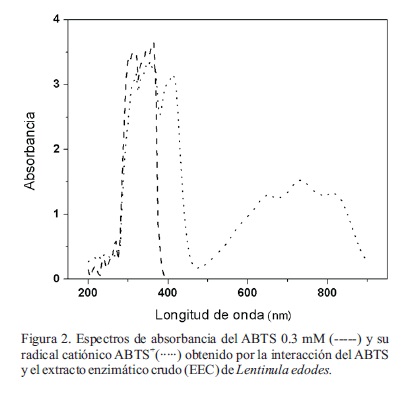
En la Figura 2 se presentan los espectros de absorción característicos de la molécula de ABTS y del producto de la acción enzimática del extracto crudo (EEC) sobre el ABTS. Aunque en esta figura se observa que las muestras empleadas estuvieron muy concentradas al alcanzar absorbancias máximas cercanas a las 4 UA, los perfiles del ABTS y su producto de oxidación ABTS + son idénticos a los descritos por la literatura (Solís-Oba et al., 2005). Al no ser una prueba cuantitativa, no resulta relevante una posible saturación del sistema. En el caso de la molécula de ABTS se observan dos máximos a 320 y 365 nm mientras que en el producto de oxidación, estos máximos disminuyen ligeramente y se generan nuevos picos con máximos a los 410, 650 y 730 nm. Cabe mencionar que estos máximos corresponden al espectro característico del primer estado de oxidación del ABTS, el radical catiónico ABTS+, tal como es reportado por Solís-Oba et al. (2005), con máximos a 414, 646 y 728 nm. Las lacasas son capaces de oxidar compuestos fenólicos o al ABTS en presencia de O2 atmosférico (Youn et al., 1995). A diferencia de las lacasas, las peroxidasas si bien pueden oxidar el ABTS, requieren de H2O2 como co-sustrato (Tien y Kirk, 1984), el cual sin embargo, es generado en la reacción catalizada por las lacasas. Todos estos aspectos sugieren que la oxidación del ABTS puede ser ocasionada por estos tipos de fenol oxidasas contenidas en el EEC de L. edodes.
En la Figura 3 se presentan los espectros de absorción del extracto metanólico de la poda de vid (EMPV) y de los productos resultantes de la reacción de dicho extracto con el radical catiónico ABTS+, obtenido previamente mediante la acción enzimática del EEC de L. edodes. El EMPV mostró máximos de absorbancia a los 210, 230, 250, 275, 285, 310, 330 y 350 nm. El espectro de los productos de reacción muestra únicamente dos picos máximos (320 y 365 nm) que coinciden con los de la molécula de ABTS (estado reducido). El cambio del espectro de absorción del EMPV luego de la reacción y la no detección de los picos máximos del radical catiónico ABTS+ a 410, 650 y 730 nm indica una oxidación de los compuestos contenidos en el EMPV, provocada por la reducción del radical catiónico ABTS+.
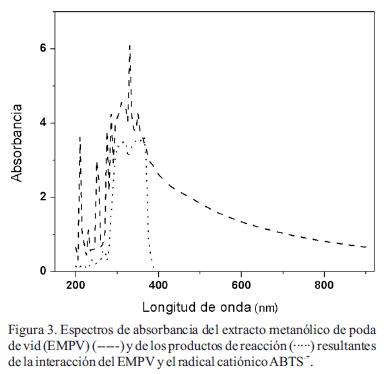
Se ha demostrado que la lacasa puede catalizar el acoplamiento del ABTS con derivados fenólicos en pocos minutos y que el radical catiónico se encuentra involucrado en dicho proceso (Matsumura et al., 1986). Apoyando esta hipótesis, Bourbonnais et al. (1998) demostraron que el radical catiónico ABTS+ reacciona eficientemente con compuestos fenólicos, tales como alcohol vainillínico, formando radicales vainillil, dicho proceso se encuentra involucrado en la degradación de lignina. De acuerdo a esto y a los cambios observados en los espectros de absorción de este estudio, posiblemente en el EMPV se encuentren presentes compuestos fenólicos que interactúan con el radical catiónico (ABTS+), generándose de esta forma un ciclo de acoplamiento entre las especies reaccionantes. El modelo propuesto para la reacción de las enzimas lacasas sobre moléculas mediadoras de bajo peso molecular como el ABTS y la acción oxidante de su radical se presenta en la Figura 4.
Cuando se añadió directamente el EEC de L. edodes sobre el EMPV, el fenómeno descrito fue similar al del sistema anterior en el que se hizo reaccionar el radical ABTS+ con el EMPV. En el espectro de los productos de la reacción destacaron la disminución en los máximos de absorción del EMPV (210, 230, 250, 275, 285, 310, 330 y 350 nm) y la presencia de dos máximos a 310 y 350 nm, muy similar a lo observado en la Figura 3. Este hecho sugiere que los compuestos contenidos en el EMPV pueden ser directamente oxidados por el EEC, prescindiendo del uso del mediador ABTS.
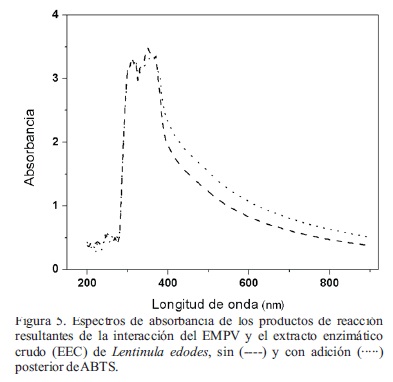
No se detectaron diferencias en los espectros de absorción cuando a los productos de reacción se les adicionó ABTS (Figura 5). Al parecer los picos máximos a 410, 650 y 730 nm del ABTS+ no se alcanzan a observar porque se encuentran traslapados con el espectro de los productos de oxidación del EMPV. Otra posibilidad es que el ABTS+ continúe reaccionando con compuestos del EMPV retomando inmediatamente a su forma reducida (ABTS), carente de dichos picos. La reactividad de la enzima lacasa y otras oxidorreductasas depende del potencial redox de los compuestos que pueda utilizar como sustrato, así se requieren sustratos con potencial redox alto para que la enzima pueda iniciar su ciclo catalítico (d' Acunzo et al., 2002). Las moléculas mediadoras como el ABTS, tienen como función activar a la enzima iniciando el proceso de oxidación de los residuos no fenólicos de la lignina y de grupos fenólicos no accesibles para la enzima (Bourbonnais et al., 1998). Los resultados obtenidos en este experimento sugieren que los compuestos del EMPV, oxidados por el EEC, son compuestos fenólicos no complejos, de fácil acceso a la enzima y de potencial redox elevado, por lo que no requieren de un mediador para ser oxidados. Cabe señalar que estos estudios se centraron sobre el EMPV como resultado de la primera prueba de cromatografía de capa fina donde se observó una cantidad mínima de compuestos en el extracto de paja de trigo y que prácticamente éstos no pudieron ser oxidados con el secretoma de L. edodes, aún con el uso del mediador ABTS.
Los resultados muestran que a diferencia del extracto metanólico de paja de trigo, el EMPV contiene una importante cantidad de subfracciones, varias de las cuales pueden ser oxidadas por las fenol oxidasas excretadas por L. edodes, sugiriendo que la poda de vid está formada por un material que puede ser metabolizado más fácilmente por el sistema enzimático del hongo. Los productos de oxidación probablemente son empleados como nutrientes por el hongo, aspecto que explicaría el incremento de su velocidad específica de crecimiento, la reducción del tiempo de fructificación y el incremento del rendimiento de conversión en relación a cuando es crecido sobre otros sustratos, tal como han reportado algunos autores.
Agradecimientos
Los autores agradecen el apoyo técnico de: Q.B. Socorro Vallejo Cohen, M.C. Aldo Gutiérrez y M.C. Alfonso Sánchez. RCR agradece el apoyo de CONACyT por su beca para estudios de maestría.
Literatura citada
Bourbonnais, R., D. Leech, M.G. Paice, 1998. Electrochemical analysis of the interactions of laccase mediators with lignin model compounds. Biochimica et Biophysica Acta 1379: 381-390. [ Links ]
Cabrera, R., 2010. Efecto de la poda de vid sobre los parámetros de crecimiento y producción de enzimas lignilolíticas de Lentinula edodes. Tesis de Maestría, CIAD, Hermosillo, Sonora, México. [ Links ]
Chang, R., 1996. Functional properties of edible mushrooms. Nutrition Reviews 54: 91-93. [ Links ]
Collins, P. J., A. D. W. Dobson, J. A.Field, 1998. Reduction of the 2,2-Azino-bis (3-ethylbenzthiazoline-6-sulfonate) cation radical by physiological organic acids in the absence and presence of manganese. Applied and Environmental Microbiology 64:2026-2031. [ Links ]
D' Acunzo, F., C. Galli, B. Masci, 2002. Oxidation of phenols by laccase and laccase-mediator systems. European Journal of Biochemistry 269: 5330-5335. [ Links ]
Fragoso, T., A. Gutiérrez, A. Sánchez, R. E. Villegas, M. Esqueda, 2004. Cambios en la composición química de madera de vid, manzano y encino por Lentinula edodes (Berk.) Pegler. Biotecnia 6: 3-12. [ Links ]
Gaitán-Hernández, R., M. Esqueda, A. Gutiérrez, A. Sánchez, M. Beltrán-García, G. Mata, 2006. Bioconversion of agrowastes by Lentinula edodes: the high potential of viticulture residues. Applied Microbiology and Biotechnology 71: 432-439. [ Links ]
Harris-Valle, C., M. Esqueda, A. Sánchez, M. Beltrán-García, E.M. Valenzuela-Soto, 2007. Polar vineyard pruning extract increase the activity of the main ligninolytic enzymes in Lentinula edodes cultures. Canadian Journal of Microbiology 53: 1150-1157. [ Links ]
Kersten, P., D. Cullen, 2007. Extracellular oxidative systems of the lignin-degrading Basidiomycete Phanerochaete chrysosporium. Fungal Genetics and Biology 44: 77-87. [ Links ]
Kirk, T. K., W.J. Connors, J. G. Zeikus, 1976. Requirement for a growth substrate during lignin decomposition by two wood-rotting fungi. Applied and Environmental Microbiology 32: 192-194. [ Links ]
Leatham, G. F., 1985. Extracellular enzymes produced by the cultivated mushroom Lentinus edodes during degradation of a lignocellulosic medium. Applied and Environmental Microbiology 50: 859-867. [ Links ]
Martínez, A. T., M. Speranza, F. J. Ruiz-Dueñas, P. Ferreira, S.Camarero, F. Guillén, M. J. Martínez, A. Gutiérrez, J. C. del Rio, 2005. Biodegradation of lignocellulosics: microbial, chemical and enzymatic aspects of the fungal attackof lignin. International Microbiology 8: 195-204. [ Links ]
Matsumura, E., E. Yamamoto, A. Numata, T. Kawano, T. Shin, S. Murao, 1986.Structures of the laccase-catalyzed oxidation products of hydroxybenzoic acids in the presence of ABTS [2, 2'-Azino-di-(3-ethylbenzothiazoline-6-sulfonic acid]. Agricultural and Biological Chemistry 50: 1355-1357. [ Links ]
Sánchez, J. E., D. Royse, 2001. La biología y el cultivo de Pleurotus spp. Editorial Limusa, . México, D.F. [ Links ]
Solís-Oba, M., V.M. Ugalde-Saldívar, I. González, G. Viniegra-González, 2005. An electrochemical-spectrophotometrical study of the oxidized forms of the mediator 2, 2'-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid) produced by immobilized laccase. Journal of Electroanalytical Chemistry 579: 59-66. [ Links ]
Tien, M., T. K. Kirk, 1984. Lignin-degrading enzyme from Phanerochaete chrysosporium: purification, characterization, and catalytic properties of a unique H2O2-requering oxygenase. Proceedings of the National Academy of Sciences of the United States of America 81: 2280-2284. [ Links ]
Youn, H. -D., Y. C. Hah, S. -O. Kang, 1995. Role of laccase in lignin degradation by white-rot fungi. FEMS Microbiology Letters 132: 183-188. [ Links ]
Zhao, J., T.H. de Koker, B.J. Janse, 1996. Comparative studies of lignin peroxidase and manganese-dependent peroxidases produced by selected white rot fungi in solid media. FEMS Microbiology Letters 145: 393-399. [ Links ]














