Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de micología
versión impresa ISSN 0187-3180
Rev. Mex. Mic vol.33 Xalapa jun. 2011
Contribuciones
Crecimiento, esporulación y germinación in vitro de cinco cepas de Metarhizium y su virulencia en huevos y ninfas de Bemisia tabaci
In vitro growth, sporulation and germination of five strains of Metarhizium and their virulence on Bemisia tabaci eggs and nymphs
Esaú Ruiz–Sánchez1, Wilberth Chan–Cupul1, Alfonzo Pérez Gutiérrez1, Jairo Cristóbal–Alejo1 Basilio Uch–Vázquez1, José M. Tun–Suárez1, Ricardo Munguía–Rosales2
1 Instituto Tecnológico de Conkal. División de Estudios de Posgrado e Investigación. Km 16.3 Antigua Carretera Mérida–Motul, Conkal, Yucatán.
2 Comite Estatal de Sanidad Vegetal del Estado de Yucatán. Calle 19 # 443 Colonia Ciudad Industrial, Mérida, Yucatán. C. P. 97288.
Autor para correspondencia:
Esaú Ruiz
esau_ruiz@hotmail.com
Recibido 4 de agosto 2009;
aceptado 21 de septiembre 2010.
Abstract
In vitro growth, sporulation and germination of four wild and one commercial strains of Metarhizium and their virulence on Bemisia tabaci eggs and second instar nymphs under laboratory and greenhouse conditions were evaluated. The radial growth of the colony was significantly lower for MaSin strain (0.30 cm/day). The sporulation was significantly higher in MaSin (8.5x106 conidia/ml) and MaCol strains (6x106 conidia/ml). The conidial germination was not significantly different between the strains evaluated. The virulence of the Metarhizium strains on B. tabaci was evaluated by immersion of leaves that contained eggs or nymphs in conidial suspension (1 x 107 conidia/ml). There was no significant difference on mortality of eggs under laboratory (9.9–32.2%) or greenhouse (18.7–30.7%) conditions by the effects of the Metarhizium isolates. There was no difference either on mortality of nymphs (67.7–88.2%) by the effects of the strains in laboratory conditions. However, in greenhouse conditions, MaSan and MaCol strains caused significantly higher mortality, with values of 60 y 50.5%, respectively. These results indicated that all strains are more virulent for nymphs than for eggs of B. tabaci. MaSan and MaCol strains could be potential candidates for the management of B. tabaci.
Keywords: biological control, entomophatogenic fungi, whitefly.
Resumen
Se evaluó el crecimiento, esporulación y germinación in vitro de cuatro cepas nativas y una comercial de Metarhizium y su virulencia en huevos y ninfas de segundo instar de Bemisia tabaci bajo condiciones de laboratorio e invernadero. El crecimiento radial de la cepa MaSin (0.30 cm/día) fue significativamente menor a lo observado en el resto de las cepas. La esporulación fue significativamente mayor en la cepa MaSin (8.5 x 106 conidios/ml) y MaCol (6 x 106 conidios/ml). No se observó diferencia significativa en la germinación de conidios. La virulencia se evaluó por inmersión de B. tabaci en una suspensión de 1 x 107 conidios/ml. No se observó diferencia significativa en la mortalidad de huevos en laboratorio (9.9–32.2%) e invernadero (18.7–30.7%) por efecto de las cepas. Tampoco se observó diferencia significativa en la mortalidad de ninfas (67.7 a 88.2%) por efecto de las cepas en las evaluaciones de laboratorio. Sin embargo, en las evaluaciones de invernadero, las cepas MaSan y MaCol ocasionaron significativamente mayor mortalidad, con 60 y 50.5%, respectivamente. Los resultados indican que las cepas evaluadas presentan más virulencia en ninfas que en huevos de B. tabaci. Las cepas MaSan y MaCol podrían ser consideradas buenos candidatos para el manejo de B. tabaci.
Palabras clave: control biológico, entomopatógenos, mosquita blanca.
Introducción
La mosquita blanca Bemisia tabaci (Hemiptera: Aleyrodidae) es un insecto fitófago, polífago y cosmopolita que se alimenta de una gran variedad de plantas cultivadas. En México esta especie es considerada plaga principal de cultivos hortícolas y ornamentales (Castellanos et al., 2007), debido a los daños que ocasiona de manera directa mediante la succión de savia e indirecta por la transmisión de enfermedades de etiología viral (Muñiz y Nombela, 2001).
El control químico de B. tabaci es la estrategia más utilizada para el manejo, debido a su rápida acción y persistencia. Sin embargo, el abuso en la utilización de estos productos ha provocado resistencia de las poblaciones de B. tabaci y efectos negativos en el ambiente, así como riesgos para la salud humana (Monzón, 2001). El uso de hongos entomopatógenos constituye una alternativa de gran valor en el manejo de B. tabaci, pues resulta inocuo al ambiente, al hombre y otros organismos superiores (Tanada y Kaya, 1993; James, 2001). Se han documentado más de 20 especies de hongos entomopatógenos con potencial infectivo en B. tabaci, destacándose por su importancia los hongos Hyphomycetes de los géneros Paecilomyces, Beauveria, Lecanicillium, Aschersonia y Metarhizium (Dos Santos y del Pozo, 2003).
Metarhizium (Moniliales: Moniliaceae) presenta amplio rango de hospederos. Se ha documentado que puede parasitar más de 300 especies de insectos de diversos órdenes (Gómez et al., 1997). Metarhizium ha sido usado exitosamente en varios programas de control biológico de plagas agrícolas, como Aeneolamia spp. en caña de azúcar y pastos (Bautista y González, 2005), Schistocerca piceifrons (Orthoptera: Acrididae) en maíz (Hernández et al., 2003), Alabama argillacea (Lepidoptera: Noctuidae) y Maconellicoccus hirsutus (Hemiptera: Pseudococcidae) en algodón (Filho et al., 2002; Ujjan y Shahzad, 2007) y Sitophilus granarius (Coleoptera: Curculionidae) en granos almacenados (Khashaveh et al., 2008). Específicamente para B. tabaci, existen antecedentes limitados de la actividad patogénica de Metarhizium. Uno de los trabajos más detallados es el de Malsam et al. (2002), quienes encontraron que M. anisopliae puede causar hasta 50% de mortalidad bajo condiciones de laboratorio, inclusive tal eficiencia puede incrementarse al 100% si se usa aceite en la formulación de las esporas y aditivos al momento de la aplicación.
El aislamiento y determinación de la patogenicidad de nuevas cepas es necesario para iniciar la selección de cepas con potencial para programas de control microbiano con hongos (Vidal et al., 1997), ya que las características de desarrollo in vitro (crecimiento y viabilidad) proporcionan datos asociados a la virulencia de los hongos (Heale et al., 1989; Estrada et al., 1997). Por lo tanto, el objetivo de esta investigación fue caracterizar el desarrollo in vitro de cuatro cepas nativas y uno comercial de Metarhizium y evaluar su virulencia en huevos y ninfas de B. tabaci bajo condiciones de laboratorio e invernadero.
Materiales y métodos
Las cepas de Metarhizium se obtuvieron del laboratorio de reproducción de hongos entomopatógenos del Comité Estatal de Sanidad Vegetal del estado Yucatán. Las cepas se aislaron de diferentes hospederos y lugares (Tabla 1). La identidad de las cepas se confirmó mediante características morfológicas y coloración del conidio, conidióforo y micelio, según Humber (1998) y Barnett y Hunter (2003). En el estudio se incluyó como referencia una cepa de Metarhizium comercialmente disponible (Agrobionsa, México). Las cepas fueron reactivadas en Sabouraud Dextrosa Agar (SDA) (Merck, Alemania) más 5 µg ml de cloramfenicol (Lab. Sophia S. A. de C. V. México), incubándose en laboratorio a 27±3°C, 75±5% de humedad relativa y fotoperíodos de 14 h luz/10 h oscuridad.
Para la evaluación del crecimiento radial de los micelios se siguió la metodología de Skrobek (2001). En el centro de una caja de Petri (60 x 15 mm) con medio de cultivo SDA, se depositó 1 µl de una suspensión de 1 x 107 conidios/ml. Las cajas de Petri se incubaron bajo las condiciones indicadas anteriormente. El crecimiento (mm/día) se obtuvo del promedio de la medición del diámetro de los micelios en dirección vertical y horizontal. Las mediciones se realizaron durante 15 días por el reverso de la caja. Cada caja de Petri representó una unidad experimental.
A los cultivos desarrollados en cajas de Petri se les agregaron 10 ml de agua destilada estéril más 5 µl de Tween 80 (Merck, Alemania). Posteriormente, el micelio se raspó con una espátula estéril y el producto obtenido se filtró a través de gasa estéril para separar los conidios del micelio y fragmentos de medio nutritivo. La concentración de conidios de la suspensión se determinó con una cámara de Neubauer (Marienfeld, Alemania) y un microscopio compuesto (Leica Inc., USA) (Li y Holdom, 1994; Gindin et al, 2000). La suspensión de conidios extraída de cada caja de Petri representó una unidad experimental.
Para la evaluación de la germinación de conidios se siguió la metodología de Berlanga–Padilla y Hernández–Velázquez (2002). Se colocaron cinco puntos de 2 µl de una suspensión de 1 x 107 conidios/ml en cajas de Petri (100 x 15 mm) con SDA. Sobre estos puntos se colocaron cubreobjetos para facilitar la observación, y cada hora con ayuda de un microscopio compuesto (Leica Inc., USA) en cada punto se observaron 100 conidios y se registró el número de conidios germinados. Se obtuvo entonces el valor promedio de los cinco puntos y este valor representó directamente la tasa de germinación (porcentaje/hora) de una unidad experimental. Se consideró conidio germinado el que presentara la longitud del tubo germinativo al menos del tamaño del conidio.
Para determinar la patogenicidad de Metarhizium en huevos y ninfas de B. tabaci, la colonia de la mosquita se estableció en el invernadero de adaptación del Instituto Tecnológico de Conkal (ITC), en Conkal, Yucatán, en jaulas entomológicas de 1.2 x 1.2 x 1 m, construídas con aluminio y malla antiáfidos. Los adultos de B. tabaci se colectaron en cultivos de chile habanero (Capsicum chinense Jacq.) del área de producción hortícola del ITC. Se confirmó la identidad de los insectos con las características morfológicas de las ninfas, pupas y adultos como lo describe Ortega (2002). La colonia de B. tabaci se mantuvo en plántulas de 30–45 días de edad de C. chinense, establecidas en macetas de plástico con sustrato Cosmopeat (Cosmocel, Canadá). Cada 15–20 días se introducían nuevas plántulas y se retiraban las anteriores con el fin de proveer hospederos nuevos a B. tabaci.
Los estados inmaduros de B. tabaci para las pruebas de patogenicidad se obtuvieron siguiendo la metodología de Muñiz y Nombela (2001). Se tomaron cinco adultos de la colonia de B. tabaci y se depositaron en una jaula pinza de 1 cm de diámetro, colocada en una hoja completamente extendida de la parte superior de las plantas de C. chinense de 30 días de edad. Los adultos y las jaulas pinza se retiraron a las 24 horas y los huevos ovipositados se usaron inmediatamente para los bioensayos respectivos. En el caso de los bioensayos con ninfas, los huevos se dejaron en las hojas por 5 a 6 días hasta obtener ninfas de segundo instar. La unidad experimental fue un grupo de 25 a 30 huevos o ninfas establecidas en una hoja.
Para realizar los bioensayos se obtuvieron suspensiones de esporas de los micelios cultivados en SDA, como se describió anteriormente (Gindin et al., 2000). Los tratamientos se llevaron a cabo por inmersión de hojas de C. chinense que contenían huevos o ninfas de B. tabaci, por 15 segundos en una solución de 1 x 107 esporas/ml (Al–Deghairi, 2008). El testigo fue tratado con agua destilada estéril más Tween 80 al 0.05% v/v. Para las evaluaciones de laboratorio, las plantas tratadas se mantuvieron en el Laboratorio de Fitopatología del ITC a 27±3°C y humedad relativa de 75±8%. Para las evaluaciones de invernadero, las plantas fueron depositadas en un invernadero rústico a 39±6°C y humedad relativa de 65±10%. Las evaluaciones de mortalidad se realizaron diariamente por 7 días en los bioensayos con huevos y 12 días en los bioensayos con ninfas, de tal forma que en los resultados se presenta la mortalidad acumulada en cada caso. El registro de los individuos muertos se realizó con un microscopio estereoscópico, contabilizando como huevos muertos los micosados, deformes y no eclosionados (Gindin et al., 2000; Skrobek, 2001); en los bioensayos con ninfas se consideraron ninfas muertas aquellas con cambios de coloración, brillo, forma y aspecto del cuerpo, así como con crecimiento de micelio sobre éste (del Pozo y Rodríguez, 2003).
En todos los experimentos se empleó un diseño estadístico completamente al azar con cinco repeticiones. Cada repetición estuvo representada por una unidad experimental. El análisis de varianza y comparación de medias Tukey (p<0.05) de las variables de desarrollo in vitro y patogenicidad se analizaron con el programa GraphPad InStat (GraphPad Software Inc.).
Resultados y discusión
El crecimiento radial de los micelios varió de 0.31 a 0.37 cm/día (Tabla 2). Las cepas MaCol, MaQui y MaVer con 0.37, 0.35 y 0.35 cm/día, presentaron valores más altos (p<0.05) que el observado en la cepa MaSin. Los valores observados en el presente trabajo son similares a los encontrados por Skrobek (2001), quien al evaluar el crecimiento micelial de M. anisopliae var. anisopliae sobre SDA a 26 °C, registró velocidad de crecimiento de 0.33 a 0.36 cm/día. Por su parte, Rachappa et al. (2007) reportaron valores de crecimiento micelial de 0.38 a 0.39 cm/día en aislamientos de M. anisopliae, los cuales son ligeramente superiores a los encontrados en el presente estudio.
Los porcentajes de germinación de los conidios variaron entre 17.4 y 21.1%/h, no observándose diferencias significativas entre las muestras evaluadas. Todas las cepas presentaron alta viabilidad in vitro, ya que alcanzaron 100% de germinación entre las 6 a 7 h de incubación. Otros estudios han reportado porcentajes más bajos de germinación de conidios, por ejemplo, Hernández et al. (2007) reportaron 80% de germinación de conidios de M. anisopliae a las 21 h posteriores a la inoculación en SDA incubado a 25 ± 1°C, y Khashaveh et al. (2008) encontraron porcentajes de germinación de 89 a 94% a las 24 h en SDA. La capacidad de desarrollo in vitro, particularmente crecimiento de la micelios y germinación de conidios, ha sido asociada directamente a la virulencia de los hongos entomopatógenos (Heale et al., 1989; Estrada et al., 1997), sin embargo, de acuerdo con los datos observados en el presente trabajo, no se podría inferir cuál cepa podría presentar mayor virulencia.
La virulencia de las cepas de Metarizium en huevos de B. tabaci fue similar en las condiciones de laboratorio e invernadero. La mortalidad de huevos por efecto de las cepas varió de 9.9 a 32.3% en laboratorio y de 18.7 a 30.7% en invernadero (Tabla 3). Skrobek (2001), quien evaluó en laboratorio la mortalidad de huevos de B. tabaci biotipo B por efecto de M. anisopliae var. anisopliae, encontró 33% de mortalidad a los 6 días después de la aplicación, este valor es ligeramente superior a los observados en el presente ensayo.
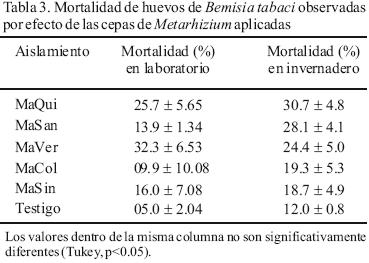
Para otras especies de insectos, existen reportes que M. anisopliae presenta buen potencial patogénico en huevos, como en la polilla del tomate Tuta absoluta (Lepidóptera: Gelechiidae), Diabrotica undecimpunctata (Coleoptera: Chrysomelidae), Haematobia irritans (Diptera: Muscidae) y Blissus antillus (Hemiptera: Lygaeidae) (Tallamy et al., 1998; Coracini y Samuels, 2002; Sahagún et al., 2005; Rodríguez et al., 2006). La baja susceptibilidad de huevos de B. tabaci a M. anisopliae podría estar relacionada a las barreras físicas del corium. Probablemente, esta estructura impide la colonización del embrión durante el período embrionario, pero no evita la mortalidad de la ninfa después de su eclosión (Tanada y Kaya, 1993).
Bajo condiciones de laboratorio, no se observó diferencia significativa en la mortalidad de ninfas de B. tabaci por efecto de las cepas de Metarhizium, ya que los valores encontrados variaron de 67.7 a 88.2% (Tabla 4). En otros trabajos de patogenicidad de M. anisopliae en B. tabaci, se han encontrado valores similares a los observados en el presente estudio. Quisberth et al. (2004) evaluaron la virulencia de cuatro especies de hongos entomopatógenos en ninfas de B. tabaci en soya obteniendo porcentajes de mortalidad que alcanzaron 89%. De manera similar, Skrobek (2001) halló porcentajes de mortalidad entre 80 y 85% en ninfas del primer instar de B. tabaci en algodón. Herrera et al. (1999), por su parte, observaron mortalidades de 97% en ninfas de B. tabaci tratadas con esporas de M. anisopliae bajo condiciones controladas (25±0,5 °C, 80±5% HR y 12:12 L:D).
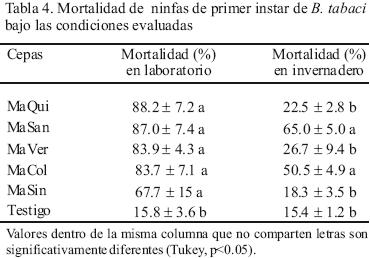
Bajo condiciones de invernadero, la mortalidad de ninfas de B. tabaci por efecto de las cepas de Metarhizium fue menor que lo observado en laboratorio, los valores de mortalidad variaron de 18.3 a 65%. Las cepas MaSan y MaCol causaron significativamente mayor mortalidad con 65 y 50.5%, los cuales fueron significativamente superiores a los observados en las cepas MaQui, MaVer y MaSin (Tabla 4). Cabe mencionar que en invernadero se tuvieron temperaturas de 39±6 °C, típico de regiones tropicales, que resaltan las buenas características de las cepas MaSan y MaCol que aún bajo éstas condiciones ambientales fueron altamente virulentos (Amed y Shahsad, 2007). La virulencia de estas cepas podría incrementarse a través de la formulación de las esporas en aceite y el uso de algunos aditivos, como lo reportan Malsam et al. (2002).
Agradecimientos
Los autores agradecen al Comité Estatal de Sanidad Vegetal del Estado de Yucatán por la búsqueda y aislamiento de las cepas de Metarhizium, así como a Agatha Rosado y Francisco Couoh, alumnos del Instituto Tecnológico de Conkal, por su apoyo en el desarrollo de los experimentos.
Literatura citada
Al–Deghairi, M.A., 2008. Bioassay evaluation of the entomopathogenic fungi, Beuveria bassiana Vuellemin against eggs and nymphs of Bemisia tabaci Gennadius (Homoptera: Aleyrodidae). Pakistan Journal Biological Science 11: 1551–1560. [ Links ]
Ahmed, U.A., S. Shahsad, 2007. Pathogenicity of Metarhizium anisopliae var. acridum strains on pink hibiscus mealy Bug (Maconellicoccus hirsutus) affecting cotton crop. Pakistan Journal Botanic 39: 967–973. [ Links ]
Barnett, H.L., B.B. Hunter, 2003. Illustrated genera of imperfect fungi. Fourth edition. The American Phytopathological Society. 218 p. [ Links ]
Bautista, G.A., C.C. González, 2005. Tres dosis de Metarhizium anisopliae sobre la mosca pinta (Aeneolamia spp.) en caña de azúcar en la región de los ríos, estado de Tabasco. Universidad y Ciencia 21(41): 37–40. [ Links ]
Berlanga–Padilla, A.M., V.M. Hernández–Velázquez, 2002. Efecto de la temperatura sobre el crecimiento y la virulencia de Metarizhium anisopliae, M. a. var acridum y Beuveria bassiana en Shistocerca piceifrons piceifrons. Manejo Integrado de Plagas (Costa Rica) 63: 51–55. [ Links ]
Castellanos, M.J., B.M. Gonzales, T. Mier, M.R. Reyes, E. Aaranda, C. Toriello, 2007. Virulence testing and extracellular subtilisin–like (Pr1) and trypsin–like (Pr2) activity during propagule production of Paecilomyces fumosoroseus isolates from whiteflies (Homoptera: Aleyrodidae). Revista Iberoamericana de Micología 24: 62–68. [ Links ]
Coracini, D., R. Samuels, 2002. Natural enemies of the Chinch Bug, Blissus antillus Leonard (Hemiptera: Lygaeidae: Blissinae), pasture pest in Rio de Janeiro State, Brazil. Neotropical Entomology 31:165–167. [ Links ]
Del Pozo N.M., D. A. Rodríguez, 2003. Alternativa para el manejo de Trialeurodes vaporariorum Westwood en tomate orgánico en Uruguay. Boletín de Sanidad Vegetal: Plagas 29 (2): 211– 218. [ Links ]
Estrada–Valencia, M. N., P. E. Vélez–Arango, E. C. Montoya–Restrepo. 1997. Caracterización de cultivos monoespóricos del hongo Beauveria bassiana. Cenicafé 48 (4): 217–224. [ Links ]
Filho, C.E., J.E. Marques, R. Barros, 2002. Selection of Metarhizium anisopliae (Metsch) and Beauveria bassiana (Huebner) caterpillars. Scientia Agricola 59: 457–462. [ Links ]
Gindin, G., N.U. Geschtovt, B. Raccah, I. Barash, 2000. Pathogenicity of Verticillium lecanii to different developmental stages of the Silverleaf Whitefly, Bemisia argentifolii. Phytoparasitica 28(3):1–11. [ Links ]
Gómez, M., N. Tinti, L. Alves, 1997. Characterization of new biotypes of P157 strain of Metarhizium anisopliae var. anisopliae, got by treatment with gamma radiation. Boletín Micológico 12(2): 41–48. [ Links ]
GraphPad InStat, 2000. GraphPad Software. La Joya, California. [ Links ]
Heale, J.B., J.E. Isaac, D. Chandler, 1989. Prospect for strain improvement in entomopathogenic fungi. Pesticide Science 26: 79–92. [ Links ]
Hernández, R.F., F.M. Pérez, B.N. Ventura, L.N. Real, T.J. García, 2007. Efecto del coadyuvante Break–Thru sobre Metarhizium anisopliae (Ascomycota: Hypocreales) y Salivazo Aeneolamia postica (Hemiptera: Cercopidae). En México. XXX Congreso Nacional de Control Biológico–Simposio del IOBC, Mérida, Yucatán, Noviembre. pp. 489–492. [ Links ]
Hernández, V.V., M.D. Hunter, L.L. Barrientos, G.R. Lezama, V.F. Reyes, 2003. Susceptibility of Schistocerca piceifrons (Orthoptera: Acrididae) to Metarhizium anisopliae var. acridum (Deuteromycotina: Hyphomycetes): laboratory and field trials. Journal of Orthoptera Research 12:89–92. [ Links ]
Herrera, F., M. Carballo, P. Shannon, 1999. Eficacia de cepas nativas de hongos entomopatógenos sobre Bemisia tabaci, en laboratorio. Manejo Integrado de Plagas (Costa Rica) 54:37–43. [ Links ]
Humber, R., 1998. Entomopathogenic fungal identification. American Phytopathological Society. Entomological Society of America Workshop, Joint annual meeting 1998. Las Vegas, Nevada, USA. 26. [ Links ]
James, R.R., 2001. Effects of exogenous nutrients on conidial germination and virulence against silverleaf whitefly for two hyphomycetes. Journal Invertebrate Pathology 77:99–107. [ Links ]
Khashaveh, A., M.A. Safaralizade, Y. Ghosta, 2008. Pathogenicity of three Iranian isolates of the fungus, Metarhizium anisopliae (Metsch.) Sorokin (Deuteromycotina: Hyphomycetes) Against Granary Weevil, Sitophilus granarius L. (Coleoptera: Curculionidae). Journal of Biological Science 8: 804–808. [ Links ]
Li, D.P., D.G. Holdom, 1994, Effects of pesticides on growth and sporulation of Metarhizium anisopliae (Deuteromycotina: Hyphomycetes). Journal of Invertebrate Pathology 63: 209–211. [ Links ]
Malsam, O., M. Kilian, E.C. Oerke, H.W. Dehne. 2002. Oils for increased efficacy to control whiteflies. Biocontrol Science and Technology 12: 337–348. [ Links ]
Monzón, A., 2001. Producción, uso y control de calidad de hongos entomopatógenos en Nicaragua. Manejo Integrado de Plagas (Costa Rica) 63:95–103. [ Links ]
Muñiz, M., G. Nombela, 2001. Differential variation in development of the B– and Q– biotypes of Bemisia tabaci on sweet pepper Capsicum annum L. at constant temperatures. Environmental Entomology 30: 720–727. [ Links ]
Ortega, A.D., 2002. Moscas blancas en ornamentales. Manejo fitosanitario de ornamentales. Bautista, N, J. Alvarado, J. Chavaría, y H. Sánchez (eds.), Colegio de Postgraduados. Montecillo, México. pp 41–54. [ Links ]
Quisberth, R.E., A.S. Batista, G.B. Clarice, S.C. Da Costa, 2004. Selección de hongos entomopatógenos para el control de Bemisia tabaci biotipo B. Manejo Integrado de Plagas y Agroecología (Costa Rica) 73:21–28. [ Links ]
Rachappa, V., S. Lingappa, R.K Patil, 2007. Effect of agrochemicals on growth and sporulation of Metarhizium anisopliae (Metschnikoff) Sorokin. Karnataka Journal Agricultural Science 20: 410–413. [ Links ]
Rodríguez Dos Santos, A., E. Del Pozo Núñez, 2003. Aislamiento de hongos entomopatógenos en Uruguay y su virulencia sobre Trialeurodes vaporariorum West. Agrociencia (Cuba) 2:71–78. [ Links ]
Rodríguez, S.M., M. Gerding, I.A. France, 2006. Selección de aislamientos de hongos entomopatógenos para el control de huevos de la polilla del tomate, Tuta absoluta Meyrick (Lepidóptera: Gelechiidae). Agricultura Técnica 66:151–158. [ Links ]
Sahagún, A.C., L.R. Gutiérrez, M.J. Ochoa, G.E. Velasco, L.M. Edwards, R.O. Domínguez, C. Vázquez, R.W. Velázquez, S.R. Skoda, J.E. Foster, 2005. Susceptibility of biological stages of the horn fly, Haematobia irritans, to entomopathogenic fungi (Hyphomycetes). Journal Insect Science 50:1–8. [ Links ]
Skrobek, A., 2001. Investigations on the effect of entomopathogenic fungi on whiteflies. Dissertation, Institut für Pflanzenkrankheiten der Rheinischen Friedrich–Wilhelms–Universitát Bonn. Doktorwürde der Agrarwissenschaften. 114 pp. <http://hss.ulb.uniborm.de/diss_online/landw_fak/2001/skrobek_anke/text.pdf> Consultado: noviembre de 2008. [ Links ]
Tallamy, D., D. Whittington, F. Defurio, D. Fontaine, P. Gorski, P. Gothro, 1998. Sequestered cucurbitacins and pathogenicity of Metarhizium anisopliae (Moniliales: Moniliaceae) on spotted cucumber beetle eggs and larvae (Coleoptera: Chrysomelidae). Environmental Entomology 27:366–372. [ Links ]
Tanada, L., H. Kaya, 1993. Insect Pathology. Academic Press. San Diego, California. [ Links ]
Ujjan, A.A., S. Shahzad, 2007. Pathogenicity of Metarhizium anisopliae var. acridum strain on pink hibiscus mealy bug (Maconellicoccus hirsutus) affecting cotton crop. Pakistan Journal Botanic 39:967–973. [ Links ]
Vidal, C., J. Fargues, L.A. Lacey, 1997. Intraspecific variability of Paecilomyces fumosoroseus: effect of temperature on vegetative growth. Journal of Invertebrate Pathology 70:18–26. [ Links ]














