ANTECEDENTES
En 1950 aproximadamente 8% de la población mundial era mayor de 60 años, para el año 2000 esta cifra se incrementó a 10% y se espera que alcance 21% para 2050, es decir, se estiman 2000 millones de adultos mayores en todo el mundo para el año 2050.1
México no escapa al envejecimiento global, en 2010 la población de adultos mayores fue de 9.67 millones, en 2013 de 10.9 millones, en 2017 de 12.3 millones y, de acuerdo con las proyecciones del Consejo Nacional de Población (CONAPO), en 2050 se incrementará esta población a 36 millones, incluidos 18 millones de mujeres y 14 millones de hombres, es decir, uno de cada 4 mexicanos serán población geriátrica a la mitad del siglo XXI.2,3
La fragilidad es un síndrome clínico común en adultos mayores que conlleva mayor riesgo de resultados adversos para la salud, incluyendo caídas, discapacidad incidente, hospitalización y mortalidad.4-6 Su prevalencia se estima entre 25 y 50% en ancianos.7,8
Fried y sus colegas propusieron que las manifestaciones clínicas de fragilidad (debilidad, lentitud, bajo nivel de actividad física, agotamiento autoinformado y pérdida involuntaria de peso) se relacionan con un ciclo de equilibrio energético negativo y sarcopenia, con disminución de la fuerza y de la tolerancia al esfuerzo.9,10
Se han descrito alteraciones en diversos sistemas y aparatos en pacientes con síndrome de fragilidad, incluidos los sistemas músculo-esquelético, cardiovascular, hematológico y endocrino.11-14
Aunque la disfunción tiroidea subclínica y la fragilidad son comunes entre adultos mayores, los datos de la relación entre estas dos condiciones son conflictivos. Virgini y colaboradores, al evaluar la relación entre disfunción tiroidea subclínica y síndrome de fragilidad, encontraron que los pacientes con hipertiroidismo subclínico tuvieron mayor riesgo de fragilidad en comparación con los eutiroideos (OR = 2.48, IC95% 1.15-5.34) en un análisis transversal-analítico, aunque en el seguimiento a cinco años ni el hipo ni el hipertiroidismo se vincularon consistentemente con mayor incidencia de fragilidad ni con sus componentes.15 Otro estudio encontró que concentraciones altas de tiroxina libre (T4 libre) se relacionan con mayor riesgo de síndrome de fragilidad.16 Sin embargo, aún es poca la asociación entre síndrome de fragilidad y disfunción tiroidea. Por lo que, con la intención de contribuir a establecer con certeza estos hallazgos, este estudio pretende determinar la asociación entre disfunción tiroidea subclínica y síndrome de fragilidad en pacientes adultos mayores.
MATERIAL Y MÉTODO
Estudio observacional, de casos y controles realizado en adultos mayores con síndrome de fragilidad (casos) y sin síndrome de fragilidad (controles) del Hospital Regional del ISSSTE en León, Guanajuato que fueron atendidos de enero de 2016 a junio de 2017. La información obtenida de los expedientes fue: edad, género, peso, talla, IMC, cifras de presión arterial sistólica (PAS) y diastólica (PAD), cifras de TSH y T4 libre, así como el diagnóstico de fragilidad de los pacientes.
El diagnóstico de síndrome de fragilidad se estableció con los criterios de Fried; es decir, se consideraron con síndrome de fragilidad los pacientes con tres o más de los siguientes criterios: pérdida de peso involuntaria de al menos 5 kg durante el año precedente, agotamiento, disminución de la fuerza muscular, actividad física reducida y velocidad lenta para la marcha.9 Se excluyeron los individuos en tratamiento antitiroideo, con administración de hormonas tiroideas o amiodarona.
Las concentraciones de referencia de T4 libre fueron 0.7-1.48 ng/dL y de TSH 0.35-4.94 mUI/ mL. Se consideró hipertiroidismo subclínico con valores de TSH < 0.55 mIU/L y concentraciones normales de T4 libre; eutiroidismo con valores de TSH de 0.55-4.78 mIU/L e hipotiroidismo subclínico cuando los valores de TSH fueron > 4.78 mUI/L con concentraciones normales de T4 libre.
Se compararon las concentraciones séricas de TSH y T4 libre en pacientes robustos, prefrágiles y frágiles. También se comparó la incidencia de individuos robustos, prefrágiles y frágiles entre pacientes con hipotiroidismo subclínico, eutiroidismo e hipertiroidismo subclínico. Se calcularon razones de momios (OR) para fragilidad en individuos con hipo e hipertiroidismo subclínico utilizando tablas de 2 x 2 y X 2 como prueba inferencial. Para comparar variables cuantitativas entre grupos se utilizó la prueba t de muestras independientes. El valor p < 0.05 se consideró significativo.
RESULTADOS
Se incluyeron 204 pacientes, de los que 100 fueron casos y 104 controles. La edad promedio en los casos y controles fue 83.2 ± 7.1 y 78.1 ± 5.5 años, respectivamente (p = 0.000). No hubo diferencias entre grupos en el género ni en el porcentaje de pacientes institucionalizados. Los pacientes frágiles tuvieron significativamente menor peso (63.1 ± 13.0 vs 68.9 ± 14.5 kg) e IMC (25.9 ± 5.2 vs 27.8 ± 5.4 kg/m2), aunque una talla similar (156.2 ± 9.8 vs 157.2 ± 6.3 cm; p = 0.577). También tuvieron menores cifras de presión arterial sistólica (119.5 ± 22.3 vs 132.4 ± 18.0 mmHg) y diastólica (68.2 ± 10.6 vs 75.0 ± 10.5 mmHg) que los controles (p < 0.05). Cuadro 1
Cuadro 1 Carácterísticas generales de los pacientes
| Características | Frágiles | Robustos | Valor de p |
|---|---|---|---|
| Edad (años) | 83.2±7.1 | 78.1±5.5 | 0.000 |
| Peso (kg) | 63.1±13.0 | 68.9±14.5 | 0.000 |
| Talla (m) | 1.56±0.98 | 1.57±0.6 | 0.577 |
| IMC (kg/m2) | 25.9±5.2 | 27.8±5.4 | 0.000 |
| Presión arterial sistólica (mmHg) | 119.5±22.3 | 132.4±18.0 | 0.009 |
| Presión arterial sistólica (mmHg) | 68.2±10.6 | 75.0±10.5 | 0.008 |
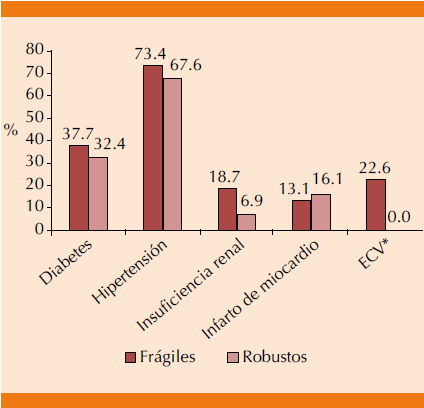
No hubo diferencias significativas entre frágiles y no frágiles en el porcentaje de diabéticos (37.7 vs 32.4%), hipertensos (73.4 vs 67.6%), nefrópatas (18.7 vs 6.9%) ni en antecedente de infarto de miocardio (13.1 vs 16.1%). Sin embargo, 22.6% de los frágiles contra ninguno de los robustos tuvieron antecedente de enfermedad cerebrovascular (p = 0.005). Figura 1
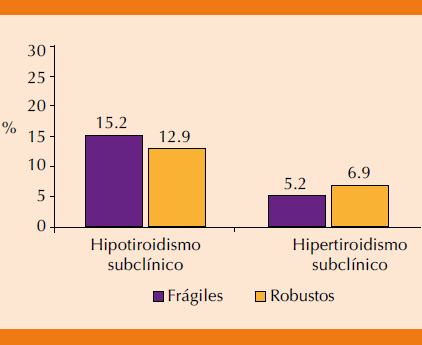
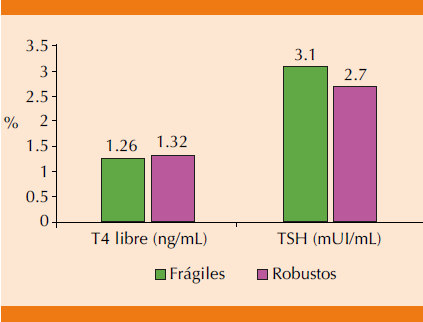
Las concentraciones de TSH en frágiles y robustos fueron 3.1 ± 2.2 y 2.7 ± 1.9 ng/mL (p = 0.594) y las concentraciones séricas de T4 libre fueron 1.26 ± 0.48 y 1.32 ± 0.90 ng/dL, respectivamente (p = 0.315; Figura 2). El porcentaje de hipotiroidismo e hipertiroidismo subclínico en pacientes con síndrome de fragilidad fue de 15.2 y 5.2%, respectivamente (p = 0.740), mientras que en individuos robustos fue de 12.9 y 6.9%, respectivamente (p = 0.714; Figura 3). La OR para fragilidad en pacientes con hipotiroidismo subclínico fue de 1.21 (IC95% 0.39-3.80, p = 0.740) y en pacientes con hipertiroidismo subclínico fue = 0.74 (IC95% 0.14-3.75, p = 0.714).
t de muestras independientes = no significativa.
Figura 2 Concentraciones séricas de TSH y T4 libre en pacientes frágiles y robustos.
DISCUSIÓN
Si bien se ha descrito que el ciclo de fragilidad consiste en la acumulación, con el envejecimiento, de los efectos de la falta de ejercicio físico, desnutrición, lesiones, enfermedades que conducen a desnutrición crónica, sarcopenia, alteraciones cardiovasculares y metabólicas, como resistencia a la insulina y disminución de la hormona del crecimiento, testosterona,17,18 la función tiroidea entre los pacientes frágiles y no frágiles se ha estudiado poco.
Se ha descrito que las concentraciones séricas de hormonas tiroideas en adultos mayores son similares a las concentraciones séricas de adultos de 40-60 años, de hecho, los valores de referencia de TSH y T4 libre son los mismos para pacientes adultos mayores de 60 años y adultos jóvenes.19 En este estudio se encontraron concentraciones promedio de TSH y T4 libre dentro de rangos de normalidad en los indivi duos ancianos estudiados. Esto coincide con lo reportado en la bibliografía y aceptado como patrón de referencia.19,26
Sin embargo, en este estudio no se observaron diferencias significativas en las concentraciones séricas de TSH y T4 libre entre individuos frágiles y robustos. De manera similar, Yeap y colaboradores no encontraron asociación de las concentraciones de TSH con fragilidad.15 Aunque a diferencia de este estudio, en el que no hubo mayor probabilidad de fragilidad en ancianos con disfunción tiroidea subclínica, Yeap y su grupo reportaron que los individuos con T4 libre elevada tuvieron mayor probabi lidad de fragilidad en un análisis transversal.15 Asimismo, Virgini y colaboradores hallaron relación de las concentraciones elevadas de T4 libre con mayor prevalencia de fragilidad en un estudio transversal, pero en el seguimiento a cinco años no encontraron asociación de las concentraciones de T4 libre con la incidencia de fragilidad,16 esto último coincide con lo encontrado en nuestro estudio de no asociación de TSH y T4L con fragilidad, ni de hipo e hipertiroidismo subclínico con la probabilidad de fragilidad.
Es posible que, más que asociarse las concentraciones de T4 libre con el síndrome de fragilidad en su conjunto, las concentraciones elevadas de esta hormona se relacionen con componentes específicos del síndrome de fragilidad. En este sentido, Bauer y colaboradores encontraron que concentraciones bajas de TSH se asocian con mayor riesgo de fracturas por osteoporosis y Lee y su grupo observaron que la disfunción tiroidea subclínica se vincula con la incidencia de fracturas de cadera,20,21 mientras que otros estudios han encontrado asociación de concentraciones elevadas de T4 libre con deterioro cognitivo,22,23 disminución de la capacidad para realizar actividad física (independientemente de las concentraciones de TSH)24 y pérdida de peso.25
Se sugiere, por tanto, evaluar en futuros estudios por separado la asociación de disfunción tiroidea subclínica con los componentes del síndrome de fragilidad y la realización de estudios de mayor tamaño y con diseños longitudinales para esclarecer el vínculo entre disfunción tiroidea subclínica y la incidencia de síndrome de fragilidad.
CONCLUSIONES
No existen diferencias significativas en las concentraciones séricas de TSH ni T4 libre entre pacientes frágiles y robustos, ni se encontró asociación de hipotiroidismo e hipertiroidismo subclínico con riesgo de síndrome de fragilidad. Por lo que, con base en estos hallazgos, se rechaza la asociación entre disfunción tiroidea sublínica y síndrome de fragilidad en ancianos mexicanos.











 nueva página del texto (beta)
nueva página del texto (beta)