ANTECEDENTES
En los últimos años, el tema de la influencia de la hiperuricemia en procesos patológicos ha sido foco importante de atención, así como objeto de ardua investigación médica. En la actualidad, se sabe que la hiperuricemia se asocia con condiciones tan relevantes como la enfermedad renal crónica y la hipertensión arterial, así como obesidad, resistencia a la insulina, hígado graso, etc. De forma clásica, la elevación del ácido úrico se había considerado secundaria a estas condiciones, solamente reflejando el aumento de la actividad URAT-1 en el caso de la hiperinsulinemia, o disminución de la eliminación en el caso de la enfermedad renal crónica, por mencionar ejemplos, lo que entonces sugería irrelevante la medición de las concentraciones de ácido úrico fuera del contexto de la artropatía gotosa. Hoy día sabemos, basados en evidencia múltiple y contundente, que la elevación de ácido úrico puede preceder a la hipertensión arterial, al síndrome metabólico y a la enfermedad renal crónica e, incluso, participar en su fisiopatología y progresión, por lo que difícilmente podría seguirse considerando una alteración secundaria en todos los casos.
Historia
Carl Scheele, farmacéutico suizo, describió por primera vez al ácido úrico en 1776, presente en un cálculo vesical, originalmente lo nombró “cálculo de ácido”, más tarde, un químico francés de apellido Fourcroy logró destilarlo a partir del ácido hidrociánico, lo llamó por primera vez “ácido úrico”.1,2 Desde 1848 se conoce su participación en procesos patológicos, entonces se logró relacionar su presencia plasmática en pacientes con ataques agudos de gota.
Hoy día se reconoce la gran relevancia de la hiperuricemia en procesos patológicos, desde la artritis gotosa y la nefropatía por ácido úrico, hasta su probable participación, sugerida por múltiples estudios experimentales, en el curso de enfermedades, como el síndrome metabólico, la hipertensión arterial y la progresión de la enfermedad renal crónica, así como un marcador de riesgo cardiovascular,5 además de otras afecciones, como obesidad, resistencia a la insulina, hígado graso, etc.11
Resulta sumamente interesante que, contrario a lo que se ha pensado de manera clásica, que el ácido úrico es resultado de diversos procesos patológicos, los resultados de múltiples estudios realizados durante la última década encaminan esta teoría en dirección contraria: se ha comprobado que la elevación del ácido úrico precede a la hipertensión o al síndrome metabólico, lo que hace difícil continuar considerando la elevación de esta sustancia secundaria en todos los casos.11
Homeostasia del ácido úrico
Como tal, el ácido úrico es un producto final del metabolismo de las purinas, mismas que aunque se degradan prácticamente en todos los tejidos, son transformadas finalmente a ácido úrico por medio de la xantino oxidasa, principalmente en el hígado y los intestinos, además de en pequeña cantidad en tejidos periféricos, como el músculo, el endotelio y los riñones; a través de la inhibición de esta enzima fármacos como el alopurinol basan su mecanismo de acción.
El ácido úrico es un ácido débil diprótico (con dos protones disociables), con pKa1 ≈ 5.4 y pKa2 ≈ 10.3. A un pH fisiológico de 7.4, 99% de las moléculas de ácido úrico disocian un protón, por esto la mayor parte del ácido úrico está presenta en el líquido extracelular en forma de urato monovalente, también conocido como hidrógeno de urato o urato ácido. En forma de anión divalente prácticamente no existe en el cuerpo humano, como consecuencia de su extremadamente alto Pk2, por ello, el término ácido úrico se usa para referirse a este urato monovalente en la bibliografía médica.9
A pesar de que el ácido úrico en condiciones fisiológicas está presente en su mayor parte como anión urato, a un pH entre 6 y 11, en orina hay más ácido úrico que urato.6 Como el ácido úrico es muy poco soluble en soluciones acuosas, el incremento del pH urinario aumenta su porcentaje de precipitación.10
La eliminación de ácido úrico depende, en gran medida, de una adecuada función renal, con una relación proporcional estrecha con el filtrado glomerular, porque se elimina hasta en 70% por esta vía, por lo que cuando el filtrado glomerular disminuye, las concentraciones de ácido úrico aumentan. Una tercera parte se elimina por las heces, a donde se secreta para sufrir posteriormente uricolisis bacteriana. Además, en presencia de estrés oxidativo, el ácido úrico puede metabolizarse a alantoína, parabanato y aloxano.
La mayor parte del ácido úrico plasmático (90%) es filtrado por el riñón y a nivel tubular proximal. De forma fisiológica, la membrana del túbulo proximal es impermeable al anión urato, en ausencia de transportadores específicos no puede ser reabsorbido. Es aquí donde interviene un complejo transportador que, pese a su amplio estudio, aún no ha sido posible entender por completo su funcionamiento y que debido a su eficiencia es responsable de las concentraciones elevadas de ácido úrico plasmático en el humano en comparación con otras especies; a este respecto se suma la ausencia de la enzima uricasa en el humano, que en otras especies se encarga de degradar el ácido úrico directamente7 y que es blanco de fármacos como la pegloticasa.8
A través del transportador aniónico URAT1, se reabsorbe 90% del ácido úrico, un transportador perteneciente a una muy estudiada superfamilia de transportadores de ácidos orgánicos. A este nivel los fármacos uricosúricos como probenecid y benzbromarona encuentran su sitio de acción. Como ejemplo de este tipo de fármacos está losartán que, además de disminuir la expresión de este transportador, reduce su actividad, generando menor reabsorción de ácido úrico en el túbulo proximal renal. Estudios experimentales compararon el efecto de losartán con otros fármacos ARA II y encontraron que es el único con efecto significativo a este respecto y que dosis superiores a 50 mg/día no tienen mayor efecto uricosúrico.23
Se han encontrado mutaciones en el gen que codifica este transportador, como lo demuestra un estudio realizado en Japón, en cuyas familias se encontró aumento en la excreción renal de ácido úrico por esta vía. Ejemplo contrario son los polimorfismos descritos en familias alemanas, quienes tienen menor actividad de este transportador e hiperuricemia.
Recientemente se propuso GLUT9, un miembro de la familia de transportadores de glucosa, como regulador importante en la homeostasia del ácido úrico, se han encontrado en familias con polimorfismos hiperuricemias sintomáticas. En humanos, se expresa principalmente en la membrana basolateral del túbulo contorneado proximal.4
Hiperuricemia: definición y epidemiología
No existe definición universal; sin embargo, en la práctica, la definición bioquímica de hiperuricemia encuentra su punto de corte a partir de 6.8 mg/dL en plasma, en este nivel inicia su solubilidad en agua, medido por métodos enzimáticos automatizados. Esta definición ha variado en distintos ensayos clínicos, que han definido como ácido úrico > 7 o 7.5 en hombres y > 6 o 6.5 en mujeres. Es de llamar la atención su gran frecuencia, pues se estima prevalencia de 13 a 21% de la población general, según el punto de corte y la definición operacional.
Causa de hiperuricemia
Por lo general, incluso en 90% de los casos, la hiperuricemia se debe a disminución de su excreción, el 10% restante corresponde a mecanismos de sobreproducción; con gran frecuencia se encuentra la participación de ambos procesos (Cuadros 1 y 2).
Cuadro 1 Causas de hiperuricemia por producción excesiva
Cuadro 2 Causas de hiperuricemia por dismiución de la excreción de ácido úrico
Adaptado de la referencia 1.
Hiperuricemia e hipertensión
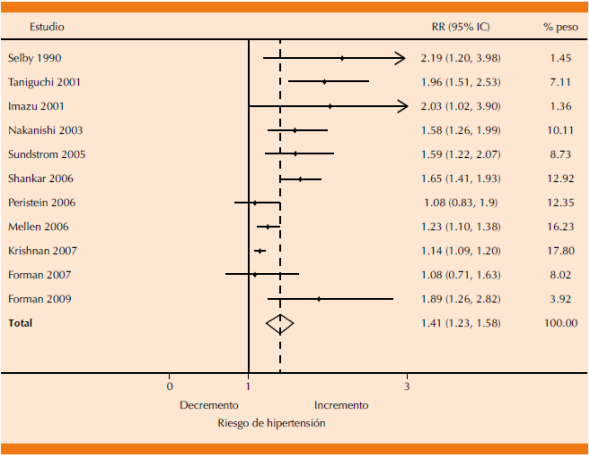
En múltiples estudios experimentales se ha demostrado la relación que existe entre la hiperuricemia y la hipertensión arterial. Como ejemplo, un metanálisis (Figura 1) que incluyó un total de 55,607 pacientes mostró que la hiperuricemia se asoció con mayor incidencia de hipertensión, RR 1.41, IC95%: 1.23-1.58.12Además, en otro ensayo clínico experimental se demostró que por cada mg/dL de incremento en el ácido úrico sérico se encontró RR de 1.35 (Figura 1) de incidencia de hipertensión (IC95%: 1.06-1.20), con resultados similares para otros factores de riesgo cardiovascular y pronóstico renal.13
Como respaldo de estos datos, otro metanálisis publicado en 2014, que incluyó 25 estudios con 97,824 pacientes, concluyó que la hiperuricemia se asoció con mayor incidencia de hipertensión, independientemente de ajustes de tasa, de datos categóricos o continuos, con aumento de una desviación estándar por cada incremento en 1 mg/dL en las concentraciones de ácido úrico (no ajustado: RR 1.73, IC95%: 1.46-2.06 para datos categóricos, RR 1.22, IC95%: 1.03-1.45 para incremento de una desviación estándar; ajustado: RR 1.48, IC95%: 1.33-1.65 para datos categóricos, RR 1.15, IC95%: 1.06, 1.26 para 1 mg/dL de incremento; p < 0.001).
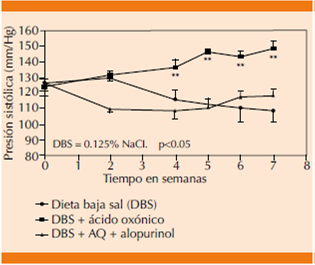
Estudios experimentales en modelos murinos demostraron una correlación positiva lineal entre la presión arterial y las concentraciones de ácido úrico (Figura 2), así como disminución en las cifras tensionales al administrar tratamiento hipouricemiante con alopurinol.13
Asimismo, se ha comprobado en adolescentes una fuerte asociación entre hiperuricemia e hipertensión arterial; ejemplo de ello, y quizá uno de los ensayos clínicos más relevantes respecto a este tema, es un estudio controlado, que incluyó a 125 pacientes, con edad promedio de 13 años, todos hipertensos, que encontró en los sujetos con hipertensión primaria concentraciones de ácido úrico mayores de 5.5 mg/dL, en contraste con los pacientes con hipertensión secundaria o normotensos, quienes tenían concentraciones por arriba de este corte en 30 y 0%, respectivamente.15,16
Como seguimiento a estos resultados, los mismos autores realizaron un ensayo clínico en 2008 también en adolescentes y se demostró que el tratamiento con alopurinol y la disminución en las concentraciones de ácido úrico redujeron las cifras tensionales.17
Otro estudio de gran trascendencia, similar, publicado en 2014, encontró beneficio al administrar alopurinol como tratamiento adjunto en pacientes hipertensos con hiperuricemia (> 5.5 mg/dL), sin encontrar efectos adversos. El estudio incluyó a 44 pacientes adolescentes, entre 12 y 19 años, con diagnóstico de hipertensión arterial esencial e hiperuricemia mayor a 5.5 mg/dL. Se comparó un grupo que recibió únicamente enalapril y otro que recibió alopurinol + enalapril, se encontraron diferencias estadísticamente significativas a favor del tratamiento adjunto, con disminución de la presión arterial sistólica -4.1 y diastólica -2 (p 0.001 y 0.006, respectivamente), con seguimiento de únicamente ocho semanas (Cuadro 3).22
Cuadro 3 Comparación de tratamiento con enalapril y tratamiento combinado
| Parámetro | Tratamiento con enalapril (grupo 1, n = 20) | Tratamiento combinado (grupo 2, n = 24) | Valor p |
|---|---|---|---|
| Reducción en la presión arterial sistólica (mmHg) media (IC95%) | -2.1 a -6.7 | -8.2 (-7.2 a -9.8) | 0.001 |
| Reducción en la presión arterial diastólica (mmHg) media (IC95%) | -1.1 a -2.2 | -6.3 (-1.9 a -7.8) | 0.006 |
| Reducción en el ácido úrico sérico medio (IC95%) | -2.9 a -5.2 | -5.1 (-4.8 a -6.7) | 0.002 |
Tomado de la referencia 22.
Hiperuricemia y enfermedad renal
Lesión renal aguda
Se ha descrito la participación también del ácido úrico en la enfermedad renal crónica y en casos de lesión renal aguda. Ejemplo de esto último son estudios realizados en pacientes a quienes se les efectuó cirugía cardiaca, en los que se encontró que la hiperuricemia es un factor predictor prequirúrgico de lesión renal aguda, con correlación lineal positiva entre mayores concentraciones y mayor grado de lesión renal aguda, más días de hospitalización y de asistencia mecánica ventilatoria.18
Enfermedad renal crónica y trasplante
Respecto a la enfermedad renal crónica, se ha encontrado que las concentraciones elevadas de ácido úrico intervienen en la progresión de la enfermedad, así como también su disminución retrasa la progresión de la misma e inclusive algunos estudios han mostrado un pequeño aumento en el filtrado glomerular con la terapia con alopurinol.
En paciente diabéticos tipo 1, la hiperuricemia parece predecir la aparición de nefropatía diabética y la progresión de la enfermedad renal crónica. Los resultados de un estudio prospectivo observacional muestran que en el grupo de pacientes con mayores concentraciones de ácido úrico ubicados en el cuartil superior tuvieron en 22.3% microalbuminuria persistente como marcador de daño microvascular renal, comparado con 9.5% en los tres cuartiles inferiores, lo que confirma mediante un análisis multivariado al ácido úrico como factor independiente asociado con macroalbuminuria persistente: HR 2.37 (IC95%: 1.04-5.37).19-21 También se han realizado estudios experimentales prospectivos que evalúan el beneficio en cuanto a progresión de enfermedad renal crónica, lo que demuestra que el tratamiento hipouricemiante podría retrasar la progresión de la pérdida de filtrado glomerular.27 En el ámbito de trasplante renal, se ha encontrado en estudios experimentales realizados en modelos murinos con trasplante renal que la hiperuricemia exacerba la nefropatía inducida por ciclosporina, por un mecanismo directo y no dependiente de depósito de cristales ni activación del sistema RAA.28
Efectos fisiopatológicos de la hiperuricemia
Estudios experimentales identificaron numerosos mecanismos a través de los cuales la hiperuricemia puede causar hipertensión (Cuadro 4).
Cuadro 4 Efectos fisiopatológicos de la hiperuricemia en la aparición de hipertensión arterial
|
1. Reducción de las concentraciones de óxido nítrico endotelial 2. Estimulación de extrés oxidativo 3. Expresión de URAT-1 endotelial 4. Activación del eje renina-angiotensina 5. Induce hiperplasia de músculo liso vascular 6. Aparición de enfermedad microvascular renal |
Reducción de las concentraciones de óxido nítrico endotelial
El mecanismo por el cual el ácido úrico disminuye las concentraciones de óxido nítrico en el endotelio vascular es un área de estudio intenso. Cultivos celulares han demostrado que el ácido úrico tiene la capacidad de interactuar con la célula endotelial logrando disminuir las concentraciones de óxido nítrico.24 Las consecuencias de esta disminución de óxido nítrico son de cualquier forma más crónicas que inmediatas, tal como lo demuestra el hecho de que infusiones de uratos en humanos no causan disfunción endotelial de forma aguda.25
Estimulación de estrés oxidativo
Se ha propuesto la hipótesis de que el ácido úrico tiene efecto proinflamatorio en el endotelio vascular, regulando a este nivel vías de proinflamación críticas. Estudios experimentales han demostrado una acción proinflamatoria directa sobre las células del músculo liso vascular, incrementando la expresión de MCP-1 (proteína quimiotáctica de monocitos tipo 1) y, además, con un comportamiento dosis y tiempo dependiente.16 Asimismo, el ácido úrico activa la transcripción de FNT K-b, proteína activadora tipo 1 y de moléculas de señalización de MAP-K, así como la expresión de ARNm de COX-2, generando un ambiente proinflamatorio, lo que sugiere que tiene un papel preponderante en los cambios vasculares asociados con hipertensión y enfermedad vascular.
Las células de músculo liso del endotelio vascular expresan receptor URAT-1
La homeostasia renal del ácido úrico es controlada en gran medida por URAT-1 (SLC22A12), un miembro de la superfamilia de transportadores de aniones orgánicos. Un estudio experimental demostró mediante PCR y Western blot la expresión de este transportador en músculo liso vascular aórtico. La expresión de URAT-1 se encontró en la membrana celular. La evidencia de la funcionalidad del URAT-1 a este nivel se demostró al encontrar que la captación de uratos fue inhibida de manera significativa en presencia de probenecid. En conclusión, la expresión de URAT-1 puede ser el mecanismo a través del cual el ácido úrico entra en las células del músculo liso vascular y determina su participación en el remodelado vascular y la enfermedad cardiovascular.26
Activación del eje renina angiotensina
En el contexto de la relación entre la hiperuricemia, la obesidad y las enfermedades cardiovasculares, un estudio realizado en cultivos celulares de adipocitos demostró que la hiperuricemia provocaba sobrerregulación genómica del SRAA (AGT, ACE1, renina, AT1r, AT2r), y de la secreción de angiotensina II; además, se demostró que estos efectos podían ser prevenidos por la administración de inhibidores del SRAA (captopril y losartán). Esto sugiere que este mecanismo podría ser una de las formas en que la hiperuricemia contribuye a la patogenia de enfermedad cardiovascular relacionada con la obesidad.30
Perlstein y su grupo demostraron que existe asociación entre las concentraciones séricas de ácido úrico y el riesgo de hipertensión y nefropatía, mediante la medición de la respuesta renal a las concentraciones plasmáticas de angiotensina II, mismos que tenían una correlación positiva lineal con las concentraciones de ácido úrico.31
El ácido úrico genera estimulación de la proliferación de músculo liso vascular
Estudios realizados en modelos murinos demostraron que el ácido úrico endotelial tiene comportamiento mitógeno, estimulando la síntesis de ADN en las células de músculo liso vascular, así como su crecimiento por vías específicas de señalización intracelulares; esto, además, con comportamiento dosis-dependiente.32 Un estudio realizado en 2008 respalda esta teoría al encontrar que el ácido úrico generaba proliferación del músculo liso vascular en cultivos celulares aórticos, encontrando, además, aumento en la expresión de endotelina-1 y especies reactivas de oxígeno, lo que podría dilucidar los principales mecanismos a través de los cuales la hiperuricemia genera la remodelación vascular asociada con hipertensión y enfermedades cardiovasculares.
El ácido úrico promueve la aparición de enfermedad microvascular en el riñón
Modelos experimentales realizados en el Instituto Nacional de Cardiología Dr. Ignacio Chávez demostraron que la hiperuricemia induce disfunción endotelial y alteraciones hemodinámicas glomerulares;14 se sugiere que la disfunción endotelial conduce a vasoconstricción de la arteriola eferente, con el consecuente daño arteriolar que perpetúa la hipertensión glomerular y, en consecuencia, se potencializa el riesgo de hipertensión y de daño renal progresivo.
Cuando la hiperuricemia se vuelve crónica, los cambios microvasculares e inflamatorios renales perpetúan una hipertensión sal-sensible, a pesar de que en este punto las concentraciones de ácido úrico sean corregidas.18 Otro ensayo clínico desarrollado en modelos murinos, a los que se indujo hiperuricemia, mostró que en ratas hiperuricémicas había mayor hipertrofia renal, así como mayor grado de glomeruloesclerosis (p ≤ 0.05) y fibrosis intersticial (p < 0.05). Los modelos murinos hiperuricémicos padecieron enfermedad renal vascular por estenosis de las arterias preglomerulares con proliferación de músculo liso. También se demostró que el tratamiento con alopurinol acompañado de reducción en las concentraciones de ácido úrico bloqueó los cambios renales funcionales e histológicos.20
En los últimos años se ha demostrado en modelos experimentales que la hiperuricemia produce daño renal no relacionado con la precipitación de cristales de urato, por lo que el tratamiento de la misma, independientemente de la existencia de síntomas, sería benéfico.13,33
En conjunto, las vías fisiopatológicas y mecanismos descritos sugieren que la hiperuricemia juega un papel muy importante en el riesgo cardiovascular y en la progresión o inicio de daño renal.
CONCLUSIONES
La evidencia reciente, en su mayor parte proveniente de los avances obtenidos a través de estudios experimentales, ha aportado nuevo conocimiento acerca de los múltiples posibles mecanismos a través de los cuales el ácido úrico tendría un papel preponderante en la hipertensión arterial sistémica y en múltiples alteraciones metabólicas.
Es prometedor que, al tener en cuenta la estrecha relación entre la hiperuricemia y estos estados patológicos, sea factible considerar que las medidas hipouricemiantes puedan atenuar los efectos nocivos del ácido úrico, lo que favorecería a un gran grupo de pacientes al retrasar la aparición de hipertensión arterial esencial y mejorar el alcance de metas de presión arterial e incluso al retardar la progresión de la enfermedad renal crónica; además de que se han descrito las múltiples vías fisiopatológicas específicas que respaldarían esta teoría, ha sido posible demostrar, por lo menos en estudios experimentales, beneficios en cuanto al control de la presión arterial en modelos sometidos a tratamiento hipouricemiante con alopurinol; sin embargo, aún no hay suficiente evidencia en grupos de pacientes ni ensayos clínicos más allá de pequeños grupos muy específicos de pacientes con hipertensión.
A pesar de la existencia de evidencia que respalda el papel del ácido úrico en la aparición de estas enfermedades, hace falta desarrollar estudios clínicos a gran escala, bien diseñados, que prueben de manera más contundente estas teorías, antes de considerar tratamientos enfocados en el manejo de la hiperuricemia asintomática en la práctica clínica diaria.











 nueva página del texto (beta)
nueva página del texto (beta)