ANTECEDENTES
En términos de salud pública Mycobacterium tuberculosis es la micobacteria más importante en todo el mundo; sin embargo, otras especies han incrementado su frecuencia y patogenia en el ser humano debido a su amplia distribución y a las nuevas técnicas de identificación. Éstas se han referido en la bibliografía como micobacterias atípicas o no tuberculosas, en las que el modo de trasmisión en algunos casos no está bien definido, pero la exposición ambiental es el mayor factor de riesgo de adquirir la infección. La trasmisión entre humanos no está bien definida y se acepta que no ocurre o es muy raro que ocurra, esto al menos en pacientes inmunocompetentes.1,2 Por ello, ante la sospecha clínica de tuberculosis o micobacteriosis, se recomienda se realicen de manera simultánea cultivos en medios sólidos y líquidos para su aislamiento y posterior tipificación.3
Los organismos del género Mycobacterium spp por su velocidad de crecimiento se clasifican como organismos de crecimiento rápido los que forman colonias en menos de una semana en medio sólido y de crecimiento lento los que forman las colonias en más de una semana. Del grupo de crecimiento rápido M. abscessus es agente patógeno importante en humanos, lo describieron Moore y Frerichs en 1953; sin embargo, en 1992, cuando fue separada del grupo de Mycobacterium chelonae, M. abscessus se identificó como un importante patógeno responsable de un amplio espectro de infecciones de tejidos blandos, infección diseminada en pacientes inmunodeprimidos, como contraindicación al trasplante pulmonar, y como causa importante de enfermedades broncopulmonares en pacientes con enfermedades pulmonares crónicas, representando entre 65 y 80% de enfermedad pulmonar causada por micobacterias de crecimiento rápido.4-6
Hace poco se subclasificó en dos especies con base en su secuencia rpoB: M. abscessus sensu stricto y M. bolletii, constituyendo el grupo de M. abscessus.7
Las micobacterias no tuberculosas están distribuidas en el ambiente, se han propuesto como fuente de contaminación del agua, como en el estudio de Castillo-Rodal y colaboradores que, además, demostraron que las micobacterias no tuberculosas son resistentes a la cloración y al ozono, aunque la relación entre el aislamiento y el riesgo de infección en humanos no se ha investigado y pudiera tener un papel más importante en pacientes inmunodeprimidos.8
Algunos factores predisponentes de enfermedad pulmonar por esta micobacteria son el sexo femenino, que se reportó incluso en 83% en una serie de casos, edad media de 60 años, enfermedad pulmonar preexistente, principalmente fibrosis quística, y no se ha relacionado con el hábito tabáquico.9
CASO CLÍNICO
Paciente femenina de 66 años de edad, sin antecedentes heredofamiliares de importancia, negó antecedentes alérgicos, quirúrgicos y enfermedades crónico-degenerativas, exposición a humo de biomasa por 30 años durante aproximadamente 4 horas diarias, con índice de biomasa 120 horas/año, exposición a casos de tuberculosis negativa, tabaquismo negado.
Inició en junio de 2008 con tos productiva, esputo blanquecino, acompañado de hemoptoicos escasos, en accesos, no disneizante ni emetizante, sin fiebre, sin pérdida de peso, se diagnosticó de manera inicial como bronquitis aguda, por lo que se administró tratamiento antibiótico con betalactámicos, sin remisión de los síntomas; al considerar la exposición a humo de biomasa se diagnosticó clínicamente enfermedad pulmonar obstructiva crónica, se inició tratamiento con agonistas beta 2 adrenérgicos de acción prolongada con esteroide inhalado, salmeterol 50 µg/fluticasona 100 µg, dos inhalaciones cada 12 horas y anticolinérgicos de acción prolongada, tiotropio cápsulas de 18 µg, una inhalación al día. Se mantuvo en control durante tres años, sin ningún episodio de exacerbación que requiriera hospitalización pero con persistencia de síndrome tusígeno crónico, reinició con hemoptoicos en 2011, que eran esporádicos con exacerbación relacionada con cambios de clima, por lo que se solicitaron baciloscopias en esputo seriadas que resultaron positivas ++/+++ y radiografía de tórax (Figura 1); se estableció diagnóstico de tuberculosis pulmonar, se inició tratamiento de seis meses con Dotbal® (rifampicina 150 mg/isoniazida 75 mg/pirazinamida 400 mg/etambutol 300 mg) en fase intensiva y de sostén. Por persistencia de tos, pérdida de peso y baciloscopias positivas +++ en 2012 se dio tratamiento durante dos años, considerando recaída de tuberculosis pulmonar, con baciloscopias positivas + y ++, en algunas ocasiones negativas, con reajustes intermitentes del esquema antituberculoso, se valoró por los servicios de Neumología e Infectología, se solicitó tomografía torácica (Figura 2) y cultivo de expectoración, como lo marcan los lineamientos nacionales, gestionado por el Laboratorio Estatal de Salud Pública de Tamaulipas y el Instituto de Diagnóstico y Referencia Epidemiológicos (InDRE), con desarrollo de Mycobacterium abscessus en dos muestras separadas y que, aunado al cuadro clínico, se estableció el diagnóstico de micobacteriosis pulmonar secundaria a Mycobacterium abscessus, por lo que se decidió inicio de tratamiento en noviembre de 2014 con amikacina 500 mg intramuscular c/24 horas durante dos meses más claritromicina 500 mg c/12 horas de manera indefinida, por no ser apta para resección de la lesión por afección bilateral no se envió a valoración de cirugía cardiotorácica.
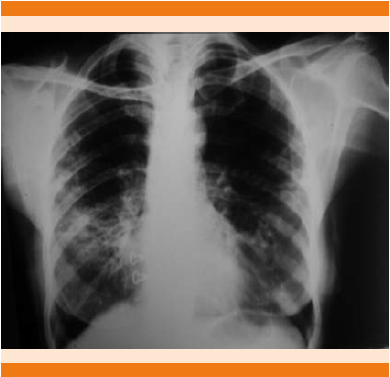
Figura 1 Radiografía de tórax con radioopacidades retículo-nodulares bilaterales de predominio derecho en la región perihiliar e hiliar.

Figura 2 Tomografía simple de tórax en la ventana pulmonar donde se observa patrón nodular bilateral, de predominio derecho, fibrosis, bronquiectasias y cavitación.
En la actualidad la paciente continúa con tos productiva escasa, con esputo blanquecino a amarillento, que se exacerba con cambios de clima; niega fiebre y pérdida de peso. Baciloscopias negativas, la radiografía de tórax muestra leve mejoría radiológica (Figura 3), la tomografía de control realizada en febrero de 2016 no mostró cambios significativos; por la evolución clínica y radiológica a pesar de tratamiento antibiótico continúa con claritromicina 500 mg cada 12 horas y está pendiente el reporte de nuevo cultivo de esputo para micobacterias.
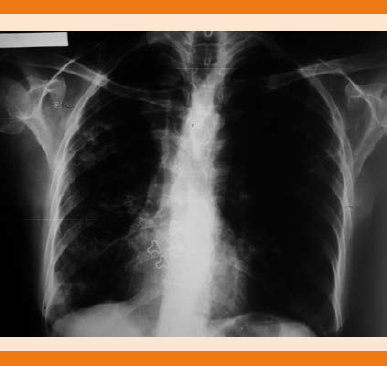
Figura 3 Radiografía de tórax, se observa disminución de radioopacidades hiliares y perihiliares, la paciente aún recibe tratamiento con claritromicina a dosis de 500 mg cada 12 horas.
Resultados de los exámenes de laboratorio:
09/07/2011: BAAR en esputo tres muestras ++/+++/+.
24/01/2012: BAAR tres muestras de esputo negativo.
28/03/2012: BAAR en esputo tres muestras ++/+/++.
26/12/13: glucosa 86 mg/dL, ácido úrico 5.2 mg/dL, proteínas totales 1.4 g/dL, albúmina 4 g/dL, TGP 15.9 UI/dL, TGO 27.3 UI/dL, leucocitos 8300/mL, hemoglobina 12 g/dL, hematócrito 40%, plaquetas 329,000.
30/07/13: BAAR en esputo tres muestras ++/+/+.
05/09/13: BAAR tres muestras de esputo negativo.
20/07/14: BAAR tres muestras de esputo ++/++/++.
27/12/14: BAAR tres muestras de esputo negativo.
DISCUSIÓN
Las características clínicas de la infección pulmonar son variables e inespecíficas, la mayoría de los pacientes cursa con tos crónica con expectoración, fatiga, malestar generalizado, fiebre sin un patrón típico, hemoptisis, dolor torácico y pérdida de peso.1,9,10
Los criterios diagnósticos de enfermedad pulmonar por micobacterias no tuberculosas propuestos por la Sociedad Torácica Americana (ATS) y la Sociedad Americana de Enfermedades Infecciosas (IDSA) primero necesitan sospecha diagnóstica e incluyen: 1)síntomas pulmonares, 2)opacidades nodulares o cavitaciones en radiografía o en tomografía de tórax de alta resolución, bronquiectasias multifocales y pequeños nódulos múltiples y la exclusión de alternativas diagnósticas y 3)más de dos cultivos de esputo, un cultivo de lavado bronqueo-alveolar o un cultivo de biopsia pulmonar positivo.10 Sin embargo, en nuestro medio representa un reto debido a la limitación de recursos, principalmente cultivos, en algunos centros de nuestro país con suficientes recursos y en los que se cuenta con medicina genómica se ha realizado secuenciación completa de los casos de presunta infección por M. tuberculosis, como lo podemos observar en el estudio de Thompson-Bonilla y colaboradores, cuyos resultados se reportaron 72 horas después de la recepción de la muestra, realizándose con dos técnicas de biología molecular PCR en tiempo real y PCR de punto final, del total de pacientes, se identificaron dos con desarrollo de M. abscessus.11
Como se demostró en otros trabajos, el resultado de baciloscopias positivas a tinción de Ziehl-Neelsen no siempre representa infección por Mycobacterium tuberculosis porque en algunas ocasiones pudiera tratarse de micobacterias no tuberculosas o, incluso, de otros gérmenes, como Nocardia spp, por lo que la recomendación en lugares con recursos limitados sería que ante la falla al tratamiento primario se realice aislamiento por cultivo.(12
La duración y el tratamiento de la enfermedad pulmonar por M. abscessus no se han establecido debido a que es resistente a muchos antibióticos, por lo que resulta difícil de tratar.4,5,9,10,13-15
La resistencia intrínseca y adquirida de M. abscessus a los antibióticos comunes limita las opciones de tratamiento. La resistencia intrínseca se atribuye a las alteraciones en la permeabilidad de la barrera debido a la complejidad de multicapas de la envoltura celular, sistemas de exportación de medicamentos, baja afinidad a antibióticos y actividad enzimática citoplasmática que los neutraliza. En la actualidad la resistencia adquirida sólo se ha observado a aminoglucósidos y macrólidos, y es conferida por mutaciones que afectan los genes que codifican rrs y rrl, respectivamente.6,10
In vitro es generalmente susceptible a cefoxitina, amikacina, imipenem y macrólidos, como claritromicina y azitromicina. El éxito del tratamiento depende en gran medida de si la infección está limitada (focalizada), en ese caso la mejor opción de tratamiento es la resección quirúrgica combinada con tratamiento antibiótico múltiple. No se ha encontrado deferencia en el éxito del tratamiento entre los grupos que reciben uno o dos fármacos parenterales; sin embargo, con frecuencia padecen efectos secundarios y tienen la necesidad de prolongar la hospitalización.10,14,16,17
La Sociedad Torácica Americana y la Sociedad Americana de Enfermedades Infecciosas recomiendan con nivel de evidencia CIII el tratamiento poliantimicrobiano con un macrólido oral (azitromicina/claritromicina) y uno o más agentes parenterales; sugieren amikacina (10-15 mg/kg/día), cefoxitina (12 g/día en dosis divididas) o imipenem (500 mg-2 g/día) por varios meses para el control de síntomas y de la progresión de la enfermedad.10
La monoterapia con macrólido frecuentemente muestra resistencia; sin embargo, se han sugerido periodos cortos con o sin otro agente parenteral para la supresión de síntomas, se reporta ligeramente superior azitromicina vs claritromicina.5,9,10,16
En algunas series la tasa de respuesta en cuanto a los síntomas se ha reportado en 83% y de 74% en cuanto a curación evaluada por tomografía, por lo que el tratamiento se considera moderadamente efectivo. La conversión y mantenimiento de la negatividad en el cultivo de esputo en más de 12 meses se ha registrado en 58% con cifras inferiores (12%) cuando existía resistencia a la claritromicina, por lo que estos pacientes deber evaluarse con frecuencia.3











 nueva página del texto (beta)
nueva página del texto (beta)


