Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Universidad y ciencia
versão impressa ISSN 0186-2979
Universidad y ciencia vol.29 no.2 Villahermosa Ago. 2013
Artículos
Uso de fertilizantes orgánicos para la mejora de propiedades químicas y microbiológicas del suelo y del crecimiento del cítrico Citrange troyer
Use of organic fertilisers to improve soil chemical and microbiological properties and citric Citrange troyer growth
Apolinar González-Mancilla1*, María del Carmen Rivera-Cruz1, Carlos Fredy Ortiz-García1, Juan José Almaraz-Suárez2, Antonio Trujillo-Narcía3, Gonzalo Cruz-Navarro3
1 Programa en Producción Agroalimentaria en el Trópico, Campus Tabasco, Colegio de Postgraduados H. Cárdenas, Tabasco, México. Correo electrónico: * mariari@colpos.mx.
2 Programa de Edafología. Campus Montecillo, Colegio de Postgraduados. Texcoco, Edo. México, México.
3 Universidad Popular de la Chontalpa. H. Cárdenas, Tabasco, México.
Artículo recibido: 28 de octubre de 2010,
Aceptado: 27 de junio de 2013
RESUMEN
Se evaluó el efecto de diferentes tipos y dosis de fertilizantes orgánicos (FO) en las propiedades químicas del suelo (C orgánico, N total y P disponible), en la densidad de bacterias reguladoras del crecimiento vegetal [Azospiríllum, Azotobacter; bacterias solubilizadoras de fosfatos (BSP) y bacterias solubilizadoras de potasio (BSK) en suelo a distancia y rizósfera, en la colonización micorrízica arbuscular (hifas, arbúsculos y vesículas] y en el crecimiento de la planta híbrida Citrange troyer [(altura (AP) y diámetro basal de tallos (DBT) en cinco tiempos; materia seca foliar (MSF) y de raíz (MSR)] a los 11 meses del trasplante en vivero. Se establecieron 14 tratamientos, 12 integrados con tipo de FO [estiércol de gallina (EG), cachaza-1 (CA1), cachaza-2 (CA2) y pinzote (PIN)] y dosis (1, 2 y 3 %), se compararon con dos testigos (uno con urea y el otro absoluto). Los resultados muestran diferencias estadísticas significativas (Tukey, p ≤ 0.05) por efectos de tipo y dosis de FO en todos los parámetros químicos, microbiológicos y en el crecimiento de C. troyer. El efecto rizósfera fue observado en la mayoría de los tratamientos con FO. El uso de EG en dosis de 2 % estimula la AP y la dosis 3 % favorece el aumento del DBT, MSF, MSR y la relación MSF/MSR. Se encontró que MSF y MSR tienen relación altamente significativa con los contenidos de N en suelo, con las densidades de Azospiríllum y de BSP, también con la colonización de la raíz con estructuras micorrízicas de hifas, arbúsculos y vesículas, por lo tanto se recomienda el uso de EG en dosis de 2 y 3 % para obtener plantas de C. troyer en vivero.
Palabras clave: Fertilizantes, Azospiríllum, Azotobacter, BSP, BSK, micorriza, altura, diámetro, materia seca.
ABSTRACT
The effect of different types and doses of organic fertilisers (OF) on the chemical properties of the soil (organic C, total N and available P), the density of bacteria that regulate plant growth Azospiríllum, Azotobacter, P-solubilising bacteria and K-solubilising bacteria in soil at a distance and rhizosphere, arbuscular mycorrhizal colonisation (hyphae, arbuscules and vesicles) and hybrid plant growth of Citrange troyer [height and basal stem diameter at five time intervals; dry foliar matter (DFM) and dry root matter (DRM)] was evaluated 11 months after transplantation in the nursery. There were 14 treatments, 12 with types of OF [chicken manure (CM), sugarcane residue-1 (SRI), sugarcane residue-2 (SR2) and banana waste (BW)] and doses (1, 2 and 3 %), that were compared with two controls (one with urea and one absolute). The results show statistically signifcant diferences (Tukey, p ≤ 0.05) due to the effect of the type and dose of OF on all the chemical and microbiological parameters, and on the growth of C. troyer. The rhizosphere effect was observed in most treatments with OF. The use of CM at a dose of 2 % stimulates plant growth and at a dose of 3 % favours an increase in basal stem diameter, DFM, DRM and the DFM / DRM relationship. It was found that DFM and DRM have a highly significant relationship with the content of N in the soil, the densities of P-solubilising bacteria and Azospiríllum, and the colonisation of the root by mycorrhizal structures of hyphae, arbuscules and vesicles. Thus, the use of CM is recommended at doses of 2 and 3 % to obtain C. troyer plants in nurseries.
Key words: Fertilisers, Azospiríllum, Azotobacter, P-solubilising bacteria, K-solubilising bacteria, mycorrhiza, height, diameter, dry matter.
INTRODUCCIÓN
En México la citricultura es una actividad importante en la fruticultura, se registra una superficie cosechada de 540 671 hectáreas, generando un volumen de producción anual de 7 390 111 toneladas de fruta, con un valor de producción de $ 9 838 747 825 pesos (SIAP-SAGARPA 2010). En Tabasco existen 14 095 hectáreas con una producción económica de S 250 744 780 (SIAP-SAGARPA 2010). Diversas especies de cítricos, principalmente limón persa y naranja valenciana, se han introducido en suelos agrícolas de México (Contreras 2007). El adecuado desarrollo, crecimiento y tolerancia a enfermedades se ha logrado con el uso de híbridos como porta injertos, entre estos el denominado Citrange troyer (CT) con resistencia a condiciones de heladas, bajas temperaturas, ataques por nemátodos, así como tolerancia a Phytophthora sp, al virus de la tristeza de los cítricos (VTC), a la psoriasis, la xyloporosis y a la gomosis (Curti-Díaz et al. 2000; Spina et al. 2008). Sin embargo, el mencionado portainjerto muestra sensibilidad a suelos calcáreos, salinidad, sequía, además es susceptible al hongo Amarillaria mellea y a la exocostis (Forner 1979; Gravina 1981; Llanos 1998; Agustí 2003). Las plantas del CT se producen en condiciones de vivero, para esto se aplican fertilizantes inorgánicos (Fl) que incrementan su crecimiento en corto tiempo, sin embargo el uso excesivo de estos afecta las propiedades físicas, químicas y biológicas del suelo (Karlidag et al. 2009). Las propiedades alteradas incluyen la porosidad debido a la compactación, disminuye la absorción de nutrimentos, los Fl inducen salinidad del suelo y afecta la absorción equilibrada de nutrimentos, el crecimiento y desarrollo de la planta (Szott & Kass 1993; Deb & Bora 1996). Otras modificaciones se manifiestan en la densidad de rizobacterias promotoras del crecimiento vegetal (PGPR) en las bacterias fijadoras de N de vida libre, en las solubilizadoras de fosfatos (Ögüt et al. 2005) y en los hongos micorrízicos arbusculares en la rizósfera. Los FO derivados de residuos vegetales y animales han sido utilizados para estimular la calidad biológica, física y química del suelo (FAO 2002; Mora 2006). Los FO ya utilizados son la semolita de arroz, melaza, bagazo de molinos azucareros, cachaza, raquis de tallos de banano, cáscara de naranja, estiércol bovino, pollinaza y gallinaza (Okumoto 2003; Intrigliolo et al. 2004; Rivera-Cruz et al. 2008; Rivera-Cruz et al. 2010). Las propiedades del suelo mejoradas por la adición de FO incluyen la disminución de la densidad aparente, el incremento de la retención de humedad, aumento de la materia orgánica, además mejoramiento de la fertilidad del suelo a través de mayores cantidades de macro y micronutrimentos (Meléndez 2003), Otros beneficios de los FO es el aumento de la provisión de la demanda de carbono, nitrógeno y energía para el crecimiento, reproducción, en la diversidad microbiana, hongos y en las PGPR (Zeng et al. 2007). La incorporación de FO en el suelo induce en la planta mayor desarrollo radicular, crecimiento, aumento de la biomasa vegetal y de frutos (Acuña 2003; Jilani et al. 2007; Francis et al. 2010). Las especies vegetales evaluadas con FO son Citrus aurantium var. sinensis (Intrigliolo et al. 2004), Zea mays (Wu et al. 2005), Lycopersicum esculentum (Meunchang et al. 2006), Lactuca sativa (Lai et al. 2008), Rianus comunis (García-Cruz et al. 2008), Musa paradisiaca AAA (Rivera-Cruz et al. 2008); Chloris gayana, Cynodon dactylon, Digitada eriantha, Eragrostis curvula, Panicum maximum y Paspalum distichum (Maliba et al. 2011) y Raphanus sativus (Reinaldo & Cisne 2011). Asociadas a la rizósfera de diversas especies vegetales, cultivadas en suelos enmendados con FO, se ha reportado la presencia de PGPR fijadoras de N de vida libre y solubilizadoras de fosfatos (Wu et al. 2005; Rivera-Cruz 2011; Vázquez-Luna et al. 2011) responsables de la fijación de N molecular atmosférico a formas inorgánicas como el amonio (Philippot & Germon 2005) y de movilizar P a forma disponibles del suelo para la planta (Deubel & Merbach 2005). El uso de FO como el estiércol de gallina, la cachaza y el pinzote para estimular el crecimiento de la planta de CT no se ha evaluado en el trópico húmedo mexicano. La importancia del portainjerto CT radica en que se adapta a las condiciones de vivero (Salazar 2001); las plantas son uniformes y vigorosas, se desarrollan rápidamente antes y después del injerto, induce buenas características a los naranjos dulces que en él se injertan y producen frutos de buena calidad. El objetivo de esta investigación fue evaluar los efectos de tipo y dosis de fertilizantes orgánicos en las propiedades químicas del suelo, en la densidad poblacional de rizobacterias promotoras del crecimiento vegetal, en la colonización de la micorriza arbuscular y en el crecimiento de la planta de Citrange troyer. El aporte de este trabajo representa una alternativa para conocer y mejorar la calidad productiva de la producción de porta injertos en vivero y contribuir a su habilitación.
MATERIALES Y MÉTODOS
El suelo y sus características
El suelo fué colectado del horizonte superficial Api de un Acrisol Umbri-Plíntico cultivado con plantas de limón persa, localizado a 17° 45' Latitud Norte y 93° 44' Latitud Oeste, en Huimanguillo, Tabasco, México (Ventura 2007). El suelo se secó bajo sombra, se molió y tamizó en mallas de 0.5 y 2 mm de abertura para la determinación del C orgánico (Corg), N total (Ntot) y P disponible (Pdisp). El suelo para el establecimiento del bioensayo en vivero con plantas de C. troyer se tamizó en malla de 5 mm de abertura. Las propiedades del suelo fueron textura areno francosa (Bouyoucos), pH en agua es 4.77 (potenciometría), 6.35 % de Corg (Nelson & Somers 1982), el Ntot 0.21 % (micro Kjeldhal, Bremmer & Mulvaney 1982) y el Pdisp fue de 31.31 mg kg−1 (Bray & Kurtz 1945). La densidad inicial de las bacterias Azotobacter sp y las solubilizadoras de K fue de 101 UFC g−1 suelo seco.
Fertilizantes orgánicos
Los cuatro FO utilizados fueron estiércol de gallina (EG), cachaza-1 (CA1), cachaza-2 (CA2) y pinzote (PIN), expuestos durante diferentes periodos a la temperatura ambiental y a la lluvia del trópico húmedo. El EG es producto de origen animal proveniente de una granja de gallinas ponedoras ubicada en la Colonia Calzada la. Sección, municipio de Cárdenas, Tabasco. Las cachazas CA1 y CA2 y el PIN son productos vegetales, los dos primeros derivados de la molienda industrial de la caña de azúcar y se colectaron del tiradero a cielo abierto en el Ingenio Santa Rosalía, municipio de Cárdenas, Tabasco. La CA1 es de la zafra 2007-2008 y la CA2 de la zafra 2008-2009, expuestas al ambiente durante 11 y tres meses, respectivamente. La CA1 tiene una relación C/N de 7.6 menor a la CA2 con 14.12 (Tabla 1), la menor relación de la CA1 es un indicador de mayor mineralización, las evidencias se encuentran en la Tabla 1, tiene mayores contenidos de Ntot, Pdisp, Ca y Zn respecto a los correspondientes a la CA2. El PIN es derivado de la descomposición natural del raquis central del racimo de banano, fue colectado de un montículo a cielo abierto, expuesto al ambiente durante tres años, en la finca bananera AGRISNA S.P. de R.L., localizada en la Ranchería Cumuapa, Cunduacán, Tabasco. Las características químicas del PIN se indican en la Tabla 1.
Producción de plántulas de Citrange troyer
Tres meses antes del establecimiento del experimento se produjeron plántulas de C. troyer. La semilla se sembró en suelo ácido y estéril acomodado en espacios cónicos llenos de suelo en charolas de PVC, el suelo se colectó del horizonte superficial de un Acrisol Umbri-Plíntico (Ventura 2007). La germinación de la semilla fue 95 %.
Establecimiento del experimento y variables evaluadas
Se estableció durante 11 meses (mayo 2009 a marzo de 2010) un experimento factorial 4x3 (cuatro tipos de FO: EG, CA1, CA2 y PIN y tres dosis: 1, 2 y 3 %, se adicionó 10, 20 y 30 g de FO por kilogramo desuelo, respectivamente). Se evaluaron 12 tratamientos más dos testigos [TI: EG + 1, T2: EG + 2, T3: EG + 3, T4: CA1 + 1, T5: CA1 + 2, T6: CA1 + 3, T7: CA2 + 1, T8: CA2 + 2, T9: CA2 + 3, TIO: PIN + 1, Til: PIN + 2, T12: PIN + 3, T13: testigo (urea, 120N ton ha−1 distribuido en tres aplicaciones en el periodo de 11 meses) y T14: testigo absoluto], alojados en un diseño completamente al azar con seis repeticiones, en total se evaluaron 84 unidades experimentales. Cada unidad experimental consistió de una maceta con 5.6 kg de suelo seco más la planta de CT con su respectivo tipo y nivel de FO. Los efectos de tipo y dosis de FO fueron evaluados en las propiedades químicas del suelo (Corg, Ntot y Pdisp), en la densidad de bacterias, en la colonización micorrízica, en el crecimiento de la planta [altura de planta (AP) y diámetro basal del tallo (DBT)] y en la producción de materia seca foliar (MSF) y radical (MSR).
Determinación de las propiedades químicas en suelo
Las propiedades químicas del suelo se determinaron en muestras colectadas a los 11 meses después de la siembra de la planta. El suelo se secó bajo sombra, se tamizó en mallas de 0.5 y 2 mm de abertura. El Corg se determinó por el método Nelson & Somers (1982), el Ntot se analizó mediante micro-Kjeldahl después de la digestión de la muestra con H2SO4 (Bremmer & Mulvaney 1982) y el Pdisp se determinó con el método de Bray & Kurtz (1945) en solución extraíble de HCl y NH4F utilizando un espectrofotómetro a 880 nm.
Conteo de microorganismos en suelo a distancia y en rizósfera
El conteo y el aislamiento de las PGPR se realizaron en muestras frescas de suelo a distancia y en rizósfera colectadas al momento de la cosecha (Kloepper & Schroth 1978). Se utilizó la técnica dilución seriada en placa de agar (Madigan et al. 2009) con medios de cultivos sólidos. Los medios utilizados fueron rojo congo para el grupo Azospirillium (Rodríguez 1982), Ashby para el grupo Azotobacter (Rao 1982), Pikovskaya para BSP (Pikovskaya 1948) y BSK (Qi-Mei et al. 2002). El conteo de bacterias se transformó a unidades formadoras de colonias por gramo de suelo (UFC g-1 suelo seco).
Porcentaje de colonización micorrízica
El conteo de la colonización micorrízica (hifas, arbúsculos y vesículas) en segmentos de raíz se realizó con la técnica de aclareo y tinción (Alarcón et al. 2001). La tinción se realizó siguiendo las siguientes etapas: a) aclareo, b) blanqueo, c) acidificación, d) tinción y e) decoloración.
Los reactivos empleados fueron hidróxido de potasio al 10 %, peróxido de hidrógeno al 10 %, ácido clorhídrico 1N; lactoglicerol y azul de tripán a 0.05 % (Sieverding 1983). Para cada muestra se evaluaron 30 campos visuales en 15 segmentos de raíz montados en lactoglicerol y observados en microscopio óptico con objetivo 10X. Para el porcentaje de colonización se divide el número de campos colonizados (puede ser hifa, arbúsculo o vesícula) entre el total de campos observados multiplicada por 100.
Crecimiento y materia seca vegetal
La altura de planta (AP) y el diámetro basal de tallo (DBT) se evaluaron en cinco tiempos (al inicio, 3, 6, 9 y 11 meses después del trasplante); la materia seca radical (MSR) y foliar (MSF) se determinaron al mes 11.
La AP se midió con una regla graduada en cm desde la base del tallo hasta la yema apical (primordio foliar). El DBT se midió en la base del tallo con un vernier electrónico. La MSR y la MSF se determinaron separando la parte aérea de la planta (tallos y hojas) y la raíz, se introdujeron en bolsas de papel y se secaron en horno a 70 °C durante 72 h (Ramírez et al. 1998).
Análisis estadístico
Se realizó análisis de varianza (ANOVA) para cada variable. Los datos de hongos micorrízicos (hifas, arbúsculos y vesículas) fueron transformados a logaritmos, después se realizó la comparación de medias con la prueba de Tukey (p ≤ 0.05).
Los datos fueron analizados con el paquete estadístico SAS (Statistical Analysis System versión 9.0 ) (SAS 2002).
RESULTADOS
Propiedades químicas de suelo
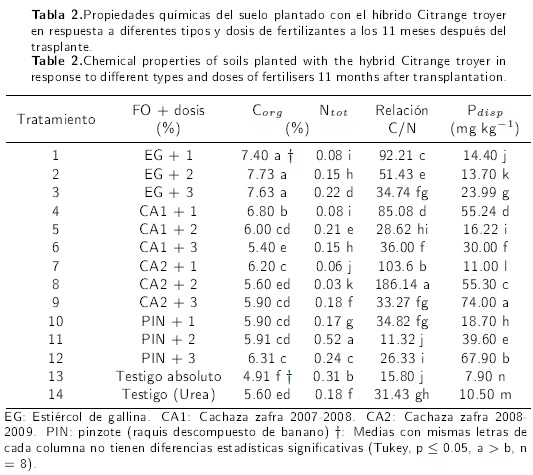
La comparación de las medias de Corg, Ntot y Pdisp muestran diferencias estadísticas significatitivas (p ≤ 0.05) (Tabla 2). La cantidad más grande de Corg (7.40 %) correspondió a los suelos fertilizados con 1, 2 y 3 % de EG, fue 1.51, 1.57, 1.55 veces mayor, respectivamente, que la cantidad del tratamiento testigo absoluto (0 % FO); también 1.32, 1.37 y 1.35 que el tratamiento testigo pero con urea.
El contenido de Ntot fue mayor al aplicar al suelo PIN + 2 %, siendo 1.67 y 2.88 veces mayor respecto a los testigos absoluto y al fertilizado con urea. El tratamiento PIN + 2 % (11.32) relación C/N, es un indicador de la mayor mineralización del Corg.
La mayor cantidad de Pdisp fue 74 mg kg−1 y correspondió al tratamiento CA2 + 3 %, las menores concentraciones (7.9 y 10.5 mg kg−1) se registraron en los dos suelos testigo, absoluto y fertilizado con urea, respectivamente.
Densidad de bacterias reguladoras de crecimiento vegetal
Los FO con sus diferentes dosis incrementaron significativamente las densidades de bacterias de los grupos Azospiríllum, Azotobacter, BSP y BSK en suelo a distancia y en la rizósfera de CT en comparación con los tratamientos testigo absoluto y fertilizado con urea (Tablas 3 y 4). La fertilización con CA1 + 1 % estimuló, tanto en rizósfera como en suelo a distancia, mayor densidad de Azospiríllum (11x104 y 62x103 UFC g−1, respectivamente). El aumento de la densidad en la rizósfera de la planta de CT fue 3.27 y 393.3 veces respecto al suelo testigo absoluto y al fertilizado con urea, respectivamente. El efecto rizósfera en la densidad de Azospiríllum ocurrió en los 12 tratamientos con EG, CA1, CA2 y PIN, el mayor efecto fue 98 en el tratamiento CA2 + 3 %. En cuanto al efecto rizósfera en Azotobacter el mayor valor fue 144 y se localizó en el tratamiento CA2 + 2 %, en el grupo de BSK fue 37.14 en suelo fertilizado con CA2 + 3 %, finalmente en las bacterias BSP la adición del biofertilizante EG + 3 % indujo un efecto rizósfera de 2550. La mayor densidad Azotobacter en rizósfera y en el suelo (28x103 y 52x102 UFC g−1) fue promovido por el tratamiento CA2 + 1 y/o 2 % y CA1 + 2 %, respectivamente. La densidad de Azotobacter aumentó 23.9 y 71.7 veces respecto a la rizósfera con suelo testigo absoluto y fertilizado con urea, respectivamente. El efecto rizósfera basado en la densidad de Azotobacter fue observado en 10 tratamientos (Tabla 3) siendo el valor mayor inducido por el efecto de la fertilización con CA2 + 2 %.
Las densidades rizosféricas de BSP y BSK fueron mayores en suelos fertilizados con CA2 + 3 %. Las BSP aumentaron sus densidades 140 y 46.6 veces respecto al tratamiento testigo absoluto y fertilizado con urea, tendencias similares se identificaron en las densidades de BSK, los incrementos fueron 13 y 6.5 veces, respectivamente. El efecto rizósfera inducido por los grupos de bacterias BSP y BSK fue observado en ocho y nueve tratamientos. Los mayores efectos (2550) y (37.14) fueron inducidos por los fertilizantes EG + 3 % y CA2 + 2 %, respectivamente (Tabla 4).
Hongos micorrízicos vesículo arbuscular
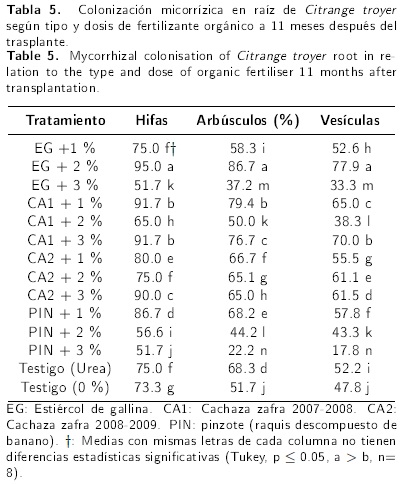
La colonización por HMVA (hifas, arbúsculos y vesículas) en la raíz de CT muestra diferencias estadísticas significativas (p ≤ 0.05) según tipo y dosis de los biofertilizantes inoculados (Tabla 5). El EG + 2 % estimuló el porcentaje de colonización micorrízica en hifas (95 %), en arbúsculos (86.7 %) y en vesículas (77.9 %). Los incrementos fueron de 1.3 (hifas), 1.7 (arbúsculos) y 1.6 (vesículas) veces más que la colonización del testigo absoluto. El PIN + 3 % inhibió la colonización en hifas (51.7 %), en arbúsculos (22.2 %) y en las vesículas (17.8 %).
Crecimiento y acumulación de materia seca
Las Figuras 1 y 2 muestran los cambios de la AP y DBT de la planta de CT durante 11 meses, se observan diferencias estadísticas significativas (Tukey p ≤ 0.05) desde el tercer hasta el mes 11. La AP el mes 11 tiene relación positiva altamente significativa con los grupos de rizobacterias reguladoras del crecimiento vegetal (Azospiríllum, BSP y BSK), con la colonización de los HMVA (hifas, arbúsculos y vesículas en la rizósfera) y con la cantidad de Ntot. La respuesta de la DBT muestra relación positiva altamente significativa con las bacterias del grupo BSP y con la colonización de los HMVA (Tabla 6). Los resultados evidencian que dos FO (EG y PIN) y el fertilizante inorgánico (urea) indujeron el crecimiento de la planta (AP). El PIN originó crecimiento directamente proporcional a la cantidad adicionada, en cambio CA1 no promovió el crecimiento, al contrario, a mayor dosis disminuyó la altura de la planta de CT. El efecto del EG en el diámetro basal del tallo (DBT) fue positivo desde el tercer mes, el mayor diámetro (13.64 cm) se asoció con la dosis 3 % de EG con un incremento de 1.75 y 1.43 veces respecto al testigo absoluto y el fertilizado con urea (Figura 2). La materia seca foliar (MSF) y radical (MSR) mostraron diferencias significativas (p ≤ 0.05) por efecto de tipo y dosos de fertilizantes aplicados al suelo (Figura 3). La mayor formación de MSF (29.02 g) y de MSR (17.23 g) se relacionó con la incorporación en el suelo de 3 % de EG, dando como resultado hasta 4.5 veces más MSF respecto al valor del testigo absoluto y hasta 4.2 veces de MSR. La relación MSF/MSR al incorporar 3 % de EG al suelo fue 1.7. La MSF muestra efecto directamente proporcional con dosis de EG y PIN pero con la adición de CA1 y CA2 no hay efecto por dosis. En cuanto a la MSR existe efecto directamente proporcional al aumento de la dosis de EG y CA1. Ambos variables (MSF y MSR) tienen relación positiva y significativa con BSP, con las tres estructuras de HMVA (hifas, arbúsculos y vesículas) y con Pdisp en suelo (Tabla 5) pero se identificó relación negativa con BSK y con Ntot en suelo.
DISCUSIÓN
Propiedades químicas en suelo
El aumento de Corg en suelos fertilizados con las tres dosis de EG se debe a que éste FO contiene 1.96, 1.27 y 1.25 veces más de Corg, que CA1, CA2 y PIN (Tabla 2). Estas bondades de mejoramiento químico del suelo han sido reportados por Wu et al. (2005) y por Meijide et al. (2007), incluso por Banger et al. (2010) y Moeskops et al. (2010) quienes encontraron incrementos de 36 y 0.14 % de producción al aplicarlo en suelos cultivados con plantas de arroz y de tomate. El mayor contenido de Ntot se encontró en suelo con 2 % de PIN, posiblemente es porque este residuo vegetal derivado del cultivo de banano contiene 0.4 y 2.1 % mayor contenido de N que los fertilizantes EG y CA1, respectivamente (Tabla 2). Resultados similares fueron encontrados por Wu et al. (2005) al aplicar estiércol de pollo incrementa el contenido de N en el suelo cultivado con maíz, lo cual puede ser atribuido no sólo al N sino también al Corg contenido en el fertilizante. Otras investigaciones indican que la incorporación de estiércol de granjas de corral a suelo cultivado con arroz aumenta 1.24 veces la cantidad de Ntot (Banger et al. 2010), igualmente Kowaljow et al. (2010) reportaron aumentos de 1.6 veces de Ntot al incorporar FO en suelo con uso forestal. En cuanto al Pdisp la mayor concentración fue 74 mg kg−1 y se determinó en suelo enriquecido con 3 % de CA2 (cachaza con tres meses de exposición al ambiente), fue mayor dos veces (36.8 mg kg-1) que el obtenido por Rivera-Cruz et al. (2010) al incorporar al suelo cultivado con naranjo agrio 3 % de cachaza. Otros resultados similares fueron obtenidos por Kowaljow et al. (2010) quienes encontraron 26.4 mg kg−1 de Pdisp al incorporar FO en suelo cultivado con plantaciones forestales.
Densidad de bacterias reguladoras del crecimiento vegetal
La densidad de PGPR fue mayor en la rizósfera (Tablas 3 y 4) que en el suelo a distancia, resultados similares han sido encontrados en diferentes experimentos (Wu et al. 2005; Manoharachary & Mukerji 2006; Meunchang et al. 2006). Se ha reportado que la rizósfera es el espacio de suelo en contacto directo con las raíces de las plantas, ahí son segregados los compuestos orgánicos derivados de su respiración y fotosíntesis (aminoácidos, vitaminas, azúcares, ácidos orgánicos, nucleótidos, flavonoides, enzimas, glucósidos, auxinas, sapónicos y taninos) (Gupta & Mukerji 2002), lo que permite el establecimiento y multiplicación de bacterias de vida libre de los grupos Azospiríllum, Azotobacter, BSK y BSP y de asociación simbiótica como las micorrizas arbusculares (Brimecombe et al. 2001). Aunado al efecto rizósfera inducido por los diferentes tipos de plantas, el uso de FO es un factor que ha demostrado el incremento de la densidad de los microorganismos. En la presente investigación la mayor densidad fue encontrada en rizósfera de CT fertilizada con CA1 (Azospiríllum) y con CA2 (Azotobacter, BSP y BSK) (Tablas 3 y 4). Resultados similares en el uso de cachaza como fertilizante incrementó hasta 30 veces la densidad de Azospiríllum respecto al suelo testigo (Rivera-Cruz et al. 2010), de igual manera Espinoza-Victoria et al. (2006) reportaron mayor densidad de Azospiríllum (13.1xl03 UFC g−1 suelo) en maíz bajo labranza de conservación, comparado con labranza convencional (6.89x103 UFC g-1 suelo). La densidad de Azotobacter también aumentó en suelo con CA2 (cachaza expuesta 11 meses al ambiente), lo anterior coincide con resultados de uso de cachaza como fertilizante aplicado a suelos cultivados con Cofíea arábica (Delgado et al. 2003) y con Citrus aurantium (Rivera-Cruz et al. 2010), aumentó 42 y 8 veces, respectivamente. Este incremento (Wani et al. 1988) se asocia con el contenido de Corg suministrado al suelo a partir de la mineralización de la cachaza, sin embargo se ha reportado que la densidad disminuye por el efecto tóxico de altos niveles de urea como fuente de N (Lai et al. 2008). Las BSP fueron aisladas en suelo a distancia y rizósfera en todos los tratamientos, la mayor densidad se encontró en suelo tratado con CA2 + 3 % (Tabla 4). Resultados de Kumar et al. (2001) muestran que las BSP son encontradas en todo tipo de suelo pero Park et al. (2009) afirmaron que pueden ser afectadas por el estrés de las plantas. Rivera-Cruz et al. (2010) encontraron 93.12x103 UFC g−1 de BSP en suelo con 1 % de pollinaza y fue mayor que la cantidad aislada de suelo fertilizado con 2 % de (23.8x103 UFC g−1) que fue 8.5 veces mayor que el testigo. Wu et al. (2005) aislaron 1x106 UFC g−1 de BSP al aplicar pollinaza a un suelo cultivado con maíz. Nuestros resultados muestran que la densidad rizosférica más grande de BSK se relacionó con la adición del tratamiento CA2 + 3 % y en suelo a distancia el más efectivo fue EG + 2 % (Tabla 4) Wu et al. (2005) encontraron 0.57x106 UFC g−1 de BSK al aplicar pollinaza a un suelo cultivado con maíz. En China Basak & Biswas (2010) al evaluar Bacillus mucilaginosus aplicado al sorgo forrajero (Sorghum vulgare) encontraron densidades hasta 1.57xl08 UFC g−1.
Hongos micorrízicos vesículo arbusculares
El tratamiento EG + 2 % indujo mayor colonización de HMVA (Tabla 5), posiblemente se asocia con el manejo del agua de riego que fue controlado y con la edad de la planta, ya que en cultivos jóvenes por la demanda nutrimental se incrementa la colonización micorrízica (Bonfante & Selosse 2010). Los resultados de esta investigación coinciden con los obtenidos en diversos trabajos. Fidelibus et al. (2000) encontraron mayor colonización micorrízica (15-31 %) en raíz de limón volkameriano sometido a riego constante, en cambio en suelo sin riego la colonización fue baja (3-23 %). Wu et al. (2005) identificaron hasta 80 % de infección micorrízica en maíz por efectos de pollinaza, siendo ocho veces mayor que la infección en suelo testigo (10 %). Salamanca & Cano (2005) al evaluar sustratos orgánicos (cascarilla de arroz y compost porcino) en cultivo de mandarina Cleopatra (Citrus reshni) encontraron mayor (55 %) colonización micorrízica respecto al testigo (11 %). La composta (estiércol vacuno y paja) aplicado a cultivo de frijol y trigo permite mayor colonización de HMVA (entre 50 y 60 %) respecto a las plantas sin composta (30-40 %) (Millaleo et al. 2006).
Crecimiento y acumulación de materia seca
El mayor efecto del EG en AP y DBT sugiere que se relaciona con los altos contenidos de Corg y Ntot del sustrato EG (Tabla 1), que a los 11 meses después de incorporado al suelo plantado con CT se mineralizó con mayor rapidez que el resto de los tres FO evaluados en esta investigación. La afirmación anterior se corrobora con los contenidos bajos de Ntot presentes en tratamientos con el EG. Otro factor que explica este efecto es la relación altamente significativa y positiva de las PGPR, HMVA y Ntot en suelo con los parámetros de crecimiento de la planta (Tabla 6). Al respecto, según Bashan et al. (1996), Alarcón y Ferrera-Cerrato (1999) y Ferrera y Alarcón (2001), la existencia de Azospiríllum en la rizósfera promueve el crecimiento vegetal a través de la fijación de N atmosférico y la síntesis de hormonas reguladoras de crecimiento. Por otra parte, los hongos micorrízicos posiblemente favorecieron la captación de agua y de nutrimentos de baja movilidad (Powell & Bagyaraj 1984; Atul-Nayyar et al. 2008) que permitieron reciclar los nutrimentos minerales liberados por la descomposición microbiana (Aristizábal et al. 2004).
La menor acumulación de materia seca en suelos fertilizados con CA1 y CA2 (Figura 3) puede ser debido a la baja mineralización de este sustrato ya que sólo estuvo expuesto a factores ambientales durante 11 meses y menos posterior a lo molienda industrial, y puede ser un factor de estrés para la planta, sin embargo en DBT este efecto no fue observado este efecto (Figura 2). La respuesta de la planta puede estar asociada a diferentes factores estresantes. Las causas del estrés se relacionan con el efecto de la temperatura, del pH y con cantidades tóxicas de elementos minerales y orgánicos en el suelo (Salisbury & Ross 2000). Nuestros resultados muestran que la CA inhibió el crecimiento de la planta de CT en cambio fue favorable el efecto del EG y del PIN; igualmente el tipo de FO, la dosis y la interacción de ambos promovió el crecimiento de la planta de CT en vivero.
LITERATURA CITADA
Acuña O (2003) El uso de biofertilizantes en la agricultura. En: Meléndez G, Soto G (ed) Taller de Abonos Orgánicos. CANIAN/GTZ/UCR/CATIE. Sabanilla, Costa Rica 9 pp. [ Links ]
Agustí M (2003) Citricultura. 2a. ed. rev. y amp. Ediciones Mundi-Prensa. ed. Aedos, S. A. Madrid-Barcelona-Méxic. 422 pp. [ Links ]
Alarcón A, Ferrera-Cerrato R (1999) Manejo de la micorriza arbuscular en sistemas de propagación de plantas frutícolas. Terra Latinoamericana 17(3): 179-191. [ Links ]
Alarcón A, Ferrera-Cerrato R, González-Chávez MC, Villegas-Monter A (2001) Hongos micorrízicos arbusculares en la dinámica de aparición de estolones y nutrición de plantas de fresa CV. Fern obtenidas por cultivo in vitro. Terra Latinoamericana 18(3): 211-218. [ Links ]
Aristizábal C, Rivera EL, Janos DP (2004) Arbuscular mycorrhizal fungi colonize decomposing leaves of Myrica parvifolia, M. pubescens and Paepalanthus sp. Mycorrhiza 14(4): 221-228. [ Links ]
Atul-Nayyar A, Hamel C, Hanson K, Germida J (2008) The arbuscular mycorrhizal symbiosis links N mineralization to plant demand. Mycorrhiza 19(4): 239-246. [ Links ]
Banger K, Toor GS, Biswas A, Sidhu SS, Sudhir K (2010) Soil organic carbon fractions after 16-years of applications of fertilizers and organic manure in a Typic Rhodalfs in semi-arid tropics. Nutrient Cycling in Agroecosystem 86(3): 391-399. [ Links ]
Basak BB, Biswas DR (2010) Co-inoculation of potassium solubilizing and nitrogen fixing bacteria on solubilization of waste mica and their effect on growth promotion and nutrient acquisition by a forage crop. Biology and Fertility of Soils 46(6): 641-648. [ Links ]
Bashan Y, Olguín G, Ferrera-Cerrato R (1996) Interacciones entre plantas y microorganismos benéficos. I. Azospirillium. Terra Latinoamericana 14(2):159-194. [ Links ]
Bonfante P, Selosse M-A (2010) A glimpse into the past of land plants and of their mycorrhizal affairs: from fossils to evo-devo. New Phytologist 186(2): 267-270. [ Links ]
Bray RH, Kurtz LT (1945) Determination of total, organic and available forms of phosphorus in soil. Soil Science 59(1): 39-45. [ Links ]
Bremmer J, Mulvaney SC (1982) Nitrogen-Total. En: Page LA, Miller HM, Keeney RD (eds.) Methods for Soil Analysis Part 2. Agronomy 9. American Society of Agronomy Inc. Soil Science Society of America Inc. Madison Wisconsin USA. 1143 pp. [ Links ]
Brimecombe MJ, De Leij FA, Lynch JM (2001) The Effect of Root Exudates on Rhizosphere Microbial Populations. En: Pintón R, Varanini Z, Nannipieri P (eds.).The Rizosphere Biochemistry and Organic Substances at the Soil-Plant. Interface. Marcel Dekker. New York USA. 424 pp. [ Links ]
Contreras GJ (2007) El viverismo en Veracruz. En: Primera Semana Internacional de la Citricultura. Martínez de la Torre Veracruz, México 10 pp. [ Links ]
Curti-Díaz SA, Loredo-Salazar X, Díaz-Zorrilla U, Sandoval RJA, Hernández HJ (2000) Tecnología para producir limón persa. INIFAP-CIRGOC. Campo Experimental Ixtacuaco. Veracruz, México DF. 144 pp. [ Links ]
Deb B, Bora N (1996) Effect of chemical fertilizer on the rhizosphere mycoflora and nodulation of pea plant. Environment and Ecology 14(4): 747-751. [ Links ]
Delgado Y, Cupull R, Pérez C, Sánchez A, Vilchez M (2003) Efecto de Azotobacter spp en la estimulación de la germinación y el desarrollo de posturas de Cofíea arábica L. Centro Agrícola 30(1): 26-31. [ Links ]
Deubel A, Merbach W (2005) Influence of Microorganisms on Phosphorus Biovailability in Soils. En: Buscot F, Varma A (eds.). Microorganisms in soils: Roles in genesis and functions. Springer Berlin Heidelberg New York 419 pp. [ Links ]
Espinosa-Victoria D, Hernández-Flores L, López-Reyes L (2006) Diversidad genética de Azospiríllum brasilense en suelo cultivados con maíz con labranza convencional y de conservación. Terra Latinoamericana 24(2): 215-223. [ Links ]
FAO (2002) Captura del Carbono en los Suelos para un mejor Manejo de la Tierra. Organización de las Naciones Unidas para la Agricultura y la Alimentación. Instituto National de Recherche Agronomique. París, Francia 73 pp. [ Links ]
Ferrera-CR, Alarcón A (2001) La microbiología del suelo en la agricultura sostenible. Ciencia Ergo Sum 8(2): 175-183. [ Links ]
Fidelibus MW, Martin CA, Wright GC, Stutz JC (2000) Effect of arbuscular mycorrhizal (AM) fungal communities on growth of 'Volkamer' lemon in continually moist or periodically dry soil. Science Horticulture 84(1-2): 127-140. [ Links ]
Forner JB (1979) Los patrones de agrios en España. Instituto Nacional de Investigaciones Agrarias. Sección Producción vegetal 24. Madrid, Esp. 31 pp. [ Links ]
Francis I, Holsters M, Vereecke D (2010) The Gram-positive side of plant-microbe interactions. Environmental Microbiology 12(1): 1-12. [ Links ]
García-Cruz A, Flores-Román D, García-Calderón NE, Ferrera-Cerrato CR (2008) Efecto de enmiendas orgánicas, higuera y micorriza sobre las características de un tepetate. Terra Latinoamericana 26(4): 309-315. [ Links ]
García-Calderón NE, Ferrera-Cerrato CR (2008) Efecto de enmiendas orgánicas, higuera y micorriza sobre las características de un tepetate. Terra Latinoamericana 26(4): 309-315. [ Links ]
Gupta R, Mukerji KG (2002) Root exudate biology. En: Mukerji KG, Manoharachary C, Chamóla BP (eds.) Techniques in Mycorrhizal Studies. Kluwer. Dordrecht, Holanda 464 pp. [ Links ]
Gravina TA (1981) Curso de Citricultura. Universidad Autónoma de Chapingo. Departamento de Fitotecnia. Chapingo, México 3 pp. [ Links ]
Intrigliolo F, Pompili L, Nisini L, Mocali S, Torrisi B (2004) Effect of long term addition of composts and poultry manure on soil quality of citrus orchards in Southern Italy. Biology and Fertility of Soils 40(3): 206-210. [ Links ]
Jilani G, Akram A, Ali RM, Hafeez FY, Shamsi IH, Chaudhry AN, Chaudhry AG (2007) Enhancing crop growth, nutrients availability, economics and beneficial, rhizosphere microflora through organic and biofertilizers. Annals of Microbiology 57(2): 177-183. [ Links ]
Karlidag H, Yildirim E, Turan M, Donmez MF (2009) Effect of Plant Growth-Promoting Bacteria on Mineral-Organic Fertilizer Use Efficiency, Plant Growth and Mineral Contents of Strawberry (Fragaria x ananassa L. Duch.). Reviewed Papers 218-226 pp. [ Links ]
Kloepper JW, Schroth MN (1978) Plant growth promoting rhizobacteria on radishes. En: Proceedings of the 4th International Conference on Plant Pathogenic Bacteria. Ed. Station de Pathologic Vegetal et Phytobacteriologic. Vol. 2. Angers, France pp. 879-882. [ Links ]
Kowaljow E, Mazzarino MJ, Satti P, Jiménez-Rodríguez C (2010) Organic and inorganic fertilizer effects on a degraded Patagonian rangeland. Plant and Soil 332(1-2): 135-145. [ Links ]
Kumar V, Behl RK, Nurula N (2001) Establishment of phosphate solubilizing strains of Azotobacter chroococ-cum in rhizosphere and their effect on wheat cultivars under greenhouse conditions. Microbiological Research 156(1) 87-93. [ Links ]
Lai W-A, Rekha PD, Arun AD, Young C-C (2008) Effect of mineral fertilizer, pig manure, and Azospiríllum rugosum on growth and nutrient contents of Lactuca sativa L. Biology and Fertility of Soils 45(2): 155-164. [ Links ]
Llanos CM (1998) Patrones tolerantes a la tristeza de los cítricos (CTV). Leñoso. Vida Rural. España 42 pp. [ Links ]
Madigan MT, Martinko JM, Dunlap, Clark PD (2009). Brock. Biología de los Microorganismos 12a.ed. Pearson Educación, S.A. Madrid, España 1259 pp. [ Links ]
Maliba BG, Zobolo AM, Siebert SJ (2011) Poultry manure enhances grass establishment at a quarry rehabilitation site in subtropical South Africa. African Journal of Agricultural Research 6(1): 46-50. [ Links ]
Manoharachary C, Mukerji GK (2006) Rhizosphere Biology an Overview. En: Mukerji GK, Manoharachary C, Singh J (eds.) Microbial Activity in the Rhizosphere. Springer. Berlin, Germany pp. 349 [ Links ]
Meléndez G (2003) Residuos orgánicos y material orgánica del suelo. En: Meléndez G y Soto G (eds.). Taller de abonos orgánicos. CANIAN/GTZ/UCR/CATIE. Centro de Investigaciones Agronómicas (CIA). Sabanillas, Costa Rica 119-174 pp. [ Links ]
Meijide A, Diez JA, Sánchez-Martín L, López-Fernández S, Va Nejo A (2007) Nitrogen oxide emissions from an irrigated maize crop amended with treated pig slurries and composts in a Mediterranean climate. Agricuture, Ecosystems & Environment 121(4): 383-394. [ Links ]
Meunchang S, Panichsakpatana S, Weaver RW (2006) Tomato growth in soil amended with sugar mill by products compost. Plant and Soil 280(1-2): 171-176. [ Links ]
Millaleo MR, Montecinos UC, Rubio HR, Contreras NA, Borie BF (2006) Efecto de la adición de compost sobre propágulos micorrízicos arbusculares en un suelo volcánico del Centro Sur de Chile. Journal of Soil Science and Plant Nutrution 6(3): 26-39. [ Links ]
Moeskops B, Sukristiyonubowo, Buchan D, Sleutel S, Herawaty L, Husen E, Saraswati R, Setyorini D, De Nevé S (2010) Soil microbial communities and activities under intensive organic and conventional vegetable farming in West Java, Indonesia. Applied Soil Ecology 45(2): 112-120. [ Links ]
Mora DJR 2006. Contribuciones del Compost al Mejoramiento de la Fertilidad del Suelo. Universidad de Costa Rica 6 pp. [ Links ]
Nelson DW, Sommers LE (1982) Total carbon, organic carbon, and organic matter. En: Page AL (ed.). Methods of Soil Analysis . Part 2. Chemical and Microbiological Properties. 2nd. ASA. SSSA. Madison, Wl, USA. 539-579 pp. [ Links ]
Ögüt M, Akda C, Düzdemir O, Sakin MA (2005) Single and double inoculation with Azosp/V/7/um/Trichoderma: the effects on dry bean and wheat. Biology and Fertility of Soils 41(4): 262-272. [ Links ]
Okumoto S (2003) Uso de inoculante microbiano para la elaboración de abono orgánico. En: Meléndez GSG (ed) Taller de Abonos Orgánicos. CANIAN/GTZ / UCR/CATIE. Sabanilla, Costa Rica 52-61 pp. [ Links ]
Park K-H, Lee C-Y, Son H-J (2009) Mechanism of insoluble phosphate solubilization by Pseudomonas fluorescens RAF15 isolated from ginseng rhizosphere and its plant growth-promoting activities. Letters in Applied Microbiology 49(2): 222-228. [ Links ]
Pikovskaya Rl (1948) Mobilization of phosphorus in soil in connection with their vital activities of some microbial species. Mikrobiologya 17: 362-370. [ Links ]
Philippot L, Germon JC (2005) Contribution of bacteria to initial input and cycling of nitrogens in soils. En: Buscot F, Varma A (eds.) Microroganisms in Soil: Roles in Genesis and Functions. Springer-Verlag. Heidelberg New York USA. pp. 161-175. [ Links ]
Powell PDCL, Bagyaraj PDJ (1984) VA Mycorrhiza. Scientist-in-Charge Horticultural Research Station, Ministry of Agriculture and fisheries, Pukekohe, New Zealand. Associate Professor Department of Agricultural Microbiology, University of Agricultural Sciences GKVK-Campus Bangalore, India. CRC Press, Inc. Boca Raton, Florida, USA. 234 pp. [ Links ]
Qi-Mei L, Zheng-Hug R, Yan-Xing S, Jun Y, Li-Jun X (2002) Identification and practical application of silicate-dissolving bacteria. Agricultural Sciences in China 1(2): 81-85. [ Links ]
Ramírez SLF, Alcántar GG, Ortega EM, Escalante EA, Soto HM, Sánchez GP (1998) Fertilización foliar orgánica e inorgánica y rendimiento de sorgo en condiciones de salinidad. Terra Latinoamericana 16(3): 205-210. [ Links ]
Rao NS (1982) Biofertilizers in agriculture. Oxford and IBH publishing. Nueva Delhi, India 186 pp. [ Links ]
Reinaldo JLM, Cisne C (2011). Efecto de biofertilizantes (EM-Boskashi) sobre el crecimiento y rendimiento del rábano (Raphanus sativus). Universidad Nacional Agraria. Nicaragua. La Calera 1:1-29 [ Links ]
Rivera-Cruz MC, Trujillo NA, Cordova BG, Kohler J, Caravaca F, Roldán A (2008). Poultry manure and banana waste are effective biofertilizar carrier for promoting plant growth and soil sustainable in banana crops. Soil Biology & Biochemistry 40(12): 3092-3095. [ Links ]
Rivera-Cruz MC, Trujillo-Narcía A, Alejo PDE (2010) Los biofertilizantes integrados con bacterias fijadoras de N, solubilizadoras de P y sustratos orgánicos en el crecimiento de naranjo agrio Citrus aurantium L. Interciencia. 35(2): 113-119. [ Links ]
Rivera-Cruz MC (2011). Bacterias y hongos en suelos contaminados con petróleo crudo en Tabasco. En: Gamboa AM y Rojas HR (eds.). Recursos genéticos microbianos en la Zona Golfo-Sureste de México. Subsistema Nacional de Recursos Genéticos Microbianos (Subnargem) del Sistema de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (Sagarpa). Mérida, Yucatán 65-74 pp. [ Links ]
Rodríguez CEA (1982) Improve medium for isolation of Azospirillium spp. Applied and Environmental Microbiology 44(4):990-991. [ Links ]
Salamanca SCR, Cano SCA (2005) Efecto de las micorrizas y el sustrato en el crecimiento vegetativo y nutrición de cuatro especies frutales y una forestal, en la fase de vivero, en el municipio de Restrepo-Meta, Colombia. Encuentro Nacional de la Ciencia del Suelo "Materia orgánica y microorganismos en la Agricultura Colombiana". Sociedad Colombiana de la Ciencia del Suelo. CORPOICA. Medellín 8 pp. [ Links ]
Salazar SRP (2001) Evaluación de once patrones de cítricos a nivel plántula en dos localidades en el estado de Nuevo León. Tesis Ingeniero Agrónomo. Facultad de Agronomía. Universidad Autónoma de Nuevo León, México 76 pp. [ Links ]
Salisbury FB, Ross CW (2000) Fisiología de las Plantas 1. Célula: Agua, Soluciones y Superficies. Paraninfo/Thomson. Madrid, España 305 pp. [ Links ]
SAS (2002) Software: the SAS System for Windows version 9.0. SAS Institute Inc., Cary, NC, USA. [ Links ]
SIAP-SAGARPA (2010) Sistema de Información Agroalimentaria de Consulta 1980-2008 (SIACON). México DF Available from: http://www.siap.sagarpa.gob.mx [ Links ]
Sieverding E (1983) Manual de métodos para la investigación de la Micorriza vesículo-arbusculares en el laboratorio. Centro Internacional de Agricultura Tropical (CIAT). Proyecto micorriza. Apartado Aéreo 6713, Calí, Colombia 121 pp. [ Links ]
Spina, S, Coco V, Gentile A, Catara A, Cirvilleri G (2008) Association of Fusaríum solani with rolabc and wild type Troyer Citrange. Journal of Plant Pathology 90(3): 479-486. [ Links ]
Szott LT, Kass DCL (1993) Fertilizers in agroforestry systems. Agroforestry Systems 23(2-3): 157-176. [ Links ]
Vázquez-Luna M, Montiel-Flores A, Vázquez-Luna D, Herrera-Tenorio MF (2011) Impacto del petróleo crudo en suelo sobre la microbiota de vida libre fijadora de nitrógeno. Tropical and Subtropical Agroecosystems 13(3): 511-523. [ Links ]
Ventura UF (2007) Fertilidad del suelo y estado nutrimental de las plantaciones de cítricos en Huimanguillo, Tabasco. Tesis Maestría en Ciencias Producción Agroalimentaria en el Trópico. Colegio de Postgraduados. Campus- Ta basco. H. Cárdenas, Tabasco 99 pp. [ Links ]
Wani SP, Chandrapalaih S, Zambre MA, Lee KK (1988) Association between N2-fixing bacteria and pearl millet plants. Responses, mechanisms and persistence. Plant and Soil 110(2): 289-302. [ Links ]
Wu SC, Cao ZH, Li ZG, Cheung KC, Wong MH (2005) Effects of biofertilizer containing N-fixer, P and K solubilizers and AM fungi on maize growth: a greenhouse trial. Geoderma 125(1-2): 155-166. [ Links ]
Zeng LS, Liao M, Chen CL, Huang CY (2007) Effects of lead contamination on soil enzymatic activities, microbial biomass, and rice physiological indices in soil-lead-rice (Oryza sativa L.) system. Ecotoxicology and Environmental Safety 67(1): 67-74. [ Links ]