Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Universidad y ciencia
versão impressa ISSN 0186-2979
Universidad y ciencia vol.25 no.3 Villahermosa Dez. 2009
Artículos
Detección de Pantoea stewartii Mergaert, Verdonck & Kersters directamente de la semilla de maíz utilizando INMUNO –PCR
Detection of Pantoea stewartii Mergaert, Verdonck & Kersters directly from maize seeds using IMMUNO–PCR
JC Rocha–Revilla1, R Rodríguez–Herrera*1, CN Aguilar–González1, Ε Ramírez–Ramírez2, F Lara–Victoriano2
1 Facultad de Ciencias Químicas, Universidad Autónoma de Coahuila, Blvd. V. Carranza y J. Cárdenas s/n, Saltillo Coahuila, CP25280. Saltillo Coahuila, México. (JCRR)(RRH)(CNAG) * Correo electrónico: rrh961@hotmail.com
2 Centro Internacional de Servicios Fitosanitarios S.A. de C.V. (ERR)(FLV)
Artículo recibido: 21 de febrero de 2008
Aceptado: 19 de noviembre de 2009
RESUMEN
Técnicas moleculares basadas en ADN e inmunológicas han sido usadas para la detección de microorganismos debido a su sensibilidad, especificidad y rapidez. Sin embargo, cuando se trata de identificar bacterias con cero tolerancia en los niveles de presencia (eg. Pantoea stewartii), los métodos de análisis moleculares e inmunológicos no ofrecen el 100 por ciento de certeza de su detección. El objetivo de la presente investigación fue combinar las técnicas ELISA y PCR, con el fin de complementar las ventajas de cada una de ellas para detectar eficientemente la bacteria directamente de la semilla. Se utilizó una muestra de semilla de maíz importada de los Estados Unidos de América con altas probabilidades de estar infectada con Pantoea stewartii, lo cual se verificó por medio de ELISA. Una vez confirmada la presencia de la bacteria se procedió a su aislamiento e identificación por pruebas microscópicas, bioquímicas, fisiológicas, hipersensibilidad en tabaco, pruebas de patogenicidad y amplificación de rDNA 16S. Posteriormente, se optimizó la técnica de inmuno–PCR (temperatura de alineamiento de iniciadores, concentración de anticuerpos, temperatura de incubación y marca de tubos). El estudio demostró que es posible amplificar el ADN de P. stewartii directamente de la semilla de maíz, con una temperatura de alineamiento de 62 y 65 °C, tiempos de incubación de 1–3 horas, concentraciones de anticuerpos de 5:200 y 10:200 y con tubos marca Fisher y Axigen. La adaptación y optimización de la técnica inmuno–PCR es importante dado que se podrían reducir los riesgos de propagación de P. stewartii hacia lugares libres de ella.
Palabras clave: ELISA, anticuerpos, marca del tubo, marchitez de Stewart.
ABSTRACT
Immunological and molecular techniques based on DNA have been used for microorganism detection due to their sensitivity, specificity and speed. However, when the identification of bacteria with zero tolerance is required (eg. Pantoea stewartii), molecular and immunological techniques do not offer a 100% reliability. The objective of this study was to combine the ELISA and PCR techniques in order to complement their advantages and efficiently detect bacteria directly on seeds. A maize seed sample imported from the USA and with a high probability of being infected with Pantoea stewartii, and this was verified with ELISA, was used in this study. Having confirmed the presence of the bacterium, it was isolated and identified with microscopical, biochemical, physiological, tobacco hypersensibility, pathogenicity and PCR amplification of rDNA 16S tests. The immuno–PCR technique was then optimised (primer annealing temperature, antibody concentration, incubation temperature and microtube branding). The study showed that it is possible to amplify the DNA of P. stewartii directly from maize seeds, with an annealing temperature of 62 and 65 °C, incubation times of 1–3 hours, antibody concentrations of 5:200 and 10:200 and Fisher and Axigen microtubes. The adaptation and optimisation of the immuno–PCR technique is important as it may aid in the reduction of the risk of P. stewartii propagation towards areas free of bacteria.
Key words: ELISA, antibodies, microtube brand, Stewart's wilt.
INTRODUCCIÓN
Pantoea stewartii Mergaert, Verdonck y Kersters es una bacteria en forma de bacilo, Gram negativa, anaerobia facultativa e inmóvil (Schaad et al. 2001). Esta bacteria es agente causal de la enfermedad conocida como marchitamiento bacteriano del maíz o marchitez de Stewart, la cual afecta a este cultivo, ocasionando grandes pérdidas económicas y del producto. La enfermedad se caracteriza por provocar lesiones acuosas y marchitez vascular en plántulas y hojas necrosadas linealmente en plantas maduras, semejante a plantas que han sufrido ataques de insectos, daño por sequía o deficiencia nutricional (Lelliot & Stead, 1987). Esta enfermedad bacteriana puede causar que la planta no alcance un desarrollo óptimo para fines de producción, o en el peor de los casos, la muerte de la misma. Existe evidencia de que la bacteria está presente en semillas de maíz, la cual es un punto clave en la diseminación de la bacteria, por lo cual muchos países, incluyendo México, han implementado normas cuarentenarias permitiendo sólo la importación de maíz certificado como libre de la bacteria (Wilson et al. 1999). En Estados Unidos la marchitez bacteriana es considerada como una enfermedad endémica, debido a que en este país es común el insecto Chaetocnema pulicara, presente también en México, y que actúa como vector de P. stewartii (Wilson et al. 1999). La bacteria penetra a la planta por medio de las heridas que deja el insecto vector al alimentarse (De León 1984). Los síntomas se pueden confundir con los producidos por Clavibacter michiganensis subsp. nebraskensis (White, 1999). Debido a que P. steawartii es de importancia cuarentenaria, el análisis de su presencia o ausencia debe ser rápido. Actualmente, se cuenta con métodos más eficientes, de los cuales sobresalen ELISA (Enzyme Linked Immuno–Sorbent Assay) y la PCR (Reacción en Cadena de la Polimerasa) que requieren de unas cuantas horas para obtener una respuesta, sin embargo, con estas técnicas se presentan algunas desventajas. En el caso de la prueba ELISA, si los títulos del patógeno se ven disminuidos, la reacción de la enzima sobre el sustrato no genera valores que se puedan tomar como positivos. Por otra parte, la PCR aún cuando presenta alta sensibilidad y es muy específica, puede inhibir la acción de la enzima polimerasa debido a algunos componentes de la muestra. Esto es especialmente limitante cuando se trata de amplificar ADN proveniente de muestras con matriz compleja con alto contenido de carbohidratos, como ocurre en el caso de las semillas (Blakemore et al. 1992). Lo anterior sugiere la falta de una técnica de diagnóstico que sea confiable, específica, sensible, rápida y que no presente las desventajas de ELISA y de PCR al aplicarse separadamente. El objetivo del presente trabajo fue adaptar el método inmuno–PCR para la detección de P. stewartii directamente de la semilla de maíz. Para ello se integraron los métodos, ELISA y PCR, y se determinaron las mejores condiciones para la detección de la bacteria.
MATERIALES Y MÉTODOS
Material Vegetal
Semilla que se deseaba importar por un particular fue enviada para su análisis para la presencia de fitopatógenos cuarentenados al Centro Internacional de Servicios Fitosanitarios SA de CV, laboratorio aprobado por la SAGARPA (Secretaria de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación) para este tipo de análisis. La muestra de semilla de maíz fue importada de los Estados Unidos de América de un lote previamente reportado con altas probabilidades de estar infectado con Pantoea stewartii, lo cual se verificó por medio de ELISA que se realizó con un estuche comercial de Agdia para P. stewartii (Agdia, Elkhart, IN 46514, USA) de acuerdo al protocolo por el fabricante. Una vez confirmada la presencia de la bacteria se procedió a su aislamiento e identificación, para ello se realizaron las siguientes técnicas.
Aislamiento de la bacteria
Se diluyeron 10 g de la muestra de maíz infectada en una solución fisiológica con un buffer salino (fosfato de potasio 0.01 M, pH 7.0; NaCl 0.8 %),después se agitó por 2 horas a temperatura ambiente. A continuación se diluyó la suspensión a concentraciones de 10–1 y 10–10. Estas diluciones se sembraron en medios selectivos CPG (casamino–acid peptone glucose) y en KB (King medium β agar). Las placas fueron incubadas a 28 °C por 72 h. Transcurrido este tiempo se procedió a examinar las placas. Aquellas colonias que presentaron características morfológicas de P. stewartii, como son colonias pequeñas de color amarillo, lisas y brillantes se transfirieron a placas con medio de cultivo KB. Además en el caso del medio CPG se buscaron colonias que fueran de consistencia mucosa y extensible y con una ligera pigmentación, las cuales también se transfirieron a medio KB. Las placas con las posibles colonias de P. stewartii se incubaron por 72 h a 28 °C y se prepararon las pruebas para la identificación según las características bioquímicas y de patogenicidad. Para corroborar la identificación de la bacteria se realizaron análisis microscópicos, análisis bioquímicos y fisiológicos de las colonias así como pruebas de hipersensibilidad en tabaco.
Prueba de patogenicidad
Esta prueba se realizó en plantas de maíz de las variedades Sweet Corn, Hybrid Prim, Bandit Film Coat Yellow SH2 y Silver Queen. A los 15 días de emergidas las plántulas se inocularon por punción con una suspensión bacteriana a una concentración de 108 UFC ml–1. Posteriormente, las plantas se cubrieron con bolsas de plástico para favorecer el desarrollo bacteriano.
Extracción de DNA bacteriano
Se diluyó la cepa aislada de P. stewartii en 0.2 ml de buffer TE 1X (10 mM de Tris–HCl pH 8.0, 1 mM de Na2EDTA), a la cual se le añadió 0.2 ml de la solución de lisis 1X (4% Tritón x–100, 2 % SDS, 200 mM NaCl, 20 mM Tris–HCl pH 8.0) más 10 ml de la enzima proteinasa K (10 mg ml–1). En seguida se agitó suavemente en un vortex y se incubó por 30 minutos a 55 °C, una vez terminada la incubación se agregó medio volumen de la solución fenol–cloroformo–alcohol isoamílico (25:24:1) y se agitó en el vortex por unos segundos. Posteriormente, se centrifugó por 5 min a 10 000 r.p.m., generando dos fases en la solución, se tomó la fase superior (fase acuosa) y se mezcló con 0.2 ml de la solución cloroformo–alcohol isoamílico (24:1), se agitó en el vortex y se centrifugó por 5 min a 10,000 r.p.m. Se separó la fase acuosa y se mezcló con 0.2 ml de acetato de amonio al 7.5 M y se incubó en hielo por 10 min, después se volvió a centrifugar por 5 min a 10,000 r.p.m. Si se observó algún precipitado, se pasó la fase líquida a un tubo nuevo y se siguió el procedimiento, si no fue así, se siguió el procedimiento en el mismo tubo. Se agregaron 0.4 ml de isopropanol y se dejó incubando la mezcla en el congelador a –20 °C por un mínimo de 30 min, posteriormente se centrifugó por 5 min a 10,000 r.p.m. El ADN precipitado se lavó con 1 ml de etanol helado al 70 %, esta vez se centrifugó por 10 min a 10,000 r.p.m, después se decantó el etanol y se dejó evaporar hasta su totalidad. El ADN precipitado se resuspendió en 0.2 ml de buffer TE, el ADN obtenido se conservó en refrigeración hasta el momento de ser usado. El ADN extraído se fraccionó en un gel de agarosa al 1 % para determinar su integridad. Además de las colonias bacterianas se extrajo ADN de la bacteria Bacillus subtilis para usarlo como control negativo.
Reacción en cadena de la polimerasa (PCR)
El volumen de reacción para una muestra fue de 25 μl; 14.5 μl de agua desionizada estéril, buffer 1X, 2mM MgCl2, 200 μM dNTPs y 2.0 μL de cada iniciador. Los iniciadores utilizados fueron ESF 5' CCT TGA CGG GCT GAC CAC 3' y ESR 5' AGG AAT AAC GCG ACG ACC AG 3' que amplifican un segmento del gen ribosomal 16S (Blakemore et al., 1999). Todo se mezcló y se agregaron 0.5 μl de la enzima Taq Polimerasa (5Uμl). Se depositaron 23 μl del coctel en un tubo de 0.6 ml, se le adicionó 0.2 μl de ADN de la muestra y se mezcló suavemente. La muestra ya preparada se colocó en el termociclador, el cual se programó con las condiciones para la reacción: un ciclo de 94 °C por 4 min, 35 ciclos de unminuto a 94 °C, 1 min de 62 °C y 1 min de 72 °C y por ultimo un ciclo de 72 °C por cinco min. La amplificación del fragmento de ADNse visualizó por medio de una electroforesis en gel de agarosa al 1 %.
Técnica de inmuno–PCR
La técnica inmuno–PCR se compone de dos partes. La primera es la inmunológica, que consta de la fijación de los anticuerpos (sensibilización) específicos a P. stewartii según el protocolo del método ELISA, el cual se desarrolla de la siguiente manera: Primero se diluyeron los anticuerpos en un buffer alcalino de carbonatos en una relación de 1:200, anticuerpo: buffer, tomando en cuenta que se usarían 0.1 ml de la dilución por cada tubo. Se prepararon los microtubos, previamente esterilizados a 15 lb de presión a 120 °C por 15 min, se usaron microtubos de polipropileno de las marcas Fisher y Axigen de capacidad de 0.6 ml. Los tubos se incubaron en cámara húmeda a una temperatura de 4 °C, esperando un mínimo de 12 h antes de usarlos. A continuación los tubos se lavaron repetidamente con un buffer de fosfatos PBST. Este último se vertió de manera que llevase cierta presión, para lo cual se usó una pizeta y se colocaron los tubos en forma invertida, permitiendo así que la solución cayera y arrastrara los anticuerpos no fijados al tubo; los tubos fueron secados en su totalidad golpeteándolos en un papel sobre una base firme. Posteriormente, se preparó la muestra de semilla molida de maíz, diluyéndola en el buffer de extracción en una relación 1:10, muestra: buffer. Se tomó 0.1 ml de esta dilución por cada tubo, se colocó en los tubos y se dejaron incubando a una temperatura de 4 °C por 12 h mínimo. Pasado este tiempo, los tubos se lavaron de la misma manera que los tubos sensibilizados.
Para la segunda parte, se procedió a preparar el cóctel como se indicó en la metodología para PCR, sólo que esta vez se omitió el ADN, ya que este se encontraba en los tubos sensibilizados. Además se realizó una PCR de ADN de P. stewartii anteriormente extraído como control positivo y del ADN de B. subtillis utilizada como control negativo. La separación y visualización de los fragmentos amplificados se realizó como se describió previamente.
Optimización de la técnica de inmuno–PCR
a) Selección de la temperatura de alineamiento de iniciadores. Para la optimización de la técnica de inmuno–PCR se probaron las temperaturas de alineamiento de 62, 65 y 68 °C. Las temperaturas usadas fueron escogidas basándose en la temperatura fusión (Tm) de los iniciadores. La inmuno–PCR se realizó por duplicado de muestra de maíz infectada y de la bacteria pura, además de realizar a la par una PCR de DNA de las bacterias puras P. stewartii y B. subtillis. b) Influencia de la marca de tubo a usar. Se probaron microtubos de las marcas Axigen y Fisher de polipropileno, en los cuales se corrió la técnica de inmuno–PCR ya descrita, en esta prueba se volvieron a variar los tiempos de incubación para la fijación de la bacteria, usando tres tiempos de incubación (1, 2 y 3 h) y la temperatura de alineamiento de iniciadores previamente seleccionada. c) Influencia de la concentración del anticuerpo. Para el estudio de la concentración del anticuerpo en la técnica de inmuno–PCR, se utilizaron los anticuerpos en una relación de 5:200 y 10:200, al realizar la dilución en el buffer de cobertura. Este experimento se realizó a la par de la variación de la temperatura de alineamiento de iniciadores. d) Selección del tiempo de incubación de la muestra para la fijación de la bacteria. Con la finalidad de reducir los tiempos en la técnica de inmuno–PCR,se planteó un experimento en el cual se variaron los tiempos de incubación para la fijación de la bacteria al anticuerpo. Se tomaron tubos previamente sensibilizados de la marca Fisher, se probaron cuatro tiempos de incubación, (3, 6, 9, 12 h) y como muestra se uso semilla infectada. Transcurrido el tiempo de incubación de los cuatro tubos se continuó la técnica de inmuno–PCR, usando la temperatura de alineamiento ya seleccionada. Como control positivo se usó DNA extraído de un cultivo puro de P. stewartii, el cual se procesó con el protocolo de la PCR, descrito anteriormente.
RESULTADOS
ELISA
La prueba de ELISA evidenció que en ocho de las 12 muestras analizadas se presentaron valores mayores o iguales a 0.100 de densidad óptica tanto en el primer análisis como en su repetición. Para considerar aceptables los resultados de una placa ELISA, la media de las lecturas de densidad óptica del testigo deben ser menor a = 0.06 y del testigo positivo diluido aproximadamente de 0.20. La reacción se consideró positiva (presencia de P. stewartii) si la lectura de densidad óptica fue mayor o igual a tres veces la media del testigo negativo. Como el testigo negativo mostró en promedio valores de densidad óptica menores a 0.03, sólo se consideraron positivas aquellas muestras con densidades ópticas mayores a 0.1.
Identificación de la bacteria
Al realizar la observación del frotis con el objetivo de inmersión (100X) se lograron observar células en forma de bacilos de una coloración rojiza que indica la presencia de bacilos Gram negativos. Estas bacterias fueron inoculadas en los medios con diferentes fuentes de carbono (rafinosa, sucrosa, manitol y sorbitol) y dieron positivo a la producción de ácido, demostrado por el cambio de color, comparados con el control que mantuvo el color original; dichos resultados corresponden a los reportados para Pantoea stewartii (Schaad et al. 1999). En las pruebas de oxidación/fermentación, la bacteria presentó un crecimiento facultativo, tal como lo indican los reportes para P. stewartii, es decir, que la bacteria es capaz de crecer tanto en presencia como en ausencia de oxígeno. Por último, la prueba confirmativa de hipersensibilidad del tabaco dio positivo, ya que la planta inoculada colapsó en un periodo de 12 h, con presencia de necrosamiento alrededor de la zona inoculada.
Patogenicidad de P. stewartii en plántulas de maíz
a) Variedad Sweet Corn Hybrid Prim. A los cinco días después de la inoculación la planta empezó a presentar manchas cafés claro cercanas al sitio de inoculación, en forma de líneas delgadas, que podían apreciarse por ambos lados de la hoja con un tamaño aproximado de 1–4 mm de largo por 1 mm de ancho. Transcurrida una semana la planta presentaba decoloración en casi todas las hojas, las cuales se encontraban secas con un color café (Figura 1), de igual manera el tallo se mostraba con manchas del mismo color. b) Variedad Bandit Film Coat YellowSH2. A los cinco días aparecieron manchas de apariencia húmeda color café claro de aproximadamente 2 mm de largo por 1 mm de ancho, no fue sino hasta una semana después de la inoculación que se presentó un encafecimiento casi total, en el tallo y en las hojas las cuales tenían las puntas secas, además de perder rigidez en el tallo principalmente en la zona próxima a la tierra y presentar un exudado en la parte media del tallo. c) Variedad Silver Queen. A los cinco días de la inoculación las hojas presentaron manchas de color amarillo pálido de aproximadamente 2 mm de diámetro, lineales de contorno irregular que se extendían linealmente a lo largo de la hoja, por el lado del envés hasta que se juntan las lesiones. A la semana de la inoculación, las hojas presentaban casi una invasión total y las infecciones más viejas se tornaban color café. También perdió rigidez el tallo y se tornó de color café. Así mismo, se apreció un aumento en el número de manchas lineales de color amarillo pálido que con el paso del tiempo causaron que las células de la hoja murieran, dando lugar a hojas de aspecto seco y quebradizo. Las plantas inoculadas de las tres variedades presentaron síntomas característicos de la enfermedad de Stewart después de ser inoculadas con la bacteria.

Reacción en cadena de la polimerasa (PCR)
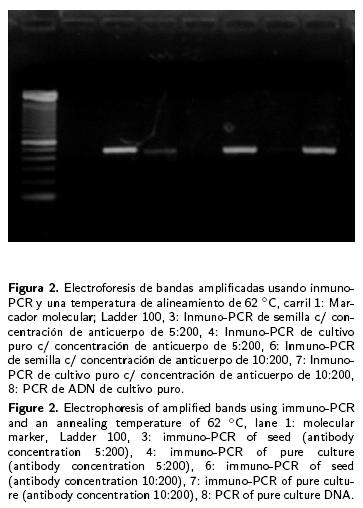
Con los iniciadores seleccionados se logró la amplificación de un segmento de ADN de 400 pb (Figura 2) del ADN extraído de la bacteria identificada como P. stewartii, logrando con esto corroborar la identificación de la bacteria. Las amplificaciones de segmentos del ADN bacteriano se emplearon como controles positivos en todas las reacciones de PCR y de inmuno–PCR.
Optimización de la técnica de inmuno–PCR
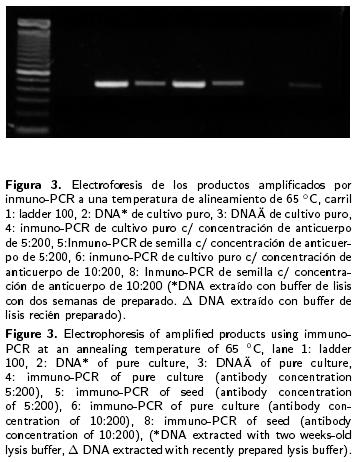
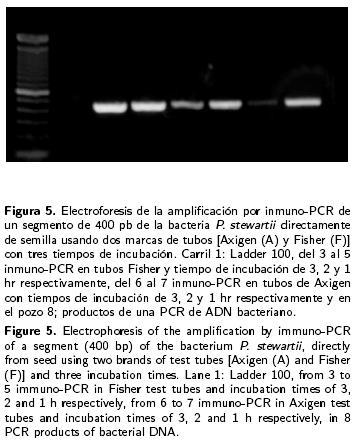
a) Selección de la temperatura de alineamiento de los iniciadores. Para la elección de las tres temperaturas a analizar, se consideró temperatura de alineamiento que se determina teóricamente; de las tres temperaturas seleccionadas sólo con dos (62 °C y 65 °C) se obtuvieron segmentos de aproximadamente 400 pb (Figuras 2 y 3), con la tercera temperatura no se logró amplificar ninguna muestra de la técnica inmuno–PCR, pero sí la de PCR, lo cual puede deberse a la concentración de ADN presente en la muestra (Figura 4). b) Selección del tiempo de incubación de la muestra para la fijación de la bacteria. En un primer estudio para determinar el tiempo adecuado de incubación que debe permanecer la muestra en contacto con el anticuerpo, se apreció que después de la amplificación de ADN por PCR se logró amplificar las muestras con los cuatro tiempos de incubación. En un segundo estudio se lograron amplificar muestras con tiempos de incubación de tres, dos y una h (Figura 5). c) Influencia de la marca de los tubos usados. La marca de los tubos usados como soporte en la técnica de inmuno–PCR no fue un factor importante para la fijación de la bacteria, así como para la amplificación por PCR de los fragmentos, dado que después de la electroforesis de los fragmentos amplificados por PCR se apreciaron bandas de aproximadamente 400 pb en todos los tubos sin importar la marca (Fisher y Axigen) (Figura 5). d) Influencia de la concentración del anticuerpo para la fijación de la bacteria. Los resultados obtenidos de la inmuno–PCR realizada con diferentes concentraciones del anticuerpo (5:200 y 10:200) para la fijación de la bacteria fueron los mismos (Figura 3), por lo cual se deduce que la concentración del anticuerpo no influye en los resultados de la inmuno–PCR.

DISCUSIÓN
Si bien, hasta hoy los métodos de mayor eficacia para la detección de P. stewartii son los inmunoensayos (ELISA) o las técnicas moleculares como la PCR ó la LCR (ligase chain reaction), estas técnicas también tienen sus desventajas. Con la técnica de inmuno–PCR se logró eliminar las desventajas de las técnicas ELISA y PCR que la componen, ya que se amplificó un segmento de ADN de P. stewartii de aproximadamente 400 pb directamente de la semilla de maíz infectada así como de la bacteria pura lo cual coincidió con la amplificación del ADN de la bacteria usada como control positivo. No se amplifico por PCR ninguna banda del ADN de la bacteria utilizada como control negativo, lo que nos indica la eficiencia de esta técnica y de los iniciadores utilizados, además de corroborar las pruebas de especificidad realizadas por Blakemore et al 1999, quienes diseñaron los iniciadores utilizados en esta investigación.
La optimización de las condiciones en que se realiza la inmuno–PCR (temperatura de alineamiento, tiempo de incubación, dilución del anticuerpo y efecto de la marca de los tubos), ha ayudado a mejorar la calidad de los resultados obtenidos, en comparación con los conseguidos al usar las condiciones que especifica la teoría. Dicha mejora incluye aspectos como: el aumentar la calidad de las bandas del segmento de 400 pb, disminuir el tiempo de incubación de la muestra hasta una hora, reduciend o de esta forma el tiempo de la prueba, así como descartar la necesidad del uso de productos o materiales de cierta marca o cantidades innecesarias de reactivos, lo que puede ayudar a reducir los costos de la prueba. En la determinación de la temperatura de alineamiento fue necesario variar la concentración del anticuerpo usado para la fijación de la bacteria al tubo, debido a que no era posible realizar la amplificación y de esta manera descartar el anticuerpo como origen del problema, lo que al parecer estaba afectando debido a la antigüedad de los anticuerpos, dicha concentración se tuvo que cambiar de una relación de 1:200 a 5:200.
Aún quedan otros factores por analizar,uno es el efecto de la composición química de los microtubos usados como soporte, así como los niveles de detección de la técnica, dichos factores no han sido evaluados en la investigación debido a que según los datos reportados para PCR es de 10 bacterias presentes en la reacción (Blakemore et al. 1999), para tal caso se puede pensar que la técnica de inmuno–PCR presenta una sensibilidad similar o mayor. Otros métodos, como la PCR–LCR, también tienen potencial como métodos de detección, debido a su gran capacidad de distinción a nivel de especies, basándose en la diferencia de un solo par de bases (Wilson et al. 1994). Otra opción es la variante de la PCR que usa métodos inmunomagnéticos para la separación de la bacteria (Walcott & Gitaitis, 2000). Po otro lado, el método común para la visualización de los productos de PCR, es la electroforesis, la cual puede en ocasiones ser insensible cuando dichos productos se encuentran en valores bajos según lo descrito por Pislak et al. 2002. Dicho inconveniente podría ser solucionado implementando un método fluorimétrico como el Taqman (Schaad et al. 1999).
LITERATURA CITADA
Blakemore EJA, Reeves JC, Ball FL (1992) Polymerase chain reaction used in the development of a DNA probe to identify Erwinia stewartii, a bacterial pathogen of maize. Seed Science and Technology, 20:331–335. [ Links ]
Blakemore EJA, Law LR. Reeves JC (1999) PCR identification of Erwinia stewartii and its comparison with two other methods. Seed Science and Technology, 27(1): 385–396. [ Links ]
De León C(1984) Enfermedades del maíz. CIMMYT. México D. F. 90–91 pp. [ Links ]
Lelliott, RA, Stead DE (1987) Methods for the diagnosis of bacterial diseases of plants. Ed. Blackwell Scientific Publications. 113–114 pp. [ Links ]
Pislak, M, Ocepek M, Zabavnik–Piano J, Pogacnik M (2002) PCR–ELISA as method for improving the diagnostic of paratuberculosis. 7° International colloquium on paratuberculosis: Bilbao, España: 11–14 pp. [ Links ]
Schaad NW, Berthier–Schaad Y, Sechler A, Knorr D (1999) Detection of Clavibacter michiganensis subsp. sepedonicus in potato tubers by BIO–PCR and an automated real–time fluorescence detection system. Plant Disease, 83(12): 1095–1100. [ Links ]
Schaad NW, Jones JB, Chun W (2001) Plant pathogenic bacteria.1a. Ed. APS USA, 73–83 pp. [ Links ]
Walcott RR, Gitaitis RD (2000) Detection of Acidovorax avenae subsp. citrulli in watermelon seed using immunomagnetic separation and the polymerase chain reaction. Plant Disease, 84(4): 470–474 [ Links ]
White DG(1999) Compendium of corn diseases. Third edition. APS Press 4–5 pp. [ Links ]
Wilson WJ, Wiedmann M, Dillard R Batt CA (1994) Identification of Erwinia stewartii by a ligase chain reaction assay. Applied and Enviromental Microbiology, 60(1): 278–284. [ Links ]
Wilson W J, Dillard H R Beer SV (1999) Assessment of phenotypic variability in Erwinia stewartii based on metabolic profiles. Plant Disease, 83(2): 114–118. [ Links ]














