Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.40 no.4 Ensenada dic. 2014
https://doi.org/10.7773/cm.v40i4.2456
Artículos
Distribución espaciotemporal de la contaminación bacteriana del agua residual agrícola y doméstica descargada a un canal de drenaje (Sinaloa, México)
Spatiotemporal distribution of the bacterial contamination of agricultural and domestic wastewater discharged to a drainage ditch (Sinaloa, Mexico)
Yesmi Patricia Ahumada-Santos1, María Elena Báez-Flores1, Sylvia Paz Díaz-Camacho1, Magdalena de Jesús Uribe-Beltrán1, Gabriela López-Angulo1, Rito Vega-Aviña2, Francisco Armando Chávez-Duran3, Julio Montes-Avila1, Otoniel Carranza-Díaz4, Monika Möder4, Peter Kuschk5†, Francisco Delgado-Vargas1*
1 Facultad de Ciencias Químico Biológicas, Universidad Autónoma de Sinaloa, Ciudad Universitaria s/n, CP 80010 Culiacán, Sinaloa, México. * Corresponding author: fdelgado@uas.edu.mx; fcodelgadovargas@gmail.com.
2 Facultad de Agronomía, UAS, Carretera Culiacán-El Dorado km 17.5, CP 80000 Culiacán, Sinaloa, México.
3 Comisión Nacional del Agua, Organismo de Cuenca Pacífico Norte, Dirección de Infraestructura Hidroagrícola, Ingeniería de Riego y Drenaje Distrito de Riego 010 Culiacán-Humaya, México.
4 Department of Analytical Chemistry and Department of Environmental Biotechnology, UFZ - Helmholtz Centre for Environmental Research, Permoserstr. 15, 04318 Leipzig, Germany.
† Peter Kuschk passed away on 14 October 2014, requiescat in pace
Received August 2014,
accepted November 2014.
RESUMEN
El agua que conducen los canales de drenaje del valle agrícola sinaloense (México) es reutilizada con frecuencia en la agricultura y acuacultura antes de ser depositada en las aguas costeras. La calidad del agua descargada debe ser adecuada para mantener la salud de los ecosistemas y evitar daño a los organismos que los componen. Esta investigación determinó la presencia de coliformes en el canal de drenaje agrícola conocido como La Michoacana (Sinaloa), que recibe agua contaminada de fuentes agrícolas y urbanas. Se estudió una sección de 3.6 km del canal durante el año 2013 y se recolectaron mensualmente muestras de agua de cinco puntos de muestreo equidistantes. A cada muestra se le analizó el contenido de coliformes totales (CT) y coliformes fecales (CF), pH, salinidad, temperatura y porcentaje de saturación de oxígeno disuelto (%OD). Los puntos de muestreo con mayor contaminación bacteriana estuvieron asociados a las descargas directas de agua residual doméstica, y aquellos con menor contaminación estuvieron asociados a la salida del canal de drenaje. El funcionamiento del canal disminuyó la carga de coliformes, con medianas y valores promedio del 96% y 87% para CT, y 98% y 85% para CF, respectivamente. Las principales bacterias identificadas fueron Escherichia coli (67.7%), Kluyvera cryocrescens (10.2%) y Enterobacter agglomerans (6.3%). La concentración de coliformes presentó una correlación positiva con la temperatura y negativa con el %OD. El canal de drenaje La Michoacana mejora la calidad microbiológica del agua que conduce, lo cual demuestra funciones de remediación en el sistema. El mantenimiento y manejo adecuado de los canales de drenaje agrícola puede impactar favorablemente la salud y biodiversidad, así como las actividades acuícolas y agrícolas intensivas del valle sinaloense.
Palabras clave: coliformes, drenaje agrícola, saneamiento, calidad del agua, remoción bacteriana.
ABSTRACT
The agricultural drainage water from the Sinaloa valley (Mexico) is often reused in agriculture and aquaculture before reaching coastal water bodies. Discharged water must be of good quality to maintain the health of ecosystems and prevent damage to the organisms that compose them. This research determined the occurrence of coliforms in a drainage ditch known as La Michoacana (Sinaloa) that receives contaminated water from agricultural and urban sources. A section of 3.6 km was studied during 2013 and samples were obtained monthly from five equidistant sampling sites. Each water sample was analyzed for total coliform (TC) and fecal coliform (FC) content, pH, salinity, temperature, and dissolved oxygen percentage (%DO). The sampling sites with the highest bacterial contamination were associated with direct discharges of domestic wastewater and those with the lowest to the output drain. The performance of this agricultural ditch decreased the concentration of coliforms, with median and average values of 96% and 87% for TC, and 98% and 85% for FC, respectively. The most common bacteria were Escherichia coli (67.7%), Kluyvera cryocrescens (10.2%), and Enterobacter agglomerans (6.3%). Coliform concentration was positively correlated with temperature and negatively with %DO. The ditch improved the microbiological quality of the water, demonstrating remediation activities in the system. Proper management and maintenance of agricultural drainage ditches would favorably impact the health and biodiversity, as well as the intensive aquaculture and agricultural activities of the Sinaloa valley.
Key words: coliforms, agricultural drains, sanitation, water quality, bacteria removal.
Introducción
El agua es indispensable para la vida, sin embargo, las actividades antropogénicas (e.g., domésticas, industriales y agrícolas) frecuentemente la contaminan. En los países en desarrollo, el 80% de las aguas residuales se descargan sin tratamiento directamente a los cuerpos de agua, los cuales reciben de 300 a 400 t año-1 de residuos industriales. La contaminación del agua contribuye a la degradación de los ecosistemas, pérdida de biodiversidad y desarrollo de enfermedades, y ocasiona la muerte de aproximadamente 3.5 millones de personas anualmente (ONU-DAES y UN-water 2014). Este panorama enfatiza la necesidad de contar con tratamientos de agua efectivos (i.e., aquellos que eliminen contaminantes químicos y biológicos) y de bajo costo.
Los humedales (naturales o construidos) proporcionan, con bajo esfuerzo técnico, un beneficio integral al medio ambiente y a la salud humana (Pierre y Finlayson 2011, Alexander y McInnes 2012). Diversos estudios han demostrado el desempeño de los humedales sobre la mejora de la calidad del agua que conducen. Al actuar como biofiltros, los humedales remueven contaminantes químicos y biológicos (e.g., bacterias patógenas) mediante diversos procesos físicos, químicos y biológicos (Kadlec y Wallace 2009, Reinoso et al. 2008, Azaizeh et al. 2012, Lekeufack et al. 2012, Rühmland y Barjenbruch 2012).
Las bacterias coliformes fecales, encontradas en el intestino y heces de animales, son indicadores de contaminación y consecuentemente de la calidad del agua, y advierten así sobre la posible presencia de organismos patógenos que pueden afectar la salud humana. Su presencia en ambientes acuáticos puede deberse a la incorporación abundante de aguas contaminadas con excretas y otros desechos orgánicos derivados de actividades antropogénicas (Cupul-Magaña et al. 2006, Bagordo et al. 2012, Sidhu et al. 2012, Barrera-Escorcia et al. 2013, Ochoa Izaguirre y Soto-Jiménez 2013, Valdés et al. 2014, Wu et al. 2014).
La agricultura es la principal actividad económica en el estado de Sinaloa, el cual cuenta con 838,278.58 ha de riego (= 14.5% de las zonas de riego de México) y en 2013 el valor de su producción fue de aproximadamente $2184 millones de dólares (SIAP 2014). Las actividades agrícolas en Sinaloa demandan una gran cantidad de mano de obra. En 2004, el 30% de los trabajadores migrantes (72,000) de México llegaron a Sinaloa para emplearse en el campo agrícola, y la mayoría vive en los campos agrícolas en pequeños poblados (Ramírez-Romero et al. 2006). La infraestructura de Sinaloa incluye 8548.5 km de canales de drenaje agrícola, y es común la presencia de comunidades humanas en su entorno; consecuentemente, los canales reciben con frecuencia aguas altamente contaminadas (e.g., aguas negras y residuales de comunidades rurales cercanas y de riego de cultivos). El agua que conducen estos canales de drenaje es reutilizada corriente abajo en el riego de cultivos, como fuente de agua para ganado y en granjas acuícolas ubicadas a lo largo del curso del canal antes de ser depositada en cuerpos de agua costeros; incluso, puede utilizarse en actividades con contacto humano en las zonas de depósito final (e.g., ríos, bahías, esteros) (CONAGUA 2011). Al igual que en la agricultura, Sinaloa destaca en la pesca. En 2011, este estado ocupó el primer lugar en producción acuícola del litoral mexicano en el pacífico, con una aportación de 57,929 t (31.09% de la producción acuícola total de la costa mexicana en el pacífico).
Las principales actividades económicas de Sinaloa dependen de abundates recursos hídricos y de la calidad del agua (CONAPESCA 2012). Hoy en día se conoce que el agua contaminada de los canales de drenaje agrícola afecta de manera negativa la vida acuática y terrestre en Sinaloa (Escobedo-Urías et al. 1999, Haws et al. 2006, Ochoa Izaguirre y Soto-Jiménez 2013), México y el mundo (Bagordo et al. 2012, Matano et al. 2013, Riera et al. 2013, Valdés et al. 2014, Wu et al. 2014). Por otra parte, los canales de drenaje pueden funcionar como humedales artificiales de flujo superficial y disminuir la contaminación del agua y sus efectos negativos, pero éstos deben transportar bajos flujos de agua para favorecer el establecimiento de las plantas acuáticas (Kadlec y Wallace 2009). El objetivo de este trabajo fue analizar la efectividad de un canal de drenaje agrícola en la disminución de las concentraciones de bacterias coliformes en el agua que descarga.
Materiales y métodos
Área de estudio
El canal de drenaje agrícola conocido como La Michoacana tiene una longitud de aproximadamente 6.3 km y se ubica en un área con intensa actividad agrícola en el municipio de Navolato, Sinaloa, México. Este drenaje recibe agua de escurrimiento de riegos y pluvial, así como agua residual doméstica y desechos sólidos de una pequeña comunidad (Colonia Michoacana, 1225 habitantes) que habita en sus márgenes (SEDESOL 2014). De manera general, La Michoacana transporta flujos intermitentes de agua y la vegetación en el lecho del canal es dominada por Typha domingensis durante todo el año. El agua de La Michoacana se mezcla con la del canal de drenaje Navolato. Esta agua se usa para el riego agrícola en áreas más cercanas a la costa y, aproximadamente a 20 km corriente abajo, para la acuacultura, y finalmente es vertida en el océano Pacífico. Para analizar el agua que fluye por una sección de 3.6 km del canal de dreanaje La Michoacana, se seleccionaron cinco puntos de muestreo (PM) aproximadamente equidistantes: el punto inicial (PM1) se ubicó corriente arriba (24°43'29.6" N, 107°37'14.6" W) y el punto final (PM5) corriente abajo (24°43'20.4" N, 107°39'21.4" W); PM5 se ubicó a aproximadamente 35 m de la intersección con el canal de drenaje Navolato. La sección estudiada del canal de drenaje recibe cuatro entradas puntuales de agua (descargas residuales domésticas) y 16 no puntuales (descargas de áreas de cultivo cercanas) (fig. 1).
Recolección y análisis de muestras de agua
Se recolectaron muestras de agua mensualmente de marzo a diciembre de 2013. Las muestras fueron tomadas durante las primeras horas de la mañana utilizando bolsas estériles (Whirl-Pak) de 500 mL y a una profundidad aproximada de 15 cm de la superficie. Las muestras se mantuvieron en condiciones de refrigeración (4 °C) hasta su análisis dentro de las siguientes 8 h. Se cuantificó la presencia de coliformes totales (CT) y coliformes fecales (CF) empleando la técnica de filtración por membrana; el análisis se realizó por duplicado para cada muestra y en condiciones de esterilidad. Primero, el agua se homogenizó y, en caso necesario, se realizaron diluciones con agua peptonada (pH = 7.2, Difco). Luego, se filtró un volumen de 5 mL de la muestra de agua directa o diluida a través de una membrana con un tamaño de poro de 0.45 μηι (Pall Corporation), y el residuo se lavó con 50 mL de agua destilada estéril. La membrana se transfirió a los medios de cultivo Agar m-Endo (pH = 7.2, Difco), en el caso de CT, y Agar FC (pH = 7.4, Difco), en el caso de CF.
Las placas fueron incubadas a 37 °C (CT) o 45 °C (CF) durante 24 h. Se realizó el recuento directo de colonias características que se desarrollaron sobre la membrana y los resultados se expresaron como unidades formadoras de colonias (UFC) en 100 mL de muestra (APHA et al. 2005). Medios de cultivo sin muestra filtrada fueron sometidos al mismo proceso como control de esterilidad.
Identificación de cepas bacterianas
De las bacterias coliformes cuantificadas, se seleccionaron de tres a cinco colonias aisladas de cada PM por fecha de muestreo para su identificación mediante pruebas bioquímicas y fisiológicas convencionales (utilización de citrato y malonato como fuente de carbono; fermentación de carbohidratos; descarboxilación de aminoácidos; producción de gas, ácido sulfhídrico e indol; y movilidad) (MacFaddin 2003).
Medición de parámetros fisicoquímicos del agua
El pH, la salinidad, el porcentaje de saturación de oxígeno disuelto (% OD) y la temperatura (°C) del agua de cada PM por fecha de muestreo fueron medidos in situ con un medidor multiparamétrico HI9828 (Hanna Instruments).
Análisis estadístico
Se realizó un análisis de varianza (ANOVA, por sus siglas en inglés) con los factores mes de muestreo y PM. Las medias fueron comparadas aplicando la prueba de Duncan (a = 0.05). Se realizó un análisis de correlación de Pearson entre los parámetros fisicoquímicos del agua y las concentraciones de CT y CF. Los análisis se realizaron con el programa estadístico STATGRAPHICS plus 5.1.
Resultados
Las concentraciones de CT y CF variaron de acuerdo con la fecha y el punto de muestreo. Las concentraciones en algunos PM fueron mayores que en el punto inicial de muestreo (PM1) de la sección del canal de drenaje. PM2 presentó las mayores concentraciones de CT y CF en el 80% y 60% de los meses muestreados, respectivamente, mientras que PM5 presentó las menores concentraciones en el 85% de los meses muestreados. En relación con la temporalidad, las mayores concentraciones de coliformes para los primeros cuatro puntos (PM1-4) fueron observadas en junio y julio, mientras que para PM5 fueron registradas en septiembre (fig. 2), mes en que Sinaloa fue afectado por el huracán Manuel. En contraste, las menores concentraciones de coliformes para PM1-4 fueron observadas en marzo y noviembre, y para PM5 en abril (fig. 2).
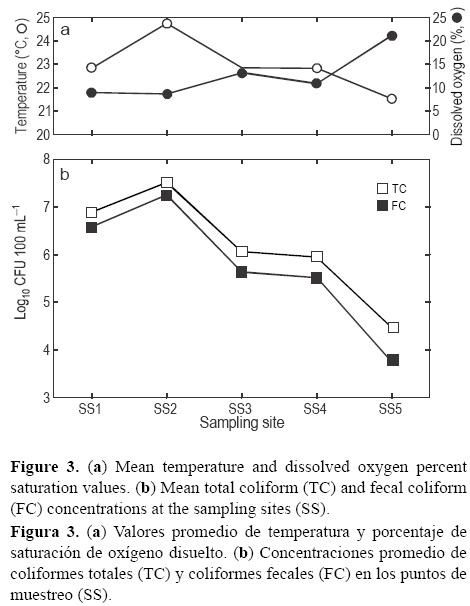
Según el análisis global del periodo estudiado, PM2 presentó las mayores concentraciones promedio de coliformes (CT, 3.23 χ 107 UFC 100 mL-1; CF, 1.77 χ 107UFC100 mL-1) y PM5 las menores (CT, 2.8 χ 104UFC 100 mL-1; CF, 5.4 χ 103 UFC 100 mL-1) (fig. 3). El análisis estadístico mostró diferencias significativas para julio (CT, P = 0.0001; CF, P = 0.0037) y PM2 (CT, P = 0.0007; CF, P = 0.0257). Las reducciones porcentuales promedio de las concentraciones de coliformes por segmento de la sección del canal de drenaje analizada (i.e., PM1 a PM2, PM2 a PM3, PM3 a PM4 y PM4 a PM5) fueron -223%, 59%, 37% y 62% para CT y -700%, 59%, 30% y 60% para CF, respectivamente, donde los valores negativos representan incrementos. Por otra parte, al analizar los porcentajes de reducción mensuales y considerando el primer (PM1) y el último (PM5) punto de muestreo, se observó una clara tendencia hacia la disminución en la concentración de coliformes (fig. 2). Se encontraron diferencias estadísticas en 7 de los 10 meses muestreados (P < 0.05). Los valores de la mediana y el promedio de los porcentajes de remoción fueron 96% y 87% para CT y 98% y 85% para CF, respectivamente. Estos resultados correspondieron a disminuciones de 2.42 (CT) y 2.84 (CF) unidades logarítmicas en la concentración de coliformes a lo largo de la sección del canal de drenaje analizada (figs. 2, 3).
Se identificaron 127 cepas bacterianas, que correspondieron a Escherichia coli (67.7%), Kluyvera cryocrescens (10.2%), Enterobacter agglomerans (6.3%), Citrobacter amalonaticus (3.9%), grupo Serratia liquefaciens (3.1%), Hafnia alvei (2.4%), Enterobacter aerogenes (2.4%), Serratia odorifera (1.6%), Citrobacter freundii (1.6%) y Enterobacter sakazakii (0.8%). En general, no se registraron tendencias que relacionaran la presencia de alguna especie bacteriana con el mes de muestreo; sin embargo, E. coli fue la única bacteria identificada en las muestras de agua de todos los PM y meses muestreados. El resto de las bacterias no fueron detectadas en al menos un PM o mes muestreado. En particular, tres bacterias sólo se encontraron en un PM (S. odorifera, PM4; C. freundii, PM2; y E. sakazakii, PM1) y en una o dos fechas de muestreo. La mayor diversidad de especies bacterianas fue registrada para PM1, con 7 de las 10 especies identificadas (E. coli, K. cryocrescens, E. agglomerans, C. amalonaticus, H. alvei, E. aerogenes y E. sakazakii), y la menor diversidad fue registrada para PM3, con 4 de las 10 especies identificadas (E. coli, K. cryocrescens, E. agglomerans y C. amalonaticus).
Las mediciones de los parámetros fisicoquímicos del agua variaron con el PM (fig. 3), pero no se observaron diferencias estadísticas (P > 0.05) entre los PM. El análisis de correlación entre las concentraciones promedio de coliformes y las variables fisicoquímicas evidenció una correlación positiva con la temperatura (CT, r = 0.905, P = 0.034; CF, r = 0.900, P = 0.037) y una correlación negativa con el %OD (CT, r = -0.939, P = 0.017; CF, r = -0.947, P = 0.014) (fig. 3).
Discusión
La gran variabilidad observada en las concentraciones de coliformes para cada PM analizado es explicada por las fuentes puntuales de ingreso de agua residual doméstica de los asentamientos humanos en las inmediaciones del área de estudio. Específicamente, PM2 está asociada a una entrada constante de aguas residuales domésticas ubicada a sólo 6 m corriente arriba del punto; la zona alrededor de PM2 tiene la mayor densidad poblacional del área de estudio (fig. 1). Lo mismo fue registrado para PM3, donde se identificó una entrada permanente de agua residual doméstica a 6 m de distancia corriente arriba de este punto; la zona alrededor de PM3 tiene una menor densidad poblacional que aquella en torno a PM2, lo cual resulta consistente con las menores concentraciones de CT y CF en relación con PM2 (figs. 1, 2). Las menores concentraciones de CT y CF en PM5 mostraron que este punto prácticamente no recibió entradas de aguas residuales domésticas y las entradas cercanas a ese punto derivaron de aguas de riego de cultivos cercanos y aguas pluviales (figs. 1, 2).
Nuestros resultados demuestran el impacto negativo de las actividades antropogénicas sobre la calidad del agua del canal de drenaje La Michoacana. Diferentes investigaciones han demostrado el daño ambiental y el riesgo para la salud que causan las descargas de aguas residuales a los cuerpos de agua en varias partes del mundo (e.g., Opisa et al. 2011, Bagordo et al. 2012, Matano et al. 2013, Riera et al. 2013). En 1997, el 75% de las muestras de agua y el 72% de las muestras de moluscos obtenidas de la bahía de Altata y Ensenada El Pabellón (Sinaloa) presentaron contenidos de CT y CF por encima de la norma Mexicana (NOM-113-SSA1-1994), lo cual provocó que los moluscos fueran inadecuados para el consumo (Haws et al. 2006). En 2004, el 28% de los trabajadores agrícolas migrantes que arribaron a Sinaloa se vieron afectados por enfermedades infecciosas, probablemente asociados al contacto con agua y alimentos contaminados (Ramírez-Romero et al. 2006).
Las mayores concentraciones de CT y CF en las muestras obtenidas de PM1-4 fueron registradas durante junio y julio. Este fenómeno puede asociarse a un efecto de concentración, ya que durante ese periodo inició el incremento habitual de las temperaturas en la región, no se presentaron lluvias y los riegos agrícolas no se permitían. Por tanto, no hubo flujo continuo de agua a lo largo del canal de drenaje y PM5 permaneció seco durante los muestreos de junio a agosto. Estudios previos han mostrado que las lluvias pueden arrastrar coliformes presentes en zonas aledañas al canal (Hathaway et al. 2011). Esto, en parte, explicaría el aumento registrado en PM5 durante septiembre, mes durante el cual la precipitación fue muy alta debido al huracán Manuel (fig. 2). Por otro lado, las muestras de agua obtenidas durante los meses de menor flujo de agua (junio a agosto) presentaron visualmente mayor turbidez. Kadlec y Wallace (2009) registraron que la luz UV de la radiación solar puede afectar la supervivencia de las bacterias en el agua residual de un humedal de flujo superficial y el tamaño de las partículas suspendidas en el agua son un factor determinante; por lo tanto, la alta turbidez favorece el incremento en las concentraciones de coliformes (figs. 2, 3). La densidad poblacional de Typha domingensis en la sección del canal de drenaje varió y el agua estuvo expuesta al aire y a la luz solar directa en varias subsecciones del canal; por ende, el impacto de la fotooxidación sobre la disminución de CT y CF no puede descartarse.
Entre los múltiples beneficios que los humedales proveen se encuentra la remoción de organismos patógenos (Vacca et al. 2005). Los porcentajes de reducción de CT y CF obtenidos en este trabajo son similares a los registrados tanto para humedales naturales como artificiales (Hinds et al. 2002, Kadlec y Wallace 2009, Lekeufack et al. 2012), así como la disminución en el rango de 2 a 3 unidades logarítmicas de coliformes y E. coli (Azaizeh et al. 2012, Rühmland y Barjenbruch 2012). Sin embargo, aún con la buena reducción de coliformes señalada, los niveles encontrados en el 91.49% (43/47) de las muestras analizadas estuvieron fuera de lo que establece la Norma Oficial Mexicana NOM-001-ECOL-1996 (expedida por la Secretaría de Medio Ambiente y Recursos Naturales, SEMARNAT): el promedio mensual diario de coliformes fecales para descargas de aguas residuales en bienes nacionales así como las descargas vertidas a suelo (uso en riego agrícola) debe ser menor o igual que 1000 y 2000 NMP 100 mL-1 (NMP, número más probable), respectivamente. Solamente las muestras recolectadas en PM4 en noviembre y en PM5 en abril, mayo y noviembre cumplieron con esta norma (fig. 2). Éstas últimas cuatro muestras (8.51%, 4/47) también cumplieron con lo establecido en la norma NOM-003-ECOL-1997 para aguas residuales tratadas que se reutilizan en servicios al público con contacto ocasional o indirecto (máximo de 1000 CF 100 mL-1), mientras que sólo el 4.25% (2/47) de las muestras (i.e., PM5 en abril y mayo) cumplieron con lo establecido por la misma norma para el reúso de agua en servicios con contacto directo (máximo de 240 CF 100 mL-1) (fig. 2). En general, nuestros valores de CF también estuvieron fuera tanto de los lineamientos establecidos por la Agencia de Protección Ambiental de Estados Unidos, es decir, valores que van de 0 (e.g., usos urbanos de libre disposición y embalses) a 200 UFC 100 mL-1 (e.g., uso urbano restringido y uso agrícola para cultivos no alimenticios) (EPA 2012), como los establecidos por la Organización Mundial de la Salud para el agua reciclada utilizada para el riego de los productos agrícolas frescos comestibles (< 1000 UFC 100 mL-1) (Ayres and Mara 1996).
De acuerdo con nuestros resultados, el canal de drenaje agrícola La Michoacana tuvo un efecto positivo en la remoción de coliformes, ya que los porcentajes registrados fueron mayores que el 90% en el 80% de los meses muestreados. La menor remoción se presentó en junio y marzo (fig. 3). El resultado de junio posiblemente se debe a que el canal de drenaje se alimentó principalmente de agua residual doméstica con alta concentración de coliformes, a la disminución en la distancia que recorre el agua, al flujo intermitente entre PM1 y PM4, y a que PM5 estuvo seco. Los resultados de marzo podrían deberse a que las autoridades realizaron limpieza del canal como parte de la preparación para la temporada de lluvias y eliminaron gran parte de la vegetación, principalmente dominada por T. domingensis. A pesar de los eventos ocurridos durante el periodo de estudio, algunos inusuales (i.e., sequía prolongada, restricción en los riegos agrícolas y huracán Manuel) y otros programados (e.g., limpieza del canal de drenaje), el efecto remediador del canal pudo establecerse a partir de las diferencias significativas observadas entre PM1 y PM5 (n = 7), que ocurrieron independientemente de la resolución del muestreo (muestras distribuidas a lo largo de 10 meses).
La disminución de la contaminación bacteriana (CT y CF) a lo largo del canal de drenaje puede asociarse a la interacción de procesos físicos, químicos y biológicos. En particular, la correlación negativa entre la concentración de coliformes y el %OD sugiere la importancia de condiciones aeróbicas en la remoción de las bacterias (fig. 3). En estudios previos se ha demostrado que la distancia que recorre el agua en los humedales es muy importante para los mecanismos de remoción de microorganismos de la columna de agua (e.g., sedimentación, filtración, atrapamiento físico y predación), que también son influenciados por el tiempo de residencia y la velocidad del flujo del agua (Kadlec y Wallace 2009, Hathaway et al. 2011). La predación de bacterias patógenas por otros organismos (e.g., protozoarios) también es importante para mejorar la calidad del agua en los sistemas de remediación (Vacca et al. 2005). De igual manera, la presencia de especies vegetales en los humedales de flujo superficial ha mostrado ser un factor muy importante en la remoción de coliformes (Karim et al. 2008, Lekeufack et al. 2012, Abou-Elela et al. 2013), puesto que se involucran procesos como la filtración, la formación de biopelículas asociada a la liberación de fotosintatos y compuestos orgánicos, la liberación de compuestos que afectan la viabilidad bacteriana, la absorción de nutrientes en el medio circundante, entre otros (Kadlec y Wallace 2009, Karim et al. 2008). Vymazal (2013) registró que las plantas más comunes en los humedales, naturales o construidos, pertenecen a los géneros Typha, Scirpus (Schoenoplectus), Phragmites, Juncus y Eleocharis, y específicamente para América Central y del Sur a T. domingensis, que fue la especie dominante a lo largo del canal de drenaje La Michoacana.
Las bacterias coliformes forman parte de la flora intestinal de los humanos y animales de sangre caliente. Su presencia en ambientes acuáticos es un indicador de contaminación de origen fecal, principalmente bacteriana; sin embargo, los coliformes también pueden tener un origen ambiental porque están presentes en el aire, suelo y agua superficial. Los coliformes identificados en este estudio han sido aislados previamente de ambientes acuáticos (McMahan et al. 2012, Sidhu et al. 2012, Barrera-Escorcia et al. 2013). Se les ha relacionado con el desarrollo de enfermedades gastrointestinales e infecciones de vías urinarias, por lo cual representan agentes potencialmente patógenos para los humanos, principalmente la población infantil, las personas con el sistema inmune comprometido y, en general, las personas que habitan en regiones sin acceso a agua potable o saneamiento adecuado (Sidhu et al. 2012). Una búsqueda en Current Contents Connect (Thomson Reuters) hasta julio de 2014 mostró que los géneros Escherichia, Enterobacter, Citrobacter y Serratia han sido registrados comúnmente en humedales y canales de desagüe, pero no Kluyvera y Hafnia, que en este estudio representaron el 10.25% y 2.40%, respectivamente, de las cepas aisladas. Por otro lado, la presencia de coliformes en muestras de agua ha sido considerada como un indicador de la presencia de otros patógenos (e.g., virus, parásitos) relacionados con enfermedades transmitidas por agua (Kadlec y Wallace 2009). En este estudio, la identificación de dichos organismos y de especies de Salmonella, Shigella y Vibrio no fue considerada; por lo tanto, no se descarta su presencia en el canal de drenaje La Michoacana.
En las muestras de agua analizadas, las concentraciones de coliformes (CT y CF) se correlacionaron con las variables temperatura y %OD. Los coliformes pueden crecer en aguas superficiales naturales debido a la gran cantidad de materia orgánica y a las altas temperaturas (Kadlec y Wallace 2009). En nuestro trabajo, la mayor concentración de coliformes se registró para los meses con la temperatura ambiental más alta (junio a agosto) (fig. 2) y para los PM con temperatura promedio del agua más alta (PM1-2) (fig. 3). Kadlec y Wallace (2009) mencionaron que las temperaturas frías afectan la supervivencia de organismos que se originan en animales de sangre caliente, como los coliformes; esto indica que la mejor condición de supervivencia para las bacterias se encontró en los PM con temperatura del agua cercana a su óptima de crecimiento (37 °C). La correlación positiva entre la concentración de coliformes y la temperatura no coincidió con la registrada por Riera et al (2013), quienes analizaron el efecto de las variables fisicoquímicas del agua sobre la presencia de coliformes totales en una zona costera con descargas de aguas residuales domésticas y salmuera, y encontraron una correlación negativa. En cuanto al %OD, se ha registrado que una mayor cantidad de oxígeno disuelto favorece la fotooxidación y, consecuentemente, el proceso de desinfección (Kadlec y Wallace 2009). Al igual que en nuestro trabajo, Cheng et al. (2013) encontraron una correlación negativa entre los niveles de oxígeno disuelto y la densidad de E. coli; la aireación del humedal favoreció el desarrollo de depredadores de E. coli y promovió el daño fotooxidativo. En la bahía de Daya (China), la presencia de bacterias y microal-gas estuvo asociada a la concentración de nutrientes (nitratos, amonio y silicatos), los cuales son altamente impactados por las actividades antropogénicas, mientras que el oxígeno disuelto tuvo una menor correlación (Wu et al. 2014). En el caso del pH, los valores encontrados en todos los PM del canal de drenaje cumplen con lo establecido por la norma NOM-001-ECOL-1996 (pH = 5-10), que establece los límites máximos permisibles de contaminantes en las descargas de aguas residuales en aguas y bienes nacionales. La ausencia de correlación del pH y de la salinidad con el contenido de coliformes coincide con lo registrado por Riera et al. (2013). En contraste, los valores relativamente altos del pH, asociados a una alta descomposición de materia orgánica, favorecieron el proceso de desnitrificación en el sistema lagunar de Urias, golfo de California, México (Ochoa Izaguirre y Soto-Jiménez 2013), así como la presencia de microalgas y bacterias en la bahía Daya, China (Wu et al. 2014).
El canal de drenaje La Michoacana, ubicado en una zona de agricultura intensiva y flanqueado por una comunidad rural, conduce agua con un alto contenido de CT y CF. El 91.49% de las muestras de agua analizadas no cumplió con los límites establecidos por las normas oficiales mexicanas ni los lineamientos internacionales para el contenido de estos microorganismos, lo cual muestra la severidad de la contaminación. De manera interesante, el funcionamiento de este canal reduce hasta en un 96% los CT y hasta en un 98% los CF, mejorando considerablemente la calidad del agua que conduce. Sin embargo, la calidad microbiológica del agua a la salida del canal debe mejorarse antes de ser reutilizada o depositada en cuerpos de agua costeros, ya que en las condiciones actuales, estas descargas son una fuente de contaminación que pone en riesgo la salud del ecosistema y humana. Los resultados del presente trabajo indican la participación de diversos procesos físicos, químicos y biológicos en la remediación de la contaminación bacteriana del canal de drenaje La Michoacana, además sugieren que este tipo de canales agrícolas, con características similares a humedales de flujo superficial, pueden incrementar su efecto remediador con un mantenimiento apropiado. Estudios más profundos, como el análisis metagenómico, permitirán determinar la presencia de consorcios microbianos (e.g., algas, bacterias, fagos y hongos) en el canal y su participación en el sistema agua-sedimento-planta y en la remediación de la contaminación bacteriana en el agua de este tipo de sistema.
Agradecimientos
Esta investigación fue financiada por el Consejo Nacional de Ciencia y Tecnología, México (CONACYT I010/214/2012), y el Servicio Alemán de Intercambio Académico (DAAD Pestmex KTR U455D813). Los autores agradecen a Seifeddine Jomaa su colaboración en la selección del canal de drenaje, la definición de los sitios de muestreo, el análisis de estrategias metodológicas y el diseño de gráficos, y a Ignacio Osuna-Ramírez su ayuda en el análisis de datos.
Referencias
Abou-Elela SI, Golinelli G, Saad El-Tabl A, Hellal MS. 2013. Treatment of municipal wastewater using horizontal flow constructed wetlands in Egypt. Water Sci. Technol. 69: 38-47. [ Links ]
Alexander S, McInnes R. 2012. Los beneficios de restauración de humedales. Notas de Información Científica y Técnica de Ramsar No. 4. Ramsar Secretariat, Gland, Switzerland, pp. 1-22. [ Links ]
[APHA, AWWA, WEF] American Public Health Association, American Water Works Association, Water Environment Federation. 2005. Standard Methods for the Examination of Water and Wastewater. 21st ed. American Public Health Association, Washington DC, 55 pp. [ Links ]
Ayres RM, Mara DD. 1996. Analysis of wastewater for use in agriculture: A laboratory manual of parasitological and bacteriological techniques. World Health Organization, Finland and Geneva, 31 pp. [ Links ]
Azaizeh H, Linden KG, Barstow C, Kalbouneh S, Tellawi A, Albalawneh A, Gerchman Y. 2012. Constructed wetlands combined with UV disinfection systems for removal of enteric pathogens and wastewater contaminants. Water Sci. Technol. 67: 651-657. [ Links ]
Bagordo F, Serio F, Lugoli F, Grassi T, Idolo A, Gabutti G, De-Dono A. 2012. Phenotypic characterization of culturable marine luminous bacteria isolated from coastal waters of the southern Adriatic Sea (Otranto, Italy). Cienc. Mar. 38: 599-608. http://dx.doi.org/10.7773/cm.v38i4.2119 [ Links ]
Barrera-Escorcia G, Fernández-Rendón CL, Wong-Chang I, Ramírez-Romero P. 2013. La sensibilidad del grupo coliforme como indicador de la presencia de enterobacterias patógenas en cuatro cuerpos acuáticos de México. Hidrobiológica 23: 87-96. [ Links ]
[CONAGUA] Comisión Nacional del Agua. 2011. Infraestructura hidráulica. In: Estadísticas del Agua en México, edición 2011. CONAGUA, México, pp. 57-78. [ Links ]
[CONAPESCA] Comisión Nacional de Acuacultura y Pesca. 2012. Anuario Estadístico de Acuacultura y Pesca 2011. Mazatlán, Sinaloa, México, 305 pp. [ Links ]
Cupul-Magaña L, Mösso-Aranda C, Sánchez-Arcilla A, Sierra-Pedrico J, Fermán-Almada J, Romero I, Falco S. 2006. Distribución bacteriológica en el agua de mar en la Bahía Cullera, España. Cienc. Mar. 32: 311-318. [ Links ]
Cheng J, Niu S, Kim Y. 2013. Relationship between water quality parameters and the survival of indicator microorganisms Escherichia coli in a stormwater wetland. Water Sci. Technol. 68: 1650-1656. [ Links ]
[EPA] Environmental Protection Agency. 2012. Guidelines for Water Reuse. USAID and CDM Smith Inc., USA, 643 pp. [ Links ]
Escobedo-Urías D, Hernández-Real MT, Herrera-Moreno N, Ulloa-Pérez AE, Chiquete-Ozono Y. 1999. Calidad bacteriológica del sistema lagunar de San Ignacio-Navachiste, Sinaloa. Ciencia y Mar 9: 17-27. [ Links ]
Hathaway JM, Hunt WF, Graves AK, Bass KL, Caldwell A. 2011. Exploring fecal indicator bacteria in a constructed stormwater wetland. Water Sci. Technol. 63: 2707-2712. [ Links ]
Hinds J, Terry D, Brown RR, Burns EHJ. 2002. Reduction of fecal coliform levels in two created wetlands at the Olentangy River Wetland Research Park. Olentangy River Wetland Research Park at the Ohio State University, Annual Report, Columbus, Ohio, pp. 69-72. [ Links ]
Kadlec RH, Wallace SD. 2009. Treatment Wetlands. 2nd ed. Taylor & Francis Group, Boca Raton, Florida, 1016 pp. [ Links ]
Karim MR, Glenn EP, Gerba CP. 2008. The effect of wetland vegetation on the survival of Escherichia coli, Salmonella typhimurium, bacteriophage MS-2 and polio virus. J. Water Health 6: 167-175. [ Links ]
Lekeufack M, Fonkou T, Pamo TE, Amougou A. 2012. Removal of faecal bacteria and nutrients from domestic wastewater in a horizontal surface flow wetland vegetated with Echinochloa pyramidalis. Afr. J. Environ. Sci. Technol. 6: 337-345. [ Links ]
MacFaddin JF. 2003. Pruebas Bioquímicas para la Identificación de Bacterias de Importancia Clínica. 3rd ed. Médica Panamericana, Argentina, 850 pp. [ Links ]
Matano AS, Anyona DN, Owuor PO, Abuom PO, Dida GO, Kapiyo R, Ofulla AVO. 2013. Effects of land use types on the levels of microbial contamination based on total coliform and Escherichia coli counts on the Mara River, East Africa. Afr. J. Trop. Hydrobiol. Fish. 13: 5-11. [ Links ]
McMahan L, Grunden AM, Devine AA, Sobsey MD. 2012. Evaluation of a quantitative H2S MPN test for fecal microbes analysis of water using biochemical and molecular identification. Water Res. 46: 1693-1704. [ Links ]
Ochoa-Izaguirre MJ, Soto-Jiménez MF. 2013. Evaluation of nitrogen sources in the Urías lagoon system, Gulf of California, based on stable isotopes in macroalgae. Cienc. Mar. 39: 413-430. http://dx.doi.org/10.7773/cm.v39i4.2285 [ Links ]
ONU-DAES, UN-water (2014). Decenio Internacional para la Acción "El agua fuente de vida" 2005-2015 [cited May 2014]. Available from: http://www.un.org/spanish/waterforlifedecade/quality.shtml. [ Links ]
Opisa S, Odiere MR, Jura WG, Karanja DM, Mwinzi PN. 2011. Faecal contamination of public water sources in informal settlements of Kisumu City, western Kenya. Water Sci. Technol. 66: 2674-2681. [ Links ]
Haws M, Rojas-Umaña A, and Ochoa E. 2006. Salud, Ambiente y Acuicultura en la Costa Pacifica de México. ACRSP, Oregon State University, Corvallis, Oregon, 149 pp. [ Links ]
Pierre H, Finlayson CM. 2011. Wetlands as settings for human health: Incorporating ecosystem services and health impact assessment into water resource management. BioScience 61: 678-688. [ Links ]
Ramírez-Romero SJ, Palacios Nava D, Velazco-Samperio D. 2006. Diagnóstico sobre la condición social de las niñas y niños migrantes internos, hijos de jornaleros agrícolas. Fondo de las Naciones Unidas para la Infancia (UNICEF-México), México, 153 pp. [ Links ]
Reinoso R, Torres LA, Bécares E. 2008. Efficiency of natural systems for removal of bacteria and pathogenic parasites from wastewater. Sci. Total Environ. 395: 80-86. http://dx.doi.org/10.1016/j.scitotenv.2008.02.039 [ Links ]
Riera R, Tuya F, Sacramento A, Ramos E, Monterroso Ó, Rodríguez M. 2013. Influence of the combined disposal of sewage and brine on meiofauna. Cienc. Mar. 39: 15-27. http://dx.doi.org/10.7773/cm.v39i1.2162 [ Links ]
Rühmland S, Barjenbruch M. 2012. Disinfection capacity of seven constructed wetlands and ponds. Water Sci. Technol. 68: 2111-2117. [ Links ]
[SEDESOL] Secretaría de Desarrollo Social. 2014. Sistema de Apoyo para la Planeación del Programa de Desarrollo para Zonas Prioritarias [cited 23 November 2014]. Available from http://www.microrregiones.gob.mx/catloc/contenido.aspx?refnac=250180074. [ Links ]
[SIAP] Servicio de Información Agroalimentaria y Pesquera. 2014. Anuario Estadístico de la Producción Agrícola [cited 18 July 2014]. Available from: http://www.siap.gob.mx/cierre-de-la-produccion-agricola-por-estado/. [ Links ]
Sidhu JP, Ahmed W, Hodgers L, Toze S. 2012. Occurrence of virulence genes associated with diarrheagenic pathotypes in Escherichia coli isolates from surface water. Appl. Environ. Microb. 79: 328-335. [ Links ]
Vacca G, Wand H, Nikolausz M, Kuschk P, Kästner M. 2005. Effect of plants and filter materials on bacteria removal in pilot-scale constructed wetlands. Water Res. 39: 1361-1373. [ Links ]
Valdés J, Guiñez M, Castillo A, Vega SE. 2014. Cu, Pb, and Zn content in sediments and benthic organisms from San Jorge Bay (northern Chile): Accumulation and biotransference in subtidal coastal systems. Cienc. Mar. 40: 45-58. http://dx.doi.org/10.7773/cm.v40i1.2318 [ Links ]
Vymazal J. 2013. Emergent plants used in free water surface constructed wetlands: A review. Ecol. Eng. 61(B): 582-592. [ Links ]
Wu M-L, Wang Y-T, Wang Y-S, Sun F-L. 2014. Influence of environmental changes on picophytoplankton and bacteria in Daya Bay, South China Sea. Cienc. Mar. 40: 197-210. http://dx.doi.org/10.7773/cm.v40i3.2436 [ Links ]














