Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.38 no.2 Ensenada jun. 2012
Artículos
Comportamiento reproductivo y variación de la proporción sexual de Pleuroncodes monodon (Crustacea: Galatheidae) en la costa peruana
Breeding behavior and sex ratio variation of Pleuroncodes monodon (Crustacea: Galatheidae) off the Peruvian coast
MT Franco-Meléndez
Instituto del Mar del Perú (IMARPE), Esquina Gamarra y Gral. Valle s/n, PO Box 22, Chucuito, Callao, Peru. E-mail: mfranco@imarpe.gob.pe
Received June 2011,
received in revised form October 2011,
accepted November 2011.
RESUMEN
Se analizó el comportamiento reproductivo y la variación de la proporción sexual del camaroncito rojo Pleuroncodes monodon. Las muestras provinieron de lances experimentales en tres cruceros de evaluación hidroacústica de recursos pelágicos durante 2001 frente a la costa peruana. Un total de 8517 ejemplares fueron diferenciados según el sexo. Los machos presentaron un marcado dimorfismo sexual, mientras que las hembras se diferenciaron entre aquellas ovígeras y no ovígeras. Las tallas entre sexos no mostraron diferencias significativas (prueba de Kolmogorov-Smirnov, P > 0.05); las tallas medias fueron menores que 20 mm de longitud cefalotorácica. La proporción sexual indicó que en invierno hubo una mayor predominancia de machos que de hembras (prueba χ2, P < 0.05). Se observaron hembras ovígeras durante todo el periodo de estudio, con mayor actividad en primavera, y una dispersión de la población en la temporada reproductiva.
Palabras clave: camaroncito rojo, Pleuroncodes monodon, dimorfismo sexual, periodo de portación de huevos, mar peruano.
ABSTRACT
The breeding behavior and sex ratio variation of the carrot squat lobster Pleuroncodes monodon were analyzed. Specimens were collected from experimental hauls in three acoustic pelagic resource assessment surveys during 2001 off the Peruvian coast. A total of 8517 individuals were differentiated according to sex. Males showed clear sexual dimorphism, while females were divided into ovigerous or non-ovigerous individuals. Size did not differ significantly between sexes (Kolmogorov-Smirnov test, P > 0.05); average sizes were smaller than 20 mm cephalothoraxic length. The sex ratio indicated that in winter males were more predominant than females (χ2 test, P < 0.05). Ovigerous females were observed during all the period of study, with major activity in spring, and population dispersion occurred during the breeding season.
Key words: carrot squat lobster, Pleuroncodes monodon, sexual dimorphism, egg-carrying period, Peruvian Sea.
Introducción
Pleuroncodes monodon Milne Edwards 1837, llamado comúnmente camaroncito rojo, múnida o langostino colorado, es un pequeño crustáceo anomuro, miembro de la familia Galatheidae, muy abundante y forma parte de la producción secundaria de uno de los sistemas de surgencias más productivos del mundo, el Sistema Peruano-Chileno de la Corriente de Humboldt. Este crustáceo se distribuye desde Chile (~41° S) hasta el sur de México (~15° N) (Longhurst y Seibert 1971, Hendrickx y Harvey 1999). En particular, en las costas sudamericanas se extiende desde isla Lobos de Afuera (~06° S), Perú, hasta bahía Ancud (~42° S), Chile (Chirichigno 1970). Su distribución batimétrica está condicionada a la oceanografía de la región y al comportamiento reproductivo (Rivera y Santander 2005). Bajo esta premisa, Palma y Arana (1997) determinaron la distribución batimétrica de hembras de P. monodon frente a la costa de Chile, y encontraron que éstas habitan aguas más profundas, entre 200 y 350 m de profundidad, al inicio del periodo de portación de huevos (otoño) y luego, a fines de invierno, migran hacia aguas más someras, entre 70 y 200 m de profundidad, donde registraron el mayor porcentaje de hembras ovígeras.
Pleuroncodes monodon es una especie heterosexual con marcado dimorfismo sexual; los machos presentan el primer y segundo par de pleópodos adaptados como órganos copula-dores (Gutiérrez y Zúñiga 1977). Los antecedentes sobre la conducta reproductiva de este crustáceo se basan en la temporada de portación de huevos, que se caracteriza por su prolongación. Gallardo et al. (1992) determinaron un periodo de portación de huevos extenso, desde abril hasta noviembre. Bustos y Retamal (1985) registraron una sola época de desove para esta especie entre punta Lobos (36°40'18" S) y punta Nugurne (36°00' S), donde el periodo de portación de huevos fue de alrededor de seis meses (abril-septiembre). Palma y Arana (1997) documentaron que el pico máximo de este periodo fue entre comienzos de mayo y fines de octubre frente a la costa de Concepción, Chile. Rivera y Santander (2005) determinaron que la etapa reproductiva de P. monodon ocurre con mayor incidencia en invierno (agosto). En el caso de la langostilla, Pleuroncodes planipes, del Pacífico norte, el periodo de portación de huevos se presenta desde diciembre hasta abril (Boyd y Johnson 1963). Frente a la costa occidental de Baja California, la temporada reproductiva de la langostilla es entre diciembre y mayo (invierno-primavera), pero con mayor intensidad en enero y febrero (Gómez-Gutiérrez y Sánchez-Ortiz 1997); sin embargo, se pueden encontrar organismos reproductivamente activos en verano y otoño (Díaz 2006). Estudios previos sobre la etapa reproductiva de P. monodon muestran una marcada estacionalidad asociada a la oceanografía del área. Ello se traduce en posibles desplazamientos de las hembras ovígeras hacia zonas someras, donde un incremento en la temperatura conllevaría a la reducción del periodo de portación y aceleraría el desarrollo embrionario (Palma y Arana 1997); sin embargo, su asociación a los centros de eclosión y núcleos costeros de bajas temperaturas favorecería una mayor supervivencia larval (Gómez-Gutiérrez y Sánchez-Ortiz 1997, Fagetti y Campodonico 1971).
En la estructura poblacional, la proporción sexual de 1:1 (Fischer 1930) es un indicativo del equilibrio biológico de la población; sin embargo, diversos factores como la selección, competencia, reproducción, supervivencia, etc. conducen a la dominancia de individuos de uno u otro sexo. En el caso de los crustáceos marinos, es frecuente observar estrategias competitivas que maximizan el encuentro entre machos y hembras al momento de estar éstas receptivas; además, las hembras de muchos crustáceos mudan antes de ser copuladas y son más vulnerables a la depredación (Pérez y Calcagno 2005), lo que resulta en una notable disminución de esta fracción poblacional. La proporción sexual en P. monodon ha sido documentada en varias zonas de la costa chilena. Gutiérrez y Zúñiga (1977) registraron que la mayor concentración de hembras ocurrió de septiembre a diciembre y la de machos, de junio a septiembre. Por otra parte, frente a la zona centro y sur de Chile, Bustos y Retamal (1985) registraron una predominancia de machos en octubre y enero (1.57:1 a 9.57:1) a una profundidad máxima de 300 m; las hembras se hallarían a mayores profundidades, pero luego ascenderían a menores profundidades según el ciclo reproductivo. Un estudio sobre P. planipes frente a bahía Magdalena (Baja California, México) demostró que, durante su temporada reproductiva, la proporción de hembras incrementaba conforme disminuía la profundidad (Serrano-Padilla y Aurioles Gamboa 1992).
El objetivo de este estudio consistió en determinar el comportamiento reproductivo y la proporción sexual de P. monodon en la costa peruana para entender su estrategia reproductiva. Aunque es un recurso potencial, el conocimiento que existe sobre esta especie es escaso.
Materiales y métodos
Las muestras se obtuvieron durante tres cruceros de evaluación hidroacústica de recursos pelágicos que se llevaron a cabo a lo largo del litoral peruano, desde Puerto Pizarro, Tumbes (03° S), hasta Los Palos, Tacna (18° S), a bordo de los B/I Alexander von Humboldt, José Olaya y SNP-2, con el apoyo de las lanchas pesqueras IMARPE IV y V para cubrir áreas litorales someras durante febrero-abril, julio-agosto y octubre-noviembre de 2001. La figura 1 corresponde a la carta de trayectos y lances experimentales propuestos para cada buque y lancha en un área explorada desde la zona costera hasta aproximadamente 100 millas náuticas mar adentro. En cada crucero se efectuaron arrastres con una red pelágica de media agua por un periodo de 20-30 min.
Se muestreó un total de 8517 individuos de ambos sexos. Para todos los casos, se determinó la longitud cefalotorácica (LC, mm), medida desde la prolongación anterior del caparazón (rostro) hasta el margen medio posterior del cefalotórax (Arana y Pizarro 1970). Luego, los ejemplares se separaron por sexo con base en los caracteres sexuales externos. Para el caso de los machos, el segundo par de pleópodos está modificado en órganos copuladores denominados gonopodios (Gutiérrez y Zúñiga 1977, Serrano-Padilla y Aurioles-Gamboa 1995). Otro carácter externo es el tamaño de la quela; esto es notorio en ejemplares de mayor talla cuya importancia está asociada a la reproducción y selectividad (Serrano-Padilla y Aurioles-Gamboa 1992).
Para contrastar las diferencias en las frecuencias de tallas entre machos y hembras, se empleó la prueba de Kolmogorov-Smirnov de dos muestras (α = 0.05) para detectar las discrepancias entre las frecuencias relativas acumuladas de los sexos (Giraldo y Rodríguez 1997).
El periodo de portación de huevos en las hembras de P. monodon se determinó con base en la relación porcentual entre el número de hembras con huevos visibles entre los pleópodos y el número total de hembras capturadas en el lance (IFOP 2003), según la siguiente expresión:
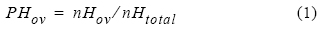
donde PHov es la proporción de hembras ovígeras, nHov es el número de hembras portadoras de huevos en los distintos estados de desarrollo y nHtotal es el número total de hembras.
El periodo con mayor número de hembras portadoras de huevos se determinó como aquel en el que se observó más del 25% del total (Palma y Arana 1997). Para comparar diferencias en la LC respecto a los diferentes estados de desarrollo de los huevos en hembras ovígeras de P. monodon, se utilizó el análisis de varianza de un factor con la finalidad de comparar las medias de longitud del caparazón de los grupos. En caso de existir diferencias significativas entre los grupos, se realizaron las comparaciones post hoc con la finalidad de encontrar si todas las medias eran diferentes o si sólo una difería de las demás, con la prueba de comparaciones múltiples de Tukey.
Para la determinación macroscópica del estado de madurez de los huevos, se empleó la metodología realizada por Palma y Arana (1997), teniendo en cuenta la coloración de los huevos, la forma y el grado de pigmentación de los globos oculares de los embriones. Se estableció una escala de cuatro estados de desarrollo.
La proporción de sexos total para cada periodo se calculó dividiéndo el número total de hembras entre el número de hembras y machos (IFOP 2006). A fin de conocer si la proporción entre ambos sexos difería significativamente de la relación esperada de 1:1, se empleó la prueba de chi-cuadrada (χ2) de Pearson, con un nivel de significación del 5%, de acuerdo con la siguiente ecuación:
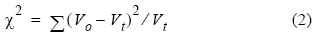
donde V0 es el valor observado y V1, es el valor teórico
Se acepta la hipótesis nula cuando χ2 < χt2 (r - 1) (k - 1); en caso contrario, se rechaza. Además, se determinó la proporción sexual en función de la talla del total de ejemplares muestreados, y los valores más próximos a 1 indicarían una mayor proporción de uno u otro sexo. Los análisis estadísticos se realizaron con el software SPSS v13.0.
Resultados
Distribución de frecuencias de tallas y talla media
La estructura de las frecuencias de tallas no reflejó marcadas diferencias en la amplitud del intervalo de tamaños (P > 0.05, D = 0.029, prueba de Kolmogorov-Smirnov = 1.351). Ambos sexos estuvieron representados principalmente por ejemplares con tallas medias menores que 20 mm LC (curtosis negativa). La longitud máxima fue de 31 mm LC en las hembras y 35 mm LC en los machos. No se observaron diferencias entre el tamaño medio de machos y hembras (fig. 2).
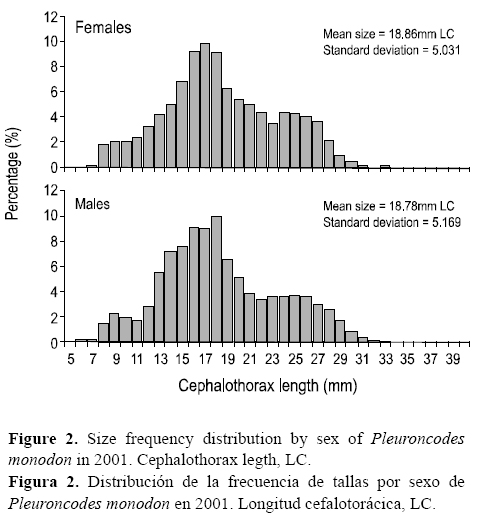
Según las regiones, la estructura de tallas global (machos + hembras) se caracterizó por tallas medias que se incrementaron desde la zona norte (19.1 ± 4.3 mm LC) hacia la zona centro (19.3 ± 5.6 mm LC), pero luego disminuyeron (15.6 ± 4.9 mm LC) en la zona sur (fig. 3). Para cada estación según las regiones (norte = 05°-10° S, centro = 11°-15° S y sur = 16°-18° S), las variaciones de las tallas medias fueron diferentes. En verano, la tendencia fue a disminuir de norte (23.4 ± 4.5 mm de LC) a sur (17.2 ± 3.9 mm LC). Por el contrario, en invierno se observó la mayor talla media en la zona sur, mientras que en primavera se observó un incremento desde la zona norte hacia la zona centro y luego una disminución en la zona sur (14.1 ± 4.8 mm LC) (fig. 3).
Al analizar las tallas medias por intervalos de profundidad, P. monodon mostró dos agrupamientos definidos: a niveles superficiales (menores que 40 m), las tallas medias fluctuaron entre 14.1 y 19.2 mm LC, y a profundidades mayores que los 40 m, las tallas medias fluctuaron entre 20.2 mm y 24.0 mm LC (fig. 4a). En verano (febrero-abril), el intervalo de profundidad fue superficial, y las tallas medias fluctuaron entre los 14.6 y 20.2 mm LC (fig. 4b). En invierno (julio-agosto), las tallas menores que 18 mm LC se registraron dentro de los 30 m de profundidad y aquellas superiores a los 20 mm LC se hallaron a mayor profundidad (fig. 4c). En primavera (octubre-noviembre), la distribución de las tallas medias fue similar a la de los periodos anteriores, pero dentro de los 50 m de profundidad las tallas medias no sobrepasaron los 20 mm LC (fig. 4d).
Comparación de las tallas medias en hembras ovígeras y no ovígeras de P. monodon
En verano, las tallas medias de la LC en hembras varió estadísticamente con relación a los grados de desarrollo de la masa ovígera portada en sus pleópodos (F = 231.283, g.l. = 5.326, P = 0.000). Mediante la prueba post hoc de Tukey, se observó que las hembras que no portaban huevos presentaron tallas medias más pequeñas que las hembras con huevos visibles entre sus pleópodos (tabla 1). En invierno, también se registraron diferencias significativas de las tallas medias de los grupos (F = 6.504, g.l. = 5.154, P = 0.000); las menores tallas medias se registraron para las hembras con huevos en estado 4 (embrión) en comparación con los otros grupos (tabla 1). En primavera, la LC varió significativamente (F = 113.740, g.l. = 4.224, P = 0.000) entre las hembras que portaban huevos y las que no (tabla 1). En resumen, se observó que la variación de las tallas medias en hembras ovígeras y no ovígeras fue diferente según el periodo: en verano, se registraron hembras portando huevos en diferentes fases con tallas medias superiores a los 20 mm LC, mientras que en invierno y primavera fue característica la reducción en las tallas medias, e inclusive se encontraron hembras con masa ovígera bajo el abdomen con tallas menores que 10 mm LC (madurez precoz de individuos jóvenes).
Dinámica reproductiva
Ciclo reproductivo
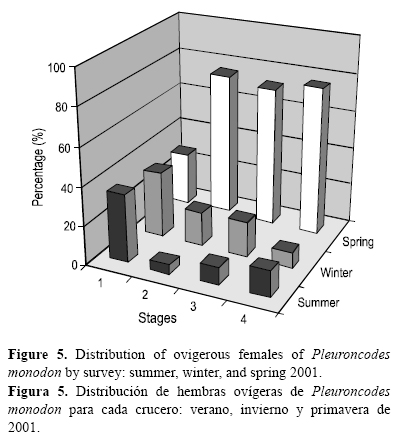
Se observaron hembras ovígeras durante todo el periodo de estudio, lo que indica un largo proceso de portación de huevos. Sin embargo, los mayores porcentajes de hembras en estado de madurez avanzado (estados 2 y 3) y con embriones desarrollados (estado 4) durante la primavera indicó que el periodo de liberación de huevos o eclosión larval se efectúa a partir de esta época del año (fig. 5).
Proporción de hembras portadoras de huevos según el grado latitudinal
La distribución espacial según el grado latitudinal de las hembras con masa ovígera respecto a las no ovígeras indica una mayor predominancia de hembras sin masa ovígera durante el verano (>70%), mientras que las hembras ovígeras no alcanzaron el 50%. En invierno, se apreciaron tres importantes focos de concentración de hembras ovígeras: entre 06° y 09° S (punta La Negra-Chimbote), en 16° S (Atico) y en 11° S (Huacho). En primavera, las hembras ovígeras abarcaron gran parte de la costa, principalmente desde 05°30' S (Sechura) hasta 12° S (Callao) y en la zona sur (17°-18° S); cabe destacar la presencia de ejemplares sin masa ovígera entre 15°-16° S (punta Caballas-Atico), que en su mayoría presentaron tallas menores que 15 mm LC (fig. 6).
Proporción sexual
Proporción sexual global
Según la prueba de chi-cuadrada, en invierno se observó la mayor predominancia de machos (χ2 = 35.08, g.l. = 1, P < 0.05); es decir, durante este periodo hubo mayor heterogeneidad entre los individuos. Por el contrario, en las estaciones de verano (χ2 = 1.94) y primavera (χ2 = 1.58) no hubieron diferencias significativas (P > 0.05).
Proporción sexual según el grado de latitud y la distancia (millas náuticas) de la costa
En verano, la proporción sexual según el grado de latitud mostró que en gran parte del litoral la proporción fue del 50% tanto para machos como para hembras. Esta homogeneidad podría deberse a la concentración de la población registrada durante este periodo. En invierno se observó mayor heterogeneidad; en este caso, se podría suponer que las hembras fueron menos vulnerables porque estuvieron más dispersas y se hallaron a mayores profundidades. Al trazar una línea de tendencia, se observa que la distribución de las hembras decrece de norte a sur por debajo del 55%. En primavera, la proporción sexual estuvo sesgada a favor de las hembras. Sin embargo, los machos y las hembras no se distribuyeron homogéneamente en el área de estudio, con predominancia alternada de uno u otro sexo (fig. 7).
Se observaron diferencias significativas en la proporción de machos y hembras en determinados intervalos de distancia de la costa (10.1-20 mn: χ2 = 1191, P < 0.05; 20.1-30 mn: χ2= 4.17, P < 0.05; 40.1-50 mn: χ2 = 10.79, P < 0.05; >50.1 mn: χ2 = 26.70, P < 0.05). Al agrupar la variable distancia de la costa en <40 mn (χ2 = 1.54) y >40.1 mn (χ2 = 1.15), no hubo diferencias significativas (P > 0.05), lo que evidenció la equiparidad en la proporción sexual.
Proporción sexual según el intervalo de profundidad
La distribución total de la proporción sexual de P. monodon según los intervalos de profundidad mostró diferencias entre las proporciones de machos y hembras. Para el total de cruceros, fue notoria la superposición entre ambos sexos; sin embargo, las diferencias no fueron marcadas a menores profundidades (P > 0.05). En cambio, entre los 30 y 35 m de profundidad (25.1-30 m: significación = 0.004, P < 0.01; 30.1-35 m: significación = 0.000, P < 0.01) y a mayores profundidades (45.1-50 m: significación = 0.000, P < 0.01; 50.1-55 m: significación = 0.005, P < 0.01) la proporción sexual fue favorable tanto para los machos como para las hembras (fig. 8a).
Por estaciones, en verano este crustáceo se registró a menores profundidades y por lo general no hubieron diferencias significativas (P > 0.05) en la proporción de ambos sexos (fig. 8b). En invierno se observó mayor agregación de machos a menores profundidades (<5 m: significación = 0.011, P < 0.05; 5.1-10 m: significación = 0.000, P < 0.01 y 10.1-15 m: significación = 0.000, P < 0.01) y las hembras tendieron a incrementarse hacia mayores profundidades (fig. 8c). En primavera, la distribución de machos y hembras en la columna de agua fue amplia y fluctuante, y no se observaron tendencias para ningún sexo (significación = 0.209, P > 0.05). Las distribuciones de ambos sexos dentro de los 30 m de profundidad se hallaron en proporciones del 50% para cada sexo; en intervalos de mayor profundidad, las diferencias fueron significativas (fig. 8d).
Proporción sexual según la clase de talla
En general, la proporción sexual en función de las tallas fue fluctuante tanto para machos como hembras; sin embargo, por arriba de los 28 mm LC, los machos tienden a registrar mayores proporciones que las hembras (fig. 9a).
En el crucero de verano (febrero-abril), la estructura por tallas varió marcadamente (entre los 21 y 26 mm LC) en hembras con relación a la de los machos, estos últimos dominaron a partir de los 27 mm LC (fig. 9b). En el crucero de invierno (julio-agosto), la proporción de machos fue mayor porque la amplitud de tallas (12-26 mm LC) fue mayor en comparación con las hembras (fig. 9c). Por el contrario, en el crucero de primavera (octubre-noviembre), la proporción de sexos mostró una estructura fluctuante, pasando a dominar significativamente los machos por arriba de los 28 mm LC (fig. 9d).
La comparación de la proporción hembra/macho por intervalo de talla (<10 mm, 10.1-20 mm, 20.1-30 mm y >30.1 mm LC), para el total de cruceros, fue diferente a lo esperado para el intervalo de 10.1 a >30 mm LC. En verano, la proporción de hembras fue significativamente mayor entre las tallas de 20.1-30 mm LC (P < 0.05, χ2 = 7.966, g.l. = 1) y los machos dominaron a tallas >30 mm LC (P < 0.05, χ2 = 4.500, g.l. = 1); para el resto de los intervalos de talla no hubo diferencias entre ambos sexos (no significativo). En invierno, a menores intervalos de talla, la proporción de machos fue significativamente mayor respecto a la de las hembras, mientras que en primavera, los machos fueron dominantes a tallas >30.1 mm LC; no se observaron diferencias significativas para el resto de los intervalos (tabla 2).
Discusión
Ciclo reproductivo de P. monodon
Los datos recolectados en 2001 permiten inferir, de manera aproximada, el ciclo reproductivo de P. monodon. En este trabajo, esta especie presentó un ciclo reproductivo de larga duración. Se observaron hembras portando huevos externamente. La presencia de hembras ovígeras fue menor en verano (24.3%); sin embargo, desde el invierno (julio-septiembre) hasta la primavera (octubre-diciembre), los porcentajes de hembras ovígeras fueron superiores al 25%. De manera similar, Palma y Arana (1997) documentaron que el periodo principal de portación de huevos era aquel en el que se presentaba un porcentaje igual o superior al 25%. La talla mínima de hembras portando huevos en sus abdómenes fue de 9 mm LC, la máxima fue de 31 mm LC y la frecuencia máxima promedio fue de 20 mm LC. Con base en este ciclo reproductivo esbozado preliminarmente, se podría deducir que este crustáceo tiene un marcado periodo de desove anual. Este comportamiento fue observado también en especímenes registrados frente a la costa de Concepción (Chile), donde se considera que el periodo máximo de portación de huevos ocurre de mayo a octubre (Palma 1994), que corresponden a las estaciones de invierno y primavera. Estudios realizados por Henríquez (1979) indicaron que la época principal de portación de huevos ocurre a mediados de otoño hacia octubre, mientras que Bustos y Retamal (1985) determinaron solo seis meses (abril-septiembre). Rivera y Santander (2005) determinaron, para la zona norte de Chile, que la temporada reproductiva de P. monodon ocurre con mayor incidencia en invierno (agosto). Por el contrario, Gutiérrez y Zúñiga (1977) registraron cuatro periodos de portación para bahía Mejillones: septiembre, diciembre, febrero-mayo y junio-julio, con un mínimo en abril-mayo. Para P. planipes, especie afín del Pacifico Norte (Baja California), se registraron dos etapas en el ciclo reproductivo, con un pico en los primeros tres meses del año (invierno), antes de los meses de máximo transporte costa-afuera, y una actividad reproductiva esporádica en la temporada cálida de julio-agosto (verano) (Boyd 1960, Longuhrst 1968, Gómez-Gutiérrez y Sánchez-Ortiz 1997).
El patrón reproductivo estacional y anual también ha sido observado en varias especies del género Munida (Decápoda: Anomura: Galatheidae), como Munida subrugosa del canal de Beagle (Argentina), cuya actividad reproductiva está centrada en la estación de invierno y asociada a la marcada estacionalidad del ecosistema, donde los picos de producción primaria ("blooms") se presentan durante primavera y verano, seguido por un incremento en la temperatura y radiación solar (Tapella et al. 2002).
Distribución espacial de hembras ovígeras
Durante el desarrollo del presente estudio, la distribución latitudinal de hembras ovígeras mostró que se encontraron en mayor porcentaje a lo largo de la costa peruana en invierno y primavera, pero con mayor incidencia en ésta última estación, principalmente a latitudes más bajas. Su distribución estuvo asociada con áreas costeras, donde los eventos de surgencia fueron más intensos. Por un lado, se observaron concentraciones definidas en invierno, mientras que por el otro, en primavera, hubo mayor frecuencia de hembras ovígeras con huevos en estado de desarrollo 2-4 (de madurez incipiente a madurez total). Una de las características de P. planipes en aguas costeras de Baja California es su asociación a los fenómenos de afloramiento de fitoplancton que ocurren durante las máximas intensidades de surgencias costeras; este fenómeno alcanza su máximo efecto a fines de invierno e inicios de primavera, coincidiendo con el periodo de reproducción y máxima abundancia de esta especie cerca de la costa (Aurioles-Gamboa y Balart 1995). De manera similar, Tapella et al. (2002) observaron que Munida subrugosa presenta una reproducción estacional, con la portación de huevos en invierno y la incubación de larvas desde primavera hasta verano ligadas al primer afloramiento de plancton. Arana y Culquichicón (1990), establecieron una relación directa entre los estratos de profundidad y la proporción de hembras ovígeras para P. monodon: a inicios de la portación de huevos, estos ejemplares se encuentran a mayores profundidades (225-324 m), pero a medida que avanza el grado de desarrollo de los huevos, tienden a migrar hacia aguas más someras (75-224 m) a liberar las larvas eclosionadas y luego retornar a mayores profundidades. En este estudio, el afloramiento en el litoral peruano durante la primavera de 2001 fue amplio e intenso, y las interacciones de las Aguas Templadas Sub-antárticas con las Aguas Subtropicales Superficiales y las Aguas Costeras Frías fueron características (Gutiérrez et al. 2004), lo que permitió que este pequeño crustáceo intensifique su periodo reproductivo y sea más disperso en la columna de agua.
Proporción sexual
Los resultados de este trabajo con relación a la proporción sexual de P. monodon mostraron que en invierno ésta estuvo sesgada a favor de los machos (1:0.74), es decir, diferente de la proporción teórica esperada (1:1) de acuerdo con la teoría de equilibrio de Fischer (1930). Por el contrario, en los cruceros de verano y primavera, la proporción sexual fue cercana a uno (1:0.96). El marcado sesgo en la proporción sexual durante invierno (P < 0.05; χ2 = 35.08; g.l = 1) puede deberse a la dispersión poblacional de P. monodon, principalmente las hembras portadoras de huevos, debido a las condiciones propias de la estación. Por otro lado, en los periodos cálidos (primavera y verano), la proporción macho/hembra fue homogénea; esto puede deberse al desplazamiento de la población hacia áreas más someras en busca de condiciones favorables para el rápido desarrollo y eclosión de los huevos. Estos desplazamientos también han sido observados en varias especies de crustáceos decápodos (Gallardo et al. 1992, Rodríguez y Bahamonde 1986), así como también su estrecha relación hacia zonas de mayor temperatura con la finalidad de acelerar el proceso embrionario de los huevos portados (Palma 1994, Rivera y Santander 2005). Según los intervalos de profundidad, se ha observado, de manera global (total cruceros), que la proporción sexual no fue marcada en zonas de menor profundidad (fig. 8). En cambio, a mayores profundidades, la proporción de hembras fue mayor con relación a los machos.
En primavera fue característica la amplia distribución de ambos sexos en la columna de agua; por el contrario, en las estaciones de verano e invierno, la distribución de P. monodon se halló con mayor frecuencia a menores profundidades. En primavera, la proporción macho/hembra fue similar, pero en invierno fue favorable para los machos; sin embargo a mayores profundidades, se observó el incremento de las hembras. Esto se puede interpretar como una dispersión de la población en la temporada reproductiva, cuando los enjambres muestran cierto grado de segregación sexual (Serrano-Padilla y Aurioles-Gamboa 1992).
Proporción sexual según la talla
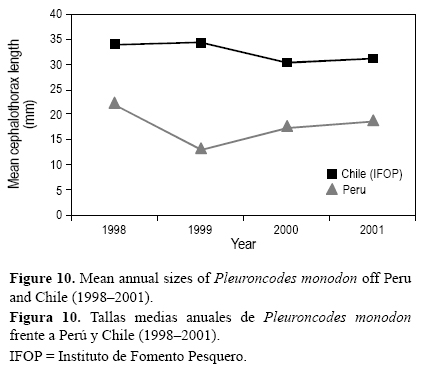
De acuerdo con los resultados obtenidos y respecto a las hembras, los machos dominaron en clases de tallas mayores (>28 mm LC); a menores tallas (<12 mm LC) y tallas intermedias (21-27 mm LC) sus porcentajes decrecieron. De manera similar, en Chile, Arana y Culquichicón (1990) determinaron, en función de las diferentes tendencias encontradas para cada periodo evaluado (agosto 1988, enero 1989 y junio 1989), que a mayores (24-39 mm LC) y menores (12-16 mm LC) intervalos de tallas el porcentaje de machos de P. monodon incrementó, pero entre los 16 y 24 mm LC, el porcentaje de machos decreció. Cabe destacar que la estructura poblacional en muestras obtenidas frente a Perú durante las evaluaciones acústicas de recursos pelágicos con redes de arrastre pelágicas es de tallas menores, por lo general la talla media no sobrepasó los 30 mm LC (Franco 2003), a diferencia de los ejemplares obtenidos en Chile mediante arrastres de fondo (por considerarse una especie de hábitos bentónicos), que se caracterizaron por presentar tallas mayores a los 30 mm LC (fig. 10).
Conclusiones
1. La distribución de tallas del camaroncito rojo Pleuroncodes monodon mostró que los individuos analizados presentaron tallas medias menores que 20 mm LC. Las diferencias entre machos y hembras no fueron tan marcadas. La talla máxima registrada fue de 35 mm LC (ejemplar macho).
2. La temporada reproductiva de Pleuroncodes monodon en 2001 ocurrió en invierno y primavera, pero el incremento de hembras con huevos en estado 4 (embriones totalmente desarrollados) se dio en primavera (la estación calida).
3. La distribución espacial de hembras ovígeras mostró tres importantes focos de concentración en invierno: uno entre 06° y 09° S, otro en 16° S y el tercero en 11° S. En primavera abarcó un mayor intervalo (05°30'-12° S) en la zona norte-centro del litoral y uno pequeño en la zona sur (17°-18° S).
4. Espacialmente, la proporción de sexos indica la marcada diferencia entre machos y hembras. En invierno, la presencia de hembras fue decreciendo de norte a sur. Según la distancia de la costa, no se observaron diferencias significativas entre ambos sexos dentro y fuera de las 40 millas.
5. La proporción sexual no fue marcada en zonas de menor profundidad, mientras que se observó lo contrario a mayores profundidades (i.e., las hembras fueron más numerosas en comparación con los machos).
6. Los machos predominaron en una mayor amplitud de tallas respecto a las hembras durante el invierno y la primavera. La proporción sexual según las tallas fue similar, excepto en tallas mayores que 28 mm LC.
Agradecimientos
Se agradece a G Cárdenas Quintana (Instituto del Mar del Perú, IMARPE) por sus invalorables aportes, así como también a R Guevara-Carrasco y J Arguelles Torres (IMARPE) por sus comentarios constructivos sobre este manuscrito.
Referencias
Arana P, Pizarro F. 1970. Análisis de los parámetros biométricos de los langostinos amarillo (Cervimunida johni) y zanahoria (Pleuroncodes monodon) de la costa de Valparaíso. Invest. Mar. 1: 285-316. [ Links ]
Arana P, Culquichón Z. 1990. Estructura poblacional del langostino colorado (Pleuroncodes monodon) en la zona centro-sur de Chile. Estudios y documentos, Universidad Católica Valparaíso 7/90, 56 pp. [ Links ]
Aurioles-Gamboa D, Balart E. 1995. La langostilla: Biología, ecología y aprovechamiento. Centro de Investigaciones Biológicas del Noreste, México, 233 pp. [ Links ]
Boyd C. 1960. The larval stages of Pleuroncodes planipes. Biol. Bull. Mar. Biol. Lab. Woods Hole 118:17-30. [ Links ]
Boyd C, Johnson M. 1963. Variations in the larval stages of a decapod crustacean, Pleuroncodes planipes Stimpson (Galatheidae). Biol. Bull. Mar. Biol. Lab. Woods Hole 124: 141-152. [ Links ]
Bustos H, Retamal M. 1985. Estudio biológico pesquero del "Langostino colorado" Pleuroncodes monodon H. Milne Edwards, 1837. Gayana Zool. 49: 1-95. [ Links ]
Chirichigno N. 1970. Lista de crustáceos del Perú (Decapoda y Stomatopoda) con datos de su distribución geográfica. Inf. Inst. Mar Perú 35: 1-95, 193 figs. [ Links ]
Díaz J. 2006. Langostilla del Océano Pacifico. In: Sustentabilidad y Pesca Responsable en México. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SARGAP), Instituto Nacional de Pesca, México, 560 pp. [ Links ]
Fagetti E, Campodonico I. 1971. Larval development of the red crab Pleuroncodes monodon (Decapoda, Anomura, Galatheidae) under laboratory conditions. Mar. Biol. 8: 70-81. [ Links ]
Fischer R. 1930. The Genetic Theory of Natural Selection. Clarendon Press, Oxford (http://www.archive.org/stream/geneticaltheoryo031631mbp#page/n11/mode/2up] [ Links ].
Franco M. 2003. Aspectos biológicos y pesqueros del camaroncito rojo Pleuroncodes monodon (M Edwards, 1873) en el litoral peruano. BEng thesis. Universidad Nacional del Callao. 184 pp. [ Links ]
Gallardo VA, Enríquez S, Roa R, Acuña A, Cañete I, Baltazar M. 1992. Biología del langostino colorado Pleuroncodes monodon H. Milne Edwards, 1837 y especies afines (Crustacea, Decapoda, Anomura, Galatheidae): Sinopsis. Faranda F, Oscar Parra O (eds.), Proyecto EULA, Universidad de Concepción-Chile, 113 pp. [ Links ]
Giraldo R, Rodríguez D. 1997. Métodos estadísticos aplicados a la investigación biológica. Revista de Divulgación Científica y Tecnológica N° RA-16, Actividad: Evaluación de Recursos Pesqueros. Manual del curso de capacitación efectuado en Santa Marta, Colombia, del 8 al 13 de mayo de 1995, 57 pp. [ Links ]
Gómez-Gutiérrez J, Sánchez-Ortiz O. 1997. Larval drift and population structure of the pelagic phase of Pleuroncodes planipes (Simpson) (Crustacea: Galatheidae) off the southwest coast of Baja California, Mexico. Bull. Mar. Sci. 61: 305-326. [ Links ]
Gutiérrez J, Zúñiga O. 1977. Pleuroncodes monodon H. Milne Edwards, en la bahía de Mejillones del Sur, Chile. Rev. Biol. Mar. Dept. Oceanol. Univ. Chile 16: 161-169. [ Links ]
Gutiérrez M, Ramiro Castillo P, Ganoza F, Herrera N, Peraltilla S, Aliaga A. 2004. Análisis de la distribución y abundancia de algunos recursos pelágicos peruanos acústicamente evaluados en la primavera de 2001. Inf. Inst. Mar Perú 32: 167-179. [ Links ]
Hendrickx ME, Harvey AW. 1999. Checklist of anomuran crabs (Crustacea: Decapoda) from the Eastern Tropical Pacific. Belg. J. Zool. 129: 363-389. [ Links ]
Henríquez G. 1979. Langostino colorado Pleuroncodes monodon (Crustacea, Decapoda, Anomura, Galatheidae). En: Estado Actual de las Principales Pesquerías Nacionales. Bases para un desarrollo pesquero. Corporación de Fomento de la Producción, Gerencia de Desarrollo, AP 79-18, 52 pp. [ Links ]
IFOP. 2003. Evaluación directa de langostino colorado y langostino amarillo entre la II y VIII regiones. Fondo de Investigación Pesquera FIP N° 2002-06. 217 pp. [ Links ]
IFOP. 2006. Dinámica y estructura poblacional del langostino colorado entre la III y IV regiones. Fondo de Investigación Pesquera FIP N° 2005-41. 340 pp. [ Links ]
Longhurst A. 1968. The pelagic phase of Pleuroncodes planipes Stimpson (Crustacea, Galatheidae) in the California Current Rep. Calif. Coop. Ocean. Fish. Invest. 11: 142-154. [ Links ]
Longhurst AR, Seibert DLR. 1971. Breeding in an oceanic population of Pleuroncodes planipes (Crustacea, Galatheidae). Pac. Sci. 25: 426-428. [ Links ]
Palma S. 1994. Distribución y abundancia de larvas de langostino colorado Pleuroncodes monodon frente a la costa de Concepción, Chile. Invest. Mar. 22: 13-29. [ Links ]
Palma S, Arana P. 1997. Aspectos reproductivos del langostino colorado (Pleuroncodes monodon H. Milne Edwards, 1837) frente a la costa de Concepción, Chile. Invest. Mar. 25: 203-221. [ Links ]
Pérez B, Calcagno J. 2005. Comportamiento de apareamiento de las langostillas Munida gregaria y Munida subrugosa. XXV Congreso de Ciencias del Mar y XI Congreso Latinoamericano de Ciencias del Mar. Viña del Mar (Chile), 16-20 Mayo 2005. [ Links ]
Rivera J, Santander E. 2005. Variabilidad estacional de la distribución y abundancia de larvas de langostino colorado en la zona norte de Chile (Decapoda, Anomura, Galatheidae). Invest. Mar. 33: 3-23. [ Links ]
Rodríguez L, Bahamonde R. 1986. Contribución al conocimiento de Munida subrugosa (White 1847) de la XII Región, Chile. In: Arana P (ed.), La Pesca en Chile. Escuela de Ciencias del Mar, Universidad Católica de Valparaíso, pp. 283-296. [ Links ]
Serrano-Padilla V, Aurioles-Gamboa D. 1992. Dimorfismo sexual en la langostilla Pleuroncodes planipes 1860 (Crustacea: Decapoda: Galatheidae). Centro de Investigaciones Biológicas, Departamento de Recursos Marinos La Paz, Baja California Sur, México. Proceedings of the San Diego Society of Natural History (13), 5 pp. [ Links ]
Serrano-Padilla V, Aurioles-Gamboa D. 1995. Ecología reproductiva de la langostilla. In: Aurioles-Gamboa D, Balart E (eds.), La Langostilla: Biología, Ecología y Aprovechamiento. Pub. Esp. Centro de Investigaciones Biológicas del Noroeste, México, pp. 109-123. [ Links ]
Tapella F, Lovrich G, Romero C, Thatje S. 2002. Reproductive biology of the crab Munida subrugosa (Decapoda: Anomura: Galatheidae) in the Beagle Channel, Argentina. J. Mar. Biol. Assoc. UK 82: 589-595. [ Links ]














