Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.37 no.4a Ensenada dic. 2011
Efecto del suministro de cuatro densidades de copépodos (Acartia sp. y Calanus pacificus) en la respuesta productiva de Litopenaeus vannamei preengordado intensivamente a nivel microcosmos*
Effect of supplying four copepod densities (Acartia sp. and Calanus pacificus) on the productive response of Litopenaeus vannamei pregrown intensively at microcosm level
LR Martínez–Córdova1*, A Campaña–Torres2, M Martínez–Porchas3
1 Departamento de Investigaciones Científicas y Tecnológicas de la Universidad de Sonora, Luis Donaldo Colosio s/n, Hermosillo 83000, Sonora, México.
2 Centro de Investigaciones Biológicas del Noroeste, Mar Bermejo #195, colonia Playa Palo de Santa Rita, La Paz 23090, Baja California Sur, México.
3 Centro de Investigación en Alimentación y Desarrollo, AC, Carretera a La Victoria Km 0.6, Hermosillo 83304, Sonora, México.
*Autor para correspondencia:
E–mail: lmtz@guaymas.uson.mx
Received September 2010;
accepted May 2011.
RESUMEN
Se realizó un experimento durante siete semanas para evaluar el efecto del suministro de copépodos (Acartia sp. y Calanus pacificus), como alimento exógeno durante la preengorda intensiva de camarón blanco (Litopenaeus vannamei), en los parámetros de producción y la calidad del agua. Se probaron cinco tratamientos en los que el camarón fue alimentado con dieta formulada más la adición de 0 (control), 1, 2, 4 u 8 copépodos mL–1. En los tratamientos con 1 y 4 copépodos mL–1 se observaron niveles de nitrógeno amoniacal total superiores al resto de los tratamientos (>4 mg L–1). El nivel de nitritos fue significativamente más alto en el tratamiento con 8 copépodos mL–1, mientras que el de nitratos fue más elevado en todos los tratamientos en comparación con el control. La concentración de fosfatos fue superior en los tratamientos con 4 y 8 copépodos mL–1. Los camarones en los tratamientos con 2, 4 y 8 copépodos mL–1 presentaron mayor supervivencia (>93%), peso (>3.1 g) y biomasa final (>77 g). El tratamiento con 2 copépodos mL–1 presentó el mejor factor de conversión alimenticia (1.19) en comparación con el resto (>1.7). Los resultados sugieren que la adición de copépodos como alimento natural exógeno durante la preengorda intensiva del camarón puede tener un efecto negativo sobre la calidad del agua, aunque esto no afectó la supervivencia; sin embargo, el efecto en los parámetros de producción fue positivo y se considera viable el uso de copépodos como alimento vivo para la etapa de preengorda en el cultivo de camarón blanco.
Palabras clave: alimento natural, calidad de agua, crecimiento, producción intensiva, zooplancton.
ABSTRACT
A seven–week experiment was performed to evaluate the effect of supplying copepods (Acartia sp. and Calanus pacificus), as exogenous feed during the intensive pre–growout phase of white shrimp (Litopenaeus vannamei), on the productive parameters and water quality. Five treatments were tested in which shrimp were fed formulated feed and the addition of 0 (control), 1, 2, 4, or 8 copepods mL–1. Treatments with 1 and 4 copepods mL–1 had higher ammonia nitrogen levels than the rest of the treatments (>4 mg L–1). Nitrite levels were significantly higher in the treatment with 8 copepods mL–1, whereas nitrate levels were higher in all treatments relative to the control. Phosphate concentration was higher in the treatments with 4 and 8 copepods mL–1. Shrimp from the treatments with 2, 4, and 8 copepods mL–1 showed a higher survival (>93%), weight (>3.1 g), and final biomass (>77 g). The treatment with 2 copepods mL–1 had the best feed conversion ratio (1.19) compared with the rest (>1.7). The results suggest that the additional supply of copepods as exogenous feed during the intensive pre–growout phase of shrimp culture can have a negative effect on the water quality, although survival was not affected; however, the effect on the production parameters was positive, indicating that the use of copepods as exogenous live feed is feasible in the culture of white shrimp.
Key words: natural feed, water quality, growth, intensive production, zooplankton.
INTRODUCCIÓN
El crecimiento notable de la actividad camaronícola en el mundo, con producciones superiores a los cuatro millones de toneladas a nivel mundial y más de 130,000 t en México (Juárez 2008, FAO 2009), ha tenido un impacto significativo en la economía de las naciones que la practican, especialmente en la creación de empleos y generación de divisas. Es muy importante que este crecimiento se mantenga constante, pero de manera sustentable; es decir, ambientalmente amigable sin dejar de ser redituable. Existen diversas acciones que se puede tomar para colaborar en este importante propósito. Una de ellas es la reducción en la utilización de alimentos formulados, sobre todo de aquellos que usan harina de pescado y de otros organismos acuáticos como su ingrediente principal, ya que no solamente son costosos, sino que además implican un impacto negativo en las pesquerías de donde se obtienen (Naylor et al. 2000). Por otra parte, estos alimentos son contaminantes tanto de los mismos sistemas de producción acuícola como de los ecosistemas receptores de las descargas (Martínez–Córdova et al. 2009). El uso de alimento natural se ha sugerido como una de las estrategias más viables para reducir el suministro de alimento formulado (Campaña–Torres et al. 2009, Ballester et al. 2010, Porchas–Cornejo et al. 2010). Se ha demostrado que este tipo de alimento puede contribuir con una adecuada cantidad denutrimentos para los organismos cultivados (Bombeo–Tuburan et al. 1993, Khatoon et al. 2009). El alimento natural puede ser tanto endógeno, aquél que se promueve y produce dentro de los mismos sistemas de cultivo (Cardozo et al. 2008; Martínez–Córdova 2009), como exógeno, aquél que se captura o cultiva fuera de los sistemas y se incorpora posteriormente a los mismos. El uso de alimento natural exógeno se ha implementado desde hace tiempo, aunque se usa principalmente en el cultivo larvario y, ocasionalmente, en la maternización de diversos organismos acuícolas; raramente se ha utilizado en la preengorda y menos aún en la engorda. Entre los organismos utilizados como alimento natural se encuentran los copépodos (Rippingale y Payne 2005, Farhadian et al. 2009), los rotíferos (Campaña–Torres et al. 2009), los cladóceros (Wiwattanapatapee et al. 2002, Martin et al. 2006), y las artemias (Faleiro y Narciso 2009, Campaña–Torres et al. 2010, González et al. 2010), entre otros.
Los copépodos son probablemente los organismos zooplanctónicos más comunes y abundantes en estanques de cultivo de camarón y, por lo tanto, fácil de conseguir. Además, forman parte importante de la dieta de camarones peneidos (Martínez–Córdova y Peña–Messina 2005). Su valor nutricional ha sido documentado por varios investigadores como Watanabe et al. (1983) y Tho et al. (2011). Farhadian et al. (2009) encontraron que el copépodo Apocyclops dengizicus puede ser una fuente de lípidos y proteína para organismos cultivados, ya que contienen niveles de proteína entre 39% y 42%, y de lípidos entre 16% y 19%, según la microalga con que son alimentados.
Por lo anterior, los copépodos son, además de la Artemia, uno de los organismos más utilizados ampliamente como alimento vivo en el cultivo larvario de peces y crustáceos. Rippingale y Payne (2005) demostraron la conveniencia del uso de Gladioferens imparipes para el cultivo intensivo de larvas de peces. Shields et al. (1999) encontraron que Eurytemora velox tiene un valor nutricional mejor que la Artemia para el cultivo larvario del pez plano Hippoglossus hippoglossus. Chesney (2005) hizo una revisión importante sobre los copépodos como presas vivas y los factores que influencian su éxito como alimento para larvas de peces. Sin embargo, a pesar del éxito que ha tenido el uso de copépodos en la acuicultura, su uso en maternización, preengorda y engorda es limitado, particularmente en el cultivo de crustáceos.
El objetivo del presente estudio fue evaluar el efecto del suministro de diferentes concentraciones de copépodos (Acartia sp. y Calanus pacificus) en la respuesta productiva del camarón blanco del Pacífico, Litopenaeus vannamei (Boone 1931) durante su preengorda intensiva a nivel microcosmos, así como en la calidad del agua del sistema.
MATERIALES Y MÉTODOS
El estudio se llevó a cabo durante siete semanas en la Unidad Experimental Kino del Departamento de Investigaciones Científicas y Tecnológicas de la Universidad de Sonora, ubicado en Bahía Kino (Sonora, México).
La cepa de Acartia sp. fue obtenida de las instalaciones de acuicultura de la Universidad Autónoma de Jalisco (Jalisco, México). La cepa de C. pacificus fue aislada de los estanques de cultivo de camarón de la Universidad de Sonora en Bahía Kino. El mantenimiento de la cepa y el cultivo de copépodos se llevaron acabo según la metodología descrita para rotíferos por Fukusho (l989) y Fengqi (2003). Los copépodos se mantuvieron en matraces Erlenmeyer de 2 L a una temperatura de 26 ± 1 °C y se alimentaron con las microalgas Nannochloropsis oculata y Chaetoceros muellerii. Posteriormente, los cultivos se escalaron en instalaciones bajo techo con garrafones de polietileno teraftalato de 19 L. y, finalmente, se transfirieron a columnas de fibra de vidrio de 80 L con el objetivo de garantizar la producción requerida en el experimento. Las cosechas de copépodos se realizaron una vez que los organismos alcanzaron una concentración superior a 300 organismos mL–1, con un tamiz de 60 µm. Las postlarvas L. vannamei se obtuvieron de un laboratorio comercial (Maricultura del Pacífico SA), y se criaron en el laboratorio hasta alcanzar la talla deseada.
La inclusión de los copépodos en la fase de preengorda de camarón se evaluó a nivel microcosmos en tinas de plástico de 40 L con un volumen operacional de 30 L. Se diseñó un experimento simple con un arreglo completamente al azar y tres réplicas por cada tratamiento. Los tratamientos consistieron en cinco niveles de inclusión diaria (09:00 h) de los copépodos Acartia sp y Calanus pacificus en proporción 1:1. Los niveles de inclusión fueron: 0 (control), 1, 2, 4 y 8 copépodos mL–1. En cada unidad experimental se colocaron 25 juveniles de L. vannamei con un peso de 0.1 ± 0.02 g (0.83 individuos L–1). Además, a los camarones se les suministró alimento comercial con 35% de proteína cruda (Camaronina de Purina, México) en dos raciones diarias (09:00 y 20:00 h), que en total correspondieron al 5% de su biomasa.
En las unidades experimentales se mantuvieron niveles de oxígeno disuelto superiores a 5 mg L–1, mediante un soplador de 1 HP, y temperaturas en alrededor de 27 ± 1 °C mediante calentadores de ambiente de 150 W. No se realizó recambio de agua a lo largo del experimento, aunque la pérdida de agua por evaporación fue compensada por la adición de agua dulce previamente aireada y declorinada. Las variables fisicoquímicas como temperatura, oxígeno disuelto, pH y salinidad se registraron diariamente (11:00 h) con una sonda multi parámetros YSI 6600 (YSI Inc., Yellowspring, Ohio). Las concentraciones de nutrientes en el agua tales como nitrógeno amoniacal total (NAT), nitritos, nitratos y fosfatos se registraron semanalmente con un espectrofotómetro programable Hach DR 4000 y su respectivo kit de reactivos (Hach Co. Loveland, Colorado).
Cada semana se contaron y se pesaron en una balanza digital los camarones de cada unidad experimental. Se calculó la biomasa de cada unidad y, con base en ello, la ración de la siguiente semana. Al final del experimento se obtuvo el peso, la supervivencia y la biomasa de cada organismo; también se calculó el factor de conversión alimenticia (FCA) dividiendo el alimento total proporcionado (incluyendo el alimento formulado y los copépodos en base seca) entre la biomasa final de camarones.
Los datos de la calidad del agua fueron analizados por medio de un análisis de varianza de medidas repetidas con el software estadístico NCSS 2007. Los datos finales de los parámetros de producción se analizaron mediante un análisis de varianza de una sola vía (Zar 1996). Se utilizó una prueba de Tukey para la comparación de medias entre tratamientos. La supervivencia se evaluó con una prueba de chi cuadrada. Para los análisis estadísticos se consideró un nivel de confianza de α = 0.05.
RESULTADOS
No se encontraron diferencias estadísticas entre tratamientos para los parámetros de temperatura (25.8–28.1 °C), salinidad (35–37.1), oxígeno disuelto (5.4–7.7 mg L–1) y pH (8.2–8.8).
Respecto a la calidad del agua, se registraron diferencias en algunos parámetros (tabla 1); todos los tratamientos incrementaron con el paso del tiempo (Ptiempo < 0.05, fig. 1). La concentración de NAT fue mayor en los tratamientos con 1 y 4 copépodos mL–1, mientras que los valores más bajos se registraron en los tratamientos con 2 y 8 copépodos mL–1. La concentración de nitritos fue más alta en el tratamiento de 8 copépodos mL–1 (>0.37 mg L–1) en comparación con la registrada en el resto de los tratamientos (<0.24 mg L–1). La concentración de nitratos fue la más alta en los tratamientos con 1 y 8 copépodos mL–1, seguidas del tratamiento con 2 copépodos mL–1; los valores más bajos se encontraron en los tratamientos con 0 y 4 copépodos mL–1. Las concentraciones más altas de fosfatos se registraron en los tratamientos con 4 y 8 copépodos mL–1.

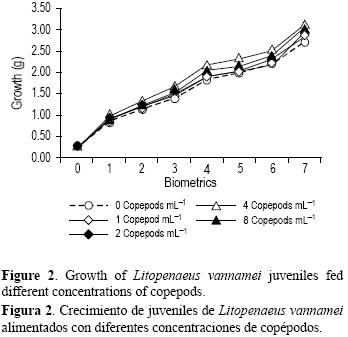
Con relación a la respuesta productiva, se observaron diferencias significativas entre los tratamientos (tabla 2). El crecimiento semanal presentó una relación directa con la concentración de copépodos suministrados (fig. 2). La peso final fue significativamente mayor en los tratamientos con 4 y 8 copépodos mL–1 que en el control; sin embargo, no hubo diferencia respecto a los tratamientos con 1 y 2 copépodos mL–1. En comparación con el control, los tratamientos de 4 y 8 copépodos mL–1 presentaron un peso 12% y 13% superior. La biomasa final fue significativamente mayor en el tratamiento con 8 copépodos mL–1 en comparación con el control, mientras que no se registraron diferencias entre este tratamiento y aquellos con 1, 2 y 4 copépodos mL–1. La supervivencia fue superior al 90% en todos los tratamientos en donde se suministraron copépodos. La supervivencia en los tratamientos con 2 y 8 copépodos mL–1 fue superior a la registrada en el control, y no se registraron diferencias de estos dos tratamientos con respecto a los tratamientos de 1 y 4 copépodos mL–1. El tratamiento con 2 copépodos mL–1 presentó un FCA estadísticamente menor que todos los demás tratamientos.
DISCUSIÓN
Durante el experimento, la temperatura, la salinidad, y el oxígeno disuelto se mantuvieron dentro de los intervalos recomendados o al menos aceptables para la especie (Martínez–Córdova 2009), y no se encontraron diferencias estadísticas entre los tratamientos. Sin embargo, algunos parámetros de la calidad del agua se vieron afectados por la inclusión de copépodos en la dieta de los juvelines. En el caso del NAT, no se observó un patrón definido debido a que los valores más altos se registraron en los tratamientos con 1 y 4 copépodos y los más bajos en aquéllos con 2 y 8organismos.
Los niveles de NAT estuvieron, en algunos casos, por encima de los niveles observados comúnmente en granjas comerciales. Estos niveles altos podrían deberse a que el experimento se realizó con un sistema sin recambio de agua y algunos de los metabolitos pudieron haberse acumulado en el transcurso del mismo. Las concentraciones de NAT fueron superiores a las recomendadas para el cultivo de peneidos (Chen et al. 1990). Alcaraz et al. (2007) documentaron que los camarones expuestos a niveles superiores a 0.7 mg L–1 de NH3 tuvieron daños severos en las branquias, lo que afectó su tasa respiratoria, y que esta concentración fue letal cuando se presentaron bajos niveles de oxígeno disuelto. Sin embargo, Chen y Lin (1992) y Tsai y Chen (2002) documentaron valores peligrosos de NAT, mucho más elevados para postlarvas de Penaeus monodon a diferentes salinidades. Li et al. (2007) encontraron que la concentración letal (LC50) de NAT para L. vannamei fue de 9.33 mg L–1 a 96 h. Es necesario tomar en consideración que de acuerdo con los valores máximos de pH (8.8) y temperatura (28 °C) registrados durante el presente estudio, alrededor del 70% de este NAT estuvo en la forma no ionizada NH4+, que es menos tóxica para el camarón. En virtud de lo anterior, no se observó un efecto negativo en la supervivencia de los organismos. Las concentraciones de nitratos y nitritos se mantuvieron muy por debajo de los límites de seguridad recomendados para camarones y otros crustáceos (Gross et al. 2004, Alcaraz et al. 2007, Seneriches–Abiera et al. 2007), aunque para el tratamiento con mayor número de copépodos se observó una mayor tasa de incremento con respecto al tiempo, lo cual podría llegar a ser un factor negativo para el crecimiento del camarón.
Los niveles de fosfatos también tuvieron una relación directa con la concentración de copépodos suministrados, observándose valores mayores en los tratamientos con 4 y 8 copépodos mL–1. Estos valores fueron más altos que los registrados comúnmente para estanques camaronícolas (de la Lanza y Hernández 1998). Existe escasa información en la literatura respecto al efecto de los fosfatos en camarones cultivados. Ritvo (1999) encontró un efecto negativo del contenido alto de fósforo en el sedimento sobre la supervivencia de L. vannamei; no obstante, las concentraciones que encontró (183 mg L–1) son mucho más altas que las encontradas en el presente estudio, donde no se observaron efectos negativos en la supervivencia de los juveniles. Méndez et al. (2004) encontraron que el crecimiento de postlarvas de camarón (L. stylirostris) era mayor cuando eran cultivadas en estanques con altos niveles de fósforo en el sedimento.
La respuesta productiva del camarón se vio favorecida por la inclusión de copépodos en la dieta, ya que la mayoría de los parámetros fueron mejores en aquellos tratamientos con mayor nivel de inclusión, en comparación con el control. Sun y Fleeger (1995) demostraron que el copépodo harpacticoideo Amphiascoides atopus es una fuente importante de alimento vivo en la nutrición de peces y crustáceos, y argumentan que estos organismos son útiles no solamente en el cultivo larvario, sino en etapas posteriores (e.g., la preen–gorda), tal como en este experimento.
En el presente estudio, el crecimiento presentó una relación directa con el número de copépodos suministrados, aunque las diferencias significativas sólo se manifestaron entre el tratamiento con 8 copépodos mL–1 y el control. El crecimiento obtenido en el tratamiento con el mayor número de copépodos suministrados puede considerarse como aceptable para propósitos comerciales, sobre todo si se toma en cuenta que la preengorda se llevó a cabo en nivel intensivo (Martínez–Córdova 2009). La supervivencia y el FCA fueron tan buenos como las que se reportan en cultivos intensivos experimentales (Reid y Arnold 1992), aunque para el tratamiento de 2 copépodos mL–1 la respuesta de ambos parámetros fue mejor. Una supervivencia mayor que 90% en todos los tratamientos en que se suministraron copépodos es excelente, sobre todo si se considera que se trató de un sistema intensivo y que, en la etapa de preengorda, muchas veces es más importante la supervivencia que el crecimiento y la biomasa, ya que se intenta tener la mayor cantidad de organismos listos para la engorda. Durante esta última etapa, los organismos pueden tener un crecimiento compensatorio,como se ha demostrado en algunos estudios (Stumpf et al. 2010). El FCA en el tratamiento con 2 copépodos mL–1 fue 39% inferior al obtenido en el control, lo que implica la posibilidad de un gran ahorro en alimento formulado; sin embargo, esto debe ser evaluado mediante un estudio económico.
Los resultados del presente estudio son similares a los encontrados en otros que utilizaron ya sea copépodos (Amaya–Jacho 1991) u otros organismos vivos para alimentar postlarvas o juveniles de camarón. Campaña–Torres et al. (2009, 2010) encontraron un efecto positivo en la respuesta de juveniles de L. vannamei alimentados con diferentes concentraciones del rotífero Brachionus rotundiformis o de la artemia Artemia franciscana. Brito et al. (2000) observaron que las postlarvas de L. vannamei alimentadas con una mezcla de alimento formulado, nauplios de Artemia y microalgas, tuvieron una mejor respuesta productiva en comparación con las postlarvas alimentadas con uno solo de estos alimentos. Stottrup (2000) encontró que el uso de copépodos como alimento vivo es benéfico en el cultivo de organismos acuáticos, y que las especies del género Acartia y Calanus pueden ser cultivados de manera intensiva para ser usadas como alimento vivo. Esto también sugiere que los copépodos forman parte importante de la dieta de L. vannamei en el medio natural, al menos en sus etapas de postlarva y juvenil.
Como conclusión, se puede establecer que es viable la utilización de copépodos como alimento natural exógeno durante la preengorda intensiva del camarón blanco, sin que haya un efecto muy significativo en la calidad del agua, pero sí un efecto positivo en los parámetros de producción. No obstante, es necesario buscar estrategias para disminuir la concentración de NAT ante un incremento eventual. Para un sistema sin recambio de agua, se sugiere la inducción de comunidades bióticas que promuevan la recirculación de nutrientes.
REFERENCES
Alcaraz G, Espinoza V, Venegas C, Chiappa–Carrara X. 2007. Acute effect of ammonia and nitrite on respiration of Penaeus setiferus larvae under different oxygen levels. J.World Aquacult. Soc. 30: 98–100. [ Links ]
Amaya–Jacho NF. 1991. Alimentación de larvas de camarón con copépodos cosechados en piscinas. MSc dissertation, Escuela Superior del Litorial, Guayaquil, Ecuador, 77 pp. [ Links ]
Ballester ELC, Abreu PC, Cavalli RO, Emerenciano MAL, Wasielesky W. 2010. Effect of practical diets with different protein levels on the performance of Farfantepenaeus paulensis juveniles nursed in zero water exchange suspended microbial flocs intensive system. Aquacult. Nutr. 16: 163–172. [ Links ]
Bombeo–Tuburan I, Guanzon NG, Schroeder GL. 1993. Production of Penaeus monodon (Fabricius) using four natural food types in an extensive system. Aquaculture 112: 57–65. [ Links ]
Brito R, Chimal ME, Gaxiola G, Rosas C. 2000. Growth, metabolic rate, and digestive enzyme activity in the white shrimp Litopenaeus setiferus early postlarvae fed different diets. J. Exp. Mar. Biol. Ecol. 255: 21–36. [ Links ]
Campaña–Torres A, Martínez–Córdova LR, Villarreal–Colmenares H, Hernández–López J, Ezquerra–Brauer JM, Cortés–Jacinto E. 2009. Efecto de la adición del rotífero Brachionus rotundiformis (Tschugunoff 1921) sobre la calidad del agua y la producción, en cultivos superintensivos de camarón blanco del Pacífico Litopenaeus vannamei (Boone 1931). Rev. Biol. Mar. Oceanogr. 44: 335–342. [ Links ]
Campaña–Torres A, Martínez–Córdova LR, Villarreal–Colmenares H, Cortés–Jacinto E. 2010. Evaluation of different concentrations of adult live Artemia (Artemia franciscana, Kellogs 1906) as natural exogenous feed on the water quality and production parameters of Litopenaeus vannamei (Boone 1931) intensively pregrown. Aquacult. Res. 42: 40–16. [ Links ]
Cardozo AP, Bersano JGF, Amaral WJA. 2008. Composition, density and biomass of zooplankton in culture ponds of Litopenaeus vannamei (Decapoda: Penaeidae) in southern Brazil. Braz. J. Aquat. Sci. Technol. 11: 13–20. [ Links ]
Chen JC, Lin CY. 1992. Lethal effects of ammonia on Penaeus chinensis Osbeck juveniles at different salinity levels. J. Exp. Mar. Biol. Ecol. 156: 139–148. [ Links ]
Chen JC, Liu PC, Lei SC. 1990. Toxicity of ammonia and nitrite to Penaeus monodon adolescents. Aquaculture 89: 127–137. [ Links ]
Chesney EJ. 2005. Copepods as live prey: A review of factors that influence the feeding success of marine fish larvae. In: Lee CS, O'Bryen PJ, Marcus NH (eds.), Copepods in Aquaculture. Blackwell Publishing, Ames, Iowa, pp. 133–150. [ Links ]
De La Lanza EG, Hernández PS. 1998. Nutrientes y productividad primaria en estanques acuícolas. In: Martínez CL, Ecología de los Sistemas Acuícolas. AGT Editor, México, pp. 27–66. [ Links ]
Faleiro F, Narciso L. 2009. Brachionus vs Artemia duel: Optimizing first feeding of Upogebia pusilla (Decapoda: Thalassinidea) larvae. Aquaculture 295: 205–208. [ Links ]
FAO. 2009. The State of World Fisheries and Aquaculture 2008. Food and Agriculture Organization of the United Nations, Rome, Italy, 196 pp. [ Links ]
Farhadian O, MdYuso F, Mohamed S. 2009. Nutritional values of Apocyclops dengizicus (Copepoda: Cyclopoida) fed Chaetocerous calcitrans and Tetraselmis tetrathele. Aquacult. Res. 40: 74–82. [ Links ]
Fengqi L. 2003. Production and application of rotifers in aquaculture. Aquacult. Mag. 22: 16–22. [ Links ]
Fukusho K. 1989. Biology and mass production of the rotifer Brachionus plicatilis. Int. J. Aquacult. Fish. Technol. 1: 232–240. [ Links ]
González R, Celada JD, González A, García V, Carral JM, Sáez–Royuela M. 2010. Stocking density for the intensive rearing of juvenile crayfish, Pacifastacus leniusculus (Astacidae), using Artemia nauplii to supplement a dry diet from the onset of exogenous feeding. Aquacult. Int. 18: 371–378. [ Links ]
Gross A, Abutbul S, Zilberg D. 2004. Acute and chronic effect of nitrite to shrimps, Litopenaeus vannamei, at low salinity water. J. World Aquacult. Soc. 35: 315–321. [ Links ]
Juárez LM. 2008. Current status of shrimp aquaculture in Mexico. Panorama Acuícola 13: 49–53. [ Links ]
Khatoon H, Banerjee S, Yusoff M, Shariff M. 2009. Evaluation of indigenous marine periphytic Amphora, Navicula and Cymbella grown on substrate as feed supplement in Penaeus monodon postlarval hatchery system. Aquacult. Nutr. 15: 186–193. [ Links ]
Li E, Chen L, Zeng C, Chen X, Yu N, Lai Q, Qin JG. 2007. Growth, body composition, respiration and ambient ammonia nitrogen tolerance of the juvenile white shrimp, Litopenaeus vannamei, at different salinities. Aquaculture 265: 385–390. [ Links ]
Martin L, Arenal A, Fajardo J, Pimentel E, Hidalgo L, Pacheco M, García C, Santiesteban D. 2006. Complete and partial replacement of Artemia nauplii by Moina micrura during early postlarval culture of white shrimp (Litopenaeus schmitti). Aquacult. Nutr. 12: 89–96. [ Links ]
Martínez–Córdova LR. 2009. Camaronicultura Sustentable. Editorial Trillas, México, 176 pp. [ Links ]
Martínez–Córdova LR, Peña–Messina E. 2005. Biotic communities and feeding habits of Litopenaeus vannamei (Boone 1931) and Litopenaeus stylirostris (Stimpson 1974) in monoculture and polyculture semi–intensive ponds. Aquacult. Res. 36: 1075–1084. [ Links ]
Martínez–Córdova LR, Martínez–Porchas M, Cortés Jacinto E. 2009. Camaronicultura mexicana y mundial: ¿Actividad sustentable o industria contaminante?. Rev. Int. Contam. Ambient. 25: 181–196. [ Links ]
Méndez LC, Racotta IS, Acosta B, Portillo–Clark G. 2004. Effect of sediment on growth and survival of post–larval Litopenaeus stylirostris (Boone 1931). Aquacult. Res. 35: 652–658. [ Links ]
Naylor RL, Goldburg RJ, Primavera JH, Kautsky N, Beveridge MCM, Clay J, Folke C, Lubchenco J, Mooney H, Troell M. 2000. Effect of aquaculture on world fish supplies. Nature 405: 1017–1024. [ Links ]
Porchas–Cornejo MA, Martínez–Córdova LR, Ramos–Trujillo L, Hernández–López J, Martínez–Porchas M, Mendoza–Cano F. 2010. Effect of promoted natural feed on the production, nutritional, and immunological parameters of Litopenaeus vannamei (Boone 1931) semi–intensively farmed. Aquacult. Nutr. 17: 622–628. [ Links ]
Reid B, Arnold CR. 1992. The intensive culture of the penaeid shrimp Penaeus vannamei Boone in a recirculating raceway system. J. World Aquacult. Soc. 23: 146–153. [ Links ]
Rippingale RJ, Payne MF. 2005. Suitability of the copepod Gladioferens imparipes for intensive cultivation for aquaculture. In: Lee CS, O'Bryen PJ, Marcus NH (eds.), Copepods in Aquaculture. Blackwell Publishing, Ames, Iowa, pp. 209–223. [ Links ]
Ritvo G. 1999. Elemental composition of shrimp pond soils, with emphasis on the potential negative effect of sulfur and its control. PhD thesis, Texas A & M University, College Station, Texas, 91 pp. [ Links ]
Seneriches–Abiera ML, Parado–Estepa F, Gonzales GA. 2007. Acute toxicity of nitrite to mud crab Scylla serrata (Forsskãl) larvae. Aquacult. Res. 38: 1495–1499. [ Links ]
Shields RJ, Gordon Bell J, Luizi FS, Gara B, Bromage NR, Sargent JS. 1999. Natural copepods are superior to enriched Artemia nauplii as feed for halibut larvae (Hippoglossus hippoglossus) in terms of survival, pigmentation and retinal morphology: Relation to dietary essential fatty acids. J. Nutr. 129: 1186–1194. [ Links ]
Stottrup JG. 2000. The elusive copepods: Their production and suitability in marine aquaculture. Aquacult. Res. 31: 703–711. [ Links ]
Stumpf L, Calvo NS, Pietrokovsky S, López Greco LS. 2010. Nutritional vulnerability and compensatory growth in early juveniles of the "red claw" crayfish Cherax quadricarinatus. Aquaculture 304: 34–41. [ Links ]
Sun B, Fleeger JW. 1995. Sustained mass culture of Amphiascoides atopus a marine harpacticoid copepod in a recirculating system. Aquaculture 136: 313–321. [ Links ]
Tho N, Merck R, Ut VU. 2011. Biological characteristics of the improved extensive shrimp system in the Mekong delta, Vietnam. Aquacult. Res., doi:10.1111/j.1365–2109.2011.02858.x. [ Links ]
Tsai SJ, Chen JC. 2002. Acute toxicity of nitrate on Penaeus monodon juveniles at different salinity levels. Aquaculture 213: 163–170. [ Links ]
Watanabe T, Oowa C, Kitajima C, Fujita S. 1983. Nutritional values of live organisms used in Japan for mass propagation of fish: A review. Aquaculture 34: 115–143. [ Links ]
Wiwattanapatapee R, Padoongsombat N, Choochom T, Tang S, Chaimongkol A. 2002. Water flea Moina macrocopa as a novel biocarrier of norfloxacin in aquaculture. J. Contr. Release 83: 23–28. [ Links ]
Zar JH. 1996. Biostatistical Analysis. 3rd ed. Prentice Hall, Englewood Cliffs, New Jersey. [ Links ]
* Descargar versión bilingüe (Inglés–Español) en formato PDF.














