Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.37 no.4a Ensenada dic. 2011
Efecto del estrés térmico en la supervivencia y el retraso de la metamorfosis en larvas del erizo morado Strongylocentrotus purpuratus*
Effect of thermal stress on survival and delay of metamorphosis in larvae of the purple sea urchin Strongylocentrotus purpuratus**
L Díaz–Pérez, E Carpizo–Ituarte*
Instituto de Investigaciones Oceanológicas, Universidad Autónoma de Baja California, Apartado postal 453, Km 103 carretera Tijuana–Ensenada, Ensenada 22800, Baja California, México.
*Autor para correspondencia:
E–mail: ecarpizo@uabc.edu.mx, ecarpizo@gmail.com.
Received November 2010;
accepted May 2011.
RESUMEN
El efecto del estrés térmico (choque térmico) en la supervivencia de estadios larvarios avanzados y en el retraso de la metamorfosis en larvas competentes de erizo morado Strongylocentrotus purpuratus fueron evaluados en condiciones de laboratorio. Las larvas precompetentes de ocho brazos y competentes se mantuvieron a 15, 19, 23, 27 y 31 °C durante 24 h para determinar su límite de tolerancia térmica y medir su supervivencia en cada tratamiento. El retraso de la metamorfosis se evaluó en larvas competentes sometidas a tratamientos de choque térmico a 15, 20, 24, 28 y 32 °C durante 30 min; las larvas fueron inducidas a la metamorfosis mediante biopelículas y KCl. Los resultados indicaron que el límite de tolerancia térmica para larvas precompetentes y competentes fue de 27 °C; las temperaturas iguales o superiores a este valor resultaron letales para ambos estadios de desarrollo, donde se observó 100% de mortalidad en un periodo de 24 h para el tratamiento de 27 °C y de 2 h para el de 31 °C. Se observó que las larvas competentes sometidas a condiciones de estrés térmico de 28 °C durante 30 min retrasaron el inicio de la metamorfosis (<40% de metamorfosis), y mostraron porcentajes altos de larvas con metamorfosis incompleta (55%). Estos resultados indican la sensibilidad de los estadios larvales tardíos a temperaturas superiores a 27 °C por periodos de tiempo cortos, y que esta sensibilidad puede comprometer el inicio de la metamorfosis. Esto puede tener algún efecto en el asentamiento y los patrones de reclutamiento del erizo morado, particularmente en sitios del intermareal expuestos a altas temperaturas durante el verano.
Palabras clave: larva competente, metamorfosis, retraso de la metamorfosis, KCl, biopelícula.
ABSTRACT
The effect of thermal stress (heat shock) on survival was evaluated for advanced larval stages and the possible effect on delay of metamorphosis in competent larvae was also evaluated in the purple sea urchin Strongylocentrotus purpuratus under laboratory conditions. Eight–arm precompetent and competent larvae were kept at 15, 19, 23, 28, and 31 °C during 24 h to estímate their thermal tolerance and measure their survival in each treatment. Delay of metamorphosis was evaluated in competent larvae exposed to heat shock treatments of 15, 20, 24, 28, and 32 °C for 30 min. After this, larvae were induced to metamorphose in the presence of biofilms and KCl. Our results indicated that the thermal tolerance limit for precompetent and competent larvae was 27 °C; temperatures equal or above this value are lethal for both stages of development, where we observed 100% mortality in a period of 24 h for the treatment at 27 °C and of 2 h at 31 °C. Competent larvae subjected to a heat shock treatment of 28 °C for 30 min delayed the onset of metamorphosis (<40%) and showed high percentage of larvae with incomplete metamorphosis (55%). These results indicate the sensitivity of late larval stages to temperatures above 27 °C for short periods of time, and that this sensitivity may compromise the onset of metamorphosis. This could have some effect on the settlement and recruitment patterns of the purple sea urchin, particularly in intertidal sites exposed to high temperatures during the summer.
Key words: competent larva, metamorphosis, delay of metamorphosis, KCl, biofilm.
INTRODUCCIÓN
El erizo morado Strongylocentrotus purpuratus (Stimpson 1857) se distribuye en aguas templadas del océano Pacífico, desde Alaska hasta la isla de Cedros en Baja California, México, y experimenta un intervalo amplio de temperaturas que oscila de 4 a 20 °C (Osovitz y Hofmann 2005). Esta especie habita en la zona somera del submareal, donde el promedio anual de temperatura superficial del mar es entre 16 y 20 °C frente Baja California (McClatchie et al. 2008). También habita en la zona del intermareal rocoso en donde puede llegar a experimentar temperaturas por encima de 8 °C del promedio anual (Palleiro–Nayar et al. 2008). La variación de la temperatura en la zona intermareal puede ser muy rápida y en algunos casos puede ser extrema, lo que podría ocasionar problemas fisiológicos para los organismos (Helmuth et al. 2006, Kuo y Sanford 2009). Por lo tanto, la temperatura es uno de los factores ambientales más importantes ya que juega un papel central en el desarrollo, la supervivencia y la distribución de los organismos en los ecosistemas.
Diversos estudios han mostrado la dependencia de la temperatura durante el desarrollo embrionario y larvario, el asentamiento, la metamorfosis y la supervivencia de larvas de diferentes invertebrados marinos (O'Connor y Lawler 2004, Dove y O'Connor 2007, O'Connor et al. 2007, Putnam et al. 2008, Parker et al. 2009, Saunders y Metaxas 2009). Rahman et al. (2009) encontraron que, en el erizo de mar Tripneustes gratilla, las temperaturas por debajo de 22 °C y por encima de 29 °C tuvieron efectos en la supervivencia y presencia de anormalidades en el desarrollo embrionario y larvario con diferentes tiempos de exposición. Hammond y Hofmann (2010) determinaron que, para S. purpuratus, una temperatura de 32 °C durante 1 h de exposición era letal (100% mortalidad) en estadios de desarrollo tempranos (gástrula y equinopluteus de cuatro brazos). A pesar de los estudios realizados acerca del efecto de la temperatura en el desarrollo y la supervivencia de larvas de invertebrados marinos (ver Bassim y Sammarco 2003, Randall y Szmant 2009), en particular los equinodermos (ver Johnson y Babcock 1994), poco se sabe acerca de los efectos de altas temperaturas en el asentamiento y el inicio de la metamorfosis. Se han reportado desarrollos larvarios de especies de distribución más tropical, como Tripneustes ventricosus, que completa adecuadamente su desarrollo a temperaturas de hasta 29 °C (ver Rosas et al. 2009). Chen y Chen (1992) encontraron que las larvas de la galleta de mar Arachnoides placenta mantenidas a un intervalo de temperaturas entre 28 y 34 °C mostraron una disminución en el porcentaje de larvas metamorfoseadas al final de los experimentos.
La metamorfosis es un evento clave durante el ciclo de vida de muchos invertebrados marinos; es un cambio de la forma de vida pelágica en larvas a bentónica en juveniles y adultos, por lo tanto, incluye cambios de comportamiento y morfogenéticos. La metamorfosis se inicia con la respuesta de las larvas a claves ambientales, que pueden ser de origen químico o físico, asociadas al hábitat y/o presencia de adultos de la misma especie. Se ha registrado que las películas bacterianas asociadas a las superficies marinas juegan un papel esencial en la generación de compuestos inductores de la metamorfosis (Lau y Qian 2001, Díaz–Pérez 2006, Chiu et al. 2007, Hadfield 2011). Además, se ha documentado que la respuesta a películas bacterianas es especie–específica; es decir, las larvas tienen la capacidad de discriminar y responder a ciertas claves ambientales asociadas a biopelículas en los sustratos apropiados para sobrevivir y desarrollarse (Elkin y Marshall 2007). De esta manera, un incremento de la temperatura al inicio de la metamorfosis puede tener consecuencias ecológicas desfavorables al momento de la detección de la clave ambiental y, por ende, en la selección de los sustratos adecuados para desarrollarse (Gebauer et al. 2003).
Hasta el momento son pocos los trabajos que documentan el efecto de la temperatura en el retraso de la metamorfosis en invertebrados marinos y ninguno en particular en el erizo morado. El objetivo del presente estudio fue documentar los límites de tolerancia térmica y el efecto del estrés térmico en el inicio de la metamorfosis en larvas de estadios avanzados y competentes del erizo morado S. purpuratus. Los resultados del presente estudio representan los primeros datos para esta especie.
MATERIALES Y MÉTODOS
Recolección de organismos y cultivo de larvas
Se recolectaron erizos morados (S. purpuratus) adultos durante la temporada de invierno en la zona intermareal de dos localidades en Baja California, México: Punta Baja (29°56'58.29" N, 115°48'42.65" W; temperatura superficial del océano, 17 °C) y Bajamar (32°00'51.32" N, 116°52'27.23" W; temperatura superficial del océano, 16 °C). Los organismos se transportaron al laboratorio en el Instituto de Investigaciones Oceanológicas de la Universidad Autónoma de Baja California en Ensenada, donde se mantuvieron en estanques de 40 L con flujo de agua continua, a una temperatura de 15 a 16 °C (±1 °C), y alimentaron con la macroalga Macrocystis pyrifera hasta su utilización.
La obtención de los gametos se realizó de acuerdo con el método descrito por Strathmann (1987), que consistió en estimular su expulsión mediante la inyección de 2–3 mL de KCl 0.53 M en la cavidad celómica a través de la membrana peristomal. La fertilización de los huevos y el mantenimiento de larvas se realizó de acuerdo con el método descrito por Carpizo–Ituarte et al. (2002). El desarrollo larvario se llevó a cabo en tanques cónicos de 45 L con agua de mar filtrada a 5y 1 |am y pasada a través de una lámpara de luz ultravioleta para eliminar la contaminación bacteriana. Los cultivos se realizaron a una densidad de 3 larvas mL–1 con aireación continua a una temperatura de 16 °C (±1 °C); el recambio de agua al 50% se realizó cada dos días y el recambio al 100%, una vez a la semana. Las larvas se alimentaron diariamente con la microalga Rhodomonas sp. a una concentración de 20,000 células mL–1 hasta que alcanzaron el estadio de competencia. Se consideraron larvas competentes cuando el rudimento era claramente visible y ocupaba la región izquierda del cuerpo larval, y en él se observaba la presencia de pies ambulacrales bien diferenciados, de acuerdo con lo descrito por Carpizo–Ituarte et al. (2002) y Smith et al. (2008). El estadio de competencia se alcanzó a los 23 días de desarrollo a una temperatura de 16 °C (±1 °C).
Límite de tolerancia térmica en estadios larvarios avanzados
Las arvas precompetentes de ocho brazos y de 18 días de edad (experimento 1a) y las larvas competentes de 23 días de edad (experimento 1b) fueron expuestas a diferentes tratamientos experimentales de choque térmico (15, 19, 23, 27 y 31 °C). Los experimentos se realizaron en cajas multipozos (Falcon), con 5 mL de agua de mar filtrada (AMF) a 5 y 1 µm e irradiada con luz ultravioleta por pozo. Se colocaron de 20 a 30 larvas precompetentes de ocho brazos y competentes por pozo en experimentos independientes. Todos los tratamientos se realizaron por triplicado. El tratamiento a 15 ° C fue considerado como control en todos los experimentos debido a que todo el desarrollo larvario se llevó a cabo a esta temperatura. El porcentaje de supervivencia se determinó al trancurrir 1, 2, 3, 4, 6, 8, 10 y 24 h para las larvas precompetentes de ocho brazos (experimento 1a) y al transcurrir 1, 2, 4, 6 y 24 h para las larvas competentes (experimento 1b).
Retraso de la metamorfosis en condiciones de estrés térmico e inducción con KCl y biopelículas
Las larvas competentes que se mantuvieron a 16 °C durante todo su desarrollo fueron sometidas a choque térmico durante 30 min en diferentes tratamientos experimentales (15, 20, 24, 28 y 32 °C) (experimento 2a). Posterior al estrés, se colocaron de 20 a 25 larvas (por pozo) en 5 mL de AMF y se les indujo a la metamorfosis mediante la adición de KCl (100 mM durante 15 min), de acuerdo con lo descrito por Carpizo–Ituarte et al. (2002). La solución de KCl fue sustituida por AMF después de 15 min para evitar efectos tóxicos por una exposición prolongada. Se realizaron seis réplicas por tratamiento y la temperatura se mantuvo a 16 °C (±1 °C) hasta el final del experimento.
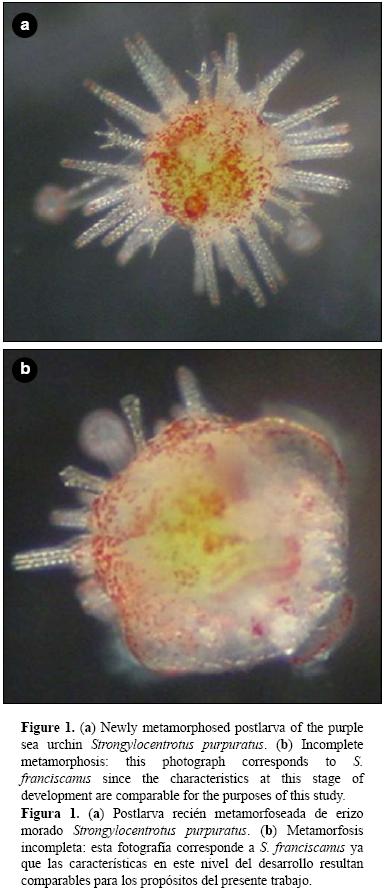
En un experimento adicional (experimento 2b), las larvas competentes se aclimataron durante 30 min a 20 °C y, posteriormente, se expusieron a estrés térmico durante 30 min adicionales en diferentes tratamientos experimentales (15, 20, 24, 28 y 32 °C). Posterior al estrés, las larvas fueron puestas en contacto con biopelículas para inducir el inicio de la metamorfosis. Las biopelículas se generaron previo a la realización del experimento mediante la introducción de cajas multipozos (Falcon) durante 10 días consecutivos en acuarios con presencia de erizos morados adultos a una temperatura de 17 °C (±3 °C). Cada tratamiento se realizó por triplicado. Posterior al estrés térmico, los tratamientos se mantuvieron a 16 °C (±1 °C) hasta el final del experimento. En ambos experimentos (2a y 2b) se incluyó un control positivo, que consistió en la inducción a la metamorfosis en 20 a 30 larvas competentes por pozo con exposición a KCl (100 mM, durante 15 min); pasado el tiempo, la solución fue retirada y remplazada por 5 mL de AMF. El control positivo no fue sometido a estrés térmico y se mantuvo a una temperatura de 16 °C (±1 °C) durante todo el periodo experimental. También se incluyó un control negativo en donde las larvas competentes permanecieron en AMF a una temperatura de 16 °C (±1 °C) durante todo el periodo experimental, tal como lo describen Carpizo–Ituarte et al. (2002). El porcentaje de larvas metamorfoseadas se evaluó a las 12 y 24 h después de la inducción a la metamorfosis en ambos experimentos. También se evaluó el porcentaje de larvas con metamorfosis incompleta, el porcentaje de supervivencia de larvas que iniciaron la metamorfosis y el porcentaje de supervivencia de larvas totales para ambos experimentos. Las larvas se consideraron metarmofoseadas cuando ya no había evidencia del epitelio larval, la postlarva se desplazaba en el fondo del recipiente y las espinas juveniles fueron evidentes (fig. 1a). Se determinó como metamorfosis incompleta cuando, transcurridas 12 o 24 h, todavía era evidente el cuerpo larval y las espinas juveniles no estaban desplegadas en su totalidad (fig. 1b). El porcentaje de metamorfosis incompleta (MI) se determinó de la siguiente manera:
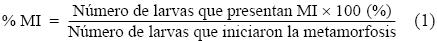
Análisis estadístico
El análisis estadístico se realizó mediante el uso del software SigmaStat 3.5 (SigmaPlot 11). A los datos en porcentaje se les realizó la transformación arcoseno previo a los análisis estadísticos. Se aplicó la prueba de Shapiro–Wilk para determinar la normalidad y la homogeneidad de varianzas. Cuando los datos no cumplían con la normalidad y/o homogeneidad de varianzas, se aplicaron pruebas no paramétricas. Para los experimentos 1a y 1b, los datos se analizaron mediante un análisis de varianza de Kruskal–Wallis para cada tiempo de evaluación y se utilizó la prueba de Student–Newman–Keuls (SNK) para realizar las comparaciones múltiples entre tratamientos. Para el experimento 2a, los datos se analizaron mediante un análisis de varianza de Kruskal–Wallis para cada tiempo de evaluación y se utilizó la prueba de Mann–Whitney para determinar diferencias entre los tratamientos. En el experimento 2b, los datos se analizaron mediante un análisis de varianza (ANOVA, por sus siglas en inglés) de una via para cada tiempo de evaluación y se utilizó la prueba de Fisher de menor diferencia siginificativa (LSD) como prueba a posteriori para determinar diferencias entre los tratamientos. En todas la pruebas estadísticas se consideraron diferencias significativas cuando los valores de P fuesen menor que 0.05.
RESULTADOS
Límite de tolerancia térmica en estadios larvarios avanzados
Las larvas precompetentes de ocho brazos (experimento 1a) tuvieron una supervivencia de entre el 90% y el 100% en los tratamientos a 15, 19 y 23 °C durante todo el periodo experimental (fig. 2a). En el tratamiento a 27 °C, el porcentaje de supervivencia estuvo por encima del 90% en las primeras 6 h y posteriormente disminuyó a 83%, 65% y 0% transcurridas 8, 10 y 24 h, respectivamente. En el tratamiento a 31 °C la mortalidad fue del 100% transcurridas 2 h de haber iniciado el experimento (fig. 2a). Los resultados obtenidos en los tratamientos a 27 y 31 °C mostraron diferencias significativas con relación al resto de los tratamientos: el tratamiento a 31 °C fue diferente a las 2 h de evaluación (Kruskal–Wallis, P < 0.001; SNK, P < 0.05) y el tratamiento a 27 °C, a las 8, 10 y 24 h (Kruskal–Wallis, P < 0.001; SNK, P < 0.05) (fig. 2a).
La supervivencia de las larvas competentes (experimento 1b) fue del 100% en los tratamientos a 15, 19 y 23 °C durante todo el experimento (fig. 2b). En el tratamiento a 27 °C, la supervivencia fue entre el 90% y el 100% durante las primeras 6 h, similar a los tratamientos con temperaturas inferiores, pero se redujo a 0% a las 24 h (fig. 2b). Los resultados obtenidos en el tratamiento a 31 °C mostraron una supervivencia del 100% en las primeras 2 h y del 0% a las 4 h (fig. 2b). La respuesta obtenida en los tratamientos a 27 y 31 °C fue estadísticamente significativa en los diferentes tiempos de evaluación con respecto al resto de los tratamientos: el tratamiento a 31 °C fue diferente a las 4 h de evaluación y el tratamiento a 27 °C, a las 24 h (Kruskal–Wallis, P < 0.001) (fig. 2b).
Estrés térmico e inducción a la metamorfosis con KCl y biopelículas (retraso de la metamorfosis)
El efecto del estrés térmico en el inicio de la metamorfosis en S. purpuratus fue evaluado a las 12 y 24 h, y se encontraron diferencias estadísticas entre los tratamientos en los diferentes tiempos de evaluación (Kruskal–Wallis, P < 0.05) (experimento 2a). El porcentaje de larvas con metamorfosis que se observó para los tratamientos a 15, 20 y 24 °C fue similar a las 12 y 24 h (del 75% al 85%, respectivamente); por lo tanto, no se encontraron diferencias significativas entre estos tratamientos ni en relación con el control positivo de KCl (62% de larvas metamorfoseadas) (Mann–Whitney, P > 0.05) (fig. 3a). Para el tratamiento a 28 °C, este porcentaje fue menor que 25% a las 24 h y fue significativamente diferente al resto de los tratamientos, a excepción del control negativo (Mann–Whitney, P < 0.05) (fig. 3a). En el tratamiento de 32 °C no se observó metamorfosis. Para el porcentaje de larvas con metamorfosis incompleta, no se encontró que existieran diferencias significativas entre los tratamientos a las 12 h de evaluación (Kruskal–Wallis, P > 0.05), pero sí se observaron diferencias a las 24 h (Kruskal–Wallis, P < 0.05). El número de larvas con metamorfosis incompleta tendió a incrementar a mayor temperatura (fig. 3b). El porcentaje de supervivencia de las larvas que iniciaron la metamorfosis en los tratamientos a 15, 20, 24 °C y KCl fue del 100% al final del experimento, mientras que en el tratamiento a 28 °C fue del 80%. El porcentaje de supervivencia de larvas totales (metamorfoseadas y no metamorfoseadas) osciló entre el 94% y el 100% para todos los tratamientos, excepto en el tratamiento a 32 °C, donde fue del 50% a las 12 h y del 0% a las 24 h.
Cuando las larvas se aclimataron durante 30 min a 20 °C, previo a ser expuestas a los diferentes tratamientos experimentales de temperatura e inducidas a la metamorfosis con biopelículas (experimento 2b), se encontraron diferencias significativas entre los tratamientos a las 12 y 24 h de evaluación (ANOVA de una via, P < 0.05). El porcentaje de larvas metamorfoseadas observado en los tratamientos a 15, 20 y 24 °C a las 12 y 24 h fue entre el 66% y el 80% (fig. 4a), y no se observaron diferencias significativas con relación al control positivo (KCl) (79% de metamorfosis) (LSD, P > 0.05). Para el tratamiento a 28 °C, el porcentaje de larvas con metamorfosis fue del 35% y 50% a las 12 y 24 h, respectivamente, y fue significativamente diferente al resto de los tratamientos en ambos tiempos evaluados (LSD, P< 0.05). No se observaron larvas metamorfoseadas en el tratamiento a 32 °C (fig. 4a). El porcentaje de larvas que presentaron metamorfosis incompleta mostró diferencias significativas entre los tratamientos a las 12 y 24 h de evaluación (ANOVA de una via, P < 0.05). Para los tratamientos a 28 °C y con KCl, el porcentaje de metamorfosis incompleta varió entre el 35% y el 56%, y fue significativamente diferente al resto de los tratamientos (LSD, P < 0.05) (fig. 4b). Se observó un mayor número de larvas con metamorfosis incompleta a mayor temperatura, similar a lo observado en el experimento 2a. El porcentaje de supervivencia de las larvas que iniciaron la metamorfosis en los tratamientos a 15, 20, 24 y 28 °C varió entre el 70% y el 80% a las 24 h. La supervivencia de larvas totales fue entre el 63% y el 99% al final del experimento en todos los tratamientos, excepto el tratamiento a 32 °C, donde todas las larvas estaban muertas a las 12 h de evaluación. En el tratamiento de KCl se observó una supervivencia del 82% y el 26% a las 12 y 24 h, respectivamente.
DISCUSIÓN
Los resultados del presente estudio mostraron que las larvas precompetentes de ocho brazos y las larvas competentes (experimentos 1a y 1b) de erizo morado S. purpuratus tienen una termotolerancia alta en periodos de tiempo cortos (24 h). Por lo tanto, estas larvas son capaces de soportar cambios de temperatura significativos, superiores a los encontrados en el submareal en ambas localidades de mues–treo (16–20 °C), así como el incremento de temperatura en escenarios de cambio climático en donde se pronostica un incremento de la temperatura superficial del mar de 4 °C en los próximos 90 años (Brennand et al. 2010). En la zona del intermareal rocoso se pueden llegar a presentar temperaturas extremas en condiciones de marea baja (Helmuth 2002, Helmuth et al. 2006). Para el sitio de muestreo en Punta Baja, hemos registrado temperaturas de alrededor de 25 °C y, en algunos casos, temperaturas extremas de 30 °C. De esta manera, es posible que las larvas puedan llegar a experimentar temperaturas extremas en la zona intermareal, las cuales pueden llegar a superar su máximo de tolerancia termal y, consecuentemente, comprometer el inicio de la metamorfosis y su supervivencia. Algunos estudios sobre S. purpuratus y Heliocidaris erythrogramma han documentado esta termotolerancia alta durante el proceso de fertilización y el desarrollo larvario temprano (Farmamfarmaian y Giese 1963, Byrne et al. 2009). Hammond y Hofmann (2010) determinaron que la tolerancia al estrés térmico en dos estadios de desarrollo temprano (gástrula y larva pluteus de cuatro brazos) fue de manera similar: registraron una mortalidad del 100% con 1 h de exposición a 32 °C y un perfil de expresión de proteínas de choque térmico muy similar para ambos estadios de desarrollo. Estos autores mencionan que es probable que exista una tolerancia de temperatura universal durante el desarrollo larvario en esta especie, como un mecanismo para su supervivencia en su etapa planctónica. Nuestros resultados para los estadios tardíos (pluteus de ocho brazos y competente) de S. purpuratus mostraron una termotolerancia muy similar a lo reportado por Hammond y Hofmann (2010) para estadios tempranos. En el presente estudio se observó una mortalidad del 100% en larvas pluteus de ocho brazos y larvas competentes después de 2 y 4 h, respectivamente, de exposición a 31 °C. Por lo tanto, es posible que S. purpuratus presente una tolerancia de temperatura similar a lo largo de su desarrollo larvario, con un incremento de la termotolerancia en el estadio competente, el cual le permita llevar a cabo el asentamiento y la metamorfosis con éxito.
En cuanto al retraso de la metamorfosis por efectos de estrés térmico, los resultados mostraron que a medida que se incrementa la temperatura se retrasa la metamorfosis (experimentos 2a y 2b). Esto mismo fue observado por Chen y Chen (1992) para la galleta de mar Arachnoides placenta. Estos autores mostraron que el porcentaje de larvas metamorfoseadas disminuyó a niveles inferiores al 40% a una temperatura de 28 °C e inferiores al 10% a 34 °C. Para S. purpuratus, en el presente trabajo, el menor porcentaje de larvas metamorfoseadas se observó a 28 °C (entre el 20% y el 40%) y, cuando las larvas fueron mantenidas a 31 °C durante 30 min, se redujo a cero. Lo anterior ocurrió a pesar de inducir a las larvas a metamorfosearse utilizando KCl como un inductor artificial. La inducción con KCl usualmente resulta muy eficaz para inducir la metamorfosis en una gran variedad de larvas de invertebrados marinos, incluido el erizo morado (Carpizo–Ituarte et al. 2002). Por otro lado, el porcentaje de larvas metamorfoseadas observado con biopelículas como inductores de la metamorfosis fue similar a lo encontrado con KCl. Se observó un patrón similar en ambos experimentos: el porcentaje de larvas con metamorfosis disminuyó a medida que se incrementó la temperatura. Lo anterior sugiere que a pesar de utilizar diferentes inductores (naturales o artificiales) para estimular el inicio de la metamorfosis, las larvas retrasan el inicio de la metamorfosis si se encuentran térmicamente estresadas. Este retraso en la metamorfosis, a su vez, sugiere que en condiciones de estrés térmico se produce una respuesta a nivel celular en las rutas de transducción metamórfica y/o regulación de la expresión génica, que previene que las larvas inicien la metamorfosis, probablemente como un mecanismo de supervivencia. Por otro lado, las diferencias encontradas en la supervivencia larval en los experimentos 2a y 2b probablemente se deban a la variabilidad entre las cohortes de larvas utilizadas en ambos experimentos.
En general, los resultados obtenidos en el presente estudio muestran que el umbral de temperatura en la cual las larvas tienen la capacidad de iniciar y terminar con éxito la metamorfosis se encuentra por debajo de los 28 °C. Las consecuencias ecológicas del retraso de la metamorfosis han sido documentadas para algunos invertebrados marinos (ver Pechenick 1990, 2006). Es posible que, en condiciones de estrés térmico, la selección de los sustratos favorables para el asentamiento y la metamorfosis por parte de las larvas se vea alterada y, por lo tanto, tenga como consecuencia que no metamorfoseen en los sitios adecuados. Lo anterior las obligaría a prolongar su vida larval en busca de los sustratos adecuados, tal como lo han reportado diversos autores (Gebauer et al. 2003, Toonen y Tyre 2007). Además, es posible que la supervivencia de las larvas en el momento de la metamorfosis pueda verse afectada de manera directa durante eventos de temperaturas extremas, particularmente en el intermareal, donde hemos registrado temperaturas superiores a los 27 °C en la localidad de Punta Baja. Los estudios encaminados a documentar los límites de tolerancia térmica de las especies que habitan un ecosistema, así como su capacidad de ajustarse a incrementos de temperatura, serán necesarios para entender cómo los organismos podrían ser afectados por lasvariaciones de temperatura en el océano (Somero 2002, Pörtner 2008, Visser 2008), y resultan de particular interés en las condiciones actuales del cambio climático global.
CONCLUSIONES
Los resultados obtenidos en la presente investigación indican que las larvas de erizo morado S. purpuratus en estadios de desarrollo avanzados tienen una alta termotolerancia; sin embargo, la exposición de las larvas a temperaturas alrededor de 28 °C por periodos de tiempo cortos (30 min) puede comprometer el inicio de la metamorfosis. Asimismo, la metamorfosis en las larvas se retrasa a medida que incrementa la temperatura, lo que pudiera tener implicaciones en la distribución de esta especie, ya que parece ser particularmente sensible a las temperatura altas en el momento de transición de la columna de agua a la elección de un sustrato en el bentos. Los periodos de estrés térmico asociados a sitios de metamorfosis en el intermareal rocoso pueden tener como consecuencia una disminución en el número de reclutas y, por ende, en la dinámica poblacional del erizo morado en estos sitios. Lo anterior podría ser más relevante en la parte sur de su distribución (península de Baja California), en donde es posible que la temperatura superficial del océano se incremente en escenarios de cambio climático.
AGRADECIMIENTOS
La presente investigación contó con el apoyo financiero del Consejo Nacional de Ciencia y Tecnología (CONACYT, No. 47658) y de la Universidad Autónoma de Baja California (proyecto interno IIO–UABC No. 533 a cargo de ECI). El primer autor contó con el apoyo de la beca CONACYT (No. 207382) para sus estudios de doctorado. Los autores agradecen también a todos los miembros del Laboratorio de Ecología y Biología del Desarrollo del Instituto de Investigaciones Oceanológicas su ayuda y valiosos comentarios durante la realización de este trabajo. Un agradecimiento especial a E Valenzuela y F Núñez–Cebrero por proporcionar la microalga Rhodomonas sp. para alimentar las larvas de erizo.
Referencias
Bassim KM, Sammarco PW. 2003. Effects of temperature and ammonium on larval development and survivorship in an scleractinian coral (Diploria strigosa). Mar. Biol. 142: 241–252. [ Links ]
Brennand HS, Soars N, Dworjanyn SA, Davis AR, Byrne M. 2010. Impact of ocean warming and ocean acidification on larval development and calcification in the sea urchin Tripneustes gratilla. PLoS ONE 5: 1–7. [ Links ]
Byrne M, Ho M, Selvakumaraswamy P, Nguyen HD, Dworjanyn SA, Davis AR. 2009. Temperature, but not pH, compromises sea urchin fertilization and early development under near–future climate change scenarios. Proc. R. Soc. B 276: 1883–1888. [ Links ]
Carpizo–Ituarte E, Salas–Garza A, Parés–Sierra G. 2002. Induction of metamorphosis with KCl in three species of sea urchins and its implications in the production of juveniles. Cienc. Mar. 28: 157–166. [ Links ]
Chen CP, Chen BY. 1992. Effects of high temperature on larval development and metamorphosis of Arachnoides placenta (Echinodermata: Echinoidea). Mar. Biol. 112: 445–449. [ Links ]
Chiu JMY, Thiyagarajan V, Pechenick JA, Hung OS, Qian PY. 2007. Influence of bacteria and diatoms in biofilms on metamorphosis of the marine slipper limpet Crepidula onyx. Mar. Biol. 151: 1417–1431. [ Links ]
Díaz–Pérez L. 2006. Inducción a la metamorfosis en larvas del erizo blanco Lytechinus pictus (Verril 1867), mediante biopelículas y caracterización bioquímica de las cepas aisladas. M.Sc. thesis, Universidad Autónoma de Baja California, Ensenada, Mexico, 95 pp. [ Links ]
Dove MC, O'Connor WA. 2007. Salinity and temperature tolerance of Sydney rock oysters Saccostrea glomerata during early ontogeny. J. Shellfish Res. 26: 939–947. [ Links ]
Elkin C, Marshall DJ. 2007. Desperate larvae: Influence of deferred cost and habitat requirements on habitat selection. Mar. Ecol. Prog. Ser 335: 143–153. [ Links ]
Farmanfarmaian A, Giese AC. 1963. Thermal tolerance and acclimatation in the western purple sea urchin Strongylocentrotus purpuratus. Physiol. Zool. 36: 237–343. [ Links ]
Gebauer P, Paschke K, Anger K. 2003. Delayed metamorphosis in decapod crustaceans: Evidence and consequences. Rev. Chil. Hist. Nat. 76: 169–175. [ Links ]
Hadfield MG. 2011. Biofilms and marine invertebrate larvae: What bacteria produce that larvae use to choose settlement sites. Annu. Rev. Mar. Sci. 3: 453–470. [ Links ]
Hammond LM, Hofmann GE. 2010. Thermal tolerance of Strongylocentrotus purpuratus early life history stages: Mortaliy, stress–induced gene expression and biogeographic patterns. Mar. Biol. 157: 2677–2687. [ Links ]
Helmuth B. 2002. How do we measure the environment? Linking intertidal thermal physiology and ecology through biophysics. Integr. Comp. Biol. 42: 837–845. [ Links ]
Helmuth B, Broitman BR, Blanchette CA, Gilman S, Halpin P, Harley CDG, O'Donell MJ, Hofmann GE, Menge B, Strickland D. 2006. Mosaic patterns of thermal stress in the rocky intertidal zone: Implications for climate change. Ecol. Monogr. 76: 461–479. [ Links ]
Johnson LG, Babcock RC. 1994. Temperature and the larval ecology of the crown–of–thorns starfish, Acanthaster placi. Biol. Bull. 187: 304–308. [ Links ]
Kuo ESL, Sanford E. 2009. Geographic variation in the upper thermal limits of an intertidal snail: Implications for climate envelope models. Mar. Ecol. Prog. Ser 388: 137–146. [ Links ]
Lau SCK, Qian PY. 2001. Larval settlement in the serpulid polychaete Hydroides elegans, in response to bacterial biofilms: An investigation of the nature of putative larval settlement cue. Mar. Biol. 138: 321–328. [ Links ]
McClatchie S, Goericke R, Koslow JA, Schwing FB, Bograd SJ, Charter R, Watson W, Lo N, Hill K, Gottschalck J, L'Heureux M, Xue Y, Peterson WT, Emmett R, Collins C, Gaxiola–Castro G, Durazo R, Kahru M, Mitchell BG, Hyrenbach KD, Sydeman WJ, Bradley RW, Warzybok P, Bjorkstedt E. 2008. The state of the California Current, 2007–2008: La Niña conditions and their effects on the ecosystem. CalCOFI Rep. 49: 39–76. [ Links ]
O'Connor WA, Lawler NF. 2004. Salinity and temperature tolerance of embryos and juveniles of the pearl oyster, Pinctada imbricata Röding. Aquaculture 229: 493–506. [ Links ]
O'Connor MI, Bruno JF, Gaines SD, Halpern BS, Lester SE, Kinlan BP, Weiss JM. 2007. Temperature control of larval dispersal and the implications for marine ecology, evolution and conservation. PNAS 104: 1266–1271. [ Links ]
Osovitz CJ, Hofmann GE. 2005. Thermal history–dependent expression of the hsp70 gene in purple sea urchins: Biogeographic patterns and the effect of temperature acclimation. J. Exp. Mar. Biol. Ecol. 327: 134–143. [ Links ]
Palleiro–Nayar JS, Salgado–Rogel ML, Aguilar–Montero D. 2008. La pesca de erizo morado, Strongylocentrotus purpuratus, y su incremento poblacional en Baja California, México. Cienc. Pesq. 16: 29–35. [ Links ]
Parker LM, Ross PM, O'Connor WA. 2009. The effect of ocean acidification and temperature on the fertilization and embryonic development of the Sydney rock oyster Saccostrea glomerata (Gould 1850). Global Change Biol. 15: 2123–2136. [ Links ]
Pechenick JA. 1990. Delayed metamorphosis by larvae of benthic marine invertebrates. Does it occur? Is there a price to pay? Ophelia 32: 63–94. [ Links ]
Pechenick JA. 2006. Larval experience and latent effects: Metamorphosis is not a new beginning. Integr. Comp. Biol. 46: 323–333. [ Links ]
Pörtner HO. 2008. Ecosystem effects of ocean acidification in times of ocean warming: A physiologist's view. Mar. Ecol. Prog. Ser. 373: 203–217. [ Links ]
Putnam HM, Edmunds PJ, Fan TY. 2008. Effect of temperature on settlement choice and photophysiology of larvae from the reef coral Stylophora pistillata. Biol. Bull. 215: 135–142. [ Links ]
Rahman S, Tsuchiya M, Uehara T. 2009. Effects of temperature on hatching rate, embryonic development and early larval survival of the edible sea urchin, Tripneustes gratilla. Biologia 64: 768–775. [ Links ]
Randall CJ, Szmant AM. 2009. Elevated temperature reduced survivorship and settlement of the larvae of the Caribbean scleritian coral, Flavia fragum (Esper). Coral Reefs 28: 537–545. [ Links ]
Rosas J, Velásquez A, Fernández S, Mata E, Cabrera T. 2009. Desarrollo larvario y supervivencia hasta la metamorfosis del erizo Tripneutes ventricosus (Lamarck) (Echinodermata: Echinoidea) alimentado con microalgas a dos temperaturas. Rev. Biol. Mar. Oceanogr. 44: 387–396. [ Links ]
Saunders MI, Metaxas A. 2009. Effects of temperature, size and food on the growth of Membranipora membranacea in laboratory and field studies. Mar. Biol. 156: 2267–2276. [ Links ]
Smith MM, Cruz–Smith L, Cameron RA, Urry LA. 2008. The larval stages of the sea urchin Strongylocentrotus purpuratus. J. Morphol. 269: 713–733. [ Links ]
Somero GM. 2002. Thermal physiology and vertical zonation of intertidal animals: Optima, limits, and cost of living. Integr. Comp. Biol. 42: 780–789. [ Links ]
Strathmann MF. 1987. Phylum Echinodermata: Class Echinoidea. In: Strathmann MF (ed.), Reproduction and Development of Marine Invertebrates of the Northern Pacific Coast. University of Washington Press, Seattle, pp. 511–534. [ Links ]
Toonen RJ, Tyre AJ. 2007. If larvae were smar.t: A simple model for optimal settlement behavior of competent larvae. Mar. Ecol. Prog. Ser. 349: 43–46. [ Links ]
Visser ME. 2008. Keeping up with a warming world; assessing the rate of adaptation to climate change. Proc. R. Soc. B 275: 649–659. [ Links ]
* Descargar versión bilingüe (Inglés–Español) en formato PDF.
** English translation by Christine Harris.














