Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.37 no.3 Ensenada sep. 2011
Hábitos alimentarios de tres especies de raya (Rajiformes: Urotrygonidae) en el Pacífico central mexicano*
Feeding habits of three round stingrays (Rajiformes: Urotrygonidae) in the central Mexican Pacific**
JR Flores–Ortega*, E Godínez–Domínguez, G González–Sansón, JA Rojo–Vázquez, A Corgos, MY Morales–Jáuregui
Departamento de Estudios para el Desarrollo Sustentable de Zonas Costeras, Universidad de Guadalajara, V. Gómez Farías 82, 48980 San Patricio–Melaque, Jalisco, México.
*Corresponding author.
E–mail: percebes5@gmail.com, flortega@costera.melaque.udg.mx
Received September 2010
AcceptedMarch 2011
RESUMEN
Se realizó el análisis del contenido estomacal y de las interacciones tróficas de tres especies de raya (Urobatis halleri, Urotrygon munda y Urotrygon rogersi) capturadas en la plataforma continental del Pacífico central mexicano durante los dos periodos hidroclimáticos (T1 y T2) que caracterizan la variabilidad ambiental en la zona. Las tres especies de raya presentaron un estrecho intervalo de distribución batimétrica, y su máxima abundancia se presentó a los 20 m en ambos periodos de estudio. En general, las dietas estuvieron compuestas principalmente de microcrustáceos bentónicos (camarones carídeos) y en menor proporción de peces, poliquetos y moluscos. Las categorías de presas de mayor abundancia en las dietas fueron los carídeos de las familias Processidae y Ogyriididae, y peneidos, y en segundo término las larvas de braquiuros y estomatópodos. La estrategia alimentaria exhibida por las tres especies fue generalista. Las dietas mostraron valores altos de superposición durante el periodo T1 tanto en el análisis de intra como de interespecies, mientras que durante el periodo T2 la superposición de las dietas fue menor. No se evidenciaron cambios ontogénicos en las dietas, y el sexo tampoco representó un factor de diferencias tróficas. Se considera que las ligeras diferencias en las dietas son debidas a los cambios estacionales en las asociaciones de macroinvertebrados de fondos blandos de la zona somera, y que las relaciones como competencia y depredación no son los factores más determinantes en la dinámica de las tres especies de raya analizadas.
Palabras clave: ecología trófica, cambios en la dieta, rayas bentónicas, Urotrygonidae, Pacífico central mexicano.
ABSTRACT
Stomach contents and dietary overlap of three round stingray species (Urobatis halleri, Urotrygon munda, and Urotrygon rogersi) captured off the central Pacific coast of Mexico were analyzed during the two main hydroclimatic periods (T1 and T2) that characterize the environmental variability in the area. The three round stingray species showed a narrow bathymetric distribution range, and the highest abundances were located at 20 m depth in both seasons. In general, the diets were mainly composed of benthic microcrustaceans (caridean shrimps) and to a lesser extent of fishes, polychaetes, and molluscs. The most abundant prey items in the diets were carideans of the families Processidae and Ogyriididae, and penaeids, followed by brachyuran and stomatopod larvae. All three stingrays exhibited a generalist feeding strategy. The diets showed high overlap values during period T1 in both inter– and intraspecies analyses, but lower values during period T2. There was no evidence of ontogenetic diet changes and sex was not a factor for trophic differences. The slight differences among diets were due to seasonal changes in the soft–bottom macrobenthic invertebrate assemblages in the shallow waters, and relationships like predation and competition were not the main factors influencing the population dynamics of the three stingray species.
Key words: trophic ecology, diet changes, benthic round stingrays, Urotrygonidae, central Mexican Pacific.
INTRODUCCIÓN
El estudio de las redes tróficas provee información fundamental para describir la estructura de la comunidad y del ecosistema, y constituye una herramienta que contribuye a integrar la dinámica poblacional, las interacciones entre especies, la estabilidad, la biodiversidad y la productividad del ecosistema (Link et al. 2006).
Las rayas (Rajiformes) se encuentran en la mayoría de los hábitats marinos, en aguas someras y profundas, y en climas templados y tropicales (Allen y Robertson 1994). En el Pacífico central mexicano, las mayores abundancias y biomasas de rayas se encuentran en ambientes relativamente costeros (Coronado–Molina y Amezcua–Linares 1988, González–Sansón et al. 1997). Los valores altos de abundancia podrían estar relacionados con agregaciones reproductivas o alimentarias (Smith et al. 2009).
Las diferentes especies de raya en el mundo son depredadores importantes de peces e invertebrados en los sistemas demersales (Ebert et al. 1991, Orlov 1998, Bizarro et al. 2007, Collins et al. 2007, Navia et al. 2007, Follesa et al. 2010), y desempeñan un papel importante en la estructura de las redes tróficas marinas. En cuanto a los hábitos alimentarios, las especies de Rajiformes pueden mantener una estrategia alimentaria similar durante toda su historia de vida (e.g., Ebert et al. 1991, Mabragaña et al. 2005, Sampson et al. 2010) o presentar cambios ontogénicos importantes en la dieta (e.g., Koen–Alonso et al. 2001, Ebert y Cowley 2003, Braccini y Perez 2005, Collins et al. 2007, Treloar et al. 2007, Belleggia et al. 2008, Saglam y Bascinar 2008, Barbini et al. 2010, Schlussel et al. 2010, Sommerville et al. 2011).
La depredación y la competencia por los recursos son algunos de los factores de mayor influencia en la estructura de una comunidad (Gerking 1994), y los peces son importantes depredadores que ejercen una fuerte presión sobre el resto de las poblaciones (Belgrano et al. 2006). Sin embargo, resulta muy difícil demostrar la competencia por recursos tróficos, debido principalmente a que existen otros factores sinérgicos que afectan a la comunidad y cuyo efecto es difícil de identificar y ponderar de manera aislada. Por tal razón, es muy importante la realización de estudios de composición y superposición de dietas en asociaciones de especies con hábitos y morfologías similares. Estas investigaciones pudieran mostrar evidencias de competencia entre las especies por los recursos tróficos o, en su defecto, evidenciar mecanismos alternativos que expliquen la coexistencia de las especies de peces demersales de fondos blandos. En el Pacífico central mexicano son escasos los trabajos que abordan análisis tróficos de las especies de raya. Sólo se han localizado los estudios de Valadez–González et al. (2000, 2001, 2006) sobre tres especies de raya capturadas en la costa de Jalisco y Colima.
Los objetivos de este trabajo fueron determinar el patrón espacial de distribución, caracterizar el espectro trófico, medir la amplitud del nicho, analizar los cambios en la alimentación en relación con factores espaciales y temporales, e investigar las interacciones tróficas de tres especies de raya de la familia Urotrygonidae: Urobatis halleri (Cooper 1863), Urotrygon munda Gill 1863 y Urotrygon rogersi (Jordan y Starks 1895). La especie U. munda ha sido reportada anteriormente para el área de estudio como U. asterias (Aguilar–Palomino et al. 1996, 2001; Valadez–González et al. 2006), nombre que debe ser considerado en la sinonimia de esta especie.
MATERIAL Y MÉTODOS
El área de muestreo está localizada en el extremo sur de la costa del estado de Jalisco, en el Pacífico central mexicano (19°10'30" N, 104°42'45" W; 19°21'11" N, 105°01'43" W; fig. 1). Esta región presenta una convergencia de dos sistemas de corrientes importantes: la Corriente de California (CC) y la Contracorriente Norecuatorial (CCNE). El predominio alterno de estas corrientes produce cambios en los patrones hidroclimáticos (Pacheco 1991, Filonov et al. 2000, Kessler 2006), y determina los ciclos estacionales de las comunidades de zooplancton (Franco–Gordo et al. 2001a, 2001b, 2003), peces costeros (Godínez–Domínguez et al. 2000) y macroinvertebrados bentónicos de fondos blandos (Godínez–Domínguez et al. 2009).
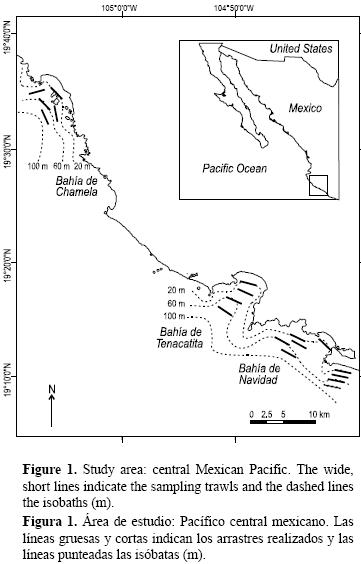
Se realizaron 41 arrastres entre octubre de 2007 y octubre de 2008 con redes tipo camaronero (12 m de boca) en cuatro estratos de profundidad de los fondos blandos: 20 m (n = 18), 40 m (n = 12 ), 60 m (n = 5) y 80 m (n = 6). Los arrastres fueron nocturnos con una duración de 30 min y sus posiciones se determinaron por medio de un Sistema Global de Posicionamiento (GPS). El total de la captura se colocó en hielo y se trasladó inmediatamente a los laboratorios para ser procesado. Para la estimación de la abundancia se utilizó el número de individuos capturados por unidad de área (CPUA). Para determinar el área barrida por cada arrastre (hectáreas), se multiplicó la distancia recorrida por la longitud de operación de la boca de ambas redes de arrastre (ver González–Sansón et al. 1997).
Las tres especies de raya se recolectaron durante los dos periodos hidroclimáticos existentes en el área: el periodo cálido o de influencia de la CCNE (T1), que se extiende de julio a diciembre, y el periodo frío o de influencia de la CC (T2), el cual se extiende de enero a junio. Las rayas fueron contadas y separadas del resto de los organismos capturados para determinar su longitud total (centímetros) y peso total (gramos). El sexo se determinó por la presencia o ausencia de pterigopodios (claspers). A cada una de las rayas se le extrajo el estómago para su posterior análisis en el laboratorio. Los estómagos se congelaron (–4 °C) hasta su procesamiento en el laboratorio. Los organismos encontrados dentro de cada estómago se identificaron hasta el taxón más bajo posible con la ayuda de claves especializadas para cada grupo (Keen 1971; Brusca 1980; Fischer et al. 1995; Hendrickx 1996, 1997a, 1997b; Hendrickx y Estrada–Navarrete 1996; De León–González et al. 2009). Los estómagos de las rayas se agruparon por especie, periodo de estudio, clase de talla y sexo. No se consideraron los estómagos vacíos para los análisis.
Para determinar la suficiencia del número de estómagos analizados, se generaron curvas de acumulación de presas para cada especie de raya por periodo de estudio, clase de talla y sexo por medio de un procedimiento de remuestreo con 50 aleatorizaciones usando el programa EstimateS 8.2 (Colwell 2009).
Los componentes alimentarios encontrados en los estómagos se cuantificaron de acuerdo con los siguientes métodos: numérico (%N = N¡ /Nt, donde N¡ es el número de organismos encontrados de una categoría ¡ y Nt es el número total de organismos encontrados de todas las categorías); gravimétrico (%P = Pi /Pt donde P¡ es el peso de la categoría i y Pt, es el peso total de todas las categorías encontradas); frecuencia de ocurrencia (%FO = N0/Ns, donde N0 es el número de ocurrencias de la categoría i y Ns es el número total de estómagos analizados); y el índice de importancia relativa (IIR = (%N + %P) x %FO) (Pinkas et al. 1971), que permite valorar la importancia de cada categoría alimentaria en la dieta y es expresado en porcentaje (Cortés 1997).
Se estimó el índice de Smith (1982) para conocer la amplitud del subnicho trófico y se calculó el índice de Pianka (1973) para conocer la superposición de las dietas, ambos según los procedimientos de Krebs (1999). Los cálculos se realizaron con el programa Ecological Methodology 7.0. Estos índices se estimaron con los valores porcentuales de peso (%P) que contribuyen cada uno de los grupos de presas.
Se utilizaron los valores del índice de Pianka trasformados a distancia (1 – Pianka) para analizar las asociaciones en función de las dietas de las especies de raya por periodo de estudio, clase de talla y sexo. Se empleó el método de escalamiento multidimensional no métrico (nMDS) y el análisis de clasificación numérica jerárquica aglomerativa (promedio aritmético de grupos de pares no ponderados, UPGMA). Los análisis se hicieron con el programa STATISTICA 7.0.
Se calcularon porcentajes de similitud y disimilitud (SIMPER) para identificar la importancia de los grupos de presas en la dieta de las especies de raya en cada periodo (similitud) y entre periodos (disimilitud). Los análisis se hicieron con el programa PRIMER versión 5.2.2 (Clarke y Gorley 2004).
RESULTADOS
Distribución batimétrica de la abundancia de rayas
Se observó un patrón similar de la distribución de la CPUA con respecto a la profundidad para las tres especies de raya estudiadas (fig. 2). La distribución batimétrica mostró una marcada predilección de las tres especies por los 20 m de profundidad en ambos periodos hidroclimáticos (T1 y T2). Las valores bajos de CPUA a 40 m de profundidad y la práctica ausencia de valores a los 60 y 80 m indican un intervalo estrecho de distribución costera de estas especies.
Descripción general de las dietas
Se examinaron un total de 579 estómagos de las tres especies de raya, pero sólo se consideraron 471 (81.3%), ya que los demás se encontraban vacíos; 204 estómagos se analizaron en el periodo T1 y 267 en el periodo T2 (tabla 1). Las presas encontradas se agruparon en 26 categorías (18 crustáceos, 2 poliquetos, 4 peces y 2 moluscos) para posibilitar la comparación (tabla 2).
Se analizaron 175 estómagos de U. halleri, de los cuales 32 estaban vacíos. La dieta de esta especie estuvo compuesta principalmente de microcrustáceos, como carídeos y larvas de estomatópodos y braquiuros (>80% IIR), y presentó cambios importantes entre los periodos de estudio (tabla 2). Durante el periodo T1 la dieta estuvo compuesta principalmente de tres categorías: Processidae, larvas de estomatópodos y larvas de braquiuros (>96% IIR). Durante el periodo T2, las categorías de mayor importancia en la dieta fueron amfípodos, carídeos (Ogyriididae y Processidae), Portunus asper y peneidos (>93% IIR).
Se analizaron 268 estómagos de U. munda, de los cuales 53 se encontraron vacíos. Los crustáceos fueron el alimento principal para esta especie. En el periodo T1 se identificaron dos categorías como principales componentes en la dieta: Processidae (77.68% IIR) y Ogyriididae (18.85% IIR). Para el periodo T2 se identificaron estas dos mismas categorías, pero con diferentes proporciones: Processidae con el 52.38% IIR y Ogyriididae con el 44.52% IIR (tabla 2).
Se examinaron 136 estómagos de U. rogersi, de los cuales 23 resultaron vacíos. Esta especie se alimentó principalmente de microcrustáceos, Processidae (89.6% IIR) y Ogyriididae (4.62% IIR). Durante el periodo T2 se presentaron estas dos categorías en la dieta (54.4% y 34.7% IIR, respectivamente), así como Penaeidae (6.9% IIR) (tabla 2).
Se considera que el número de estómagos analizados es el adecuado para describir la dieta de las tres especies de raya en este estudio, ya que las curvas muestran una tendencia hacia la asíntota, con excepción de la comparación entre clases de talla de U. rogersi para T1, en la cual hubiera sido deseable un tamaño de muestra mayor (fig. 3).
Amplitud del subnicho trófico
Los valores del índice de Smith para U. halleri indican un cambio del periodo T1, cuando los valores promedio para las tres clases de talla variaron entre 0.51 y 0.62, al periodo T2, cuando los valores promedio variaron de 0.82 a 0.92 (fig. 4a). En relación con los sexos, también se encontraron los valores más altos durante el periodo T2 (fig. 4b). No se observaron diferencias entre las tallas ni entre los sexos dentro de cada periodo.
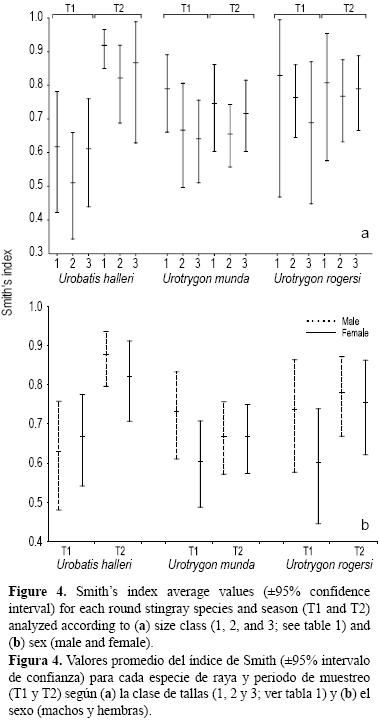
Los valores del índice de Smith para U. munda y U. rogersi no mostraron diferencias entre periodos; tampoco presentaron ningún patrón dentro de los periodos relacionado con la talla o el sexo (fig. 4a, b).
Superposición de dietas e interacciones tróficas
Existe una clara diferenciación en la superposición de las dietas, con base en el índice de Pianka, para las tres especies de raya entre los dos periodos de muestreo (fig. 5). El principal factor de agrupación fue la estacionalidad y no se evidenciaron patrones relacionados con la talla y el sexo de las tres especies de raya.
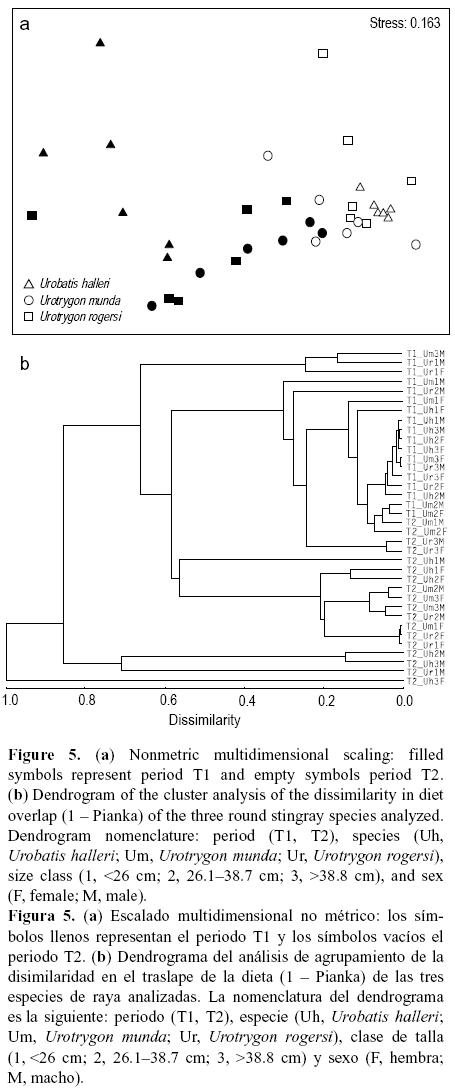
Según el análisis de similitud de las dietas de las tres especies de raya, las categorías que tipificaron las asociaciones de presas durante T1 fueron principalmente Processidae, con un intervalo del porcentaje de similitud de 32.5% a 51.3%, seguidos de lejos por los peces (6.4% a 12.4%) y las larvas de braquiuros, que fueron importantes para U. rogersi (8.6%) y U. halleri (19.86%). Ogyriididae resultó importante para U. munda (22.7%) y U. rogersi (13.9%) (tabla 3). Las categorías de presas que tipificaron la dieta de las rayas en T2 fueron Processidae (18.8% a 28.7%), Ogyriididae (11.4% a 36.2%) y Portunus asper (8.3% a 20.4%). El grupo de presas que tipificaron la disimilitud entre las temporadas para las tres especies de raya fueron Penaeidae, Processidae, Portunus asper, peces y Squillidae.
DISCUSIÓN
Las especies del orden Rajiformes se caracterizan por tener la boca en la parte ventral del cuerpo. Ésta es una restricción morfológica que influye directamente en los hábitos alimentarios de estos organismos, los cuales consumen organismos que se encuentran sobre el fondo marino (bentos). En los estudios tróficos sobre las especies del orden Rajiformes alrededor del mundo, se describen las estrategias alimentarías de estas especies para conseguir su alimento. En general, los diferentes autores señalan a los patrones temporales y ontogénicos como determinantes en el comportamiento trófico de estas especies, ya que la abundancia de las presas durante ciertas temporadas del año y la relación entre la talla del depredador y las presas son fundamentales para definir la dieta de las especies. En cambio, el sexo no es un factor importante que influya en el comportamiento trófico de las especies de raya en sus hábitats (Treloar et al. 2007, San Martin et al. 2007, Belleggia et al. 2008, Saglam y Bascinar 2008, Barbini et al. 2010). Su alimentación se basa principalmente en crustáceos y peces pequeños de hábitos bentónicos, y con menor importancia en moluscos (Schlussel et al. 2010), poliquetos (Ebert y Cowley 2003) y zooplancton (Sampson et al. 2010).
En la mayoría de las comparaciones realizadas de los hábitos alimentarios, la curva acumulada de presas indica un comportamiento asintótico, con excepción de la comparación por tallas para U. rogersi. En este último caso, los resultados podrían estar sujetos a una nueva interpretación con un número de estómagos adicional; sin embargo, dado que los índices utilizados para analizar la superposición de la dieta y la amplitud del subnicho trófico están basados en la proporción del peso de las presas, el criterio de suficiencia de las muestras basado sólo en el número de presas pudiera resultar demasiado conservador.
Durante el periodo T1, los crustáceos y peces fueron los grupos de mayor importancia en la dieta de las especies de raya consideradas en este estudio, mientras que durante el periodo T2 disminuyó el consumo de peces y el de crustáceos se elevó. Estos resultados difieren con lo reportado por Valadez–González et al. (2001, 2006), quienes no encontraron variabilidad estacional en las dietas de estas especies en años anteriores. El incremento de crustáceos en la dieta y el detrimento de los peces durante el periodo T2 podría estar determinado por un incremento en la disponibilidad de crustáceos, ya que en esta zona está documentado el desplazamiento estacional de la comunidad de macroinvertebrados bentónicos de fondos blandos hacia aguas someras (20 m) durante los periodos de influencia de la CC (T2) (Godínez–Domínguez y González–Sansón 1998).
Las categorías de presas que tipificaron la similitud de la dieta en cada periodo fueron básicamente las mismas especies que tipificaron la disimilitud entre las temporadas para las tres especies de raya, lo cual se explica por el hecho de que dichas presas aparecen durante ambos periodos y sólo varían en el porcentaje de importancia. El mismo argumento sirve para explicar el cambio observado en la amplitud del subnicho trófico de U. halleri. Dicha variación se debió, principalmente, a cambios sutiles en el número y contribución de algunas especies de un periodo a otro. Los cambios estacionales en la dieta basados en cambios en la disponibilidad de las presas se han documentados para varias especies de raya en el mundo (Muto et al. 2001, Collins et al. 2007, San Martin et al. 2007, Moura et al. 2008, Sommerville et al. 2011). Braccini y Perez (2005) y Saglam y Bascinar (2008) indican que los cambios en las dietas son producto de la versatilidad que tienen los Rajiformes de cambiar su alimentación en respuesta a la abundancia de las presas en el medio, más que a la preferencia o selectividad de alimento (Rinewalt et al. 2007).
Para varias especies de Rajiformes, se han documentado cambios ontogénicos en la dieta. Un patrón de cambio de dieta durante el crecimiento de varias especies de raya alrededor del mundo podría resumirse como: depredadores de crustáceos cuando jóvenes y, al alcanzar tallas mayores, los peces constituyen una parte importante de su dieta (Koen–Alonso et al. 2001, Valadez–González et al. 2006, Bizarro et al. 2007, Belleggia et al. 2008, Moura et al. 2008, Sommerville et al. 2011). Estas especies incorporan a los peces y otros organismos a la dieta conforme desarrollan su capacidad y habilidad para capturarlos (Sommerville et al. 2011), ya que los principales cambios en la dieta están en función del tamaño del depredador (Ebert y Cowley 2003, Bizarro et al. 2007, Barbini et al. 2010, Schlussel et al. 2010) y de la morfología de la boca (Smith y Merriner 1985, Fariasa et al. 2006, Collins et al. 2007, Treloar et al. 2007, Marshall et al. 2008, Barbini et al. 2010). Existen otros factores que interactúan con los anteriores y que están relacionados con cambios en la dieta a lo largo de gradientes batimétricos o hábitats, los cuales podrían explicarse por los cambios en la distribución de las presas en el gradiente (Ebert y Cowley 2003, Bizarro et al. 2007). Los resultados del presente estudio muestran que no existen cambios ontogénicos en la dieta de U. halleri, U. munda y U. rogersi, lo cual concuerda con lo reportado por Valadez–González et al. (2001, 2006), quienes no encontron una diferenciación trófica con relación a la talla de estas especies en el área de estudio.
Si bien la mayoría de las rayas responden a estrategias alimentarias de tipo generalista con amplios subnichos tróficos, existen algunos ejemplos de estrategias especialistas cuya dieta se basa en un espectro de presas reducido (Smith y Merriner 1985, Bruno et al. 2000, Mabragaña et al. 2005, Sampson et al. 2010). También es frecuente encontrar reportes sobre los cambios en la amplitud del subnicho trófico relacionados con la talla y la época del año (Brickle et al. 2003, Braccini y Perez 2005, Treloar et al. 2007, Marshall et al. 2008, Moura et al. 2008, Schlussel et al. 2010,
Sommerville et al. 2011), lo cual refuerza la idea de que las rayas tienen la capacidad de adaptarse como parte de la estrategia generalista oportunista (Brickle et al. 2003, Collins et al. 2007). De acuerdo con Colloca (2010), la especialización incrementa el potencial de la competencia entre especies de peces de sistemas demersales, lo cual incluye a las rayas.
Las tres especies de raya estudiadas mostraron un patrón similar de uso de hábitat, el cual se caracteriza por ser un intervalo batimétrico estrecho de fondos blandos someros, donde los organismos se distribuyen sin ninguna pauta espacial relacionada con la talla o sexo. Al no existir diferencias en las abundancias de las tres especies de raya estudiadas, ni un patrón de ocurrencia espacial o estacional diferenciado, ni migraciones aparentes, ni diferencias en los intervalos de tallas entre las tres especies, cabría esperar una dominancia marcada de alguna de éstas por el principio de exclusión competitiva, en caso de ser la competencia un factor importante entre las especies estudiadas. En conclusión, las relaciones como competencia y depredación tuvieron poca influencia sobre la estructura y funcionamiento de las poblaciones de las rayas estudiadas, lo cual coincide con lo propuesto por González–Sansón y Aguilar–Palomino (datos no publicados) para la asociación de peces demersales de fondo blando en el Pacífico central mexicano. Se ha aceptado el argumento de que la partición de recursos es una de las estrategias principales para eludir la competencia entre especies y entre los individuos de una población; sin embargo, existen diversos ejemplos en los que una gran diversidad y abundancia de crustáceos permiten la explotación de éstos por un gran número de depredadores, evitando relaciones competitivas entre las especies de depredadores (Platell et al. 1998, Marshall et al. 2008). La coexistencia entre especies con dietas similares y un subnicho trófico estrecho puede ser posible por el hecho de que las poblaciones de dichas especies puedan permanecer por debajo de la capacidad de carga, por lo que los recursos no serían un factor limitante (Colwell y Futuyma 1971).
REFERENCIAS
Aguilar–Palomino B, Mariscal–Romero J, González–Sansón G, Rodríguez–Ibarra LE. 1996. Ictiofauna demersal de fondos blandos de la plataforma continental de Jalisco y Colima, México, en la primavera de 1995. Cienc. Mar. 22: 469–481. [ Links ]
Aguilar–Palomino B, Pérez–Reyes C, Galván–Magaña F, Abitia–Cárdenas LA. 2001. Ictiofauna de la Bahía de Navidad, Jalisco, México. Rev. Biol. Trop. 49: 173–190. [ Links ]
Allen GR, Robertson DR. 1994. Fishes of the Tropical Eastern Pacific. Hawaii Univ. Press, Hawaii, 332 pp. [ Links ]
Barbini SA, Scenna LB, Figueroa DE, Cousseau MB, Díaz de Astarloa JM. 2010. Feeding habits of the Magellan skate: Effects of sex, maturity stage, and body size on diet. Hydrobiologia 641: 275–286. [ Links ]
Belgrano A, Scharler UM, Dunne J, Ulanowicz RE. 2006. Aquatic Food Webs. An Ecosystem Approach. Oxford Univ. Press, Oxford, 262 pp. [ Links ]
Belleggia M, Mabragaña E, Figueroa DE, Scenna LB, Barbini SA, Díaz de Astarloa JM. 2008. Food habits of the broad nose skate, Bathyraja brachyurops (Chondrichthyes, Rajidae), in the southwest Atlantic. Sci. Mar. 72: 701–710. [ Links ]
Bizarro JJ, Robinson HJ, Rinewalt CS, Ebert DA. 2007. Comparative feeding ecology of four sympatric skate species off central California, USA. Environ. Biol. Fish. 80: 197–220. [ Links ]
Braccini JM, Perez JE. 2005. Feeding habits of the sandskate Psammobatis extenta (Garman 1913): Sources of variation in dietary composition. Mar. Freshwat. Res. 56: 395–403. [ Links ]
Brickle P, Laptikhovsky V, Pompert P, Bishop A. 2003. Ontogenetic changes in the feeding habits and dietary overlap between three abundant rajid species on the Falkland Islands' shelf. J. Mar. Biol. Assoc. UK 83: 1119–1125. [ Links ]
Bruno C, Cousseau MB, Bremec C. 2000. Contribution of the polychaete annelids to the diet of Cheilodactylus bergi (Pisces, Cheilodactylidae) in Argentina. Bull. Mar. Sci. 67: 277–286. [ Links ]
Brusca RC.1980. Common Intertidal Invertebrates of the Gulf of California. 2nd ed. University of Arizona Press, Tucson, 513 pp. [ Links ]
Clarke KR, Gorley RN. 2004. PRIMER v5: User Manual/Tutorial. PRIMER–E, Plymouth Marine Laboratory, UK. [ Links ]
Collins AB, Heupel MR, Hueter RE, Motta PJ. 2007. Hard prey specialists or opportunistic generalists? An examination of the diet of the cownose ray, Rhinoptera bonasus. Mar. Freshwat. Res. 58: 135–144. [ Links ]
Colloca F, Carpentieri P, Balestri E, Ardizzone G. 2010. Food resource partitioning in a Mediterranean demersal fish assemblage: The effect of body size and niche width. Mar. Biol. 157: 565–574. [ Links ]
Colwell RK. 2009. EstimateS: Statistical estimation of species richness and shared species from samples. Version 8.2. User's Guide and Application published at http://purl.oclc.org/estimates. [ Links ]
Colwell RK, Futuyma DJ. 1971. On the measurement of niche breadth and overlap. Ecology 52: 567–576. [ Links ]
Coronado–Molina C, Amezcua–Linares F. 1988. Distribución y abundancia de los peces demersales de la costa de Guerrero, en el Pacífico de México. An. Inst. Cienc. Mar Limnol. Univ. Nac. Autón. México 15: 67–93. [ Links ]
Cortés E. 1997. A critical review of methods of studying fish feeding based on analysis of stomach contents: Application to elasmobranch fishes. Can. J Fish. Aquat. Sci. 54: 726–738. [ Links ]
De León–González JA, Bastida–Zavala JR, Carrera–Parra LF, García–Garza ME, Peña–Rivera A, Salazar–Vallejo SI, Solís–Weiss (eds.). 2009. Poliquetos (Annelida: Polychaeta) de México y America Tropical. Universidad Autónoma de Nuevo León, Monterrey, México, 737 pp. [ Links ]
Ebert DA, Cowley PD. 2003. Diet, feeding behaviour and habitat utilisation of the blue stingray Dasyatis chrysonota (Smith, 1828) in South African waters. Mar. Freshwat. Res. 54(8): 957–965. [ Links ]
Ebert DA, Cowley PD, Compagno LJV. 1991. A preliminary investigation of the feeding ecology of skates (Batoidea: Rajidae) off the west coast of southern Africa. S. Afr. J Mar. Sci. 10: 71–81. [ Links ]
Fariasa I, Figueiredo I, Moura T, Serrano–Gordo L, Neves ABS–P. 2006. Diet comparison of four ray species (Raja clavata, Raja brachyura, Raja montagui and Leucoraja naevus) caught along the Portugese continental shelf. Aquat. Living Resour. 19: 105–114. [ Links ]
Filonov AE, Tereshchenko IE, Monzón CO, González–Ruelas ME, Godínez–Domínguez E. 2000. Variabilidad estacional de los campos de temperatura y salinidad en la zona costera de los estados de Jalisco y Colima, México. Cienc. Mar. 26: 303–321. [ Links ]
Fischer W, Krupp F, Scheinder W, Sommer C, Carpenter KE, Niem VH (eds.). 1995. Guía FAO para la identificación de especies para los fines de la pesca. Pacífico centro–oriental. FAO, Rome (Vols. I–II–III). [ Links ]
Follesa MC, Mulas A, Cabiddu S, Portu C, Deiana AM, Cau A. 2010. Diet and feeding habits of two skate species, Raja brachyura and Raja miraletus (Chondrichthyes, Rajidae), in Sardinian waters (central–western Mediterranean). Ital. J. Zool. 77: 53–60. [ Links ]
Franco–Gordo C, Godínez–Domínguez E, Suárez–Morales E. 2001a. Zooplankton biomass variability in the Mexican eastern tropical Pacific. Pac. Sci. 55: 191–202. [ Links ]
Franco–Gordo C, Suárez–Morales E, Godínez–Domínguez E, Flores–Vargas R. 2001b. A seasonal survey of the fish larvae community of the central Pacific coast of Mexico. Bull. Mar. Sci. 68: 383–396. [ Links ]
Franco–Gordo C, Godínez–Domínguez E, Suárez–Morales E. 2003. Zooplankton diversity in the central Mexican Pacific. Estuar. Coast. Shelf Sci. 57: 111–121. [ Links ]
Gerking SD. 1994. Feeding Ecology of Fish. Academic Press, San Diego, California, 416 pp. [ Links ]
Godínez–Domínguez E, González–Sansón G. 1998. Variación de los patrones de distribución batimétrica de la fauna macrobentónica en la plataforma continental de Jalisco y Colima, México. Cienc. Mar. 24: 337–351. [ Links ]
Godínez–Domínguez E, Rojo–Vázquez JA, Galván–Piña VH, Aguilar–Palomino B. 2000. Changes in the structure of a coastal fish assemblage exploited by a small scale gillnet fishery during an El Niño–La Niña event. Estuar. Coast Shelf Sci. 51: 773–787. [ Links ]
Godínez–Domínguez E, Freire J, Franco–Gordo C, González–Sansón G. 2009. Decomposing diversity patterns of a soft–bottom macroinvertebrate community in the tropical eastern Pacific. J. Mar. Biol. Assoc. UK 89: 31–38. [ Links ]
González–Sansón G, Aguilar–Palomino B, Arciniega–Flores J, García de Quevedo–Machaín R, Godínez–Domínguez E, Landa–Jaime V, Mariscal–Romero J, Michel–Morfín JE, Saucedo–Lozano M. 1997. Variación espacial de la abundancia de la fauna de fondos blandos en la plataforma continental de Jalisco y Colima, México (primavera 1995). Cienc. Mar. 23: 93–110. [ Links ]
Hendrickx ME. 1996. Los Camarones Penaeoidea Bentónicos (Crustacea: Decapoda: Dendrobranchiata) del Pacífico Mexicano. CONABIO. Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, 147 pp. [ Links ]
Hendrickx ME. 1997a. Los Cangrejos Braquiuros (Crustacea: Brachyura: Dromiidae hasta Leucosiidae) del Pacífico Mexicano. CONABIO. Instituto de Ciencias del Mar y Limnología. Universidad Nacional Autónoma de México, 178 pp. [ Links ]
Hendrickx ME. 1997b. Los Cangrejos Braquiuros (Crustacea: Brachyura: Majoidea y Parthenopoidea) del Pacífico Mexicano. CONABIO. Instituto de Ciencias del Mar y Limnología. Universidad Nacional Autónoma de México, 274 pp. [ Links ]
Hendrickx ME, Estrada–Navarrete FD. 1996. Los Camarones Pelágicos (Crustacea: Dendrobranchiata y Caridea) del Pacífico Mexicano. CONABIO. Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, 157 pp. [ Links ]
Keen MA. 1971. Sea Shells of Tropical West America. Marine Molluscs from Baja California to Peru. Stanford Univ. Press, Stanford, California, 104 pp. [ Links ]
Kessler WS. 2006. The circulation of the eastern tropical Pacific: A review. Prog. Oceanogr. 69: 181–217. [ Links ]
Koen–Alonso M, Crespo EA, García NA, Pedraza SN, Mariotti PA, Berón–Vera B, Mora NJ. 2001. Food habits of Dipturus chilensis (Pisces: Rajidae) off Patagonia, Argentina. ICES J. Mar. Sci. 58: 288–297. [ Links ]
Krebs CJ. 1999. Ecological Methodology. Addison–Wesley, California, 620 pp. [ Links ]
Link JS, Stockhausen WT, Methratta ET. 2006. Food–web theory in marine ecosystems. In: Belgrano A, Scharler UM, Dunne J, Ulanowicz RE (eds.), Aquatic Food Webs. An Ecosystem Approach. Oxford Univ. Press, Oxford, pp. 98–113. [ Links ]
Mabragaña E, Giberto DA, Bremec CS. 2005. Feeding ecology of Bathyraja macloviana (Rajiformes: Arhynchobatidae): A polychaete–feeding skate from the southwest Atlantic. Sci. Mar. 69: 405–413. [ Links ]
Marshall AD, Kyne PM, Bennett MB. 2008. Comparing the diet of two sympatric urolophid elasmobranchs (Trygonoptera testacea Müller & Henle and Urolophus kapalensis Yearsley & Last): Evidence of ontogenetic shifts and possible resource partitioning. J. Fish Biol. 72: 883–898. [ Links ]
Moura T, Figueiredo I, Farias I, Serra–Pereira B, Neves A, Borges M, Serrano L. 2008. Ontogenetic dietary shift and feeding strategy of Raja undulata Lacepède, 1802 (Chondrichthyes: Rajidae) on the Portuguese continental shelf. Sci. Mar. 72: 311–318. [ Links ]
Muto EY, Soares LSH, Goitein R. 2001. Food resource utilization of the skates Rioraja agassizii (Müller and Henle 1841) and Psammobatis extenta (Garman 1913) on the continental shelf off Ubatuba, southeastern Brazil. Rev. Bras. Biol. 61: 217–238. [ Links ]
Navia AF, Mejía–Falla PA, Giraldo A. 2007. Feeding ecology of elasmobranch fishes in coastal waters of the Colombian eastern tropical Pacific. BMC Ecology 7: 8. [ Links ]
Orlov AM. 1998. The diet and feeding habits of some deep–water benthic skates (Rajidae) in the Pacific waters off the northern Kuril Islands and southeastern Kamchatka. Alaska Fish. Res. Bull. 5: 1–17. [ Links ]
Pacheco SP. 1991. Oceanografía física. In: De la Lanza G (ed.), Oceanografía de los Mares Mexicanos. AGT, México, pp. 151–159. [ Links ]
Pianka ER. 1973. The structure of lizard communities. Annu. Rev. Ecol. Syst. 4: 53–74. [ Links ]
Pinkas L, Oliphant MS, Iverson LK. 1971. Food habits of albacore, bluefin tuna, and bonito in Californian waters. Calif. Dept. Fish. Game Fish Bull. 152: 1–105. [ Links ]
Platell ME, Potter IC, Clarke KR. 1998. Resource partitioning by four species of elasmobranchs (Batoidea: Urolopidae) in coastal waters of temperate Australia. Mar. Biol. 131: 719–734. [ Links ]
Rinewalt CS, Ebert DA, Cailliet GM. 2007. The feeding habits of the sandpaper skate, Bathyraja kincaidii (Garman 1908), in central California: Seasonal variation in diet linked to oceanographic conditions. Environ. Biol. Fish. 80: 147–163. [ Links ]
Saglam H, Bascinar NS. 2008. Feeding ecology of thornback ray (Raja clavata Linnaeus 1758) on the Turkish coast of the south–eastern Black Sea. Mar. Biol. Res. 451–457. [ Links ]
Sampson L, Galván–Magaña F, De Silva–Dávila R, Aguíñiga–García S, O'Sullivan JB. 2010. Diet and trophic position of the devil rays Mobula thurstoni and Mobula japanica as inferred from stable isotope analysis. J. Mar. Biol. Assoc. UK 90: 969–976. [ Links ]
San Martin MJ, Braccini JM, Tamini LL, Chiaramonte GE, Perez JE. 2007. Temporal and sexual effects in the feeding ecology of the marbled sand skate Psammobatis bergi Marini 1932. Mar. Biol. 151: 505–513. [ Links ]
Schlussel V, Bennett MB, Collin SP. 2010. Diet and reproduction in the white–spotted eagle ray Aetobatus narinari from Queensland, Australia and the Penghu Islands, Taiwan. Mar. Freshwat. Res. 61: 1278–1289. [ Links ]
Smith EP. 1982. Niche breadth, resource availability, and inference. Ecology 63: 1675–1681. [ Links ]
Smith JW, Merriner JV. 1985. Food habits and feeding behaviour of the cownose ray, Rhinoptera bonasus, in lower Chesapeake Bay. Estuaries 8: 305–310. [ Links ]
Smith WD, Bizzarro JJ, Cailliet GM. 2009. The artisanal elasmobranch fishery on the east coast of Baja California, Mexico: Characteristics and management considerations. Cienc. Mar. 35: 209–236. [ Links ]
Sommerville E, Platell ME, White WT, Jones AA, Potter IC. 2011. Partitioning of food resources by four abundant, co–occurring elasmobranch species: Relationships between diet and both body size and season. Mar. Freshwat. Res. 62: 54–65. [ Links ]
Treloar MA, Laurenson LJB, Stevens JD. 2007. Dietary comparisons of six skate species (Rajidae) in southeastern Australian waters. Environ Biol. Fish. 80: 181–196. [ Links ]
Valadez–González C, Aguilar B, Hernández S. 2000. Dieta de la raya (Narcine entemedor) en la plataforma continental de Jalisco y Colima, México. Bol. Cent. Invest. Biol. 34: 1–20. [ Links ]
Valadez–González C, Aguilar–Palomino B, Hernández–Vázquez S. 2001. Hábitos alimentarios de la raya Urobatis halleri (Cooper 1863) (Chondrichthyes: Urolophidae) capturada en la plataforma continental de Jalisco y Colima, México. Cienc. Mar. 27: 91–104. [ Links ]
Valadez–González MC, Saucedo–Lozano M, Raymundo–Huizar AR. 2006. Aspectos tróficos de las rayas bentónicas de Jalisco y Colima. In: Jiménez–Quiroz MC, Elaine Espino–Barr E (eds.), Los Recursos Marinos y Acuícolas de Jalisco, Colima y Michoacán. INP–SAGARPA, México, pp. 235–249. [ Links ]
*English translation by Christine Harris.
**Descargar versión bilingüe (Inglés–Español) en formato PDF.














