Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.36 no.3 Ensenada sep. 2010
Artículos
Efectos ambientales y espaciales en la distribución de tallas del pez vela en el Océano Atlántico*
Environmental and spatial effects on the size distribution of sailfish in the Atlantic Ocean**
BL Mourato1, 2, HG Hazin1, C Wor1, P Travassos1, CA Arfelli3, AF Amorim3, FHV Hazin1
1 Departamento de Pesca e Aqüicultura, Universidade Federal Rural de Pernambuco (DEPAq–UFRPE), R. Dom Manoel de Medeiros s/n, Dois Irmaos 52171–900, Recife, PE, Brasil.
2 Departamento de Oceanografia, Universidade Federal de Pernambuco (UFPE), Cidade Universitária, 50670–901, Recife, PE, Brasil. E–mail: bruno.pesca@gmail.com
3 Instituto de Pesca, APTA/SAA/SP, Santos, SP, Brasil.
Received March 2010
Accepted June 2010
RESUMEN
Se aplicó un análisis de regresión generalizado y predicción espacial (GRASP) para describir las preferencias de hábitat de jóvenes y adultos del pez vela (Istiophorus platypterus) en el Atlántico ecuatorial y sudoccidental, con base en factores ambientales y espaciales. Se analizaron 9954 datos de talla de la longitud mandíbula inferior a la horquilla (7541 individuos capturados por palangre y 2413 en redes de enmalle) de la base de datos de la Comisión Internacional para la Conservación del Atún Atlántico de 1998 a 2007. Se consideraron cuatro variables ambientales: la temperatura superficial del mar, la profundidad de la capa de mezcla, la concentración de clorofila y la batimetría. Los resultados indican que los adultos fueron más frecuentes al este de 25°W, en áreas con capas de mezcla más superficiales (<30 m), entre 3000 y 6000 m de profundidad, y temperaturas superficiales menores a 24°C. La proporción de adultos fue mayor a concentraciones de clorofila entre 0.3 y 0.8 mg m–3. También se observaron densidades altas de adultos al oeste de 40°W, tanto en el norte como en el sur del área de estudio. Los jóvenes presentaron una tendencia opuesta, ya que parecen asociarse con aguas con temperaturas superficiales mayores a 28°C y capas de mezcla más profundas (>50 m) del lado occidental, particularmente entre 10–20°S y 25–35°W.
Palabras clave: pez vela, tallas, predicción espacial, GRASP, Atlántico Sur.
ABSTRACT
Generalized regression analysis and spatial prediction (GRASP) was applied to size data for sailfish (Istiophorus platypterus) to better describe its preferential habitats in relation to juveniles and adults, based on environmental and spatial factors in the equatorial and southwestern Atlantic. We analyzed a total of 9954 lower jaw fork length size data (7541 fish caught by longline and 2413 by gillnet) from the International Commission for the Conservation of Atlantic Tunas database for 1998 to 2007. Four main environmental variables were considered: sea surface temperature (SST), mixed layer depth, chlorophyll concentration, and bathymetry. Results indicated that adults were more frequent to the east of 25°W in areas with a shallow mixed layer (<30 m), between 3000 and 6000 m depth, and SSTs lower than 24°C. The proportion of adults was highest at chlorophyll concentrations between 0.3 and 0.8 mg m–3. High adult densities were also observed to the west of 40°W, both in the northern and southern parts of the study area. An opposite trend was observed in relation to juveniles, since they appear to be associated with waters with SSTs higher than 28°C and a deep mixed layer (>50 m) on the western side, particularly between 10–20°S and 25–35°W.
Key words: sailfish, size data, spatial prediction, GRASP, South Atlantic.
INTRODUCCIÓN
El pez vela, Istiophorus platypterus (Shaw y Nodder 1791), es un recurso importante para las pesquerías comercial y recreacional, y se captura en océanos tanto tropicales como subtropicales. Según algunos autores, comprende especies del Atlántico y del Indo–Pacífico (Nakamura 1985), pero los datos genéticos son consistentes con la existencia de una sola especie (Finnerty y Block 1995, Graves 1998) con una distribución global (Beardsley et al. 1975); por tanto, el pez vela junto con el marlin azul, Makaira nigricans, son los únicos peces picudos pandémicos de la familia Istiophoridae (Nakamura 1985). Debido a su naturaleza altamente migratoria, el pez vela es capturado por varias naciones con diferentes artes de pesca y, por tanto, se requiere de una administración internacional, la cual en el Océano Atlántico cae bajo la jurisdicción de la Comisión Internacional para la Conservación del Atún Atlántico (ICCAT, por sus siglas en inglés). Actualmente existe una gran preocupación a nivel mundial por los efectos de la pesca sobre las poblaciones de peces picudos en el Atlántico. La mortalidad incidental en la pesca con palangre de túnidos y peces espada representa uno de los principales impactos sobre las poblaciones de peces picudos en el Océano Atlántico (Uozomi 2003). En el Atlántico oriental tropical también se capturan incidentalmente grandes cantidades de peces picudos en las pesquerías europeas de redes de cerco (Gaertner et al. 2002), y por las flotas artesanales, como la de canoas, en Ghana (ICCAT 2009). Asimismo, los peces picudos son un importante recurso para varias pesquerías costeras y artesanales en el Caribe, así como para pesquerías recreacionales, especialmente en los Estados Unidos, Venezuela, Brasil y varios países caribeños (Peel et al. 2003). En la más reciente evaluación del pez vela, con datos hasta 2008, los resultados indican una reducción en la biomasa de las poblaciones de pez vela, particularmente en el Atlántico oriental; sin embargo, los análisis de esta evaluación se vieron fuertemente obstaculizados por la falta de datos precisos (ICCAT 2009). Uno de los principales requerimientos para una evaluación apropiada de la condición poblacional es el conocimiento de la estructura geográfica de las poblaciones y la identificación de las principales zonas donde se encuentran las diferentes clases de talla, así como de la influencia de los factores ambientales sobre su distribución.
Los datos de frecuencia de tallas de la pesquería comercial con palangre siempre han proporcionado información valiosa para poder entender los cambios en la estructura de edad de las poblaciones y la variabilidad estacional en la distribución de túnidos y especies afines en relación con factores ambientales y espaciales. Se han empleado varios métodos para evaluar la oceanografía pesquera de especies pelágicas, incluyendo modelos lineales generalizados, modelos basados en hábitats, modelos aditivos generalizados, modelos de árboles de regresión y sistemas de información geográfica (Swartzman et al. 1992; Hinton y Nakano 1996; Zheng et al. 2002; Venables y Dichmond 2004; Valavanis et al. 2004, 2008). Otro enfoque es el uso de técnicas de predicción espacial con base en algoritmos de interpolación (e.g., kriging), los cuales generalmente requieren una gran cantidad de datos bien distribuidos. Este requerimiento es raramente alcanzable con datos pesqueros, especialmente cuando la especie bajo estudio no constituye el objetivo principal de la pesquería, como normalmente sucede en el caso de los peces picudos (Ortiz y Arocha 2004).
Recientemente se desarrolló un método basado en modelos estadísticos para predicciones espaciales, llamado análisis de regresión generalizado y predicción espacial (GRASP, por sus siglas en inglés). Este método utiliza relaciones estadísticas entre las variables de respuesta (i.e., distribución de especies) y las variables ambientales para modelar la predicción espacial mediante mapas de predicción (Lehmann et al. 2002).
Como parte de la herramienta GRASP, se utilizan modelos aditivos generalizados (MAG) para ajustar las variables de respuesta a las variables ambientales explicativas usando una función suavizante no paramétrica (Hastie y Tibshirani 1990). Tal método ha resultado ser adecuado en el caso de los recursos pesqueros. Inicialmente se aplicó en el Océano Atlántico Sur para modelar la distribución espacial del pez espada (Xiphias gladius), usando datos de las pesquerías comerciales con palangre de Brasil (Hazin y Erzini 2008). En el presente trabajo se aplicó GRASP a los datos de talla del pez vela capturado con palangre y red de enmalle proporcionados por ICCAT, para un mejor entendimiento de la relación entre la distribución de tallas y los factores espaciales y ambientales.
MATERIALES Y MÉTODOS
Datos de talla
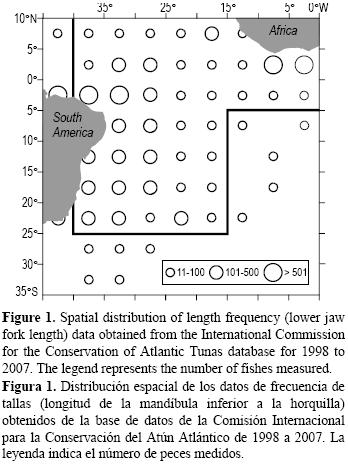
Se obtuvieron datos de la distribución de frecuencia de tallas (longitud de la mandíbula inferior a la horquilla [LMIH], en centímetros) de la base de datos de ICCAT de peces capturados por las pesquerías con palangre y redes de enmalle que operan en el Atlántico ecuatorial y sudoccidental. Los datos se agruparon en cuadrantes de 5° × 5° considerando la posición inicial de la operación de pesca, por mes, año, latitud y longitud, de 1998 a 2007. Se utilizó un total de 9954 datos de LMIH, de los cuales 7541 fueron de capturas de las flotas palangreras de Brasil, Venezuela y España, y 2413 fueron de capturas de las pesquerías con redes de enmalle que operan en Ghana, Costa de Marfil y Venezuela. La distribución espacial y la densidad de estos datos se muestran en la figura 1. Para evaluar la distribución espacial por longitud, se establecieron las siguientes dos clases de LMIH siguiendo los procedimientos descritos por Jolley (1977) y Mourato et al. (2009a): (a) <155 cm, individuos inmaduros (o jóvenes), y (b) >155 cm, individuos maduros (o adultos). Estos datos se transformaron en la proporción de jóvenes y adultos, por cuadrante de 5° × 5°, suponiendo una distribución binomial.
Datos ambientales
Se obtuvo una serie de tiempo de la temperatura superficial del mar y la profundidad de la capa de mezcla del Physical Oceanography Distributed Active Archive Center (PODAAC), del Jet Propulsion Laboratory de la NASA (1998–2007). La batimetría en el sitio de los lances de pesca se obtuvo del National Geophysical Data Center (ETOPO5, Earth Topography 5 min). La concentración de clorofila a se obtuvo de imágenes proporcionadas por el proyecto SeaWiFS, del Goddard Space Flight Center de la NASA y se convirtieron en datos numéricos (mg m–3). Estos datos, con una resolución original de 0.5° (excepto la concentración de clorofila a, la cual tuvo una resolución inicial de 9 km), fueron utilizados para construir una base de datos con una resolución de 5° × 5°, por mes, año, latitud y longitud. Subsecuentemente, estos datos se acoplaron con los datos de frecuencia de tallas.
Modelado
Se modeló la predicción espacial de la proporción de adultos (PR) como una función de las variables ambientales y espaciales usando GRASP v3.2 (Lehmann et al. 2002). En este modelo, las predicciones espaciales se obtienen por las relaciones entre una variable de respuesta (proporción de individuos en etapa adulta) y variables predictoras seleccionadas (variables ambientales y espaciales) mediante el ajuste de un MAG. La formulación general del MAG se expresa de la siguiente manera:
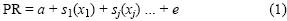
donde a es una constante, s1 es el efecto de la función suavizante para la variable independiente x1, y e es el error aleatorio de la función. Los efectos no lineales del modelo se ajustaron mediante el suavizado de funciones splines cúbicos naturales con cuatro grados de libertad. La selección de los grados de libertad se basó en una inspección visual y un análisis exploratorio. Tal método permite detectar los principales efectos y reduce los patrones espurios que pueden surgir de un sobreajuste (Maravelias et al. 2000). Se utilizó la distribución binomial con una función de enlace logit. Debido a una discontinuidad en la distribución espacial de las clases de LMIH, el análisis se restringió a la zona delimitada en la figura 1. Esto fue necesario debido a la menor capacidad predictiva de los modelos en áreas con baja densidad de datos.
La consistencia del modelo final se evaluó mediante (1) una regresión lineal entre los valores observados, seleccionados aleatoriamente, de la proporción de adultos y los generados por el modelo usando las variables independientes como entrada (validación simple), y (2) una validación cruzada que evaluó la bondad de ajuste del modelo. La correlación entre los valores observados y los pronosticados se estimó con el coeficiente de correlación de Pearson, mientras que la prueba de la característica operativa del receptor se utilizó para el modelo binomial. Tal característica indica el desempeño del modelo, independientemente del umbral de probabilidad aparentemente arbitrario en los modelos de proporción, donde se acepta la presencia de un rasgo objetivo (Fielding y Bell 1997). Se seleccionaron aleatoriamente 5000 longitudes de la base de datos de la frecuencia de tallas (además de las 9954 mediciones usadas en el modelo). Éstas se utilizaron exclusivamente para la validación cruzada y, por tanto, no se incluyeron en el modelo. Se seleccionaron los predictores usando un procedimiento paso a paso (stepwise) hacia adelante y hacia atrás, procediendo en ambas direcciones de un modelo completo y eliminando los predictores de acuerdo a una prueba F (α = 0.05). El efecto relativo de cada variable xj sobre la variable dependiente (en este caso la proporción de adultos) se evaluó mediante la distribución de residuales parciales.
RESULTADOS
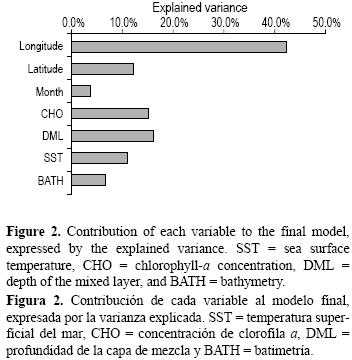
El modelo final explicó 52.8% de la varianza total, incluyendo latitud, longitud, temperatura superficial del mar, concentración de clorofila a, profundidad de la capa de mezcla y batimetría como variables continuas, y mes como un factor (tabla 1). La contribución relativa para cada variable en la varianza total explicada (52.8%) para el modelo seleccionado mostró que el efecto de longitud fue el factor más significativo en el análisis. Entre las variables ambientales, la profundidad de la capa de mezcla fue la más importante, seguida por la concentración de clorofila a, la temperatura superficial y la batimetría (fig. 2). En la tabla 1 se muestran los resultados de la validación simple y la validación cruzada. Los valores de la característica operativa del receptor (validación simple y validación cruzada, 0.78 y 0.81, respectivamente) indican que las predicciones se ajustaron razonablemente y se acoplaron bien con los datos.
La proporción de adultos aumentó a una concentración de clorofila a de 0.3 mg m–3, y permaneció bastante estable a mayores concentraciones (fig. 3). El efecto de la batimetría mostró que los peces vela adultos fueron más abundantes que los jóvenes a profundidades mayores que 4000 m. También se observó una mayor abundancia de adultos en zonas donde la profundidad de la capa de mezcla fue <20 m, así como en aguas con temperaturas superficiales <24°C (fig. 3). La proporción de adultos fue mayor en marzo y septiembre (fig. 3).
La predicción espacial (fig. 4) mostró que los adultos fueron más frecuentes al oeste de 40°W, tanto en la parte norte como en la parte sur del área de estudio, así como al este de 25°W. A lo largo de la costa brasileña, de 25°W a 40°W, la proporción de adultos fue muy baja, en particular entre 10°S y 25°S (fig. 4).
DISCUSIÓN
Un buen conocimiento de los hábitats esenciales de peces es crucial para el desarrollo de estrategias de manejo pesquero con base en un enfoque por ecosistemas (Valavanis et al. 2004). En el presente trabajo se utilizó la herramienta GRASP para describir las preferencias de hábitat de jóvenes y adultos de pez vela mediante datos ambientales, espaciales y de distribución de tallas. Existen varias aplicaciones de GRASP, incluyendo su uso para animales terrestres (Fraser et al. 2005), plantas (Lehmann et al. 2002, Zerger et al. 2009), pasto marino (Bekkby et al. 2008) y arrecifes coralinos (Garza–Pérez et al. 2004).
Aunque longitud como factor espacial proporcionó la mayor habilidad explicativa de la proporción de adultos, los efectos ambientales también fueron significativos. La inclusión de las variables ambientales en el análisis frecuentemente arrojó bajos niveles de explicación, ya que en general los datos ambientales y de pesca no se obtuvieron simultáneamente (Brill y Lutcavage 2001) y las relaciones no se describen bien a escalas de 5° en datos mensuales. Por otro lado, el ciclo de vida de muchas especies, en particular las que son altamente migratorias, está estrictamente relacionado con las condiciones ambientales que afectan su disponibilidad y vulnerabilidad (Fréon y Misund 1999). Por tanto, la inclusión de variables ambientales en el modelo es relevante para entender apropiadamente la distribución del pez vela en el Océano Atlántico Sur.
La proporción de adultos fue mucho más alta al este de 25°W. Esto concuerda con Beardsley (1980) y Prince y Goodyear (2006), quienes también indicaron que los peces vela de mayor tamaño se localizan en el lado oriental del Atlántico. Los datos de la distribución de tallas del pez vela del Océano Pacífico también muestran una tendencia similar a los del Atlántico Sur, encontrándose los individuos de mayor tamaño en el Pacífico oriental (Kume y Joseph 1969, Wares y Sakagawa 1974, Prince y Goodyear 2006). La diferencia en la distribución de tallas del pez vela en ambos lados del Atlántico Sur probablemente esté relacionado con su ciclo de vida y movimientos migratorios, los cuales, a su vez, probablemente se asocien con las diversas condiciones oceanográficas que afectan las preferencias de hábitat de jóvenes y adultos de forma diferente. Prince y Goodyear (2006), sin embargo, consideran que el mayor tamaño de los peces vela del Atlántico oriental y el Pacífico oriental es una posible consecuencia de la compresión de hábitat por hipoxia, la cual incrementa las oportunidades de emboscada de los individuos que se encuentran comprimidos en un nivel superficial somero junto con sus presas. El Atlántico oriental tropical se caracteriza por intensos eventos de surgencia y, consecuentemente, por una termoclina muy somera (~25 m) y una alta concentración de clorofila superficial. En las costas de Ghana, Costa de Marfil y Nigeria las surgencias se presentan estacionalmente, siendo débiles de enero a marzo e intensas de julio a septiembre (Longhurst 1962, Picaut 1983, Ibe y Ajayi 1985). En cambio, el Atlántico occidental presenta una capa superficial de agua templada, una termoclina profunda (~75 m) y una menor concentración de clorofila superficial (Hazin 1993, Becker 2001). Los jóvenes parecen asociarse con aguas de temperaturas superficiales >28°C del lado occidental, particularmente entre 10–20°S y 25–35°W. La mayor concentración de jóvenes en el lado occidental también puede ser resultado de su proximidad a la zona de desove, de donde posteriormente se dispersan conforme crecen (Mourato et al. 2009a). Los adultos, a su vez, parecen ser más comunes en el Atlántico oriental, observándose concentraciones altas cerca de la costa de África y en el Golfo de Guinea, una región muy rica en nutrientes y, por tanto, con mayores cantidades de presas potenciales para el pez vela, como son los clupleidos pequeños como Engraulis sp. y Sardinella sp. (Ovchinnikov 1971, Ibe y Ajayi 1985). El pez vela presenta un comportamiento alimenticio oportunístico y consecuentemente es atraido por las regiones con altas concentraciones de presas (Beardsley et al. 1975, Nakamura 1985).
El modelo utilizado en este análisis consideró cuatro variables ambientales principales que han sido asociadas con la abundancia de peces picudos: la temperatura superficial del mar, la profundidad de la capa de mezcla, la concentración de clorofila y la batimetría (Ueyanagi et al. 1970, Ovchinnikov 1971, Nakamura 1985, Brill y Lutcavage 2001, Prince y Goodyear 2006). El pez vela pasa la mayor parte del tiempo en la capa de mezcla y prefiere aguas con temperaturas entre 25°C y 30°C, como se ha demostrado en otros estudios basados en etiquetas móviles de satélite (tipo PSAT) y telemetría ultrasónica (Kerstetter et al. 2003, Hoolihan 2004, Prince y Goodyear 2006, Hoolihan y Luo 2007, Mourato et al. 2010). Asimismo, se ha informado sobre la preferencia por aguas más templadas y superficiales de otros istiofóridos en el Océano Atlántico, tales como el marlin blanco, Tetrapturus albidus (Horodysky y Graves 2005, Horodysky et al. 2007), y el marlin azul, Makaira nigricans (Graves et al. 2002, Goodyear et al. 2008). Por tanto, la profundidad de la capa de mezcla, que marca la parte superior de la termoclina, es una característica importante que puede afectar directamente la vulnerabilidad, capturabilidad y abundancia local del pez vela y otros istiofóridos. Prince y Goodyear (2006) indicaron que la distribución de profundidad del pez vela en zonas donde la surgencia es intensa puede restringirse a una capa delgada, tan somera como 25 m de profundidad, en la superficie oceánica por la compresión del hábitat físico aceptable debido a la menor concentración de oxígeno disuelto por debajo de la termoclina, dejándolo más vulnerable a artes de pesca superficiales (i.e., palangre y red de enmalle).
En el Atlántico oriental tropical, la abundancia del pez vela varía temporalmente en relación con el enfriamiento del agua superficial por la intensificación estacional del proceso de surgencia. El pez vela se traslada a lo largo de la costa de África de sur a norte en primavera, y aparentemente de regreso, de norte a sur, en otoño, siguiendo las isotermas más cálidas (Ovchinnikov 1971, Diouf 1994, Bard et al. 2002).
Varios estudios han mostrado que la abundancia del pez vela también es altamente estacional en el Atlántico sudoccidental (Arfelli y Amorim 1981; Hazin et al. 1994; Mourato et al. 2009a, 2009b). Según Mourato et al. (2009a), el pez vela inicia su migración reproductiva de la costa noreste de Brasil a mediados de septiembre, y llega a la costa sudeste de Brasil en noviembre y diciembre. El desove ocurre principalmente durante enero y febrero, y las especies permanecen cerca de la costa sureste hasta principios de marzo. Como se ha demostrado para el marlin blanco y el marlin azul, esta migración hacia el sur probablemente esté asociada con los cambios estacionales en la temperatura superficial del mar, reflejados en el desplazamiento de las isotermas superficiales. Varios autores han indicado que en varias partes del mundo el patrón migratorio del pez vela se restringe a la isoterma superficial de 28°C (Ueyanagi et al. 1970, Ovchinnikov 1971, Nakamura 1985), la cual sólo sucede durante el primer y cuarto trimestre del año en la costa sureste de Brasil (Matsuura 1986).
El conocimiento de la estructura poblacional de las especies explotadas es uno de los requerimiento para la delineación de las unidades de manejo pesquero. Tal información es crítica para el manejo y la conservación efectiva de los recursos pesqueros. En el Océano Atlántico, la gestión pesquera del pez vela está a cargo de la ICCAT, que tradicionalmente contempla la existencia de dos poblaciones (oeste y este) separadas arbitrariamente por los meridianos asociados con la cordillera del Atlántico medio (long. 40°W, Atlántico Norte; long. 20°W, Atlántico Sur), con base en la distribución de las capturas, la información proporcionada por los experimentos de marcado y recaptura, y algunos datos morfológicos (i.e., talla y peso). Nuestros resultados sugieren que por lo menos parte de la población de pez vela en el Océano Atlántico está estructurada longitudinalmente según las etapas ontogenéticas, reflejadas por las preferencias ambientales de los adultos y jóvenes o subadultos. Asimismo, la continuidad de la captura del pez vela en toda la cuenca del Atlántico Sur, así como la distancia bastante estrecha entre la costa de África y la punta noreste de Brasil, sugieren que tal mezcla longitudinal es muy probable. En este contexto, se puede plantear la siguiente pregunta: ¿Es correcta la suposición de la ICCAT en cuanto al límite de las poblaciones de pez vela? Estudios genéticos basados en marcadores mitocondriales y nucleares han sugerido la existencia de una sola población en el Océano Atlántico (Graves 1998, Graves y McDowell 2003). Por otro lado, los datos proporcionados por estudios de marcado y recaptura muestran que no hay movimientos transatlánticos o transecuatoriales (Ortiz et al. 2003, Orbesen et al. 2008). En conclusión, sigue existiendo mucha incertidumbre en cuanto a la estructura poblacional del pez vela en el Océano Atlántico y, con base en la información disponible, la ICCAT continúa considerando dos poblaciones (este y oeste) de esta especie en el Atlántico. Se requieren estudios adicionales (e.g., de marcado y recaptura, las tendencias espaciales y temporales de las tasas de captura, la identificación de las áreas de desove y análisis genéticos) para reducir la incertidumbre en cuanto a la estructura poblacional del pez vela en el Océano Atlántico. Asimismo, las futuras evaluaciones realizadas por la ICCAT deberían considerar otros escenarios alternativos de la estructura poblacional, ya que el uso de supuestos inadecuados puede resultar en un serio sesgo del estatus de las poblaciones de pez vela en el Océano Atlántico.
AGRADECIMIENTOS
Este trabajo fue apoyado por la Secretaría Especial de Acuicultura y Pesca de la Presidencia de la República de Brasil (SEAP). El primer autor recibió una beca doctoral del Consejo Nacional de Desarrollo Científico y Tecnológico (CNPq, Brasil). Los autores agradecen a K Bigelow, F Carvalho, E Prince y los revisores anónimos sus comentarios constructivos que ayudaron a mejorar el manuscrito.
REFERENCIAS
Arfelli CA, Amorim AF. 1981. Estudo biológico–pesqueiro do agulhão–vela, Istiophorus platypterus (Shaw & Nodder 1791), no sudeste e sul do Brasil (1971 a 1980). Bol. Inst. Pesca 8: 9–22. [ Links ]
Bard FX, Joanny T, Ngoran NY. 2002. Standardized indices of abundance of sailfish (Tetrapterus albicans) off Côte D'Ivoire, 1988–2001. Collect. Vol. Sci. Pap. ICCAT 54: 764–771. [ Links ]
Beardsley GL. 1980. Size and possible origin of sailfish, Istiophorus platypterus, from the eastern Atlantic ocean. Fish. Bull. 78: 805–808. [ Links ]
Beardsley GL, Merrett NR, Richards WJ. 1975. Synopsis of the biology of the sailfish, Istiophorus platypterus (Shaw and Nodder 1791). In: Shomura RS, Williams F (eds.), Proc. Intl. Billfish Symp., Pt. 2. NOAA Tech. Rep. NMFS SSRF–675: 335 pp. [ Links ]
Becker H. 2001. Hidrologia dos bancos e ilhas oceânicas do nordeste brasileiro. Uma contribuicao ao Programa REVIZEE. Ph.D. thesis, Federal University of São Carlos, São Paulo, Brazil, 175 pp. [ Links ]
Bekkby T, Rinde E, Erikstad L, Bakkestuen V, Longva O, Christensen O, Isaeus M, Isachsen PE. 2008. Spatial probability modelling of eelgrass (Zostera marina) distribution on the west coast of Norway. ICES J. Mar. Sci. 65: 1093–1101. [ Links ]
Brill RW, Lutcavage ME. 2001. Understanding environmental influences on movements and depth distributions of tunas and billfishes can significantly improve population assessments. Am. Fish. Soc. Symp. 25: 179–198. [ Links ]
Diouf T. 1994. Les istiophoridés en Atlantique est: Etude des pêcheries et quelques aspects de La biologie du voilier au Sénégal . Collect. Vol. Sci. Pap. ICCAT 41: 442–457. [ Links ]
Fielding AH, Bell JF. 1997. A review of methods for the assessment of prediction errors in conservation presence/absence models. Environ. Conserv. 24: 38–49. [ Links ]
Finnerty JR, Block BA. 1995. Evolution of cytochrome b in the Scombroidei (Teleostei): Molecular insights into billfish (Istiophoridae and Xiphiidae) relationships. Fish. Bull. 93: 78–96. [ Links ]
Fraser KW, Overton JM, Warburton B, Rutledge DT. 2005. Predicting spatial patterns of animal pest abundance. Sci. Conserv. Ser. 236: 1–57. [ Links ]
Fréon P, Misund OA. 1999. Dynamics of Pelagic Fish Distribution and Behaviour: Effects on Fisheries and Stock Assessment. 1st ed. Science, BS Fishing News Books, Oxford. [ Links ]
Gaertner D, Ménard F, Develter C, Ariz J, Delgado de Molina A. 2002. Bycatch of billfishes by the European tuna purse–seine fishery in the Atlantic Ocean. Fish. Bull. 100: 683–689. [ Links ]
Garza–Pérez JR, Lehmann A, Arias–González JE. 2004. Spatial prediction of coral reef habitats: integrating ecology with spatial modeling and remote sensing. Mar. Ecol. Prog. Ser. 269: 141–152. [ Links ]
Goodyear CP, Luo J, Prince ED, Hoolihan JP, Snodgrass D, Orbesen ES, Serafy JE. 2008. Vertical habitat use of Atlantic blue marlin Makaira nigricans: Interaction with pelagic longline gear. Mar. Ecol. Prog. Ser. 365: 233–245. [ Links ]
Graves JE. 1998. Molecular insights into the population structures of cosmopolitan marine fishes. J. Hered. 89: 427–437. [ Links ]
Graves JE, MacDowell JR. 2003. Stock structure of the world's istiophorid billfishes: A genetic perspective. Mar. Freshwat. Res. 54: 287–298. [ Links ]
Graves JE, Luckhurst BE, Prince ED. 2002. An evaluation of popup satellite tags for estimating postrelease survival of blue marlin (Makaira nigricans) from a recreational fishery. Fish. Bull. 100: 134–142. [ Links ]
Hastie T, Tibshirani R. 1990. Generalized Additive Models. Chapman and Hall, London. [ Links ]
Hazin FHV. 1993. Fisheries–oceanographical study on tunas, billfishes and sharks in the southwestern equatorial Atlantic Ocean. Ph.D. thesis, Tokyo University of Fisheries, Japan, 286 pp. [ Links ]
Hazin HG, Erzini K. 2008. Assessing swordfish distribution in the South Atlantic from spatial predictions. Fish. Res. 90: 45–55. [ Links ]
Hazin FHV, Lessa RPT, Arraes RR, Coimbra MRM, Souza RC, Matsui N, Pantoja Jr PS. 1994. Distribution and relative abundance of tunas and billfishes in the southwestern equatorial Atlantic. Collect. Vol. Sci. Pap. ICCAT 41: 309–324. [ Links ]
Hinton MG, Nakano H. 1996. Standardizing catch and effort statistics using physiological, ecological, or behavioral constraints and environmental data, with an application to blue marlin (Makaira nigricans) catch and effort data from Japanese longline fisheries in the Pacific. Bull. Inter–Am. Trop. Tuna Comm. Bull. 21: 169–200. [ Links ]
Hoolihan JP. 2004. Horizontal and vertical movements of sailfish (Istiophorus platypterus) in the Arabian Gulf, determined by ultrasonic and pop–up satellite tagging. Mar. Biol. 146: 1015–1029. [ Links ]
Hoolihan JP, Luo J. 2007. Determining summer residence status and vertical habitat use of sailfish (Istiophorus platypterus) in the Arabian Gulf. ICES J. Mar. Sci. 64:1–9. [ Links ]
Horodysky AZ, Graves JE. 2005. Application of pop–up satellite archival tag technology to estimate postrelease survival of white marlin (Tetrapturus albidus) caught on circle and straight–shank (J) hooks in the western North Atlantic recreational fishery. Fish. Bull. 103:84–96. [ Links ]
Horodysky AZ, Kerstetter DW, Latour RJ, Graves JE. 2007. Habitat utilization and vertical movements of white marlin (Tetrapturus albidus) released from commercial and recreational fishing gears in the western North Atlantic Ocean: Inferences from short duration pop–up archival satellite tags. Fish. Oceanogr. 16: 240–256. [ Links ]
Ibe AC, Ajayi TO. 1985. Possible upwelling phenomenon off the Nigerian coast. Tech. Pap. Nigerian Inst. Oceanogr. Mar. Res. 25: 1–30. [ Links ]
ICCAT. 2009. International Commission for the Conservation of Atlantic Tunas: Report of the 2009 sailfish assessment, 117 pp. [ Links ]
Jolley JW. 1977. The biology and fishery of Atlantic sailfish, Istiophorus platypterus, from southeast Florida. Fla. Mar. Res. Publ. 28: 1–31. [ Links ]
Kerstetter DW, Luckhurst BE, Prince ED, Graves JE. 2003. Use of pop–up satellite archival tags to demonstrate survival of blue marlin (Makaira nigricans) released from pelagic longline gear. Fish. Bull. 101: 939–948. [ Links ]
Kume S, Joseph J. 1969. Size composition and sexual maturity of billfish caught by the Japanese longline fishery for tunas and billfishes in the Pacific ocean east of 130°W. Bull. Far Seas Fish. Res. Lab. 2: 115–162. [ Links ]
Lehmann A, Overton JM, Leathwick JR. 2002. GRASP: Generalized regression analysis and spatial predictions. Ecol. Model. 157: 189–207. [ Links ]
Longhurst AR. 1962. A review of the oceanography of the Gulf of Guinea. Bull. Inst. Afr. Noire 24: 633–663. [ Links ]
Maravelias CD, Reid DG, Swartzman G. 2000. Modeling spatio–temporal effects of environment on Atlantic herring, Clupea harengus. Environ. Biol. Fish. 58: 157–172. [ Links ]
Matsuura Y. 1986. Contribuição ao estudo da estrutura oceanográfica da Região Sudeste entre Cabo Frio (RJ) e Cabo de Santa Marta Grande (SC). Ciênc. Cult. 38: 1439–1450. [ Links ]
Mourato BL, Pinheiro P, Hazin FHV, Melo VB, Amorim AF, Pimenta E, Guimarães C. 2009a. Preliminary analysis of gonadal development, spawning period, sex ratio and length at first sexual maturity of sailfish, Istiophorus platypterus, on Brazilian coast. Collect. Vol. Sci. Pap. ICCAT 64: 1927–1940. [ Links ]
Mourato BL, Amorim AF, Arfelli CA, Hazin HG, Hazin FHV, Wor C. 2009b. Standardized CPUE of Atlantic sailfish (Istiophorus platypterus) caught by recreational fishery in southern Brazil (1996–2007). Collect. Vol. Sci. Pap. ICCAT 64: 1941–1950. [ Links ]
Mourato BL, Carvalho FC, Hazin FHV, Pacheco JC, Hazin HG, Travassos P, Amorim AF. 2010. First observations and habitat preference of Atlantic sailfish, Istiophorus platypterus, in the southwestern Atlantic Ocean. Collect. Vol. Sci. Pap. ICCAT 65 (in press). [ Links ]
Nakamura I. 1985. FAO Species Catalogue. Vol. 5: Billfishes of the World. An annotated and illustrated catalogue of marlins, sailfishes, spearfishes and swordfishes known to date. FAO Fish. Synop.125, 65 pp. [ Links ]
Orbesen ES, Hoolihan JP, Serafy JE, Snodgrass D, Peel EM, Prince ED. 2008. Transboundary movement of Atlantic istiophorid billfishes among international and US domestic management areas inferred from mark–recapture studies. Mar. Fish. Rev. 70: 14–23. [ Links ]
Ortiz M, Arocha F. 2004. Alternative error distribution models for standardization of catch rates of non–target species from a pelagic longline–fishery: Billfish species in the Venezuelan tuna longline fishery. Fish. Res. 70: 275–294. [ Links ]
Ortiz M, Prince ED, Serafy JE, Holts DB, Dary KB, Pepperell JG, Lowry MB, Holdsworth JC. 2003. Global overview of the major constituent–based billfish tagging programs and their results since 1954. Mar. Freshwat. Res. 54: 489–507. [ Links ]
Ovchinnikov VV. 1971. Swordfishes and billfishes in the Atlantic Ocean. Eng. Trans. H Mills. Israel Program for Scientific Translations, Jerusalem, 77 pp. [ Links ]
Peel E, Nelson R, Goodyear PC. 2003. Managing Atlantic marlin as bycatch under ICCAT. The fork in the road: Recovery or collapse. Mar. Freshwat. Res. 54: 575–584. [ Links ]
Picaut J. 1983. Propagation of the seasonal upwelling in the eastern equatorial Atlantic. J. Phys. Oceanogr. 13: 18–37. [ Links ]
Prince ED, Goodyear CP. 2006. Hypoxia–based habitat compression of tropical pelagic fish. Fish. Oceanogr. 15: 451–464. [ Links ]
Swartzman G, Huang C, Kaluzny S. 1992. Spatial analysis of Bering Sea groundfish survey data using generalized additive models. Can. J. Fish. Aquat. Sci. 49: 1366–1378. [ Links ]
Ueyanagi S, Kikawa S, Uto M, Nishikawa Y. 1970. Distribution, spawning and relative abundance of billfishes in the Atlantic Ocean. Bull. Far Seas Fish. Res. Lab. 3: 15–55. [ Links ]
Uozumi Y. 2003. Historical perspective of global billfish stock assessment. Mar. Freshwat. Res. 54: 555–565. [ Links ]
Valavanis VD, Georgakarakos S, Kapantagakis A, Palialexis A, Katara I. 2004. A GIS environmental modelling approach to essential fish habitat designation. Ecol. Model. 178: 417–427. [ Links ]
Valavanis VD, Pierce GJ, Zuur AF, Palialexis A, Saveliev A, Katara I, Wang J. 2008. Modelling of essential fish habitat based on remote sensing, spatial analysis and GIS. Hydrobiologia 612: 5–20. [ Links ]
Venables WN, Dichmont CM. 2004. GLMs, GAMs and GLMMs: An overview of the theory for applications in fisheries research. Fish. Res. 70: 319–337. [ Links ]
Wares PG, Sakagawa T. 1974. Some morphometrics of billfishes from the eastern Pacific Ocean. In: Shomura RS, Williams F (eds.), Proc. Intl. Billfish Symp. Pt. 2. NOAA Tech. Rep. NMFS SSRF–675, 335 pp. [ Links ]
Zerger A, Gibbons P, Seddon J, Briggs S, Freudenberger D. 2009. A method for predicting native vegetation condition at regional scales. Landsc. Urban Plann. 91: 65–77. [ Links ]
Zheng X, Pierce JG, Reid DG, Jolliffe IT. 2002. Does the North Atlantic Current affect spatial distribution of whiting? Testing environmental hypotheses using statistical and GIS techniques. ICES J. Mar. Sci. 59: 239–253. [ Links ]
* Traducido al español por Christine Harris.
** Descargar versión bilingüe (Inglés–Español) en formato PDF.














