Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.36 no.1 Ensenada mar. 2010
Notas de Investigación
Respuesta al incremento abrupto de temperatura (shock térmico) en el coral Pocillopora verrucosa en condiciones de laboratorio*
Response to sudden increases in temperature (thermal shock) under laboratory conditions in the coral Pocillopora verrucosa
AP Rodríguez–Troncoso1, E Carpizo–Ituarte1*, A Cupul–Magaña2
1 Instituto de Investigaciones Oceanológicas, Universidad Autónoma de Baja California, Km 103 Carretera Tijuana–Ensenada, Ensenada, CP 22860, Baja California, México. * E–mail: ecarpizo@uabc.edu.mx
2 Centro Universitario de la Costa, Universidad de Guadalajara, Av. Universidad No. 203. Puerto Vallarta, CP 48280, Jalisco, México.
Recibido en agosto de 2009
Aceptado en febrero de 2010
ABSTRACT
Coral bleaching is an increasing worldwide phenomenon associated with climate change. Bleaching results from the interaction of biotic and abiotic variables including sudden changes in temperature. To evaluate the response to sudden changes in temperature (thermal shock) prior to bleaching, fragments of Pocillopora verrucosa were subjected to experimental thermal stress. The fragments were acclimatized at 27°C during eight days and then exposed to thermal shock at two temperatures (28.5°C and 30.5°C) for 72 h. The stress response was evaluated quantifying the total lipid content, symbiont density, and tissue damage. Changes in the evaluated estimators were evident at 30.5°C when an initial increase in the amount of lipids was detected, followed by a decrease after 30 h; symbiont density diminished up to 84% at the end of the experiment relative to the initial density estimated. The control and 28.5°C treatments presented no differences. Damage to the polyp tissue was mainly observed as a thinning of the mesenteries and the gastrodermal layer. The study area is strongly influenced by internal waves that cause sudden changes in temperature, so understanding how corals respond to these daily fluctuations will allow us to estimate their survival potential and help future management and conservation efforts in this region.
Key words: Pocillopora, bleaching, lipids, symbiont.
RESUMEN
El blanqueamiento de los corales es un fenómeno que se ha incrementado a nivel mundial debido entre otras cosas al cambio climático. El blanqueamiento es la resultante de interacciones tanto bióticas como abióticas; entre ellas, cambios abruptos de temperatura que pueden provocar el inicio del mismo. Con el fin de evaluar la respuesta a cambios abruptos en temperatura (shock térmico) previos al blanqueamiento, se sometieron experimentalmente a estrés térmico fragmentos de Pocillopora verrucosa. Los fragmentos se aclimataron a 27°C durante ocho días y posteriormente se sometieron a "shock térmico" a 28.5°C y 30.5°C durante 72 h. La respuesta al estrés se cuantificó mediante la estimación de los lípidos totales, la densidad de simbiontes y el daño al tejido. Los cambios en los estimadores evaluados fueron más evidentes a 30.5°C, en donde se detectó un incremento inicial en la cantidad de lípidos, seguida de un decremento después de 30 h y una disminución en la densidad de simbiontes de hasta 84% al final del experimento con respecto a la densidad inicial estimada. En el control y a 28.5°C no hubo diferencias. El efecto en el tejido fue un adelgazamiento del mesenterio y de la gastrodermis. El área de estudio está fuertemente influenciada por ondas internas que provocan incrementos repentinos de la temperatura, por lo que entender cómo responden los corales ante estas fluctuaciones diarias nos ayudará a valorar su capacidad de respuesta. Lo anterior puede resultar determinante para su supervivencia y futuros esfuerzos de manejo y conservación en esta región.
Palabras clave: Pocillopora, blanqueamiento, lípidos, simbionte.
INTRODUCCIÓN
Con el incremento gradual de la temperatura media de los océanos, producto del cambio climático, así como la presencia de fenómenos El Niño/Osilación del Sur (ENSO por sus siglas en inglés), las comunidades coralinas están siendo expuestas a condiciones térmicas no experimentadas en su historia reciente. En la región central del Pacífico mexicano, se han registrado blanqueamientos masivos que han afectado a las especies coralinas de la región, principalmente a las pertenecientes al género Pocillopora (Reyes–Bonilla et al. 2002). Además del efecto de estos eventos periódicos, las comunidades son afectadas por variaciones diarias de temperatura de hasta 3°C, que provocan que los organismos de manera recurrente tengan que responder rápidamente y en forma continua a cambios térmicos. Lo anterior puede tener consecuencias directas en su termotolerancia y en forma crónica y no evidente, afectar su resistencia al blanqueamiento.
En condiciones normales, usualmente el simbionte provee de más del 90% de sus requerimientos energéticos diarios al hospedero, que se utilizan principalmente para la respiración (Davies 1984). El excedente de energía es traspasada al hospedero en forma de carbono inorgánico y es guardada en forma de lípidos (Patton et al. 1977, Davies 1984). De esta manera, el organismo mantiene almacenados productos energéticos para soportar periodos donde las condiciones del medio ambiente no son las idóneas (Fitt et al. 2000, Baird et al. 2008).
Como consecuencia del blanqueamiento, el hospedero deja de recibir nutrientes del simbionte y tiene que hacer uso de sus reservas energéticas acumuladas en forma de lípidos (Szmant y Gassman 1990, Fitt et al. 2000, Grottoli et al. 2004, Rodrigues y Grottoli 2007). Ante los eventos de estrés, las especies han desarrollado estrategias alternas, como en Montipora capitata, la cual durante periodos de blanqueamiento mantiene sus reservas energéticas alimentándose por medios heterótrofos (Rodrigues et al. 2008).
De la capacidad que tengan los corales de recuperarse de eventos de estrés o blanqueamiento dependerá su subsistencia en el ecosistema. Conocer el efecto que tienen cambios abruptos en la temperatura sobre el desempeño de los corales, como lo son cambios que se pueden observar de manera diaria, generará información acerca de la capacidad de tolerancia térmica de las distintas especies en áreas determinadas, ante los cambios en las condiciones térmicas en las regiones donde se encuentran.
El objetivo del presente trabajo es documentar, en condiciones de laboratorio, el efecto que tienen los incrementos abruptos en la temperatura sobre Pocillopora verrucosa, presente en las comunidades coralinas de la región central del Pacífico mexicano. La respuesta fisiológica de los organismos se evaluó por medio de la cuantificación de lípidos totales, densidad de simbiontes, así como el daño al tejido. Los resultados obtenidos nos permitirán evaluar las posibles consecuencias para la especie en escenarios futuros de cambio climático en la región.
MATERIALES Y MÉTODOS
Área de estudio y trabajo experimental
El muestreo se llevó a cabo en la Isla Redonda, la cual forma parte del Parque Nacional Islas Marietas (20°40'35"–20°41'45" N, 105°33'30"–105°38'10" O),Nayarit, México.
Se recolectó una porción de una colonia del coral P. verrucosa la cual fue fragmentada en 21 piezas de 5 cm de largo colocadas dentro de tres acuarios con agua marina (los acuarios fueron previamente estabilizados a una temperatura de 27°C [control] durante ocho días). Cuatro días antes de la experimentación se incrementó la temperatura en dos de los acuarios estabilizándolos a 28.5°C y 30.5°C antes de pasar los fragmentos de coral. Los acuarios estuvieron expuestos a luz natural, con filtros de agua y un termógrafo programado para registrar la temperatura cada 15 min.
Diariamente se elaboraron registros del estado físico de los fragmentos y cada hora de temperatura, salinidad, oxígeno disuelto y pH. Después de ocho días de aclimatados, se traspasaron siete fragmentos a los acuarios con temperaturas de 28.5° y 30.5° para la experimentación. Se hicieron siete evaluaciones a los tiempos 0, 6, 12, 24, 30, 48 y 72 h de introducidos los fragmentos y para su análisis se preservaron en formaldehído al 10%. Previo a cada evaluación se hacían las observaciones del estado físico de los fragmentos (coloración).
Trabajo de laboratorio
Para la extracción de lípidos totales, se obtuvo el tejido descalcificando los fragmentos con acido acético al 10% y se trataron de acuerdo con el método descrito por Folch (1957). Los resultados corresponden a la media resultante y se expresan como gramos de lípidos totales por gramo de peso seco ± error estándar.
Las observaciones del tejido se hicieron por medio de cortes histológicos utilizando la metodología descrita en Rodríguez–Troncoso (2004). Se elaboraron cortes con un grosor de 6 Lm con un microtomo de rotación marca American Optical modelo 820. Las observaciones se realizaron con la ayuda de un microscopio compuesto Axioscop (Zeiss) motorizado. La densidad de simbiontes fue obtenida a partir de análisis de imagen con ayuda del programa Axiovision Rel. 4.7 (Zeiss). Los datos se presentan como número de células por unidad de área ± error estándar.
RESULTADOS
Una vez que se logró estabilizar los acuarios a la temperatura experimental deseada no se registraron variaciones considerables (fig. 1). La salinidad fluctuó entre 33.6 y 35.1, el pH se mantuvo entre 8.3 y 8.4, y los valores de oxígeno disuelto fueron de 5.6 a 7.7 mg L–1 durante el periodo experimental.
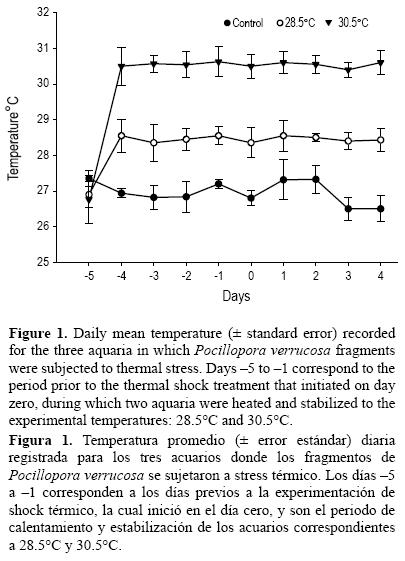
Durante el periodo de aclimatación no hubo cambios en la coloración o estado físico de los fragmentos. Durante el periodo de experimentación se observó que en el acuario control y en el de 28.5°C no hubo evidencia de blanqueamiento. Los cambios fueron evidentes a 30.5°C, donde a las 24 h el blanqueamiento comenzaba a ser evidente, a las 30 h aproximadamente el 50% del fragmento se encontraba parcialmente blanqueado y a las 72 h el 90% del fragmento se encontraba blanqueado, con tejido adherido en todo el esqueleto.
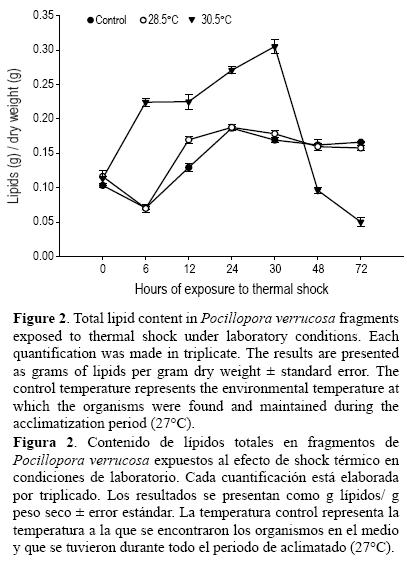
A partir de la cantidad inicial de lípidos totales para los tres acuarios, se encontró un comportamiento similar entre el control y el acuario a 28.5°C, con pocos cambios. En el acuario con la temperatura de 30.5°C se observó un incremento gradual en la cantidad de lípidos, comenzando con 0.11 g peso seco–1 (±0.0109) y llegando a un máximo a las 30 h de 0.305 g peso seco–1 (± 0.106), lo cual coincide con el tiempo en donde se observó el 50% del fragmento blanqueado. Después de este punto, la cantidad de lípidos fue decayendo y para las 72 h los lípidos disminuyeron en un 44% (0.0501 ± 0.0066 g peso seco–1 ) a partir de la cantidad inicial (fig. 2).
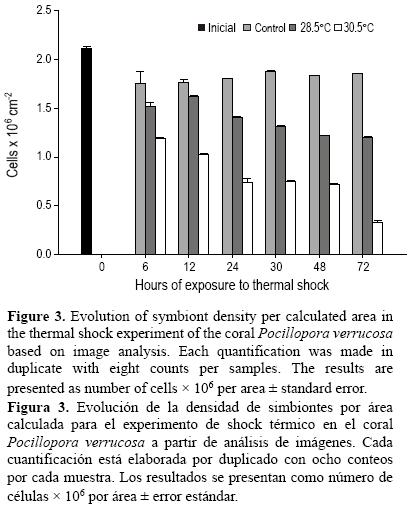
La densidad promedio de simbiontes se estimó en 2.0 x 106 ± 0.20 cél cm–2 al inicio del periodo experimental (tiempo cero), la cual disminuyó 12.5% en el acuario control y después se mantuvo constante (1.81 x 106 ± 0.0065 cél cm–2) (fig. 3). Los fragmentos a 28.5°C tuvieron una respuesta de disminución de 20% de simbiontes durante el tiempo de experimentación, de 1.51 x 106 ± 0.041 cél cm–2 a las 6 h a 1.20 x 106 ± 0.0054 cél cm–2 al final del experimento (fig 3). Al igual que con los lípidos totales, en el acuario con la temperatura de 30.5°C se pudo observar una disminución gradual en la cantidad de células, y en la evaluación de las 72 h (fig. 3)se calculó una pérdida del 84% (0.32 x 106 ± 0.0163 cél cm–2) de células simbiontes. Lo anterior coincidió con el tiempo en que el fragmento ya se consideraba como blanqueado.
Los daños en el tejido debido al incremento en la temperatura fueron evidentes sólo en las muestras que se sometieron a la más alta temperatura (30.5°C) (fig. 4). Inicialmente, el organismo se observa con un tejido entero y con simbiontes asociados principalmente a la región de los tentáculos (fig. 4a). Conforme el tejido fue expuesto durante más tiempo al estrés térmico, se presenta evidencia del daño en los tejidos del pólipo, principalmente un adelgazamiento del mesenterio y de la gastrodermis; estructuras, como la cavidad gástrica, no perdieron su forma pero resultó evidente una disminución en la presencia de simbiontes (fig. 4c). A las 72 h, debido a la exposición del tejido al incremento en la temperatura, el mesenterio se observó "degradado" y "roto", posiblemente debido al daño provocado tanto por la temperatura como por la expulsión de simbiontes; además las estructuras del pólipo estaban tan dañadas y perdieron su forma, por lo que los tentáculos parecían fusionados. Debido a que el pólipo estaba perdiendo su forma estructural característica, no se pudo observar con claridad la cavidad gástrica (fig. 4d).
DISCUSIÓN
Los datos generados en este estudio son una primera aproximación experimental de la respuesta fisiológica inmediata (utilizando la densidad de simbiontes y la cantidad del lípidos totales) ante el efecto de shock térmico en P. verrucosa.
Una de las características de la región de estudio es la presencia de ondas internas de gran amplitud que provocan cambios repentinos en la temperatura (Filonov et al. 1996), que según los registros obtenidos, pueden generar cambios hasta de 3°C. Estos cambios abruptos le podrían provocar una respuesta de shock térmico al organismo y ésta debe de ser inmediata. Por lo tanto, es importante tener aproximaciones de cómo funciona el organismo ante las fluctuaciones diarias de temperatura que son determinantes, para entender su comportamiento y supervivencia en la región.
El género Pocillopora es uno de los más estudiados debido a la amplia distribución que tiene a nivel mundial; sin embargo, su respuesta fisiológica varía dependiendo de las condiciones ambientales a las que se encuentre sujeto. Nuestros resultados muestran un contenido de lípidos totales que varió de 11% (en relación al peso seco de la muestra) a 35% en un periodo de 30 h. Ambos valores han sido previamente reportados para este género (Patton et al. 1977, Harland et al. 1993), pero los datos reportados representan un solo muestreo. Las primeras variaciones estacionales fueron estimadas por Stimson (1977) con valores del orden de 31% a 41%. Cabe resaltar que aunque son valores similares a los obtenidos a los del presente estudio, las variaciones reportadas aquí representan una escala temporal corta de respuesta (horas), y constituyen la respuesta inmediata del organismo ante los posibles cambios diurnos de las condiciones oceanográficas presentes en la zona.
Para P. verrucosa el shock térmico en fragmentos mantenidos en condiciones de laboratorio tuvo como primera respuesta un incremento en la cantidad de lípidos y al mismo tiempo una pérdida en la densidad de simbiontes. Se sabe que el simbionte genera los lípidos necesarios para llevar a cabo actividades diarias y de manera simultánea; el hospedero necesita sintetizar sus lípidos propios, lo cual estará limitado por la actividad fotosintética del simbionte (Patton et al. 1977, Muscatine et al. 1981, Davies 1984). Inicialmente, un aumento abrupto en la temperatura producirá un incremento en los lípidos como resultado del aumento en la actividad metabólica del holobionte, los cuales serán utilizados como almacenaje de reservas energéticas y reparación de membranas que le permitan sobrellevar el periodo inicial de estrés. Sin embargo, al seguir en condiciones estresantes, que provocan la expulsión del simbionte, el hospedero pierde su capacidad de continuar con la síntesis de lípidos y eventualmente al dejar de obtener la energía provista por el simbionte, la síntesis de lípidos se detiene y sus niveles dentro del organismo decaen.
El decremento en la cantidad de lípidos resultado de blanqueamiento ha sido previamente documentado en otras especies (Glynn et al. 1985, Borell et al. 2008). Sin embargo, contrastantemente con nuestros resultados, en otras especies como Porites compressa, la pérdida de lípidos no está asociado con el periodo de estrés sino al de recuperación después del blanqueamiento (Grottoli et al. 2004) o inclusive hay especies en donde a pesar de estar en condiciones de estrés térmico, no cambia su cantidad de lípidos presentes (Grottoli et al. 2004, Fitt et al. 2009).
Igualmente, la densidad de simbiontes es variable entre especies y dentro de la misma especie dependiendo de la región y las condiciones del muestreo. Por efecto de shock térmico la densidad de células decayó 84% a las 72 h de experimentación. La pérdida de simbiontes por estrés térmico ha sido ampliamente documentada (Rodrigues y Grottoli 2007, Rodrigues et al. 2008, Fitt et al. 2009), así como su capacidad de recuperación cuando las condiciones regresan a ser favorables (Jones y Yellowless 1997). Aunque la densidad de simbiontes sea baja, el coral mantiene cierta capacidad de recuperación. Esta recuperación estará en función de la respuesta que pueda proprocionar la cantidad de simbiontes remanentes en el tejido. Esto limitará la capacidad del hospedero para acumular nuevamente reservas energéticas para futuros eventos de estrés.
Los resultados obtenidos pueden ser utilizados como una herramienta que ayude a comprender cambios en la distribución y abundancia de las especies a una escala regional. Continuar con el trabajo experimental en condiciones tanto de shock como estrés térmico, en diferentes especies de corales y en las diferentes regiones del Pacifico mexicano podrían servir para poder explicar de manera parcial, cambios de estructura en el ecosistema. Especies como Pocillopora verrucosa, que tiene la capacidad de responder y tolerar los incrementos abruptos en la temperatura, sin llegar al blanqueamiento, es muy posible que puedan soportar y recuperarse de los incrementos graduales que se generen por futuros fenómenos ENSO o por el efecto del cambio climático y sean los dominantes en esta región.
AGRADECIMIENTOS
La presente investigación se realizó con apoyo de la Universidad Autónoma de Baja California (poyecto interno IIO–UABC No. 533 a cargo de ECI) y el Centro Universitario de la Costa de la Universidad de Guadalajara con el proyecto "Implementación del programa de monitoreo ambiental marino de los parques nacionales Isla Isabel e Islas Marietas, Nayarit, México" a cargo de ACM. APRT recibió apoyo del CONACYT (beca No. 288773) y de los fondos del programa de movilidad estudiantil UABC. Los autores agradecen a las autoridades del Parque Nacional Islas Marietas las facilidades otorgadas durante el muestreo y a los miembros del Laboratorio de Ecología y Biología del Desarrollo del IIO–UABC su apoyo.
REFERENCIAS
Baird AH, Bhagooli R, Ralph P, Takahashi S. 2008. Coral bleaching: The role of the host. Trends Ecol. Evol. 24: 16–20. [ Links ]
Borell EM, Yuliantri AR, Bishof K, Richter C. 2008. The effect of heterotrophy on photosynthesis and tissue composition of two scleractinian corals under elevated temperature. J. Exp. Mar. Biol. Ecol. 364: 116–123. [ Links ]
Davies SP. 1984. The role of zooxanthellae in the nutritional energy requirements of Pocillopora eydouxi. Coral Reefs 2: 181–186. [ Links ]
Filonov A, Monzon C, Tereshschenko I. 1996. On the conditions of internal tide wave generation along the west coast of Mexico. Cienc. Mar. 22(3): 255–272. [ Links ]
Fitt WK, McFarland FK, Warner ME, Chilcoat GC. 2000. Seasonal patterns of tissue biomass and densities of symbiotic dino–flagellates in reef corals and relation to coral bleaching. Limnol. Oceanogr. 45: 677–685 [ Links ]
Fitt WK, Gates RD, Hoegh–Guldberg O, Bythell JC, Jatkar A, Grottoli AG, Gomez M, Fisher P, Lajuenesse TC, Pantos O, Iglesias–Prieto R, Franklin DJ, Rodrigues LJ, Torregiani JM, van Woesik R, Lesser MP. 2009. Response of two species of Indo–Pacific corals, Porites cylindrica and Stylophora pistillata, to short–term stress: The host does matter in determining the tolerance of corals to bleaching. J. Exp. Mar. Biol. Ecol. 373: 102–110. [ Links ]
Folch, JLM, Sloane–Stanley GH. 1957. Simple method for the isolation and purification of total lipids from animal tissues. J. Biol. Chem. 226: 497–506. [ Links ]
Glynn PW, Pérez M, Gilchrist SL. 1985. Lipid decline in stressed corals and their crustacean symbionts. Biol. Bull. 168: 274–284. [ Links ]
Grottoli AG, Rodrigues LJ, Juarez C. 2004. Lipids and stable carbon isotopes in two species of Hawaiian corals Porites compressa and Montipora verrucosa, following a bleaching event. Mar. Biol. 145: 621–631. [ Links ]
Harland A, Navarro J, Davies S, Fixter L. 1993. Lipids of some Caribbean and Red Sea corals: Total lipid, wax esters, triglycerides and fatty acids. Mar. Biol. 117: 113–117. [ Links ]
Jones R, Yellowless D. 1997. Regulation and control of intracellular algae (= zooxanthellae) in hard corals. Phil. Trans. R. Soc. Lond. B 352: 457–468. [ Links ]
Muscatine L, McCloskey LR, Marian RE. 1981. Estimating the daily contribution of carbon from zooxanthellae to coral animal respiration. Limnol. Oceanogr. 26: 601–611. [ Links ]
Patton JS, Abraham S, Benson AA. 1977. Lipogenesis in the intact coral Pocillopora capitata and its isolated zooxanthellae: Evidence for a light–driven carbon cycle between symbiont and host. Mar. Biol. 44: 235–247. [ Links ]
Reyes–Bonilla H, Carriquiry JD, Leyte–Morales GE, Cupul– Magaña AL. 2002. Effects of the El Niño–Southern Oscillation and the anti–El Niño event (1997–1999) on coral reefs of the western coast of Mexico. Coral Reefs 21: 368–372. [ Links ]
Rodrigues LJ, Grottoli AG. 2007. Energy reserves and metabolism as indicators of coral recovery from bleaching. Limnol. Oceanogr. 52: 1874–1882. [ Links ]
Rodrigues LJ, Grottoli AG, Pease TK. 2008. Lipid class composition of bleached and recovering Porites compressa Dana, 846 and Montiopora capatitata Dana, 1846 corals from Hawaii. J. Exp. Mar. Biol. Ecol. 358: 136–143. [ Links ]
Rodríguez–Troncoso A. 2004. Ciclo reproductivo de tres especies formadoras de arrecife en bahía La Entrega, Oaxaca, México. M.Sc. thesis, Universidad Autónoma de Baja California, México, 117 pp. [ Links ]
Stimson J. 1977. The annual cycle of density of zooxanthellae in the tissues of field and laboratory–held Pocillopora damicornis (Linnaeus). J. Exp. Mar. Biol. Ecol. 214: 35–48. [ Links ]
Szmant AM, Gassman NJ. 1990. The effects of prolongated "bleaching" on the tissue biomass and reproduction of the reef coral Montastrea annularis. Coral Reefs 8: 217–224. [ Links ]














