Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.35 no.3 Ensenada sep. 2009
Artículos de investigación
Growth, mortality, maturity, and recruitment of the star drum (Stellifer lanceolatus) in the southern Gulf of Mexico*
Crecimiento, mortalidad, madurez y reclutamiento de la corvinilla (Stellifer lanceolatus) en el sur del Golfo de México
J Ramos–Miranda1*, K Bejarano–Hau1, D Flores–Hernández1, LA Ayala–Pérez2
1 Centro EPOMEX, Universidad Autónoma de Campeche, Av. Agustín Melgar s/n, entre Juan de la Barrera y calle 20, Col. Buenavista, CP 24039, Campeche, México. *E–mail: ramosmiran@yahoo.com.mx
2 Departamento el Hombre y su Ambiente, Universidad Autónoma Metropolitana Xochimilco, Calz. del Hueso 1100, Col. Villaquietud, Coyoacán CP 04960, México DF.
Recibido en febrero de 2009.
Aceptado en junio de 2009.
Abstract
The star drum Stellifer lanceolatus (Holbrook 1855) is a dominant species along the western part of the Campeche coastline, southern Gulf of Mexico, and it is regularly caught as bycatch in the seabob shrimp (Xiphopenaeus kroyeri) fishery. It is not commercially important but plays an important role in the transfer of energy through the ecosystem. The spatial and temporal abundance of the species allowed the identification of clear preferences in spatial size distribution. The von Bertalanffy growth model showed seasonal fluctuations and was defined by the following parameters: L∞ = 18.5 cm, K = 0.4 yr–1, t0 = –0.083 yr–1, C = 0.63, WP = 0.8, and Rn = 0.254. The parameters of the length–weight relationship were a = 0.52 x 10–6 (condition factor) and b = 3.16, indicating isometric growth (t0.05(2), P > 0.05) with a correlation coefficient of 0.97. The monthly condition factor was lower from February to August and increased from September to November, associated with the maturity stage. Size and age at first maturity were 9.2 cm and 1.64 yr, respectively. Total mortality rate was 1.68 yr–1. Recruitment was continuous with a main pulse from March to July. The life cycle of S. lanceolatus was determined, with reproduction occurring in the coastal zone, juveniles (<9.2 cm) then moving closer to shore until attaining maturity, and returning as adults to deeper areas to reproduce. Further studies are necessary to relate its life cycle to the environment.
Key words: Campeche, life cycle, population dynamics, Stellifer lanceolatus.
Resumen
La corvinilla Stellifer lanceolatus (Holbrook 1855) es una especie dominante en la porción occidental de la costa de Campeche, Golfo de México y es regularmente capturada como parte de la fauna acompañante en la pesca del camarón siete barbas (Xiphopenaeus kroyeri). No tiene importancia comercial pero desarrolla un papel importante en el sistema como vehículo de transferencia energética. La abundancia espacial y temporal de la especie permitió identificar claras preferencias de distribución por talla a nivel espacial. El modelo de crecimiento de von Bertalanffy mostró oscilaciones estacionales y está definido por los parámetros L∞ = 18.5 cm, K = 0.4 año–1, t0 = –0.08304 año–1, C = 0.63, WP = 0.8 y Rn = 0.254. Los parámetros del modelo de la relación longitud/peso fueron a = 0.52 x 10–6 (factor de condición) y b = 3.16, y muestran un crecimiento isométrico (t0.05(2), P > 0.05) con un coeficiente de correlación de 0.97. El factor de condición mensual fue menor de febrero a agosto y se incrementó de septiembre a noviembre, asociado a la época de maduración. La talla de primera madurez se observó a los 9.2 cm y correspondió a una edad de 1.64 años. La tasa de mortalidad total fue de 1.68 año–1. El reclutamiento fue continuo con un pulso principal entre marzo y julio. Se determinó el ciclo de vida de la especie, con reproducción en la zona costera, migración de juveniles (<9.2 cm) hacia la zona litoral hasta alcanzar la madurez, y un retorno posterior de los adultos a las áreas más profundas para reproducirse nuevamente. Es necesario llevar a cabo estudios tendientes a relacionar su ciclo de vida con el ambiente.
Palabras clave: Campeche, ciclo de vida, dinámica poblacional, Stellifer lanceolatus.
Introducción
Es ampliamente conocida la función de los peces como reguladores energéticos a lo largo de la cadena trófica y como recicladores de nutrientes y materiales entre los componentes del ecosistema (Helfman 2002). Las especies dominantes, en términos de abundancia, extensión geográfica o función, son las que mayor influencia presentan dentro de las comunidades. En este aspecto el conocimiento de las especies dominantes en un ecosistema es determinante para observar los cambios espaciotemporales en su estructura y función.
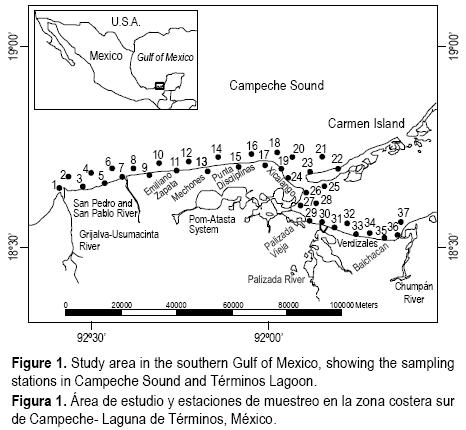
La Sonda de Campeche, al sur del Golfo de México (fig. 1), incluyendo la Laguna de Términos (actualmente un área natural protegida), como muchas regiones del mundo está siendo cada vez más impactada por las actividades antropogénicas y por los cambios ambientales naturales o posibles efectos del cambio climático global. Esta región ha sido históricamente de importancia científica, social y económica por los elevados niveles de biodiversidad, la abundancia de recursos naturales renovables de interés comercial, la actividad pesquera artesanal y las actividades de exploración y explotación de petróleo.
La región llamada Sonda de Campeche–Laguna de Términos conforma un sistema ecológico muy complejo por el intercambio de masas de agua, ya que existen transporte y mezcla, movimientos migratorios, cambios ontogénicos en los ciclos biológicos y movimientos trofodinámicos de los organismos, los cuales adaptan sus estrategias biológicas a este marco ambiental. Muchas especies, principalmente las dominantes, se benefician significativamente de esta zona que es utilizada con fines de alimentación, reproducción y crianza (Yáñez–Arancibia y Sánchez–Gil 1986). Stellifer lanceolatus (Holbrook 1855), conocida como comúnmente como corvinilla (familia Sciaenidae), es una de las especies que han sido determinadas como dominantes por su elevada abundancia y frecuencia de aparición en la comunidad demersal de esta zona (Yáñez–Arancibia y Sánchez–Gil 1986, Yáñez–Arancibia et al. 1988, Ayala–Pérez et al. 2003, Ramos–Miranda et al. 2005a, Ayala–Pérez 2006). Además, forma parte de la fauna acompañante en la pesca del camarón (Abarca–Arenas et al. 2003). Aunque en si misma no tiene importancia comercial, su calidad como especie dominante le confiere importancia ecológica, por su papel como vehículo de transferencia energética en el sistema. Ramos–Miranda et al. (2005a, b) han señalado los cambios en la diversidad de especies del necton en la Laguna de Términos en 1997 y 2003 con relación a 1980, demostrando una modificación en la estructura de la comunidad lagunar. Entre estos cambios destaca S. lanceolatus como especie dominante, vinculada fuertemente al hábitat del camarón siete barbas (Xiphopenaeus kroyeri, Heller 1862).
Se han realizado pocos estudios de la dinámica poblacional de la familia Sciaenidae en la Sonda de Campeche, y en particular sobre la de S. lanceolatus. La mayoría de éstos se han enfocado a la ecología, biología y dinámica de las poblaciones de corvinas y roncos Bairdiella chrysoura (Lacepéde 1802), B. rhonchus (Cuvier 1830), Micropogonias undulatus (Linnaeus 1766), Cynoscion arenarius (Ginsburg 1930) y C. nothus (Holbrook 1855) (Chavance et al. 1984; Tapia–García et al. 1988a, b; Ayala–Pérez et al. 1995). De manera particular, Ayala–Pérez (2006) aportó algunos aspectos sobre la distribución, abundancia y comportamiento de S. lanceolatus en la Laguna de Términos. El objetivo de este estudio fue analizar la dinámica poblacional de S. lanceolatus en términos de sus patrones de distribución, abundancia, reproducción, crecimiento y reclutamiento. Estos procesos son claves para entender el comportamiento y desarrollo de las especies en el ecosistema, y para poder observar en el futuro los posibles cambios por efecto de impactos antropogénicos o naturales a nivel de la comunidad.
Materiales y métodos
El área de estudio se ubica en la zona costera de Campeche y Tabasco, al sur del Golfo de México (fig. 1), desde la desembocadura del sistema fluvial Grijalva–Usumacinta hasta la parte media de la Isla del Carmen y la parte suroeste de la Laguna de Términos hasta la desembocadura del Río Chumpán (18°15'–18°45' N, 91°30'–92°45' W). La zona está influenciada por los ríos Candelaria, Chumpán y Palizada al interior de la Laguna de Términos y por los ríos San Pedro y San Pablo y Usumacinta en la zona litoral. En general se han reportado tres épocas climáticas en esta región: "secas" de febrero a mayo, "lluvias" de junio a septiembre y "nortes" de octubre a enero, caracterizada esta última por fuertes vientos del norte y sureste.
De febrero de 2006 a enero de 2007 se realizaron 12 muestreos mensuales en 37 estaciones en el área de estudio. Los puntos de muestreo se ubicaron de acuerdo al régimen de corrientes y aportes fluviales, así como zonas de pesca de camarón. Las muestras de peces se obtuvieron por medio de arrastres con una red de prueba camaronera (5 x 5 x 2.5 m de abertura de trabajo y luz de malla de 1.9 cm), con tablas de 0.60 x 0.40 m, utilizando una lancha de 7 m de eslora con motor fuera de borda de 65 HP. Cada arrastre tuvo una duración de 12 minutos tratando de mantener una velocidad constante de 2.5 nudos. Los organismos se almacenaron en bolsas de plástico etiquetadas y se colocaron en hielo. Adicionalmente, en cada estación se determinó la temperatura del agua en la superficie y el fondo.
En el laboratorio los organismos fueron lavados e identificados utilizando literatura especializada (Fischer 1978, Cervigón et al. 1992, Castro–Aguirre 1999). Se obtuvo la talla total (cm) y el peso total (g) de cada individuo con una balanza digital (Ohaus de 2.2 kg de capacidad y 0.1 g de precisión). Para determinar el estado de madurez se extrajeron las gónadas a cada individuo muestreado, y luego se observaron en un microscopio estereoscópico para definir sexo y la etapa de madurez de las hembras utilizando la escala de Hilge et al. (1977).
Análisis de datos
Para determinar la abundancia primero se determinó el área media barrida por estación de muestreo utilizando la fórmula propuesta por Sparre y Venema (1995): A = D x2, donde A es el área, D es la distancia y x2 la abertura de trabajo de la red. Los valores de abundancia se obtuvieron con base en la densidad (ind m–2) y la biomasa (g m–2).
Para la determinación del crecimiento se utilizó el método de progresión modal a partir de las frecuencias de talla mensuales utilizando el programa computacional ELEFAN I (Pauly y David 1981) integrado en el programa FISAT (FAO–ICLARM Stock Assessment Tools) (Gayanilo et al. 1996). El ajuste de la curva de crecimiento se hizo por medio de la ecuación de crecimiento de von Bertalanffy estacionalizada (Pauly y Gaschütz 1979):
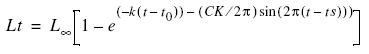
donde los parámetros de entrada son: L∞ = longitud asintótica, K = parámetro de curvatura, y t0 = punto en el tiempo en el que el pez tiene una talla 0.
En la ecuación anterior el término (CK/2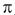 )sin(2
)sin(2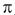 (t – ts)) indica que se producen oscilaciones en la tasa de crecimiento conforme cambia t0 a lo largo del año; ts se denomina punto de verano y adopta un valor entre 0 y 1. Se considera que la tasa de crecimiento es máxima en el momento del año en que ts ha pasado. Además es necesario calcular el punto de invierno (WP) cuando la tasa de crecimiento es la menor (WP = ts + 0.5). C se denomina amplitud, y adquiere valores de 0 y 1; si es igual a 0 no hay estacionalidad del crecimiento, si es igual a 1 la tasa de crecimiento será igual a 0 en el punto de invierno (Gayanilo et al. 1996).
(t – ts)) indica que se producen oscilaciones en la tasa de crecimiento conforme cambia t0 a lo largo del año; ts se denomina punto de verano y adopta un valor entre 0 y 1. Se considera que la tasa de crecimiento es máxima en el momento del año en que ts ha pasado. Además es necesario calcular el punto de invierno (WP) cuando la tasa de crecimiento es la menor (WP = ts + 0.5). C se denomina amplitud, y adquiere valores de 0 y 1; si es igual a 0 no hay estacionalidad del crecimiento, si es igual a 1 la tasa de crecimiento será igual a 0 en el punto de invierno (Gayanilo et al. 1996).
Para modelar el crecimiento ELEFAN I realiza la reestructuración de las frecuencias de talla a través de medias móviles para disminuir las irregularidades. Posteriormente el ajuste de la curva de crecimiento se hace mediante un análisis de progresión modal. Este análisis se realiza reestructurando los datos usando una prueba de bondad de ajuste de la relación Rn = SME/SMD, donde SME representa la suma de los máximos explicada en el histograma de frecuencias y SMD la la suma de los máximos disponibles (Sparre y Venema 1995).
El uso de este modelo se justifica por el hecho de que la zona de estudio presenta variaciones ambientales estacionales (tres épocas climáticas) y se ha observado que existe una mayor diferencia entre las temperaturas del agua que en los años ochenta (Ramos–Miranda et al 2005b). Esto puede influir en el crecimiento de la especie, que muestra así una relación no lineal clásica. Además, este modelo ya ha sido utilizado para especies tropicales y en esta región (Pauly y David 1981, Rueda y Santos 1999, Mancera–Rodríguez y Castro–Hernández 2004, Ayala–Pérez et al. 2008).
Posteriormente, el valor de t0 fue calculado utilizando la ecuación inversa de von Bertalanffy (Sparre y Venema 1995):
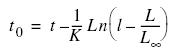
y el índice de crecimiento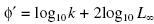 (Munro y Pauly 1983), el cual puede ser usado para comparar tasas de crecimiento entre varias especies.
(Munro y Pauly 1983), el cual puede ser usado para comparar tasas de crecimiento entre varias especies.
La relación peso–longitud (Sparre y Venema 1995) fue calculada mediante la ecuación potencial W = aLb, haciendo la debida transformación lineal de la ecuación y transformando los datos a logaritmos (log W = log a + b log L), donde W es el peso, L la longitud, a la ordenada al origen o factor de condición y b la pendiente de la recta de regresión. Dado que se considera que el peso varía en función de la potencia cúbica, se comparó el valor de la pendiente b = 3 mediante la prueba t de Student. Asimismo, el factor de condición (a) (Ricker 1958) fue obtenido cada mes para observar su variación y determinar su posible relación con el periodo de madurez gonádica.
La talla de primera madurez de la población de S. lanceolatus (L50) se estimó ajustando la proporción de individuos maduros en cada intervalo de tallas a una función logística, de acuerdo a los criterios establecidos por Sokal y Rohlf (1996): Y = 1/(1 + e(A–BX)), donde Y es la proporción de individuos maduros, X es la marca de clase de la talla de referencia, A y B son constantes del modelo y e la base del logaritmo neperiano. Posteriormente se linealizó esta ecuación mediante la transformación logarítmica Ln(1/Y –1) = A – BX , y se estimaron los parámetros A y B por regresión de mínimos cuadrados (Sokal y Rohlf 1996). Así, la longitud a la cual el 50% de la población se encuentra sexualmente madura (L50) corresponde al cociente entre los parámetros A/B del modelo. Asimismo, los rangos de variación L25% y L75% fueron obtenidos como L25% = (A – ln 3)/B y L75% = (A + ln 3)/B .
La época de madurez gonádica fue determinada por observación de la proporción de las gónadas de las hembras en plena madurez, tomando en cuenta las hembras en etapas de madurez entre II y IV.
Para determinar la mortalidad natural se utilizaron los métodos de Pauly (1980) y Rikhter y Efanov (1976) incluidos en FISAT. La ecuación de Pauly (1980) incluye la temperatura como un factor que influye en la mortalidad natural y los parámetros de crecimiento L∞ y K:
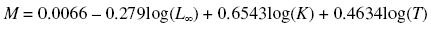
donde T es la temperatura (en este caso se utilizó la temperatura media del mar en el área estudiada, 27.29°C). La ecuación de Rikhter y Efanov (1976) se basa en el supuesto de que los peces con una mortalidad natural elevada maduran precozmente y que existe una relación entre la mortalidad natural y la edad de maduración masiva (Tm50%), que es la edad en la que el 50% de la población está madura:
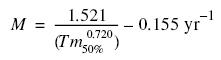
Para obtener la edad de maduración masiva se introdujo la talla de primera madurez a la ecuación inversa de von Bertalanffy (Sparre y Venema 1995):
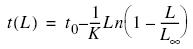
donde L es la talla de primera madurez, y t0, L∞ y K son los parámetros ya señalados anteriormente.
La mortalidad total fue obtenida mediante el método de curva de captura linealizada (incluida en FISAT) utilizando el siguiente modelo exponencial negativo: Nt = N0e–Zt, donde Nt es el número de organismos a la edad t y Z es la mortalidad total. Al linealizar esta expresión se obtiene: ln Nt = ln N0 – Zt, donde el valor de Z es la pendiente y N0 el valor de la ordenada al origen. La mortalidad por pesca fue obtenida mediante la relación Z = F + M.
Finalmente, para determinar el reclutamiento se consideraron reclutas a todos aquellos individuos con una talla <9.2 cm (talla de primera madurez gonádica calculada). El reclutamiento fue obtenido mediante el programa FISAT (rutina "reclutamiento"), el cual utilizando las frecuencias de longitud y parámetros de crecimiento L∞, K, y t0, reconstruye los pulsos de reclutamiento en el tiempo (hacia atrás) e infiere el número de pulsos y la fuerza relativa de cada pulso.
Resultados
Se realizaron 444 arrastres, capturándose 3066 organismos de S. lanceolatus con un peso total de 18.5 kg. La especie se presentó durante todos los meses del año y en todas las estaciones. A nivel espacial (fig. 2a, b), el comportamiento de la densidad y la biomasa fue muy variable entre las estaciones de muestreo. La estación 1 fue la más importante en términos de densidad y biomasa. La densidad media máxima se presentó en la estación 15 (1.4 x 10–2 ind m–2) y la mínima en la estación 37 (7.0 x 10–5 ind m–2). Sin embargo, aunque la estación 15 fue la más importante en términos de densidad, no lo fue en términos de biomasa (1.3 x 10–2 g m–2). La biomasa media por estación más alta se observó en la estación 1 (9.3 x 10–2 g m–2) y la menor en la estación 25 (5.0 x 10–5 g m–2).
A nivel temporal, la densidad media fue variable (fig. 2 c, d), con valores elevados en febrero, mayo y noviembre. La densidad y biomasa medias más altas ocurrieron en mayo (5.0 x 10–3 ind m–2 y 3.3 x 10–2 g m–2) y fueron mínimas en enero (1.0 x 10–3 ind m–2 y 5.0 x 10–3 g m–2).
El rango de tallas para la corvinilla osciló entre 1.5 y 17.5 cm, observados en la estación 1 en junio y marzo, respectivamente. A nivel espacial, de la estación 1 a la 31 se presentaron individuos de todos los rangos de talla, mientras que en las estaciones de la 32 a la 37 no se observaron individuos menores a 5.5 cm. Las estaciones 26, 30 y 31 presentaron principalmente individuos entre 3.25 y 9.25 cm. La figura 3 presenta la talla media mensual y por estación de muestreo con sus intervalos de confianza. Las mayores tallas se observaron entre marzo y abril y en agosto y octubre (fig. 3a); a nivel espacial se apreció la diferencia de la estación 33 a la 37 de individuos de tallas mayores, aunque poco abundantes (8.25 a 75.25 cm, fig. 3b).
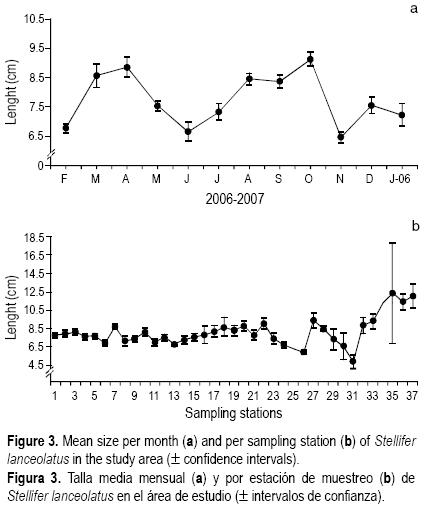
En la figura 4a se observan las oscilaciones del modelo de crecimiento para la corvinilla. Los parámetros de crecimiento obtenidos fueron L∞ = 18.5 cm, K = 0.4 año–1 y t0 = –0.083 año–1. Se observa que la curva de crecimiento presentó oscilaciones estacionales con valores de C = 0.63, WP = 0.8 y Rn = 0.254. El inicio de la cohorte anual se presentó en enero. El valor de Φ' fue de 2.14.
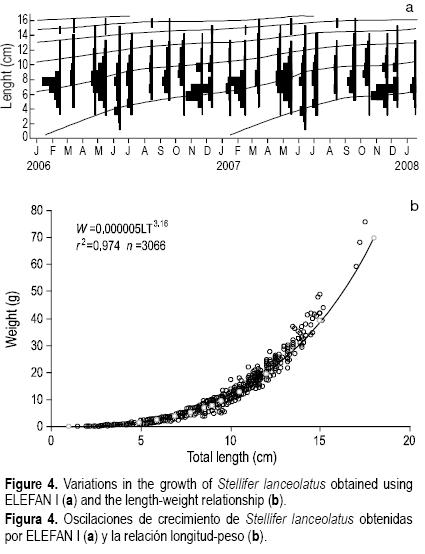
La relación talla–peso de S. lanceolatus se presenta en la figura 4b. El valor de b señala un crecimiento isométrico (t0.05(2), P > 0.05) con un factor de condición de 5.2 x 10–6 (r2 = 0.974).
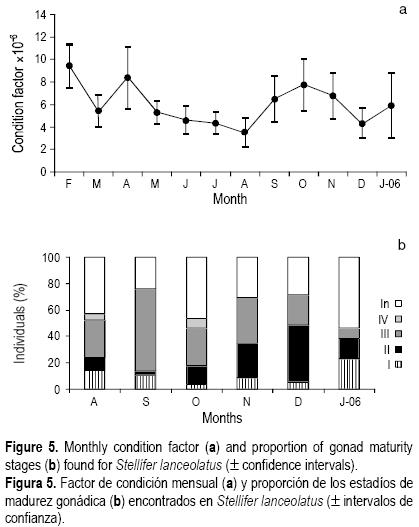
El factor de condición medio mensual disminuyó de febrero a agosto e incrementó de septiembre a noviembre (fig. 5a). Entre mayo y agosto el factor de condición fue muy bajo, lo mismo que entre diciembre y enero. Este fenómeno de baja densidad corporal generalmente está asociado a la maduración gonádica; es decir, que en este caso es de esperar que durante este periodo haya un evento de madurez. Las fases de madurez gonádica observadas por mes se muestran en la figura 5b. El mayor número de hembras maduras (fases II y III) se presentó en septiembre y diciembre. La talla a la cual el 50% de las hembras están maduras fue de 9.2 cm con un rango de 7.5–10.5 cm, respectivamente, para el 25% y el 75%. La edad de primera madurez gonádica se definió a los 1.64 años.
La mortalidad natural obtenida por los métodos de Pauly (1980) y Rikhter y Efanov (1976) fue de 1.1 y 0.9 año–1, respectivamente. Se observó una diferencia mínima entre los dos métodos (0.2 año–1). La mortalidad total fue determinada en 1.68 año–1 (fig. 6a). A partir de los valores anteriores se calculó la mortalidad por pesca en 0.78 y 0.58 año–1, utilizando ambos valores de mortalidad natural, respectivamente.
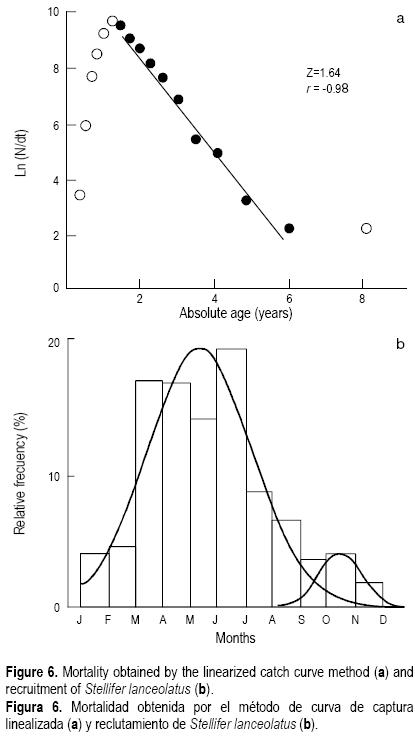
La figura 6b muestra el reclutamiento relativo mensual de la especie durante el periodo analizado. Se observó que hay reclutamiento durante todo el año, con dos picos de mayor importancia. El principal reclutamiento se presentó de marzo a julio con un 70%. También se puede observar que existe un segundo reclutamiento de septiembre a diciembre con menos de 5%.
Discusión
En la Sonda de Campeche, Yáñez–Arancibia et al. (1988) señalaron que S. lanceolatus es una especie dominante por sus altas densidad y biomasa, representando el 2.2% en número, con 1173 individuos, y 0.9% en peso (18.9 kg); asimismo, indicaron que esta es una especie residente permanente en la Boca del Carmen de la Laguna de Términos, considerada como un área de reclutamiento que representa el 16.6 % en número (455 individuos) y el 3.3 % en peso (1.6 kg). Estas informaciones son similares a lo observado en este estudio en el sentido de que esta especie es muy abundante y representa 12.0% en número (3066 individuos) y 4.7% (18.5 kg) en peso de la captura total. Fue poco frecuente en la región sur–suroeste de la Laguna de Términos en las estaciones 29 a 37 (fig. 1). Aunque las áreas estudiadas no son completamente comparables con la estudiada por Yáñez–Arancibia et al. (1988), se confirmó la importancia de la especie, en coincidencia con los resultados de este estudio. Sobre este aspecto, Ayala–Pérez (2006) indica que la especie penetra a los sistemas fluvio–lagunares, observándose en el sistema Palizada del Este, Candelaria Panlau y Pom Atasta, aunque en poca abundancia, lo que es una evidencia de que se trata de una especie eurihalina de hábitos costero–marinos principalmente.
En cuanto a la abundancia temporal, Yáñez–Arancibia y Sánchez–Gil (1986) señalaron que S. lanceolatus es más abundante durante la época de secas (marzo), lo que coincide con este estudio ya que la mayor abundancia se observó durante febrero y mayo, y coincide con la temporada de secas. Estas coincidencias en la abundancia pudieran deberse al desove que en este estudio se observó de septiembre a diciembre, coincidiendo a su vez con el periodo de reclutamiento de juveniles hacia la zona costera y la Boca del Carmen en la Laguna de Términos de marzo a junio.
Yáñez–Arancibia et al. (1988) observaron los patrones de utilización y migración de S. lanceolatus e indicaron que los adultos permanecen en la Sonda de Campeche y que durante la temporada de nortes los juveniles penetran a la laguna hasta desarrollarse y migrar como adultos de nuevo hacia la Sonda de Campeche. También indicaron que es un visitante cíclico en la cuenca central y sedentario y residente permanente en la Boca del Carmen. El rango de salinidad para el hábitat de la especie es de 10 a 35. Al respecto Sosa–López et al. (2007) mencionaron que la especie soporta rangos de salinidad de 5 hasta 30, y Ayala–Pérez (2006) señaló su presencia en los sistemas fluvio–lagunares de Palizada del Este, Chumpán, Candelaria–Panlau y Pom–Atasta, lo que confirma el amplio rango de salinidad que soporta la especie; sin embargo, Stickney et al. (1975), en un estudio realizado en estuarios de Carolina del Sur y Florida, indican que esta especie parece estar restringida a las bocas de los ríos, sondas y aguas costeras con salinidades de 20 y que no se observaron individuos de la especie río arriba, lo que concuerda parcialmente con el presente estudio.
Asimismo, Camargo e Isaac (2005) en un estudio realizado en el estuario de Caeté al norte de Brasil observaron los movimientos espaciales y temporales de dos especies del género Stellifer (S. rastrifer (Jordan 1889) y S. naso (Jordan 1889)) con relación a la salinidad estuarina, encontrando una diferencia entra la abundancia de juveniles y adultos. En la estación de secas observaron juveniles tanto en la bahía como en los ríos, mientras que los adultos fueron más abundantes en la bahía durante diciembre y abril. Estos resultados si bien no pueden ser comparados en su totalidad con este trabajo por tratarse especies distintas, si indican un comportamiento similar al observado ya que las mayores abundancias se presentaron en la zona costera y las menores en el interior de la Laguna de Términos lo que indica la preferencia por el hábitat costero–marino.
En la figura 7 se presenta la distribución hipotética del ciclo de vida de la especie propuesta tras este estudio. La reproducción se realiza en la zona costera, donde se observó mayor cantidad individuos de fases II y III, aunque la maduración se realiza en toda el área incluyendo la parte sureste de la Laguna de Términos (fig.7a), los juveniles se acercan a las áreas de alimentación cercanas a la costa (1, 3, 5, 7, 9, 11, 13, 15, 17, 19 y 24), en donde permanecen hasta alcanzar la talla de madurez (9.2 cm) para regresar a las áreas más profundas y reproducirse nuevamente (fig. 7b). Los juveniles no requieren necesariamente del hábitat estuarino para su supervivencia pero llegan a penetrar a los sistemas fluvio–lagunares y se distribuyen en toda la zona costera. Esto se concluye con base en la distribución por tallas encontrada en donde se aprecian pocos individuos al interior de la laguna (estaciones 26 a 37; figs. 3, 7).
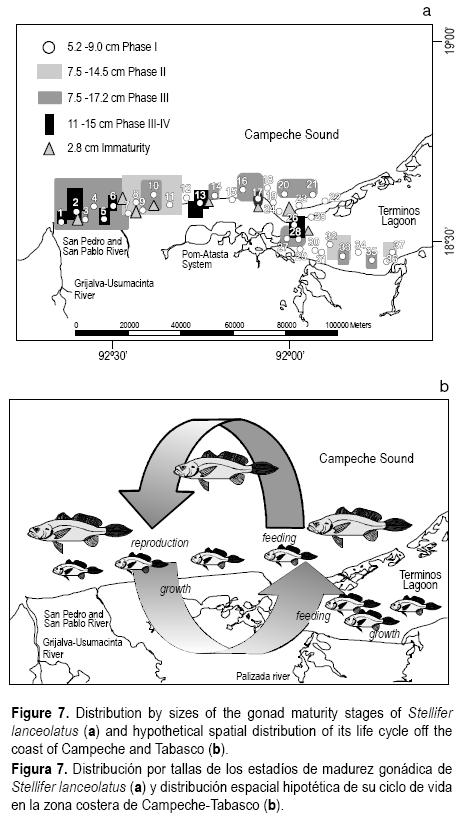
Algunos adultos y juveniles pueden penetrar a la Laguna de Términos cuando condiciones como la salinidad les resultan adecuadas (Yáñez–Arancibia et al. 1988). Esto pudiera ser por el efecto de la temporada de nortes durante los meses de octubre a enero, ya que los vientos permiten la mezcla de agua entre la laguna y la zona costera. Esto hace incrementar la salinidad al interior de la Laguna de Términos, lo que resulta favorable para la especie que utiliza la laguna como área de crianza y alimentación e incluso maduración, como lo confirmó el segundo periodo de reclutamiento observado (septiembre a diciembre).
El patrón de distribución espacial por tallas presentó una estratificación moderada, observándose juveniles y adultos en toda el área y solamente juveniles (<9.2 cm) en las estaciones 11, 13 y 26. A partir de las estaciones 31 a 37 los juveniles fueron poco abundantes, presentándose principalmente individuos de tallas mayores (figs. 3, 7a). Esta observación refuerza la hipótesis planteada anteriormente sobre el ciclo de vida de la especie ya que no existe hasta el momento ningún trabajo reportado basado en la estructura de tallas de esta especie a nivel espacial y temporal.
En cuanto a los parámetros de crecimiento obtenidos en este estudio se determinó que la especie alcanza una L∞ de 18.5 cm con valores de K de 0.4 año–1. No existen estudios formales sobre la determinación del crecimiento en esta especie; sin embargo, Ayala–Pérez (2006) en un estudio realizado en la Laguna de Términos para dos especies de sciaenidos de talla similar, Bairdiella chrysoura y B. ronchus, determinó valores de L∞ = 29.7 cm y K = 0.42 año–1 y L∞, = 29.8 cm y K= 0.55 año–1, respectivamente. Como se puede observar, la constante de crecimiento K para Stellifer y para Bairdiella son muy semejantes. Para verificar la semejanza en el crecimiento se calculó el valor de Φ' para B. chrysoura y B. ronchus, obteniendo valores de 2.57 y 2.69, respectivamente, lo que confirma la semejanza en el crecimiento de las tres especies.
La relación longitud–peso de la población fue definida por el modelo W = 0.0000052L3.16, con una r2 = 0.97. Muto et al. (2000) en un estudio realizado en el Sistema de Sao Paulo en el sureste de Brasil reportan para S. brasiliensis (Schultz 1945) y S. rastrifer (Jordan 1889) valores de W = 0.102L3.42 y r2 = 0.96, y W = 0.030L3.31 y r2 = 0.98, respectivamente. Por otra parte, Ayala–Pérez (2006) reportó para B. chrysoura valores de W = 0.0114 L2.99 y r2 = 0.98, y Chavance et al. (1984) reportaron para la misma especie W = 0.000025L2.97 con r2 = 0.98, mostrando que las especies tienen una forma semejante de crecimiento isométrico. De acuerdo a Froese (2006), si b = 3, entonces las especies pequeñas en la muestra tienen la misma forma y condición que cuando son grandes, lo cual al parecer es el caso de S. lanceolatus y de las otras especies, mostrando una forma de crecimiento similar.
Basados en las observaciones de este estudio y del comportamiento del factor de condición mensual, se puede señalar que los altos valores observados de septiembre a noviembre están asociados a la época de reproducción (fig. 5a, b). Asimismo, los altos valores en febrero y abril pudieran estar relacionados al inicio de la acumulación de grasa previa a la maduración. Flores–Coto y Pérez (1991) coinciden en que en diciembre los organismos han alcanzado el máximo grado condición para reproducirse. En el presente estudio la mayoría de las hembras maduras se encontraron en la zona costera aunque también se encontraron algunas en el interior de la laguna, al mismo tiempo se encontraron adultos y juveniles. Esto significa que el desove de la mayoría de la población se presenta en la costa y en menor grado en el interior de la laguna.
La talla de primera madurez se calculó en 9.2 cm, con un rango de 7.5 y 10.5 cm (25% y 75%, respectivamente), muy diferente a las reportadas para S. rastrifer (12.1 cm) y S. naso (11.7 cm) por Camargo e Isaac (2005). Estos autores señalan además que observaron desoves continuos de ambas especies durante el año en el estuario de Caeté en Brasil; sin embargo, se observó un pulso máximo de desove de octubre a diciembre y un segundo pulso en junio. Aunque las especies son diferentes a S. lanceolatus, parecen tener el mismo comportamiento fisiológico en la maduración. La diferencia en la talla de primera madurez podría indicar que S. lanceolatus madura más rápidamente que las otras dos especies, lo cual pudiera estar influenciado por la salinidad y/o temperatura ambientales.
La mortalidad total para S. lanceolatus fue de 1.68 año–1. Para B. chrysoura Ayala–Pérez (2006) reporta un valor de Z = 1.47 año–1, mientras que Chavance et al. (1984) estimaron 1.98 año–1. Es evidente la relativamente baja mortalidad de la especie, justificable por el hecho de no ser una especie objetivo de la pesca; sin embargo, forma parte de la fauna de acompañamiento del camarón siete barbas que si es intensamente explotado (Abarca–Arenas et al. 2003). En consecuencia para la especie, la mortalidad natural es elevada (1.10 y 0.90 año–1) y confirma que la temperatura influye sustancialmente en la supervivencia de la especie, así como en el desarrollo de la madurez gonádica, reforzando por tanto la hipótesis de la influencia de la variabilidad ambiental sobre su abundancia.
En lo que respecta al reclutamiento se observaron dos periodos. El primero de mayor intensidad (70.0%) de abril a julio y el segundo de menor intensidad de septiembre a diciembre (5.0%). El reclutamiento está asociado a la época de desove, ya que de este depende el desarrollo de juveniles, su abundancia y migración. En este sentido, si se toma en cuenta que el pico reproductivo más importante se observa de septiembre a noviembre, es muy probable que exista un incremento de reclutas de marzo a julio. Ayala–Pérez (2006) reportó para B. chrysoura un proceso de reclutamiento largo que inició en abril y continuó hasta noviembre con un máximo entre junio y julio. En este estudio, abril es cuando se encontró el mayor número de individuos de tallas pequeñas coincidiendo con el periodo de reclutamiento observado. Estas informaciones permiten corroborar que S. lanceolatus es una especie de reclutamiento continuo, con dos épocas de mayor intensidad. Un aspecto importante sería analizar la dinámica de la población en términos de variabilidad espacial y temporal a nivel de las características fisicoquímicas ambientales. Esto permitiría observar en el largo plazo los posibles cambios a nivel de especie y por tanto en la estructura del ecosistema, tomando en cuenta que la región de la Laguna de Términos y sus áreas de influencia han sido intensamente impactadas ambiental y antropogénicamente.
Agradecimientos
Los autores agradecen a CONACYT (México) y al gobierno del Estado de Campeche, su apoyo mediante el proyecto FOMIX–CAM2005–C01–040.
Referencias
Abarca–Arenas L, Franco–López GJ, Chávez–López R, Moran–Silva A. 2003. Estructura de la comunidad de peces de la pesca incidental camaronera. In: Wakida A, Solana R, Uribe J (eds.), Memorias de III Foro de camarón del Golfo de México y del Mar Caribe. Instituto Nacional de la Pesca, SAGARPA, pp. 69–73. [ Links ]
Ayala–Pérez LA. 2006. Modelo de simulación de la comunidad de peces en el área natural protegida Laguna de Términos, Campeche, México. Ph.D. thesis, Universidad Autónoma Metropolitana Xochimilco, México, 208 pp. [ Links ]
Ayala–Pérez LA, Pérez–Velásquez A, Aguirre–León A, Díaz–Ruiz S. 1995. Abundancia nictimeral de corvinas (Pisces: Sciaenidae) en un sistema costero del sur del Golfo de México. Hidrobiológica 5: 37–44. [ Links ]
Ayala–Pérez LA, Ramos–Miranda J, Flores–Hernández D. 2003. La comunidad de peces en 1a Laguna de Términos: Estructura actual comparada. Rev. Biol. Trop. 51: 738–794. [ Links ]
Ayala–Pérez LA, Ramos–Miranda J, Flores–Hernández D, Vega–Rodríguez BI, Moreno–Medina UC. 2008. Biological and ecological characterization of the catfish Cathorops melanopus off the west coast of Campeche, Mexico. Cienc. Mar. 34: 453–465. [ Links ]
Camargo M, Isaac V. 2005. Biología reproductiva y distribución espaciotemporal de Stellifer rastrifer, Stellifer naso y Macrodon ancylodon (Sciaenidae) en el estuario Caeté, al norte de Brasil. Braz. J. Oceanogr. 53: 13–21. [ Links ]
Castro–Aguirre JL. 1999. Ictiofauna Estuarino–lagunar y Vicaria de México. Limusa, 705 pp. [ Links ]
Cervigón F, Cipriano R, Fischer W, Garibaldi L, Hendrickx M, Lemus AJ, Márquez R, Poutiers JM, Robaina G, Rodríguez B. 1992. Guía de Campo de las Especies Comerciales Marinas de Aguas Salobres de la Costa Septentrional del Sur de América. FAO, Roma, 513 pp. [ Links ]
Chavance P, Flores–Hernández D, Yáñez–Arancibia A, Amezcua–Linares F. 1984. Ecología, biología y dinámica de las poblaciones de Bairdiella chrysoura (Lacépede, 1803) en la Laguna de Términos, sur del Golfo de México (Pisces: Sciaenidae). An. Inst. Cienc. Mar Limnol. Univ. Nac. Autón. México, 11: 123–161. [ Links ]
Fischer W. 1978. FAO Species Identification Sheets for Fisheries Purposes. Western Central Atlantic (Fishing Area 31), Roma FAO, Rome, Vol. IV. [ Links ]
Flores–Coto C, Pérez M. 1991. Efecto de la marea en el paso de las larvas de sciánidos (Pisces) en Boca del Carmen, Laguna de Términos, Campeche. An. Inst. Cienc. Mar Limnol. Univ. Nac. Antón. México 18: 25–35. [ Links ]
Froese BR. 2006. Cube law, condition factor and weight–length relationships: History, meta analysis and recommendations. J. Appl. Ichthyol. 22: 241–253. [ Links ]
Gayanilo FC Jr, Sparre P, Pauly D. 1996. The FAO–ICLARM Stock Assessment Tools (FiSAT) User's Guide. FAO Computerized Information Series, No. 8 (Fisheries). FAO, Rome, 126 pp. [ Links ]
Helfman GS, Collette BB, Facey D. 2002. The Diversity of Fishes. Blackwell Science, 528 pp. [ Links ]
Hilge V. 1977. On the determination of the stages of gonad ripeness in female bony fishes. Meeresforschung 25: 149–155. [ Links ]
Mancera–Rodríguez NJ, Castro–Hernández JJ. 2004. Age and growth of Stephanolepis hispidus (Linnaeus, 1766) (Pises: Monacanthidae), in the Canary Islands area. Fish. Res. 66: 381–386. [ Links ]
Munro JL, Pauly D. 1983. A simple method for comparing the growth of fishes and invertebrates. Fishbyte (ICLARM) 1: 5–6. [ Links ]
Muto EY, Soares LSH, Rossi–Wongtschowski CLDB. 2000. Length–weight relationship of marine fish species off São Sebastião system, São Paulo, southeastern Brazil. NAGA, ICLARM Quart. 23: 27–29. [ Links ]
Pauly D. 1980. Some simple methods for the assessment of tropical fish stocks. FAO Fish. Tech. Pap. (234): 52 pp. [ Links ]
Pauly D, Gaschütz N. 1979. A simple method for fitting oscillating length growth data with a program for pocket calculators. ICES CM 1979/G:24–26. [ Links ]
Pauly D, David N. 1981. ELEFAN I, a basic program for the objective extraction of growth parameters from the lengh–frecuency data. Meeresforschung 28: 205–211. [ Links ]
Ramos–Miranda J, Mouillot D, Flores–Hernández D, Sosa–Lopez A, Do–Chi T, Ayala–Pérez LA. 2005a. Changes in four complementary facets of fish diversity in a tropical coastal lagoon after 18 years: A functional interpretation. Mar. Ecol. Prog. Ser. 304: 1–13. [ Links ]
Ramos–Miranda J, Quiniou L, Flores–Hernández D, Do Chi T, Ayala–Pérez L, Sosa–López A. 2005b. Spatial and temporal changes in the nekton of the Terminos Lagoon, Campeche, Mexico. J. Fish Biol. 66: 513–530. [ Links ]
Ricker W. 1958. Handbook of computations for biological statistics of fish population. Bull. Fish. Res. Bd. Canada 119: 300 pp. [ Links ]
Rikhter VA, Efanov VN. 1976. On one of the approaches to estimation of natural mortality of fish populations. ICNAF Res. Doc. 76/VI/ 8, 12 pp. [ Links ]
Rueda M, Santos A. 1999. Population dynamics of the striped mojarra Eugerres plumieri from the Ciénega Grande de Santa Marta, Colombia. Fish. Res. 42: 155–166. [ Links ]
Sokal R, Rohlf F. 1996. Biometry. 3rd ed. WH Freeman and Co., New York, 887 pp. [ Links ]
Sosa–López A, Mouillot D, Ramos–Miranda J, Flores–Hernández D, Do–Chi T. 2007. Fish species richness decreases with salinity in tropical coastal lagoons. J. Biogeogr. 34: 52–61. [ Links ]
Sparre P, Venema SC. 1995. Introducción a la evaluación de recursos pesqueros tropicales. 1. Manual. FAO Fish Tech. Pap. (306.1) Rev. 1: 376 pp. [ Links ]
Stickney RR, Taylor D, White B. 1975. Food habits of five species of young southeastern United States estuarine Sciaenidae. Chesapeake Sci. 16: 104–114. [ Links ]
Tapia–García M, Yáñez–Arancibia A, Sánchez–Gil P, García–Abad MC. 1988a. Biología y ecología de Cynoscion arenarius (Ginsburg) en las comunidades demersales de la plataforma continental del sur del Golfo de México (Pisces: Sciaenidae). Rev. Biol. Trop. 36: 1–27. [ Links ]
Tapia–García M, Yáñez–Arancibia A, Sánchez–Gil P, García–Abad MC. 1988b. Biología y ecología de Cynoscion nothus (Holbrook) en las comunidades demersales de la plataforma continental del sur del Golfo de México (Pisces: Sciaenidae). Rev. Biol. Trop. 36: 29–54. [ Links ]
Yáñez–Arancibia A, Sánchez–Gil P. 1986. Los peces demersales de la plataforma continental del sur del Golfo de México. Caracterización ambiental ecológica y evaluación de las especies y comunidades An. Inst. Cienc. Mar Limnol. Univ. Nac. Autón. México 9: 1–230. [ Links ]
Yáñez–Arancibia A, Lara–Domínguez AL, Sánchez–Gil P, Álvarez–Guillen H. 1988. Evaluación ecológica de las comunidades de peces en la Laguna de Términos y la Sonda de Campeche. In: Yáñez–Arancibia A, Day JW (eds.), Ecología de los Ecosistemas Costeros en el Sur del Golfo de México: La Región de la Laguna de Términos. Editorial Universitaria, UNAM, México DF, pp. 323–356. [ Links ]
* DESCARGAR VERSIÓN BILINGÜE (INGLÉS–ESPAÑOL) EN FORMATO PDF














