Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud mental
versión impresa ISSN 0185-3325
Salud Ment vol.34 no.3 México may./jun. 2011
Artículo original
Insomnio, estrés y canabinoides
Insomnia, stress and cannabinoids
Oscar Prospéro García,1 Mónica Méndez Díaz,1 Alejandra E. Ruiz Contreras,2 Ilia Alvarado Capuleño,1 León Rosenthal3
1 Laboratorio de Canabinoides, Departamento de Fisiología, Facultad de Medicina, UNAM.
2 Laboratorio de Genómica Cognitiva, Facultad de Psicología, UNAM.
3 Sleep Medicine Associates of Texas. Dallas, Tx, USA.
Sociedad Mexicana para la Investigación y Medicina del Sueño
Correspondencia:
Dr. Oscar Prospéro García.
Laboratorio de Canabinoides,
Departamento de Fisiología, Facultad de Medicina,
Universidad Nacional Autónoma de México.
Apdo. Postal 70–250, 04510, México, D.F. Tel. (+52 55) 5623 2509.
Fax. (+52 55) 5622 5607. E–mail: opg@servidor.unam.mx
Recibido: 14 de enero de 2011.
Aceptado: 27 de abril de 2011.
ABSTRACT
Sleep is a universal experience and a necessary ingredient to life. Young adult humans benefit from spending 8 h a day, every day, sleeping. While the function(s) of sleep is not completely understood, it is known that sleep is critical to the survival of the species. In humans, it restores alertness, helps consolidate memory and «recharge» cognitive abilities which are impaired at the end of the activity-phase of the cycle. Humans who do not pay their toll to sleep, for one night, for example, experience difficulties maintaining wakefulness the next day. This condition may put in danger their lives, particularly if they work in the transportation industry (i. e. taxi cabs, truck or trailers-drivers, pilots and/or operating heavy machinery among many other activities). In the past, when humans were more exposed to predators, to be sleepy in the savannah was synonymous with dying. Interestingly enough, the maladaptive strategies exhibited by a sleepy subject (which put at risk his life), are reversed by sleep. It is widely believed that sleep has a restorative function. However, what precisely is being restored during sleep remains a topic of speculation and on-going research. Sleep deprivation in humans results in cognitive deterioration and increased sleepiness, which might compromise survival as aforementioned. It is known that in rats prolonged sleep deprivation leads to death. In humans, it results in sleepiness, decreased attention, compromises memory and learning skills, and may affect motor control. The negative effects of sleep loss are reversed by recovery sleep, which may show features of delta and/or REM-sleep rebound. In this context, insomnia is a condition with known negative consequences to the health of the affected individual and frequently conveys negative effects to the family nucleus and to society in general. It has been estimated that 9% to 15% of the adult population suffers from chronic insomnia. Psychophysiologic insomnia (or primary insomnia) is likely the most prevalent type of insomnia. The patient with insomnia frequently develops an aversive response to sleep and to all aspects related to this activity. The manifestations of insomnia may include difficulty falling (and staying) asleep, frequent awakenings, early morning awakenings and/or un-refreshing quality of sleep. As a result, affected individuals frequently complain of daytime consequences such as decreased concentration, negative effects on memory (and learning), and daytime fatigue. They may also complain of headaches, fuzziness (or grogginess) and might experience manifestations of excessive sleepiness (which might represent a hazard when driving and/or operating machinery). Stress and anxiety frequently represent precipitating and/or perpetuating factors in the development of insomnia.
In regards to stress, the role of the hypothalamus-pituitary-adrenal (HPA) axis in preserving homeostasis has been amply studied. The HPA axis involves the participation of peptides such as corticotropin-releasing hormone (CRH), corticotropin itself and cortisol. The autonomic nervous system activates the amygdaloid complex further enhancing the stress response. When patients are unable to control their stress response, the magnified response may be manifested as an anxiety disorder. According to the DSM-IV, the diagnosis of generalized anxiety disorder (GAD) is based on persistent symptoms of excessive anxiety and worry. Patients with GAD as well as those suffering from other anxiety disorders such as PTSD and panic attacks may manifest symptoms of insomnia. Several models of stress have been proposed to better understand these conditions. For example, prenatal stress has been suggested to increase vulnerability to life events and some reports have suggested impaired sleep among some of the animal models that have been studied. Specifically, it has been reported that rats who are deprived of maternal care suffer from dysregulation of the orexinergic system. Consequently, affected rats may have manifestations of sleep-wake dysregulation. There is more. Rats born to a low care maternal provider (which induces an early stress response) have been found to have methylated the gene that encodes the glucocorticoid receptors, which is reflected in a low expression of receptors. As a result, these animals release more corticosterone in response to stressful situations and are less efficient in managing stress. Furthermore, they have a lower expression of the CB1 receptor in several areas of the brain, thus suggesting that the systems responsible for reducing excitability of the brain (and consequently reducing the subjective sensation of fear and anxiety) are shattered.
Models of insomnia evaluating the possible role of an inadequate stress-response have not been thoroughly studied. Potential pharmacologic interventions using such a theoretical framework have not been systematically studied and thus offer a venue for novel pharmacological interventions. The addition of new therapies would be particularly useful as the clinical management of patients with chronic insomnia remains a challenging area in medical practice. This despite the availability of multiple approved hypnotic medications in the physician's armamentarium. To date there is no hypnotic medication which can be considered ideal for the treatment of chronic insomnia. Issues of tolerance and dependence remain relevant concerns for those hypnotic medications, which are considered most effective in the treatment of this condition. Research identifying new compounds based on molecules whose physiologic action is to induce sleep may render safer, more efficient pharmacological interventions to treat insomnia. Following this line of thinking, we have tested the effects of endocannabinoids (eCBs). The eCBs represent a family of molecules, lipids in nature, which bind to the same receptors to which marijuana is known to bind. The active metabolite of marijuana (delta-9-tetrahydrocannabinol [THC]) is known to bind to the CB1 receptors and produce a series of effects including relaxation and sleep. Following the discovery of several eCBs by the research groups of Mechoulam and Lerner, we have tested anandamide and oleamide as sleep inducers. Results have indicated that both molecules and a third one, 2-arachidonyl glycerol, induce sleep (mainly REM sleep).
In the present review insomnia is speculated to be a consequence of chronic stress. Several animal models of early stress are also discussed to better understand the role of stress in the causation of insomnia. The current limitations in the availability of ideal hypnotic medications prompt us to argue in favor of continued efforts to find additional, novel pharmacologic interventions to treat this condition. In this context, the potential use of endocannabinoid compounds is proposed as a possible new line of hypnotic medications. While eCBs have been used so far only in animal models, they have been amply successful in promoting the expression of non-REM and REM sleep. The endocannabinoid system has the potential to induce sleep and thus suggest that endocannabinoid agonists offer a new research venue for the exploration of novel pharmacologic interventions in the treatment of insomnia.
Key words: Insomnia, stress, cannabinoid receptor 1, endo-cannabinoids.
RESUMEN
El sueño es una actividad fundamental para el bienestar y la preservación del la salud. El no dormir resulta en consecuencias potencialmente letales. Por ejemplo, ratas experimentalmente privadas de sueño total (o de sueño MOR) mueren al cabo de algunas semanas de experimentación. Asimismo, en humanos, la privación de tan solo una noche de sueño conlleva consecuencias importantes. Hipersomnolencia y disminución de las habilidades cognoscitivas son consecuencias de la privación de sueño. El individuo privado de sueño corre el riesgo de cometer errores que potencialmente pueden poner en riesgo su vida o integridad física, así como la de otros.
Se ha sugerido que el sueño cumple con la muy importante tarea de ofrecer las condiciones para que se lleven a cabo diversos procesos de restauración y de reorganización neuronal así como el procesamiento de información y consolidación de la memoria. La ausencia de sueño interfiere con estos procesos con el consecuente deterioro de la conducta adaptativa del sujeto.
El insomnio es un trastorno que deteriora de manera importante la calidad de vida de las personas que lo padecen. Afecta aproximadamente al 10% de la población. El insomnio se presenta en diversas formas. La clasificación internacional de los trastornos del dormir considera 11 tipos de insomnio. Entre ellos, el insomnio psicofisiológico representa el tipo de insomnio que más frecuentemente se manifiesta en la población. Se trata de un padecimiento donde el paciente desarrolla una aversión a dormir y a todo lo que se relacione con ello. Este tipo de insomnio tiene un componente de estrés que precipita la aparición del insomnio y puede contribuir a los elementos que ayudan a perpetuarlo (insomnio crónico). Se han desarrollado diversos modelos animales para el estudio del estrés y sus consecuencias. Por ejemplo, el estrés temprano inducido por privación del cuidado maternal. Asimismo, por inducción de estrés en la madre (rata) gestante. Sin embargo, se han explotado poco para evaluar el insomnio y mejor aún, para ensayar fármacos que puedan beneficiar al paciente insomne. A pesar de contar con una gran variedad de medicamentos hipnóticos, en la actualidad no existe un hipnótico ideal. Los tratamientos más efectivos con los que contamos conllevan riesgos importantes de tolerancia, adicción y potencialmente efectos colaterales. Por ello, la búsqueda de nuevos fármacos con propiedades inductoras de sueño es inaplazable. Especialmente de fármacos que sean capaces de inducir las fases de sueño delta y sueño MOR sin causar sonambulismo, somnolencia residual y/o efectos negativos en la memoria. En este contexto se discute el potencial uso terapéutico de los endocanabinoides (eCBs), ya que son ansiolíticos e inductores de las fases profundas de sueño (delta y sueño MOR). Los eCBs son moléculas endógenas que tienen una actividad semejante a la de la mariguana. Esto es debido a que tanto la mariguana como los eCBs afectan a un mismo receptor, que es el receptor canabinoide 1 (CB1). Los eCBs tienen un potencial terapéutico que hasta ahora no se ha explotado en beneficio de los pacientes que sufren de insomnio y/o ansiedad. Por ello, en esta revisión se analiza el insomnio desde el punto de vista clínico, se detallan sus características para que el médico clínico no experto pueda reconocerlo y potencialmente tratarlo; también se persigue subrayar la influencia potencial del estrés en la fisiopatogénesis de este trastorno. A pesar de que hay cada vez más información acerca de la síntesis y degradación de los eCBs (lo que es muy importante porque estos mecanismos pueden ser afectados por fármacos que inhiban la degradación o la faciliten, dependiendo de las necesidades terapéuticas) no discutiremos estos temas que se vuelven más especializados. Sin embargo, es importante que se conozca y se discuta su posible uso para beneficio del paciente. Esta revisión se centra en discutir los potenciales beneficios causados por la activación del receptor CB1 en el paciente insomne para reducir su dolencia de mal dormir.
Palabras clave: Insomnio, estrés, receptor canabinoide 1, endocanabinoides.
INTRODUCCIÓN
El sueño. El sueño representa una actividad vital del organismo. Dependiendo del organismo de que se trate, la organización temporal del ciclo sueño-vigilia varia así como la duración del mismo. En el humano, a pesar de que hay variaciones ontogenéticas (el recién nacido y el viejo tienen patrones de sueño diferentes entre sí y con el adulto), se dice que el adulto en promedio ocupa ocho horas en dormir, diariamente.1
¿Para qué dormimos? Aclaremos primero que no dormir es incompatible con la vida. En animales se ha demostrado que la privación total o selectiva de sueño (como la del sueño con movimientos oculares rápidos [SMOR]), por largo tiempo, hace que dichos animales mueran.2,3 Cuando la privación de sueño es por 24 o 96 horas, se ha detectado un daño en la cromatina de las células cerebrales de las ratas.4
Asimismo, una privación menos agresiva, como ocurre cuando un humano se desvela por una noche, hace que la calidad de la vigilia disminuya. Esto es, después de la privación el sujeto esta somnoliento, pone pobre atención o ninguna a los estímulos, consecuentemente deteriora su aprendizaje y su memoria de trabajo, por lo que su habilidad para generar y exhibir estrategias adaptativas disminuye.5
Cuando el sujeto se duerme después de la privación, su sueño ocupa más tiempo en la fase de ondas lentas, llamada también fase III o delta y en sueño de movimientos oculares rápidos (SMOR), reduciendo los despertares y las fases I y II. Con ello observamos que las fases que tienen prioridad para el cerebro son la delta y el SMOR. De tal manera que un sujeto privado de sueño podría dormir el doble en estas etapas, comparado con alguien que no presenta dicha privación. A este fenómeno lo llamamos rebote de sueño.
Ambos, la vigilia prolongada que lleva a la muerte y el rebote de sueño, indican la necesidad vital que tiene el cerebro de dormir por un periodo largo (ocho horas) después de un periodo, también largo, de vigilia (16 horas).
Si un sujeto no puede dormir bien, y es una dolencia que le aqueja por años, como en el caso del insomnio crónico, sus mecanismos de restauración neuronal posiblemente se deterioren. Consecuentemente, la calidad de la vigilia se puede ver importantemente reducida. Esta falta de sueño y el consecuente deterioro de la calidad de la vigilia puede ser consecuencia del estrés.
CARACTERÍSTICAS CLÍNICAS DEL INSOMNIO
El insomnio es una de las quejas más frecuentes en las clínicas de sueño.6 Se define como la dificultad de iniciar, mantener o consolidar el sueño, así como tener un sueño no reparador, que repercute negativamente en la vigilia.7 Las consecuencias sobre la salud son dramáticas. Por ejemplo, compromete el estado de alerta, los procesos cognitivos y motores y debilita la función inmunológica,2 entre otros efectos. Además, el insomnio tiene un costo social que se calcula en aproximadamente 35 mil millones de dólares, al menos en Estados Unidos de América. Esto es debido al absentismo laboral, a los accidentes de trabajo con el consecuente gasto de atención y la reducción en la productividad.
Datos de la Organización Mundial de la Salud revelan que el 10% de la población refiere síntomas de insomnio crónico; es decir, por más de seis meses, siendo las mujeres la población más afectada.6 Como consecuencia, se ha reportado que el 5% de la población utiliza cotidianamente fármacos inductores de sueño.8
Los síntomas de insomnio pueden clasificarse con base a distintos criterios; asociados al momento de la noche en que se presenten, a la duración y a la etiología.6,7 De acuerdo al momento en que se presentan, podemos distinguir tres tipos de insomnio: el de inicio, que es la dificultad para conciliar el sueño; el intermedio, que se caracteriza por despertares a lo largo de la noche con dificultad para volver a dormir y el insomnio tardío, despertar muy temprano sin capacidad de conciliar el sueño nuevamente. Con respecto a su duración, el insomnio puede ser de tipo transitorio (menos de dos semanas). Agudo (entre dos semanas y seis meses) y crónico (más de seis meses). Por su etiología podemos identificar 11 apartados, según la Clasificación Internacional de los Trastornos de Sueño7 (cuadro 1).

Creemos que el estrés puede llegar a tener una función determinante para que el insomnio se presente y se perpetúe. En un estudio que hicimos en el 20089 detectamos que una de las razones para que un adulto en edad productiva desee un buen dormir es el trabajo. Mantener su capacidad de laborar y producir adecuadamente. Esto lo hace buscar ayuda si tiene insomnio, pero también lo llena de creencias desadaptativas que le perpetúan el insomnio. Por ello, nosotros y diversos otros grupos clínicos hemos utilizado la terapia cognitivo-conductual para tratar al paciente, con buenos resultados.10
ESTRÉS Y SUEÑO
El estrés se define como una demanda extraordinaria a la fisiología del organismo que conlleva la alteración de la constancia del medio interno. La respuesta del organismo al estrés persigue la restitución de la homeostasis utilizando servo-mecanismos orientados a dicha restitución.11 El estrés cursa con variables conductuales como el estado al que llamamos miedo, que se presenta cuando la inmediatez del estresor es evidente, y la ansiedad, cuando la inmediatez del estresor es lejana, por lo que sólo se anticipa su aparición. La respuesta humoral al estrés incluye al menos tres niveles de acción. Uno hormonal que depende del eje hipotálamo-hipófisis-adrenales, el autonómico y las respuestas mediadas por neurotransmisores en el cerebro.11
El eje hipotálamo-hipófisis-adrenales, incluye el concurso de la hormona liberadora de corticotropina (CRH, factor hipotalámico), la hormona adrenocorticotropa (ACTH, factor hipofisiario) y el cortisol (factor de la corteza de la glándula suprarrenal). La respuesta autonómica también interviene, preferentemente facilitando la liberación de adrenalina que tonifica la respuesta cardiovascular, facilita el alertamiento y la actividad de la amígdala. Diversos neuropéptidos11 han sido involucrados en la respuesta al estrés. Entre ellos la CRH, facilitadora del estrés, de la vigilia y por lo mismo inhibidora del sueño; el neuropéptido Y (NPY), las orexinas y la colecistocinina (CCK), que reducen el estrés y la vigilia y facilitan el sueño. Cuando un paciente pierde la capacidad de regular su estrés y responde con exageración a los estresores o a su potencial ocurrencia, entonces es posible que tenga un trastorno de ansiedad.
Trastorno de ansiedad generalizada (TAG). Según el DSM-IV-TR, para que un paciente sea diagnosticado con este padecimiento debe presentar preocupación excesiva sobre eventos por los que la mayoría de las personas se preocupan moderadamente. El paciente encuentra muy difícil controlar estas preocupaciones y está inquieto, irritable, fatigado, con gran tensión muscular, tiene dificultad para dormir y para poner atención y concentrarse en sus actividades. Este síndrome y otros clasificados en el DSM-IV-TR como pertenecientes a los trastornos del Eje I, como son los ataques de pánico, el estrés postraumático y otros trastornos de la ansiedad, propician el insomnio.
Los pacientes que se quejan de insomnio tienen, en general, altos los niveles de ACTH y los de cortisol, sobre todo entre las ocho y las 12 de la noche, cuando un sujeto que duerme normalmente tiene estas moléculas en su concentración más baja. Incluso dentro del grupo de insomnes podemos observar que aquellos que tienen menos elevado el cortisol tienen más sueño total que los que tienen más cortisol.12 Incluso se plantea una personalidad que predispone al insomnio.13,14 Evidentemente, es muy difícil modelar estos estados fisiopatológicos en animales. El modelaje en animales es crítico para entender la fisiopatología del trastorno y para el ensayo de medicamentos que ofrezcan mejores posibilidades terapéuticas.
MODELOS ANIMALES DE ESTRÉS CRÓNICO
Se han utilizado varios modelos animales para inducir estrés crónico. Por ejemplo, la administración de dexametasona a las ratas madres gestantes genera crías que tienen hiperrespuestas a los estresores. Asimismo la separación de la cría recién nacida de su madre por unas horas (tres horas) diariamente, del día dos posnatal al día 14, genera ratas adultas que manejan pobremente los estresores. Estos modelos pueden estar reproduciendo condiciones humanas tales como la del estrés perinatal sufrido por las madres gestantes agredidas por sus parejas (golpeadas o abusadas sexualmente) y el de niños cuyos padres están ausentes. Con ello reproducen condiciones que un sector de la población puede experimentar y que lo lleva a tener una personalidad evitadora de riesgo.15,16
A pesar de que este rasgo evitador se cree que es genético, se ha demostrado en ratas que al menos parte del sistema del estrés que subyace a esta personalidad, como es el gen que codifica para el receptor a glucocorticoides, se modifica de manera posnatal. Como sabemos, la regulación epigenética de la trascripción de los genes incluye diversos factores, entre ellos la metilación del DNA (si las citosinas están metiladas, la trascripción se reduce) y la desacetilación de las histonas-3 (que también reduce la trascripción). El cuidado maternal parece ser crucial para que el gen del receptor a glucocorticoides se desmetile y las histonas asociadas se acetilen y por lo tanto ocurra una buena transcripción del gen.
El modelo de estrés crónico en las ratas hijas de madres cuidadoras deficientes o bajas
Se ha descrito un modelo en ratas que cursa con estrés crónico.17,18 Por ejemplo, las ratas que son cuidadas por sus madres, pero que éstas les proveen de un bajo cuidado físico y probablemente afectivo, presentan diversas carencias tanto estructurales y funcionales como conductuales. Hay tres parámetros que han sido cardinales para detectar este tipo de madres: el lamido y acicalamiento de las crías y el amamantarlas arqueando su cuerpo sobre ellas (arqueo de espalda). Evaluando la frecuencia con que exhiben estos tres parámetros a lo largo de los primeros 10 días posnatales, se puede clasificar a los críos como hijos de madres altas cuidadoras (las MAC exhiben mucho estas conductas) o bajas cuidadoras (las MBC exhiben poco las conductas mencionadas). Las observaciones de estas crías han mostrado que los productos de MBC son muy poco eficientes en la resolución de tareas de aprendizaje (resolución de laberintos, v. gr. el acuático de Morris) y en varios laboratorios, incluido el nuestro, se ha mostrado que presentan menos sueño. Por otro lado, se han detectado varios cambios neuroquímicos. Por ejemplo, el exón 17 del promotor del gen que codifica para el receptor a glucocorticoides (GR) está metilado en las crías de MBC; mientras que se ha detectado desmetilado en las de MAC, lo que va de acuerdo con una baja trascripción del gen en los primeros sujetos. Adicionalmente, las crías de MBC responden con una alta secreción de corticosterona ante estresores como la restricción de movimiento. Las ratas hijas de MAC secretan menos corticosterona. Otros investigadores han mostrado que las ratas privadas de cuidados maternales tienen aumentada la expresión de las orexinas y sus receptores.
Este modelo reproduce las condiciones por las que más frecuentemente pasa un ser humano: el cuidado parental pobre o inexistente. Es posible que algunos pacientes insomnes hayan pasado por un periodo de la infancia durante el cual no recibieron los cuidados parentales adecuados.
TRATAMIENTO DEL INSOMNIO
En los años recientes se ha tratado de caracterizar el perfil del agente hipnótico ideal.19 Éste, se dice, debe tener una farmacocinética muy rápida. Es decir, llegada rápida al sitio de acción y rápida eliminación. Su acción debe ser la de mejorar el sueño en todos sus aspectos y no interferir con la vigilia al día siguiente. Es decir, como se elimina rápido, no induce somnolencia diurna. No debe facilitar el abuso de su consumo ni la dependencia. Tampoco debe haber efectos de rebote cuando se suspenda el tratamiento. Hasta hace algunos años el tratamiento del insomnio fue exclusivamente a base de benzodiacepinas tales como flurazepan, estazolam, quazepan y temazepan, que son de vida intermedia o larga, por lo que facilitan la continuidad del sueño durante la noche pero pueden llegar a causar somnolencia residual. El triazolam se ha utilizado con mejores resultados sobre los efectos residuales ya que es una benzodiacepina de vida media corta. Asimismo, los famosos fármacos Z como el zolpidem y el zaleplon son de vida media corta y por lo mismo no tienen efectos residuales en el día siguiente. Se ha aducido que estos últimos fármacos tienen mayor ventaja terapéutica ya que no inhiben la manifestación del sueño de ondas lentas. De manera interesante los medicamentos benzodiacepinicos conllevan efectos ansiolíticos y miorrelajantes, además de su efecto hipnótico, lo que representa una ventaja terapéutica en el tratamiento de pacientes con problemas de ansiedad. Desafortunadamente, tanto las benzodiacepinas como los fármacos Z presentan riesgos de tolerancia y adicción que pueden llegar a limitar su uso en algunos pacientes con insomnio crónico. Sin embargo, el manejo de estos pacientes frecuentemente requiere de una intervención farmacológica continua lo que obliga al clínico a intentar proveer alivio sintomático al paciente mientras busca minimizar las complicaciones o los efectos colaterales indeseables.
Por otro lado se conoce de manera anecdótica que diversos usuarios de marihuana la consumen para obtener relajación. Incluso, en algunos de ellos el efecto los lleva a experimentar somnolencia. Desde la perspectiva clínica, algunos pacientes con insomnio crónico llegan a reportar el uso de marihuana como una forma de auto-medicación. El mecanismo por el cual la marihuana afecta al cerebro es interfiriendo con el sistema de los endocanabinoides. En estudios hechos en animales se ha mostrado que facilitar la acción de los endocanabinoides produce sueño.20 ¿Qué son los endocanabinoides y cómo afectan el sueño?
Los endocanabinoides
En 1992 Mechoulam et al.21 describieron una molécula de naturaleza lipídica aislada del cerebro del cerdo y que tiene propiedades semejantes a las de la marihuana. La llamaron anandamida. Dos años después, nosotros describimos otro lípido al cual llamamos oleamida.22 Éste también se une a los receptores a la marihuana (CB1 y CB2) y cuando se administra sistémicamente produce diversos efectos que son parecidos a los inducidos por la marihuana. Actualmente contamos con diversos endocanabinoides como puede verse en el cuadro 2.
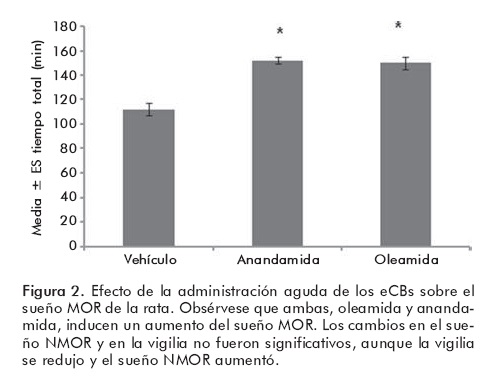
Los endocanabinoides y el sueño
Se ha observado que los endocanabinoides modulan el sueño.23-27 La oleamida fue aislada del líquido cefalorraquídeo (LCR) de gatos privados de sueño,22 y la forma sintética de esta molécula induce sueño en ratas cuando se les administra de forma sistémica,24 intracerebroventricularmente (ICV) o directamente en el parénquima cerebral, en núcleos como el pedúnculo-pontino tegmental (PPTg),26 el cual es colinérgico y se ha involucrado con la generación del sueño MOR. Adicionalmente hemos observado que un antagonista específico del receptor CB1, el SR141716A, disminuye el rebote de sueño MOR en ratas que han sido privadas de esta fase de sueño por 24 horas,27 y previene el efecto inducido por la anandamida. También se ha demostrado que el SR141716A disminuye el sueño MOR en ratas, de una manera dependiente de la dosis. Además hemos detectado que la anandamida se encuentra en mayor concentración en el hipotálamo de la rata durante la fase de luz en comparación a la fase de oscuridad, sugiriendo que debido a que las ratas duermen durante el período de luz, los endocanabinoides se elevan en regiones clave para facilitar el sueño.28
EL RECEPTOR A CANABINOIDES 1 (CB1R)
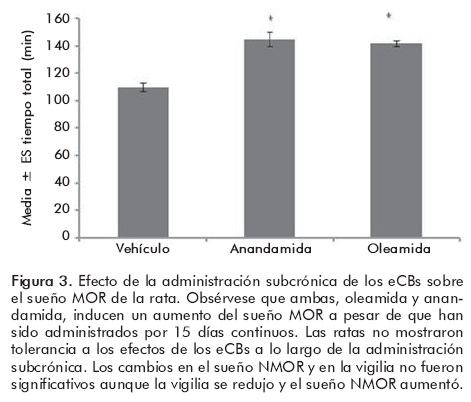
Este receptor está ampliamente distribuido en el cerebro (hipotálamo, amígdala, hipocampo, corteza, tallo cerebral y otras estructuras).29 El mecanismo de acción de este receptor no está completamente caracterizado. Sin embargo se ha descrito que reduce la probabilidad de que la terminal sináptica libere el neurotransmisor. El CB1R está en los botones terminales de neuronas de diversas estirpes neuroquímicas. Por ejemplo, glutamatérgicas, colinérgicas y GABAérgicas. En estudios hechos en ratas hemos observado que la expresión del CB1R está aumentada durante el período de luz (cuando la rata duerme). Además, el rebote de sueño inducido por la privación de sueño, tanto total como sólo de sueño MOR, aumenta la expresión del CB1R.27,30 Este hallazgo sugiere que los endocanabinoides están involucrados en la regulación del sueño. De manera particular, parecen aumentar el sueño delta y el sueño MOR. También hemos mostrado que la administración por 15 días de oleamida o de anandamida induce un aumento consistente de sueño MOR en las ratas.
LOS ENDOCANABINOIDES Y EL ESTRÉS
Por otro lado, los endocanabinoides han sido involucrados en la modulación de la respuesta al estrés.31 En diversos modelos animales en los que se ha generado un estado de estrés se ha observado que la corticosterona facilita la síntesis y liberación de endocanabinoides.32 Adicionalmente, la administración sistémica o directamente en las amígdalas reduce el estrés en modelos de condicionamiento al miedo. Complementariamente, los ratones knock-out para el CB1, se muestran más ansiosos que los ratones silvestres en pruebas de ansiedad como el laberinto elevado en cruz de brazos abiertos.33 Todos estos datos sugieren una función ansiolítica de los endocanabinoides y potencialmente inductora de sueño.
DISCUSIÓN Y CONCLUSIONES
Como se puede desprender de la información anterior, existe una estrecha relación entre las alteraciones emocionales caracterizadas por estados de ansiedad, frecuentemente derivados de situaciones estresantes, con alteraciones del sueño, particularmente referidos a los diferentes tipos de insomnio. En esta relación están involucrados los endocanabinoides, por lo que se abre una posibilidad terapéutica novedosa. El relativamente reciente conocimiento de los endocanabinoides no ha permitido aún revelar a fondo su participación en diferentes procesos patológicos. El insomnio relacionado con alteraciones emocionales podría ser uno de los primeros trastornos en donde la manipulación farmacológica de los endocanabinoides se convierta en una poderosa herramienta para traer alivio a la gran cantidad de personas que lo sufren.
AGRADECIMIENTOS
Los experimentos referidos en este artículo se hicieron con el apoyo del Donativo IN208010 de DGAPA-UNAM y del Donativo 24768 del CONACYT a OPG.
REFERENCIAS
1. Roffwarg HP, Muzio JN, Dement WC. Ontogenic development of the human sleep-dream cycle. Science 1966;152:604-619. [ Links ]
2. Everson CA, Bergman BM, Rechtschaffen A. Sleep deprivation in the rat: III. Total sleep deprivation. Sleep 1989;12:13-21. [ Links ]
3. Kushida CA, Bergman BM, Rechtschaffen A. Sleep deprivation in the rat: IV. Paradoxical sleep deprivation. Sleep 1989;12:13-2. [ Links ]
4. Andersen ML, Ribeiro DA, Bergamaschi CT, Alvarenga TA et al. Distinct effects of acute abd chronic sleep loss on DNA damage in rats. Prog. Neuro.Psychopharmacol. Biol Psychiat 2009;33:562-567. [ Links ]
5. Stickgold R. Sleep-dependent memory consolidation. Nature 2005;437:1272-1278. [ Links ]
6. Edinger J, Means M. Overview of insomnia: Definitions, epidemiology, differential diagnosis and assessment. En: Kryger Meir H, Roth T, Dement W (eds.). Principles and practice of sleep medicine. Cuarta edición. New York: Elselvier Saunders; 2005; p. 702-713. [ Links ]
7. Edinger J, Bootzin R, Buysse D, Espie C et al. Insomnia. In the International Classification of Sleep Disorders. Diagnostic and Coding Manual. Segunda edición. Westchester, Illinois: 2005; p. 1-31. [ Links ]
8. Skaer T, Robinson L, Sclar D, Galin R. Psychiatric comorbidity and pharmacological treatment patterns among patients presenting with insomnia. Clinical Drug Investigation 1999;18:161-167. [ Links ]
9. Henry D, McClellen D, Rosenthal LD, Dedrick D et al. Is sleep really for sissies? Understanding the role of work in insomnia in the US. Soc Sci Med 2008;66:715-726. [ Links ]
10. Dolan DC, Taylor DJ, Bramoweth AD, Rosenthal LD. Cognitive-behavioral therapy of insomnia: a clinical case series study of patients with comorbid disorders and using hypnotic medications. Behav Res Therapy 2010;48:321-327. [ Links ]
11. Millan MJ. The neurobiology and control of anxious states. Prog Neurobiol 2003;70:83-244. [ Links ]
12. Basta M, Chrousos GP, Vela-Bueno A, Vgontzas AN. Chronic insomnia and stress system. Sleep Med Clin 2007;2:279-291. [ Links ]
13. Kales A, Caldwell AB, Preston TA, Healey S et al. Personality patterns in insomnia. Theoretical implications. Arch Gen Psychiatry 1976;33:1128-1124. [ Links ]
14. De Saint Hilaire Z, Straub J, Pelissolo A. Temperament and character in primary insomnia. Eur Psychiatry 2005;20:188-92. [ Links ]
15. Teicher MH. Scars that won't heal: the neurobiology of child abuse. Sci Am 2002;286:68-75. [ Links ]
16. Feder A, Nestler EJ, Charney DS. Psychobiology and molecular genetics of resilience. Nat Rev Neurosci 2009;10:446-457. [ Links ]
17. Liu D, Diorio J, Day JC, Francis DD et al. Maternal care, hippocampal synaptogenesis and cognitive development in rats. Nat Neurosci 2000;3:799-806. [ Links ]
18. Weaver IC, Cervoni N, Champagne FA, D'Alessio AC et al. Epigenetic programming by maternal behavior. Nat Neurosci 2004;7(8):847-54. [ Links ]
19. Yamadera H, Suzuki H, Kudo Y, Asayama K et al. The study of poly-somnography and sleepiness the morning after administration of triazolam and brotizolam. Psychiatry Clin Neurosci 2002;56:297-298. [ Links ]
20. Prospéro García O, Méndez Díaz M, Martínez M, Navarro L. Los endocanabinoides y el sueño. Vigila-Sueño 2001;13:177-186. [ Links ]
21. Devane WA, Hanus L, Breuer A, Pertwee RG et al. Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science 1992;54:161-202. [ Links ]
22. Cravatt DF, Prospéro-García O, Siuzdak G, Gilula NB et al. Chemical characterization of a family of brain lipids that induce sleep. Science 1995;268:1506-1509. [ Links ]
23. Mendelson WB, Basile AS. The hypnotic actions of oleamida are blocked by a cannabinoid receptor antagonist. Neuroreport 1999;10:3237-3239. [ Links ]
24. Prospéro-García O, Cravatt BE, Siuzdak G, Boger DL et al. cis-9, 10 Octadecenoamide: a novel natural lipid isolated from cat CSF with potential sleep-modulating properties. Sleep Res 1995;24:50. [ Links ]
25. Prospéro-García O, Herrera-Solís A, Prospéro-García A, Di Marzo V. Function of endocannabinoids and related compounds in sleep. En: Sleep disorders: Diagnosis and therapeutics. Pandi-Perumal SR, Verster JC, Monti JM, Lader M, Langer SZ (eds.). United Kingdom: Informa; 2008; pp. 259-267. [ Links ]
26. Murillo-Rodríguez M, Cabeza R, Méndez-Díaz M, Navarro L et al. Anandamide-induced sleep is blocked by SR141716A, a CB1 receptor antagonist and by U73122, a phospholipase C inhibitor. NeuroReport 2001;12:2131-2136. [ Links ]
27. Navarro L, Martínez-Vargas M, Murillo-Rodríguez E, Landa A et al. Potential role of endocannabinoids in REM sleep rebound. Neuroscience 2003;120:855-859. [ Links ]
28. Murillo-Rodríguez M, Désarnaud F, Prospéro García O. Diurnal variation of arachidonoylethanolamine, palmitoyethanolamine and oleoyle-thanolamine in the brain of the rat. Lif Sci 2006;79:30-37. [ Links ]
29. Herkenham M, Lynn AB, Johnson MR, Melvin LS et al. Characterization and localization of cannabinoid receptors in rat brain: a quantitative in vitro autoradographic study. J Neurosci 1991;11:563-583. [ Links ]
30. Martínez-Vargas M, Murillo-Rodríguez E, González-Rivera R, Landa A et al. Sleep modulates cannabinoid receptor 1 expression in the pons of rats. Neuroscience 2001;117:197-201. [ Links ]
31. Wotjak CT. Role of endogenous Cannabinoids in Cognition and Emotionally. Mini-Reviews Medicinal Chemistry 2005;5:659-670. [ Links ]
32. Di S, Malcher-Lopes R, Marcheselli VL, Bazan NG et al. Rapid glucocor-ticoid-mediated endocannabinoid release and opposing regulation of glutamate and gamma-aminobutyric acid inputs to hypothalamic magnocellular neurons. Endocrinology 2005;146:4292-301. [ Links ]
33. Viveros MP, Marco EM, File SE. Endocannabinoid system and stress and anxiety responses. Pharmacol Biochem Behav 2005;81(2):331-42. [ Links ]














