El jitomate (Solanum lycopersicum) es una de las hortalizas de mayor producción mundial, México ocupa el décimo lugar en su producción. A nivel nacional, los principales estados productores son: Sinaloa, San Luis Potosí y Michoacán. La superficie para el cultivo durante el 2018, fue de 49,415 ha, de las cuales 7,737 ha fueron bajo el sistema de agricultura protegida, destinados principalmente en la modalidad de malla sombra. En el estado de Guerrero se destinaron durante el mismo año 119.8 ha bajo estas condiciones (SIAP, 2018). No obstante, a pesar de tener el cultivo bajo condiciones protegidas es afectado por enfermedades causadas por Phytophthora infestans, Oidiopsis taurica, Rhizoctonia spp., Fusarium oxysporum, Oidium neolycopersici y Pseudomonas syringae pv. tomato, entre otros (Rodríguez-Alvarado et al., 2011).
El hongo Fusarium es conocido por su capacidad fitopatógena y habitualmente se asocia con marchitamiento vascular (Forero-Reyes et al., 2018). Una de las tácticas para minimizar las afectaciones por este hongo, ha sido el uso de genotipos resistentes o tolerantes al patógeno, ya que la presencia de este en adición a las condiciones climáticas favorables demerita el rendimiento (Sánchez-Aspeytia et al., 2015). Por ello que, de acuerdo a las necesidades del productor, se llegan a utilizar diferentes genotipos de acuerdo a sus necesidades como el incremento en la producción, tolerancia a condiciones ambientales (temperaturas altas), plagas y enfermedades (hongos, virus, nematodos) (Rodríguez et al., 2004). Por consiguiente, el objetivo del presente trabajo fue identificar el microorganismo asociado a la marchitez y evaluar la incidencia en nueve genotipos de jitomate comerciales ante el inoculo natural del microorganismo en cuatro sistemas de producción bajo malla sombra.
El trabajo se realizó en Tepecoacuilco, Guerrero, México en el vivero “Valerio Trujano” que pertenece al Centro de Estudios Profesionales (CEP) del Colegio Superior Agropecuario del estado de Guerrero (CSAEGRO) (18° 17’ 54.5” N, 99° 27’ 38.6” W). Se seleccionaron nueve genotipos comerciales de jitomate tipo saladette de las empresas Harris Moran (ocho genotipos) y Nunhems (un genotipo) para establecerse bajo las condiciones que predominan en la zona (temperatura: 20-30 ºC y cálido húmedo con lluvias en verano): seis de crecimiento indeterminado (Cid, Sun 7705, Moctezuma, Cuauhtémoc, Ramsés y Aníbal) y tres genotipos de crecimiento determinado (Palomo, Pony express y Toro) con fertirriego y bajo casa sombra en una superficie de 1000 m2. Todos los genotipos se establecieron en cuatro sistemas de producción. Las bolsas se llenaron con sustrato tezontle rojo de reúso cuyo cultivo anterior fue el chile (serrano y jalapeño) y en donde se detectó a Fusarium asociado a la marchitez. Las macetas se colocaron sobre plástico negro para evitar el contacto directo del suelo e impedir el crecimiento de malezas entre las macetas. En el caso del sistema de producción en suelo, se utilizó acolchado plástico color gris-negro. Antes del trasplante se aplicó cuaternario de amonio para desinfestar el suelo y sustrato tezontle, a una dosis de 5 mL L-1 de agua hasta capacidad de campo.
Las semillas de los genotipos se sembraron en sustrato (tierra lama: peatmoss: naturabono) previamente esterilizado. La nutrición en esta etapa se basó en aplicaciones de Rootex (3 g L-1 de agua), Gro-Green (2 g L-1) y Ultrasol inicial (15-30-15). El experimento inició con el trasplante de las plántulas, el cual se realizó a los 30 días después de la siembra. Durante la etapa vegetativa y de producción del cultivo se realizaron aplicaciones de productos químicos y biológicos para el manejo de plagas y enfermedades. En cuanto a la nutrición del cultivo se hicieron aplicaciones de acuerdo a sus etapas fenológicas y se complementó con aplicaciones foliares de micronutrientes (Bayfolan Forte, Aminofit, Poliquel multi, Gro-Green, Biozime, entre otros). Además, los riegos se realizaron de forma automatizada, iniciando con la adición de 0.5 L de agua por planta (etapa vegetativa) hasta 3.0 L de agua (fructificación) al día.
En todos los sistemas de producción se realizaron prácticas culturales que consistieron en el tutorado, control de malezas (manual), podas de brotes y sanidad. Por otro lado, en los genotipos de crecimiento indeterminado se eliminaron las yemas laterales para dejar el tallo principal y, en los genotipos determinados esta práctica se omitió. Se implementó un diseño de bloques incompletos al azar con arreglo de parcelas divididas, en la parcela grande se ubicaron los sistemas de producción: 1) suelo con acolchado, 2) bolsas de polietileno blanco-negro de 37x37 cm, 3) bolsas de 40x40 cm y 4) bolsas de 40x45 cm. En tanto, en la parcela chica consistió en el establecimiento de los nueve genotipos con tres repeticiones por sistema de producción. Cada repetición del genotipo (32 plantas) se distribuyó aleatoriamente en cada sistema de producción (parcela grande). Cada sistema estuvo constituido por un total de 864 plantas con 96 plantas por genotipo, generando un total de 3,456 plantas conformado por los cuatro sistemas. Cada unidad experimental estuvo constituida por dos surcos de doble hilera, una longitud de 4 m y una distancia entre surcos de 1.2 m y una distancia de 0.5 m entre plantas. Para la evaluación del rendimiento, se realizó la cosecha de cada unidad experimental, tomando 12 plantas de un total de 32 plantas por repetición. Los frutos se pesaron para obtener el rendimiento por genotipo y por sistema de producción. Los datos de incidencia y rendimiento se sometieron a un análisis estadístico con el software Statistical Analysis System (SAS) donde se les realizó análisis de varianza y prueba de Tukey.
La incidencia de la marchitez se realizó en todas las plantas de cada sistema de producción. Así mismo, en cada sistema se seleccionaron plantas que mostraron síntomas de marchitez para realizar la identificación del microorganismo asociado. Las plantas se lavaron con agua potable, se realizaron cortes transversales de tallo y raíces de 1 cm aproximadamente donde se seleccionaron de la zona de avance de la enfermedad, y se enjuagaron en agua destilada estéril; se sumergieron en hipoclorito de sodio al 2% durante 60 s y nuevamente se enjuagaron con agua destilada estéril (triple lavado). Los cortes vegetales se sembraron en cajas Petri con medio PDA (Papa Dextrosa Agar). También, se realizaron cámaras húmedas en cajas Petri y se incubaron bajo condiciones ambientales. Finalmente, al observar la presencia de micelio se realizó la transferencia de puntas de hifa para su purificación e identificación morfológica (Leslie y Summerell, 2006).
Los síntomas iniciales observados, consistieron de un amarillamento en el follaje, con pérdida de turgencia en la parte apical y de un marchitamiento general; posterior, las plantas presentaron un amarillamiento acompañado de necrosis en hojas medias y basales (Figura 1A y B). Finalmente, las plantas se tornaron con una tonalidad café con los frutos adheridos. A la altura del cuello del tallo hubo presencia de una lesión de color café oscuro (Figura 1C), que conforme transcurrieron los días ésta se expandió hacia la parte superior del tallo y, al realizar un corte transversal se observó en el xilema una pigmentación café claro (Fernández-Herrera et al., 2013). Cabe mencionar que los síntomas se observaron en la etapa de producción del cultivo. Tanto en las muestras sembradas en medio PDA como en cámaras húmedas (20 plantas) se aisló consistentemente al género Fusarium, el cual produjo micelio algodonoso de color rojizo, con formación de macroconidios ligeramente curvo de dos-tres septos y abundantes microconidios (Figura 1D). Por otra parte, también se aisló a Rhizoctonia solani pero de forma esporádica (dos muestras) y mezclado con Fusarium. Se tiene reportes de la presencia de Fusarium en genotipos de jitomate bajo invernadero en el estado de Michoacán, por lo que se infiere su presencia en estos sistemas de producción (Rodríguez-Alvarado et al., 2011).

Figura 1. Síntomas y microorganismo asociado a marchitez en plantas de jitomate bajo malla sombra en Tepecoacuilco, Gro. A) Amarillamiento y marchitez general bajo el sistema de suelo con acolchado; B) Bolsas de polietileno blanco-negro con tezontle; C) lesión de color café oscuro en la base del tallo y D) conidios de Fusarium sp.
La evaluación de la incidencia se realizó a los 114 días después del trasplante. Los genotipos de crecimiento indeterminado que mostraron menor incidencia a la marchitez fueron Cuauhtémoc (11.7%) y Ramsés (12.7%) y, los de mayor incidencia fueron Cid, Moctezuma y Sun 7705 con 20, 22.4 y 29.7% en los cuatro sistemas evaluados (Figura 2). Para el caso de los genotipos de crecimiento determinado (Palomo, Pony express y Toro) mostraron una baja incidencia, del 0.3 y 1.8% respectivamente (Figura 2). En el caso del genotipo Toro presenta resistencia a F. oxysporum (Rodríguez-Alvarado et al., 2011), información que coincide con estos resultados que muestran no solo al genotipo Toro con menor incidencia, sino al resto de los genotipos de hábito de crecimiento determinado. Si bien en la presente investigación no se identificó a nivel especie, se puede relacionar algún grado de tolerancia de los genotipos a este microorganismo.
Es importante mencionar que, aunque las empresas de semillas (Harris Moran y Nunhems) reportan tolerancia a este hongo, no implica que no estén exentos al ataque de este patógeno, ya que se ha reportado infección y susceptibilidad de F. oxysporum raza 3 en los genotipos Cid, Anibal y Sun 7705 en San Luis Potosí (Hernández-Martínez et al., 2014). También cabe enfatizar que la selección de genotipos a la tolerancia de F. oxysporum no es el único parámetro a considerar al seleccionar un genotipo para su siembra, sino también se debe contemplar otros parámetros como rendimiento, tolerancia a otras enfermedades o plagas, condiciones climáticas donde se establece el cultivo (Monge-Pérez, 2014); así como la variabilidad genética que pudiera presentar el patógeno en el suelo, ya que se ha reportado variabilidad de F. oxysporum f. sp. lycopersici en zonas de alta producción de esta hortaliza (Ascencio-Álvarez et al., 2008).
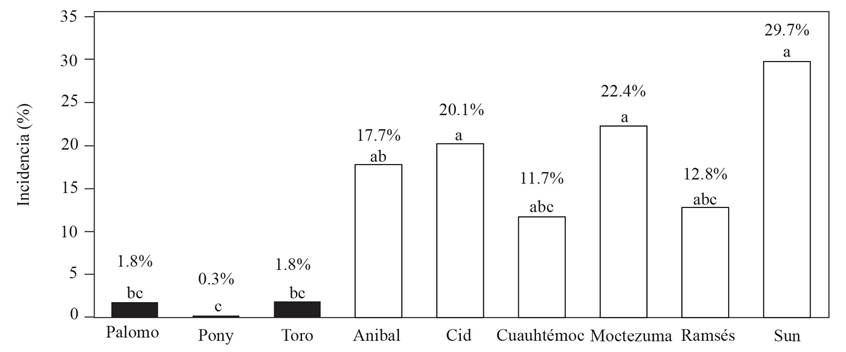
Figura 2. Incidencia de marchitez (Fusarium sp.) en genotipos de jitomate de hábito de crecimiento determinado e indeterminado establecido en cuatro sistemas de producción bajo malla sombra en Tepecoacuilco, Gro. Ciclo: Invierno-Primavera 2017-2018. Letras iguales indican que no hay diferencias significativas de acuerdo con Tukey (P<0.5).
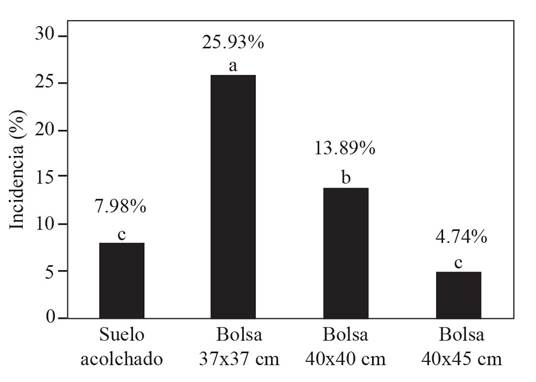
En sistema con mayor incidencia de marchitez fue donde se utilizó bolsas de polietileno de tamaño de 37x37 cm (26%) con 224 plantas marchitas. En este sistema los genotipos Aníbal, Sun 7705, Cid y Moctezuma tuvieron mayor porcentaje de plantas marchitas que oscilaron entre 39.5 a 49% de incidencia (Cuadro 1). Una explicación que se da a la alta incidencia es al hecho de que el sustrato que se utilizó era de reúso, donde previamente se estableció otro cultivo de la misma familia botánica (chile serrano y chile jalapeño) y mismo donde se detectó el microorganismo y se observaron síntomas de marchitez. La incidencia de marchitez en bolsas de tamaño de 40x45 cm fue de 4.7% (40 plantas marchitas) (Figura 3). Una respuesta a estos resultados, puede ser el hecho de tener mayor desarrollo de las raíces, al tener contenedores de mayor volumen de sustrato, por ende mayor capacidad de las plantas de tolerar el ataque del patógeno versus en bolsas de menor tamaño (37x37 cm). Al respecto, Arizaleta y Pire (2008) señalan que el tamaño de contenedores influye no solo en el desarrollo y crecimiento de la raíz, sino en el desarrollo aéreo de las plantas, en el caso de cafeto. Por otra parte, Oagile et al. (2016) también concluyen que el tamaño de grandes contenedores en el desarrollo de plántulas de jitomate influye en la altura de la planta, número de hojas, peso fresco y seco de la planta. Estos datos sustentan los resultados obtenidos en la presente investigación ya que se observó que los genotipos que se sembraron en bolsas de mayor tamaño (40x45 cm) también presentaron mayor altura de la planta, peso fresco y seco de la raíz (datos no publicados), presentando menor incidencia de marchitez. Además, en este sistema (40x45 cm) también se observó el mayor número de plantas con marchitez del genotipo Sun 7705.
Cuadro 1 Número de plantas con marchitez y rendimiento en cuatro sistemas de producción, bajo malla sombra del cultivo de jitomate establecido en el vivero “Valerio Trujano” en Tepecoacuilco, Gro. Ciclo: Invierno-Primavera 2017-2018.
| Genotipo | Plantas con marchitez/ Número de plantas totales | |||||||
|---|---|---|---|---|---|---|---|---|
| Rendimiento (t ha-1) / Sistema de producción | ||||||||
| Suelo | t ha-1 | 37x37 | t ha-1 | 40x40 | t ha-1 | 40x45 | t ha-1 | |
| Palomo | 0/96 | 53.3 bz | 5/96 | 88.6 a | 1/96 | 90.8 a | 1/96 | 77.2 a |
| Pony express | 0/96 | 56.7 b | 0/96 | 91.4 a | 0/96 | 84.1 a | 1/96 | 84.9 a |
| Toro | 0/96 | 50.4 b | 2/96 | 86.3 a | 2/96 | 85.2 a | 3/96 | 80.2 a |
| Aníbal | 6/96 | 81.7 a | 47/96 | 71.1 b | 12/96 | 67.9 b | 3/96 | 68.8 b |
| Cid | 9/96 | 80.4 a | 39/96 | 69.1 b | 23/96 | 78.3 b | 5/96 | 70.3 b |
| Cuauhtémoc | 3/96 | 84.5 a | 24/96 | 69.6 b | 14/96 | 61.9 b | 4/96 | 68.0 b |
| Moctezuma | 16/96 | 85.3 a | 38/96 | 65.7 b | 27/96 | 79.5 b | 5/96 | 78.8 b |
| Ramsés | 8/96 | 82.2 a | 27/96 | 67.0 b | 12/96 | 86.8 b | 2/96 | 63.0 b |
| Sun 7705 | 28/96 | 70.6 a | 42/96 | 60.0 b | 29/96 | 64.2 b | 16/96 | 59.7 b |
z Letras iguales en columnas indican que no existe diferencias estadísticamente significativas de acuerdo con Tukey (P<0.5).
Si bien, en el sistema de producción de tamaño de bolsa de 37x37 cm ocurrió la mayor incidencia de marchitez, se obtuvo un rendimiento potencial estimado de 74.3 t ha-1, y en el caso del sistema de producción de tamaño de bolsa de 40x45 cm (menor incidencia de marchitez) presentó un rendimiento potencial estimado de 72.3 t ha-1 (Cuadro 1). Estos resultados muestran que a pesar de la incidencia de la marchitez, los genotipos mostraron buenos rendimientos bajo las condiciones presentes en la zona. Además, la marchitez se presentó en la etapa fenológica de producción del cultivo, por lo que no afectó de manera significativa el rendimiento.
Los síntomas de marchitez en el cultivo de jitomate se asociaron al género Fusarium. Los genotipos de crecimiento indeterminado Cuauhtémoc y Ramsés mostraron baja incidencia de marchitez causada por el microorganismo en todos los sistemas de producción, y en el caso de los genotipos de crecimiento determinado, todos mostraron baja incidencia (0.2 a 1.8%). El genotipo Sun 7705 presentó la mayor incidencia de marchitez y menor rendimiento con un rango de 59.7 - 70.6 t ha-1. Finalmente, en los sistemas de producción evaluados se observó efecto en el rendimiento en los genotipos, así como en la incidencia de la marchitez, observándose menor número de plantas marchitas en los contenedores de tamaño de 40x45 cm. En este estudio se observó la infección natural de Fusarium en genotipos de jitomate; sin embargo, es importante realizar estudios adicionales para identificar el microorganismo con técnicas moleculares y evaluar la patogenicidad en todos los genotipos para determinar su tolerancia.











 text in
text in