México es el segundo productor y exportador a nivel mundial de limón. En el 2017, las exportaciones de limón generaron divisas por 500 millones de dólares (SIAP, 2018). A pesar de lo anterior, las enfermedades debidas a fitopatógenos asociados a los cítricos afectan el rendimiento del cultivo y; por lo tanto, el valor de la producción. El Huanglongbing (HLB), asociada a la α-Proteobacteria Candidatus Liberibacter spp., es una enfermedad devastadora de los cítricos y desde su introducción en América ha representado un reto para su control (Wang y Trivedi, 2013). En México, Robles-González et al. (2013) reportaron pérdidas en el rendimiento de frutos (kg árbol-1) de hasta el 40% en árboles de limón mexicano que presentaban síntomas de la enfermedad en más del 75% de su copa con respecto a árboles asintomáticos. El manejo tradicional para el control del HLB consiste en el control químico o biológico del insecto vector, la eliminación de árboles enfermos para reducir el inóculo y la producción de patrones e injertos libres de HLB, sin embargo, estas medidas no han sido completamente efectivas (Hall y Gottwald, 2011). Por otra parte, se han desarrollado estrategias alternativas para retrasar el progreso de la enfermedad y mantener el rendimiento de los cítricos, estas estrategias consisten en programas de nutrición mejorada (Gottwald et al., 2012), la aplicación de antibióticos (Zhang et al., 2011) e inductores de resistencia (Hu et al., 2018). La inducción de resistencia sistémica adquirida (SAR) o inducida (ISR) confieren protección o disminución de la severidad de la enfermedad contra un amplio espectro de fitopatógenos (Walters et al., 2013). El uso de inductores químicos en evaluaciones de campo se ha reportado para el manejo del HLB con efectos significativos en la reducción de la concentración de ʻCandidatus Liberibacter asiaticusʼ (CLas) y del progreso de la enfermedad tanto en aspersión foliar (Li et al., 2016) como en inyección directa al tronco (Hu et al., 2018). Hu et al. (2018) demostraron en pruebas de campo que la inyección directa al tronco de árboles de naranja dulce ʻHamlinʼ (Citrus sinensis) con ácido salicílico (0.8 g/árbol) disminuyó significativamente la concentración de CLas en un 65.8% con respecto al control inyectado con agua. El quitosano es bien conocido como un elicitor de la respuesta de los mecanismos de defensa en plantas, tales como, cambios en la acumulación de proteínas PR, enzimas y metabolitos secundarios relacionados con la defensa (Xing et al., 2015). Algam et al. (2010) demostraron que el pretratamiento de semillas de tomate cv. Hezou con quitosano (10 mg mL-1), dos semanas antes de la inoculación de Ralstonia solanacearum Rs-f.91, redujo significativamente un 31% la incidencia de la marchitez con respecto al control, además del aumento en la actividad de proteínas PR como quitinasa y β-1,3-glucanasa. Por otra parte, el uso de bacterias promotoras de crecimiento de plantas (BPCP) como inductores de resistencia sistémica para el control del HLB ha sido reportado. Tang et al. (2018) demostraron que la tasa de árboles enfermos de CLas disminuyó el 50% cuando se irrigaron las raíces de árboles de C. sinensis con Bacillus amyloliquefaciens GJ1 en condiciones de invernadero. El uso de ácido salicílico, quitosano y de BPCP puede ser una alternativa práctica para la inducción de resistencia en árboles de limón mexicano para el control del HLB. Por lo anterior, el objetivo de este estudio fue evaluar el efecto de inductores de resistencia sistémica sobre la concentración de ʻCandidatus Liberibacter asiaticusʼ en árboles de limón mexicano en condiciones de invernadero.
Se utilizaron árboles de limón mexicano (Citrus aurantifolia) injertados sobre el portainjerto de limón volkameriano (Citrus volkameriana) de nueve meses de edad. Los árboles fueron colocados en macetas de 40 L de capacidad con 25 L de una mezcla de sustrato de turba de esfagno-tierra de río-perlita (3:3:4/v:v). Los árboles permanecieron en condiciones de invernadero con luz natural entre 23-28 °C y 31-45% de HR. Los árboles de limón fueron fertilizados cada 20 días aplicando 3 L de una solución nutritiva que contenía 0.25 g L-1 de sulfato de magnesio, nitrato de calcio y nitrato de potasio, 0.15 mL L-1 de ácido fosfórico y 0.1 g L-1 de micronutrientes (Microfol® Combi P.S.); además cada seis meses se aplicó 40 g de fosfato monoamónico por planta. El control de plagas fue de manera química (AK-20® 2 mL L-1, Muralla Max® 0.5 mL L-1, Oberon® 2 mL L-1 y Talstar® 2 mL L-1) y orgánica previo al experimento (GreenCorp: eBioluzion® PlusvO 5 mL L-1, Akabrown® 5 mL L-1 y Specktron Plus 5 mL L-1) para insectos como araña roja, minador y pulgón cuando fue necesario. Los árboles de limón mexicano fueron inoculados por medio de injertos de yema de 2 a 3 cm de largo (Figuras 1A y 1B) obtenidas de varetas de árboles PCR positivos a CLas con síntomas característicos del HLB (Bové, 2006), considerado como un método eficiente de transmisión del patógeno (Coletta-Filho et al., 2010). La fuente de inóculo se recolectó en febrero de 2013 en una huerta de limón mexicano en Tecomán, Colima.
Previo al establecimiento del experimento, a los árboles de limón mexicano infectados a través de la inoculación con injertos de yema, cuatro meses después se les determinó la concentración de CLas por medio de la reacción en cadena de la polimerasa cuantitativa (qPCR) del ADN en tiempo real con la finalidad de iniciar el experimento con árboles que presentaran una concentración similar y así homogenizar esta variable entre los diferentes tratamientos. De cada árbol se recolectó la quinta hoja madura descendente del ápice de siete varetas. Las hojas fueron congeladas con nitrógeno líquido, liofilizadas durante 72 h y pulverizadas en un molino TissueLyser II (QIAGEN, Hilden, Germany) durante 1 min a 30 Hz. 20 mg del tejido liofilizado y molido fueron utilizados para la extracción de ADN genómico por el método de CTAB previamente descrito por Zhang et al. (1998) con ligeras modificaciones (Arratia-Castro et al., 2014). La concentración y pureza del ADN fue evaluado con un espectrofotómetro NanoDrop ND-2000 UV-Vis Spectrophotometer (NanoDrop Technologies, Wilmington, DE, USA). Las muestras de ADN fueron ajustadas a 20 ng µL-1 y almacenadas a -20 °C hasta su posterior uso. Para la cuantificación de CLas, todos los ensayos de qPCR fueron realizados mediante la combinación de PCR anidado y PCR TaqMan® en un solo tubo (Lin et al., 2010). Todos los ensayos de qPCR fueron realizados en un termociclador 7500 Fast Real-Time PCR System (Applied Biosystems, Foster City, CA). Dos repeticiones técnicas de cuatro repeticiones biológicas fueron utilizadas para los ensayos de qPCR. Cada reacción de qPCR fue realizada en un volumen de 25 µL que consistió en 12.5 µL de TaqMan® master mixture (ABI, Foster City, CA), 0.5 µL de iniciadores externos Las O-F y Las O-R (0.5 pmol), 0.2 µL de iniciadores internos Las I-F y Las I-R (20 pmol), 0.5 µL de la sonda Las-P TaqMan® (10 pmol), 5 µL de ADN (100 ng) y 5.6 µL de agua ultra pura. Las condiciones de la PCR anidada fueron: 50 °C durante 2 min y 95 °C durante 2 min, seguido de 20 ciclos de 95 °C durante 30 s, 67 °C durante 45 s y 72 °C durante 45 s, posteriormente 35 ciclos de 95 °C durante 30 s, 57 °C durante 45 s y 72 °C durante 45 s. La señal de fluorescencia se registró al final de cada paso de 57 °C durante la segunda ronda de PCR (Lin et al., 2010). Los valores de Ct fueron convertidos en concentración de células de CLas utilizando una curva estándar descrita previamente por Lin et al. (2010) mediante el Software 7500 System SDS versión 2.0.5. Después de determinar la concentración inicial de CLas por árbol, se seleccionaron árboles con concentraciones de entre 610 a 1700 células bacterianas/100 ng de ADN y se distribuyeron aleatoriamente entre los diferentes tratamientos (cuatro árboles por tratamiento). En la Figura 1C, se muestra el experimento en invernadero que se realizó de junio de 2013 a febrero de 2014.
Los inductores de resistencia probados en condiciones de invernadero fueron quitosano (0.01%), ácido salicílico (5 mM) y Azospirillum brasilense Cd (2×107 ufc g-1 de sustrato). El quitosano (quitosano≥75% desacetilación, Sigma-Aldrich®) fue preparado como stock al 1%: 5 g de quitosano fueron disueltos en 100 mL de ácido acético al 1% y después el volumen fue ajustado a 500 mL con ácido acético al 1%. La solución stock de quitosano fue ajustada a un pH de 5.75 (NaOH 1M) y esterilizada a 121 °C durante 20 min. El ácido salicílico fue preparado como solución stock a 75 mM. El quitosano y ácido salicílico fueron aplicados de manera foliar con un aspersor manual (Swissmex®) de 5.5 L de capacidad de manera individual de entre 15 a 20 mL por planta (Figura 1D). Azospirillum brasilense Cd fue crecida en caldo NFb (nitrogen free broth) (Döbereiner et al., 1976) durante 16 h a 30 °C a 200 rpm. La solución con la rizobacteria fue ajustada a una concentración 2×107 ufc g-1 de sustrato y se aplicó de manera directa al sustrato en la rizosfera de las plantas. Los inductores fueron aplicados cada 20 días durante ocho meses. Se utilizó un diseño completamente al azar con cuatro repeticiones por tratamiento. Los tratamientos fueron los siguientes: T1 ácido salicílico; T2 Azospirillum brasilense Cd; T3 quitosano y T4 sin inductor. El efecto de los inductores de resistencia en la disminución del patógeno fue evaluado mediante la determinación de la concentración de CLas por qPCR como se describió anteriormente a los 1, 2, 5 y 8 meses postratamiento. La variable concentración de CLas fue analizada mediante un análisis de varianza (ANOVA) y una comparación de medias con la prueba de diferencia mínima significativa (LSD) utilizando el paquete estadístico StatGraphics Centurion XV (StatPoint Inc., 2005).

Figura 1 Inoculación de la bacteria ʻCandidatus Liberibacter asiaticusʼ (CLas) en plantas de limón mexicano (Citrus au rantifolia) por injerto de yema (A y B). Experimento de inductores de resistencia en la concentración de CLas en condiciones de invernadero (C) y forma en que se ve la aplicación foliar de las soluciones de inductores (D).
Para evaluar el efecto en la disminución de la concentración de CLas en los árboles de limón mexicano, dos inductores fueron aplicados de manera foliar (ácido salicílico y quitosano) y A. brasilense Cd al suelo cada 20 días durante 8 meses en condiciones de invernadero. Previo al inicio del experimento, no se encontraron diferencias estadísticas significativas en la concentración de CLas (datos no mostrados), por lo que, todos los tratamientos iniciaron con concentraciones similares, sin embargo, al concluir el primer mes postratamiento se empezaron a observar diferencias entre los tratamientos en la velocidad de incremento en la concentración de CLas (Figura 2). A los 2 meses postratamiento, el T3 quitosano presentó la menor concentración de CLas (643 células bacterianas/100 ng de ADN) con respecto al T4 sin inductor. A los 5 meses postratamiento, los tres inductores de resistencia aplicados mostraron una reducción significativa (LSD, p≤0.05) en la concentración de CLas de poco más de dos veces con respecto al T4 sin inductor (Figura 2). Finalmente, a los 8 meses postratamiento el T3 Azospirillum brasilense Cd mostró un efecto significativo en la reducción del incremento de la concentración de CLas de casi tres veces menos que el T4 sin inductor (Figura 2). El T3 quitosano presentó un efecto de reducción en la concentración de CLas a los 2 y 5 meses postratamiento, sin embargo, a los 8 meses postratamiento la concentración de CLas en este tratamiento fue estadísticamente similar al T4 sin inductor. Con respecto al tratamiento sin aplicación de inductor (T4), el progreso de la concentración de CLas fue incrementado a través del tiempo sin manifestarse alguna reducción. Al final del experimento, el valor promedio para la concentración de CLas fue de 6499 células bacterianas/100 ng de ADN para el T4 sin inductor, mientras que para los tres tratamientos con inductores fue de entre 2253 a 6463 células bacterianas/100 ng de ADN (Figura 2). Se conoce que la aplicación de inductores químicos o biológicos proveen de un impulso a la resistencia sistémica o local cuando la planta es confrontada contra algún fitopatógeno, disminuyendo la severidad de la enfermedad (Walters et al., 2013). En condiciones de campo, Hu et al. (2018) demostraron que la aplicación de ácido salicílico (0.8 g/árbol) vía inyección al tronco en árboles de naranja dulce (C. sinensis) disminuyó significativamente la concentración de CLas con respecto al tratamiento control (inyección con agua). En este estudio, la aplicación foliar de ácido salicílico redujo la concentración de CLas a los 5 meses postratamiento, sin embargo, a los 8 meses postratamiento, aunque el efecto de reducción de la concentración continuó, este tratamiento no superó al tratamiento con Azospirillum en la rizosfera de limón, donde se encontraron diferencias estadísticas significativas con respecto al control sin inductor (T4). Al respecto, Li et al. (2017) demostraron que en CLas, el gen sahA codifica la síntesis de la enzima salicilato hidroxilasa capaz de degradar el ácido salicílico y sus análogos (Li et al., 2017). Además, Li et al. (2017) demostraron que la aplicación foliar de ácido salicílico (1 mM) en árboles de naranja dulce, sanos e infectados con CLas, incrementó la expresión de genes PR y la acumulación de ácido salicílico. Sin embargo, la expresión de los genes PR y la acumulación de ácido salicílico fue significativamente menor en los árboles infectados con CLas, mientras que la aplicación foliar de ácido 2,6-dicloro-isonicotínico y benzotiadiazol (inductores de SAR) mostró un patrón de expresión de los genes PR similar entre los árboles sanos e infectados con CLas, estas moléculas no son degradadas por la enzima salicilato hidroxilasa (Li et al., 2017). A diferencia de lo reportado por Hu et al. (2018), la inyección directa al tronco del ácido salicílico puede superar la degradación por la enzima salicilato hidroxilasa, esto fue demostrado con el incremento en la expresión de los genes PR-1 y PR-2 en árboles de naranja tratados con ácido salicílico con respecto al control inyectado con agua. Al respecto Hu et al. (2018) menciona que la aplicación foliar de ácido salicílico presenta algunas desventajas como la degradación y la baja absorción del mismo ácido, por parte de la planta, lo que podría estar ocurriendo en los resultados de este trabajo.
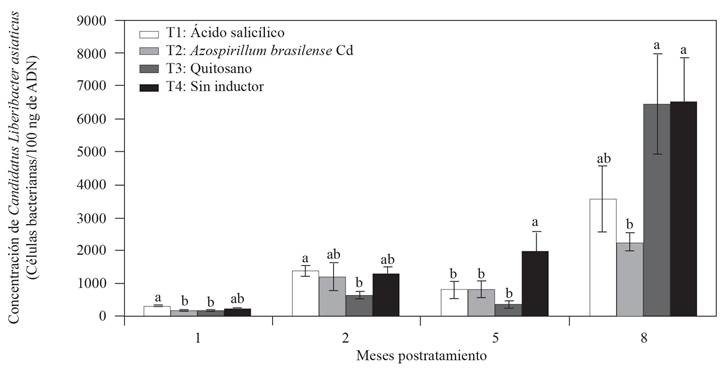
Figura 2 Efecto de inductores de resistencia y Azospirillum brasilense en la concentración de ʻCandidatus Liberibacter asiaticusʼ en arboles de limón mexicano en condiciones de invernadero. Las barras en cada rectángulo indican el error estándar (n=4 repeticiones); valores con la misma letra en cada rectángulo por mes son estadísticamente iguales (LSD, p≤0.05).
Por otra parte, se ha demostrado que el quitosano tiene la capacidad de inducir los mecanismos de defensa vegetal; sin embargo, su mecanismo de acción en la inducción de resistencia no ha sido completamente elucidado, además de que puede variar la respuesta dependiendo del patosistema, así como de otros factores (Orzali et al., 2017) como el tipo de quitosano y la forma de preparación o almacenamiento de la solución. En este estudio, la aplicación de A. brasilense Cd mostró una reducción en la concentración de CLas. La resistencia sistémica inducida (ISR) por bacterias promotoras de crecimiento de plantas (BPCP) podría proveer una alternativa para el control del HLB. Tang et al. (2018) aislaron, a partir de hojas sanas de naranja navel (C. sinensis) cv. ʻNewhallʼ, un potencial agente de control biológico para el HLB identificado como B. amyloliquefaciens GJ1. En pruebas en invernadero, plantas de naranja navel enfermas de HLB fueron irrigadas con 1.5 L de la solución de B. amyloliquefaciens GJ1 (OD600 ≈1) cada semana, después de siete irrigaciones, B. amyloliquefaciens GJ1 redujo el 50% de plantas con presencia del patógeno (Tang et al., 2018). Se ha demostrado que la capacidad para inducir resistencia o tolerancia en las plantas depende de la BPCP (Jain et al., 2014). Al respecto, Riera et al. (2018) probaron la efectividad de siete aislamientos bacterianos inoculados a las raíces de árboles ʻDuncanʼ grapefruit en el control del cancro de los cítricos, encontrando que los aislados Burkholderia territorri A63, B. metallica A53 y Pseudomonas geniculata 95 redujeron significativamente la severidad de la enfermedad con respecto a las plantas control. Por otro lado, Zhang et al. (2017) encontraron que, al inocular árboles de naranjo dulce cv. Valencia con las bacterias B. metallica A53 y B. territori A63 se incrementó la expresión relativa de genes PR1, PR2 y SAM, dependiendo de la bacteria y el tiempo después de la inoculación. Bajo este contexto, para la continuación de este estudio sería importante evaluar si la disminución de la concentración de CLas en los árboles de limón mexicano por efecto de A. brasilense Cd, está relacionada con la expresión de genes relacionados con los mecanismos de defensa vegetal. En nuestro experimento, algunos productos utilizados para el control de plagas aplicados a todos los árboles de limón durante los primeros cuatro meses cuando fue necesario, previo al inicio del experimento, podrían haber contribuido a la inducción de resistencia. Estudios previos han demostrado que algunos componentes de estos productos son capaces de inducir resistencia como el imidacloprid (Francis et al., 2009), algunos aceites esenciales (Banani et al., 2018) y extractos vegetales (Fought y Kuć, 1996; Khoa et al., 2017). A pesar de lo anterior, en nuestro experimento el tratamiento sin inductor (T4) no mostró un efecto significativo en la disminución de CLas después de 8 meses de no haberse aplicado estos productos.
En conclusión, el ácido salicílico y el quitosano evaluados como inductores de resistencia, aplicados de manera foliar, presentaron menor efectividad en disminuir la velocidad de incremento de la concentración de ʻCandidatus Liberibacter asiaticusʼ en limón mexicano. La inoculación de A. brasilense Cd en la rizosfera de limón mexicano mostró un efecto significativo en la reducción de la concentración de CLas en condiciones de invernadero. La inducción de resistencia sistémica a través de BPCP como A. brasilense en cítricos podría ser una alternativa para mitigar los efectos del HLB manteniendo la productividad del árbol por más tiempo al reducir el progreso de la enfermedad. Se sugiere la inoculación de A. brasilense Cd en cítricos, en condiciones de campo, para evaluar la inducción de resistencia a través de la expresión de genes implicados en la defensa vegetal en árboles enfermos y mostrar la disminución de la concentración de CLas.











 texto em
texto em 


