El género Capsicum, que incluye a los chiles dulces y picantes, son verduras y especias cultivadas y consumidas en todo el mundo (Carrizo et al., 2016). De acuerdo a USDA-ARS (2011), el género Capsicum cuenta con 38 especies, de las cuales Capsicum annuum, Capsicum frutescens, Capsicum chinense, Capsicum pubescens y Capsicum baccatum son cultivadas. De las cinco especies C. annuum y C. frutescens fueron domesticados en Mesoamérica y C. chinense, C. baccatum y C. pubescens en América del Sur (Pickersgill, 2007). El chile en México, por su tradición e historia es un cultivo importante, en 2016 alcanzó 2.3 mill/t, con un valor que rebasa los 22 mil 500 millones de pesos (SAGARPA, 2017). En la diversidad de chiles que se cultivan en el territorio nacional, el chile manzano (C. pubescens) ha cobrado mayor importancia en la última década y de acuerdo con SAGARPA (2018), 4,221.83 t están destinadas solo para exportación a los Estados Unidos, de las cuales el 86.3 % es producido en el sur del Estado de México. En esta región el cultivo de chile manzano es intensivo. Sin embargo, tiene limitaciones agronómicas en la producción, como la susceptibilidad a la “marchitez”, enfermedad que daña a la raíz y causa la muerte de la planta. Esta enfermedad considerada como una de las más destructivas en todo el mundo (Zhang et al., 2013), fue reportada por primera vez en C. annuum por Leonian (1922), quien identificó a Phytophthora capsici como su agente causal. Los organismos asociados pueden afectar al cultivo en cualquier etapa de desarrollo, causan la pérdida de turgencia en la planta y su muerte posterior (Kousik et al., 2012). Para C. annuum en México, se han reportado como agentes causales de la marchitez, además de P. capsici, a Rhizoctonia solani y Fusarium oxysporum (Uc-Arguelles et al., 2017).
De acuerdo con González-Pérez et al. (2014), C. pubescens cuenta con una baja diversidad génica como consecuencia de un efecto fundador durante su domesticación que lo hace una especie menos polimórfica. Aun así, en la zona sur del Estado de México, con un variado número de nichos ecológicos, se cultivan diferentes genotipos de C. pubecens, que representan considerable variación dentro de la especie y por lo tanto, un valioso reservorio de germoplasma que pudiera ser de utilidad en el mejoramiento de esta especie (Arias et al., 2017), no solo para aspectos morfológicos sino también en la resistencia a enfermedades. Con la presencia de variación natural, algunos individuos de la población pueden expresar ciertas características con mayor o menor grado que otros, las cuales pueden dar al individuo ciertas ventajas ligadas a su ciclo de vida. Estos individuos pueden variar en la producción de frutos, tanto en número como en tamaño, color, textura, sabor, maduración, apariencia y la calidad, así como la arquitectura de la planta y su capacidad de resistir estrés abiótico o biótico (Schubert et al., 2009). Debido a estos factores, la variación en la reproducción de genotipos de C. pubescens, en la que algunos pudieran tener mayor cantidad de descendientes que otros, implicaría un incremento en la frecuencia de su material genético con respecto a los demás (Nora et al., 2011).
La diversidad genética dentro de las especies es la razón principal por la que una determinada especie tenga la oportunidad de evolucionar bajo condiciones cambiantes del ambiente y presiones de selección. Asimismo, el conocimiento de la diversidad genética es indispensable para diversificar las fuentes de germoplasma, tratar de minimizar los riesgos de vulnerabilidad genética e incrementar las probabilidades de detectar alelos favorables (Ruíz et al., 2016). El Centro Universitario UAEM Tenancingo cuenta con 16 genotipos colectados en el sur del Estado de México, de los cuales, 15 presentan variabilidad morfológica y caracteres únicos de interés genético y comercial (Martínez, 2016). Con la finalidad de aprovechar los genotipos de C. pubescens que forman parte de la colección de germoplasma del CU Tenancingo, el objetivo del presente trabajo fue evaluar la respuesta de 16 genotipos de chile manzano al complejo fúngico de microorganismos asociados de la marchitez del chile en el Estado de México.
Materiales y métodos
La investigación se llevó a cabo en las instalaciones del Centro Universitario UAEM Tenancingo, ubicado a 18° 58’ 05.53’’ N y 99° 36’ 50.51’’ O, a una altitud de 2068 msnm. En 2016, en el sur del Estado de México se colectaron plantas de chile manzano con síntomas de marchitez en las localidades siguientes: 5 en Ahuacatitlán, Ixtapan de la Sal; 5 en El Zarco, Tenancingo; 3 en Santa Ana, Tenancingo; 4 en Tepoxtepec, Tenancingo; 3 en Matlazinca, Villa Guerrero; 4 en San Miguel, Ixtapan de la Sal; 5 en El Potrero, Coatepec Harinas; 5 en Ixtlahuaca, Coatepec Harinas; 3 en San Nicolás, Tenancingo; y, 4 en Las Cabañas, Tenancingo. Los sitios de colecta se clasificaron con base en la Intensidad de Cultivo (IC) definida por la superficie cultivada en: Baja, hasta 3 ha; media, de 3.1 a 8.0 ha; y alta, más de 8.1 ha. Las muestras envueltas en papel de estraza húmedo se guardaron en bolsas de plástico transparente y fueron transportadas en hielera al laboratorio, donde se mantuvieron en refrigeración a 4 ºC para su utilización al siguiente día.
Aislamiento de los organismos asociados. De 41 plantas colectadas en los 10 sitios muestreados, de cada una se obtuvieron ocho segmentos de raíz y ocho de tallo, que en total sumaron 656 muestras. Las muestras se desinfestaron y para hongos se sembraron de acuerdo a López (1984) en cajas de Petri con medio de cultivo Papa-Dextrosa-Agar (PDA); para oomicetos se sembraron en 20 g de harina de maíz, 18 g de agar-agar, 0.8 mL de pimaricina, 0.02 g de rifamicina y 0.25 g L-1 de ampicilina en agua destilada, de acuerdo a López et al., (2009), modificado de Kannwischer and Mitchell (1978). Los cultivos se incubaron a una temperatura de 24 oC bajo oscuridad. Las siembras se revisaron cada 24 h para observar el crecimiento y desarrollo del hongo. Una vez crecidos los hongos y el oomiceto, se hicieron transferencias sucesivas hasta la obtención de cultivos puros, de los que se hicieron cultivos monospóricos y de punta de hifa. Las colonias se preservaron en tubos con PDA cubierto con aceite mineral estéril.
Identificación morfológica de los organismos asociados. Los organismos asociados se identificaron por claves taxonómicas para hongos y oomicetos. Para hongos, se utilizaron las claves de Booth (1971) y Leslie y Summerell (2006), para caracterizar el tamaño y la forma de micro y macroconidios, así como descripción de clamidosporas, estructuras importantes para la identificación; y las claves de Singlenton et al. (1992) y Watanabe (2002), para la caracterización de esclerocios, ángulos de ramificación, así como micelio. Para oomicetos, se usaron las claves de Erwin y Ribeiro (1996) y Gallegly y Hong (2008), en la identificación de crecimiento de la colonia, tipo de micelio, forma de esporangios y clamidosporas.
Identificación molecular de organismos asociados. La extracción del ADN se hizo por el método (CTAB) y acetato de sodio. Se realizaron reacciones de PCR universal para hongos y oomicetos con los iniciadores ITS-1 5’-tccgtaggtgaacctgcgg-3’ y ITS-4 5’-tcctccgcttattgatatgc-3’ (White et al., 1990); los cuales amplifican fragmentos de entre 500 y 900 pares de bases (pb). La mezcla de reacción en un volumen final de 25 μL fue de 10 µL de agua ultrapura, 12 µL de MyTaq Mix® (Bioline), 1 µL de Primer F, 1 µL de Primer R y 1 µL de ADN. El programa térmico fue de 94 °C durante 2 min, seguido de 35 ciclos a 94-55-72 °C durante 30-30-60 s, respectivamente y una extensión final a 72 °C por 5 min para oomicetos. Para hongos fue de 94 °C durante 2 min, seguido de 35 ciclos a 94-60-72 °C durante 30-30-60 s, respectivamente y una extensión final a 72 °C por 5 min. Los productos de las reacciones de PCR fueron separados por electroforesis en TBE con geles de agarosa al 1.2 %.
Secuenciación. Productos de PCR se purificaron con el Kit EZ-10 Spin Column Handbook (Bio Basic Canada Inc.) y se secuenciaron en el Laboratorio de Biología Molecular de la FES- Iztacala de la Universidad Nacional Autónoma de México (UNAM). Las secuencias en formato FASTA (Chromas versión 2.6.5) se alinearon para consenso e identidad con la base de datos del banco de genes del Centro Nacional para la Información Biotecnológica de los Estados Unidos (NCBI) - BLAST (Basic Local Alignment Search Tool) (disponible en https://www.yeastgenome.org/blast-fungal).
Patogenicidad in vitro. La patogenicidad se evaluó en el genotipo M3 de C. pubescens, material más cultivado en la región. Las semillas se desinfestaron e inocularon de acuerdo a Apodaca-Sánchez et al. (2001) y después se sembraron en cajas de Petri con medio de cultivo agar-agua. Cada cepa obtenida de cultivo monospórico y de punta de hifa, fue considerada un tratamiento, con 5 repeticiones de 10 semillas cada una. El testigo fue semilla desinfestada y sumergida en agua destilada estéril. Se evaluó la patogenicidad mediante la incidencia y la severidad medidas a los 10 días de acuerdo a Herrera y Laurentin (2012), y se registraron los síntomas de radícula e hipocótilo. La incidencia se determinó por el porcentaje de plántulas con manifestación de la enfermedad. La severidad se midió por la longitud de la lesión a lo largo de la plántula expresada en porcentaje. Los valores obtenidos se promediaron dentro de cada unidad experimental. La relación entre incidencia y severidad se calculó por proporción mediante el cociente severidad/ incidencia (Segura et al., 2009; Fernández et al., 2010).
Interacción en infecciones múltiples. Semillas desinfestadas del genotipo M3, se sembraron en un tubo de ensayo con agar-agua, se mantuvieron en oscuridad a 25 °C y al germinar se establecieron a 12 h de luz y 12 de oscuridad a 25 °C. A los siete días de germinadas las semillas se inocularon de acuerdo a Herrera y Laurentin (2012). Se aplicaron 100 µL de una suspensión de esporas 1 x 106 y 100 µL de cultivo monospórico y de punta de hifa de los organismos asociados en forma individual y sus combinaciones en siete tratamientos con 10 repeticiones cada uno: P. capsici (P); P. capsici más R. solani (P+R); F. oxysporum más P. capsici (F+P); F. oxysporum más P. capsici más R. solani (F+P+R); F. oxysporum (F); y R. solani (R). Se incubaron a 12 horas de luz y 12 de oscuridad a 25 °C y se observaron cada 24 h para evaluar la severidad determinada por (longitud de la lesión/longitud de la plántula) x 100.
Interacción patógenos-genotipo. Se emplearon los genotipos de C. pubescens M1 a M16, materiales morfológicamente contrastantes a diferentes caracteres como flor y fruto, colectados en diferentes localidades de la región sur del Estado de México (Martínez, 2016). Plántulas con cuatro hojas verdaderas se inocularon con los patógenos identificados solos y combinados de acuerdo a los siguientes tratamientos (T): F. oxysporum (T1); P. capsici (T2); R. solani (T3); F. oxysporum + P. capsici (T4) y F. oxysporum + P. capsici + R. solani (T5). El método de inoculación utilizado fue el descrito por Martínez et al. (1996). Las plantas inoculadas fueron trasplantadas en vasos de poliestireno de un litro, con sustrato de una mezcla desinfestada de turba y agrolita en proporción de 2:1 respectivamente, y con cinco repeticiones por tratamiento. La severidad de la enfermedad se midió por el porcentaje de daño en hipocótilo y raíz de la plántula según la escala 1-9, desarrollada en el CIAT (Abawi y Pastor-Corrales, 1990). Los datos se transformaron logarítmicamente para obtener el modelo lineal general utilizando el paquete estadístico InfoStat (Di Rienzo et al., 2016).
Análisis estadístico. Los datos obtenidos se sometieron a análisis de varianza, los tratamientos se compararon mediante la prueba de Duncan (p=0.05), con el empleo de InfoStat.
Resultados y discusión
Organismos asociados aislados. De las localidades muestreadas se aisló a Fusarium oxysporum, Phytophthora capsici y Rhizoctonia solani (Cuadro 1). Fusarium oxysporum fue constante casi en todas las localidades (9/10), mientras que la presencia de P. capsici se limitó a las localidades con intensidad de cultivo media y alta (Cuadro 1). La presencia de R. solani en solo un sitio de muestreo sugiere limitada participación en el daño por marchitez. Solo en una localidad se aislaron los tres organismos asociados, lo que denota la participación individual o colectiva en el ataque al huésped. Los resultados coinciden con lo reportado por Anaya-López et al. (2011), quienes mencionaron a F. oxysporum como el más común y en segundo turno a R. solani en cultivo de C. annuum. De acuerdo a Nelson et al. (1983), la variación en las frecuencias de estos organismos asociados como responsables de la marchitez se ve afectada por diversos factores, donde las condiciones climáticas son determinantes. El Potrero, comunidad en la que se encontraron los tres organismos asociados, a diferencia de las otras comunidades presenta un clima más cálido y lluvioso lo que favorece el desarrollo de los organismos asociados. Por otra parte, los sistemas de producción, la utilización de fungicidas y el genotipo mismo del cultivo son determinantes para la presencia y sobrevivencia de los organismos asociados al complejo fúngico (Guigón-López et al., 2001; Lozano et al., 2015). Es posible que la etapa fenológica del cultivo al momento de la colecta influya en la presencia del complejo fúngico, como se ha marcado para la etapa de plántula en C. annuum (Vásquez et al., 2009).
Cuadro 1 Organismos aislados en cultivo de C. pubescens en localidades de tres muni cipios del sur del Estado de México.
| Localidad | Microorganismo fitopatógeno | Muestras procesadasy | |||
|---|---|---|---|---|---|
| Zona | ICz | F.oxysporum | P. capsici | R. solani | |
| Ahuacatitlan | Baja | X | 75 | ||
| El Zarco | Media | X | X | 75 | |
| Santa Ana | Baja | X | 45 | ||
| Tepoxtepec | Baja | X | 60 | ||
| Matlazinca | Media | X | X | 45 | |
| San Miguel | Media | X | X | 60 | |
| El Potrero | Alta | X | X | X | 75 |
| Ixtlahuaca | Alta | X | X | 75 | |
| San Nicolás | Baja | X | 45 | ||
| Las Cabañas | Media | X | 60 | ||
| Total | 656 | ||||
z Intensidad de cultivo; ysegmentos de tallo y raíz / z Cropping intensity; ystem and root segments.
Descripción morfológica de microorganismos asociados identificados. Fusarium oxysporum presentó micelio aéreo y abundante con un hábito de crecimiento radial y pigmentación naranja. Micelio hialino y septado, microconidios de forma ovalada, de tamaño promedio 8.6 x 4.3 µm con 0 ó 1 septo, abundantes en falsas cabezas y en monofialides; macroconidios en menor cantidad, con la célula apical atenuada y la célula basal en forma de pie de tres a cuatro septos, de tamaño promedio 23.8 x 4.2 µm. También se observaron clamidosporas abundantes, terminales o intercalares en la hifa (Figura 1).
Rhizoctonia solani presentó micelio con coloración blanca los primeros cuatro días, a partir del quinto día el micelio se tornó café y mostró la presencia de esclerocios. Microscópicamente se logró observar ramificación próxima al septo distal en células vegetativas jóvenes, ángulo de 90°, estrechamiento de hifa y formación de septos en una distancia corta del punto de origen a la ramificación hifal, hifas de 5-8 μm de ancho y esclerocios de 1-3 mm de diámetro (Figura 1).
Phytophthora capsici presentó micelio color blanco, crecimiento arrocetado en medio de cultivo PDA, micelio cenocítico, hialino y toruloso; esporangios ovoides de forma alimonada y poco papilados de 11 a 54 µm de largo y 9 a 36 µm de ancho, clamidosporas intercalares de 9.5 µm de diámetro (Figura 1).
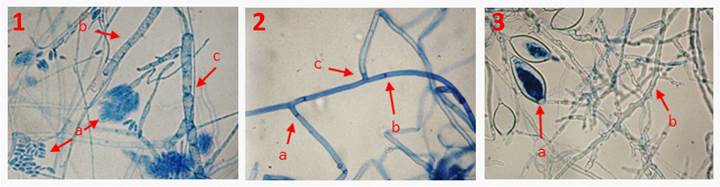
Figura 1 Organismos asociados causales de la marchitez de C. pubescens. 1. F. oxysporum a) Microconidios, b) Micelio hia lino, c) Micelio septado. 2. R. solani a) Septo cercano al punto de origen a la ramificación hifal, b) Micelio grueso y septado, c) Angulo de 90°. 3. P. capsici a) Esporangios, b) Micelio hialino y toruloso.
Dichos organismos asociados han sido reportados en C. annum como responsables de la marchitez por diferentes autores (Lozano et al., 2015). Éstos se han encontrado en el Norte y Centro de México (Anaya-López, 2011). Sin embargo para el caso de C. pubescens, aun cuando se encuentran los tres organismos asociados, la presencia de P. capsici se ve relacionada a la media y alta intensidad del cultivo en la zona productora del Estado de México (Cuadro 1).
Identificación molecular de los organismos asociados. La amplificación por PCR de los fragmentos de ADN de los tres organismos asociados confirmó la identidad, previamente establecida morfológicamente. El fragmento amplificado de F. oxysporum mostró peso molecular de 900 pares de bases (pb), mientras que P. capsici y R. solani mostraron un peso aproximado de 650 pb (Figura 2).
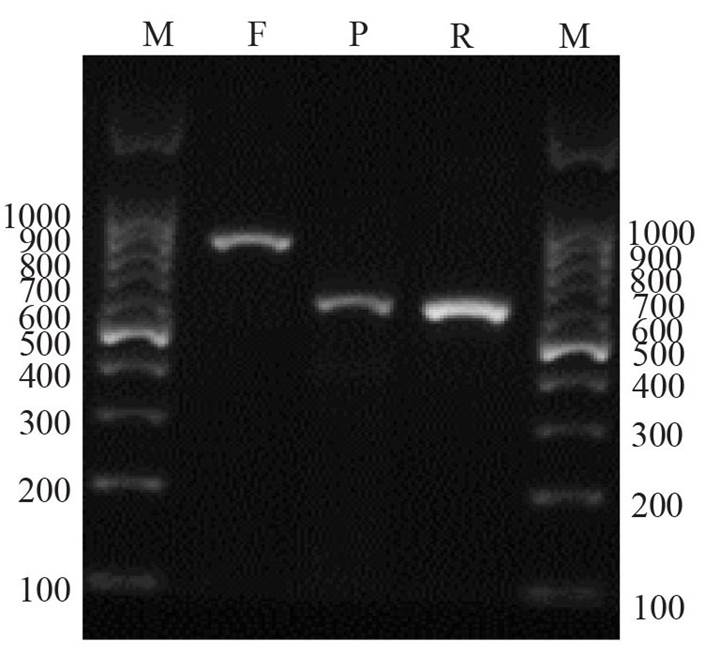
Figura 2 Electroforesis en gel de 1.2 % de agarosa en TBE para fragmentos amplificados de ADN ITS de F. oxysporum (F), P. capsici (P) y R. solani (R); ca rriles M corresponden al marcador molecular de 100 pb.
Los fragmentos secuenciados de la cepa de F. oxysporum se alinearon con la secuencia de F. oxysporum f.sp. lycopersici accesión CM000593.1, y en el consenso tuvo un 88 % de identidad en fragmentos de la región 248 a 270. Los fragmentos secuenciados de la cepa de P. capsici se alinearon con la secuencia de P. capsici_ LT1534, versión 11, accesión PcapLT1534_SC064, con un 83 % de identidad en conceso con fragmentos de la región 146 - 259. Similarmente los fragmentos secuenciado de ADN de la cepa de R. solani se alinearon con secuencias del banco de genes NCBI y su mayor identidad (90 %) se consensó con R. solani accesión número JATN01000256.1 (Versión JATN01000256.1 GI: 576995022), con fragmentos de la región 144 - 292.
Patogenicidad in vitro. Los síntomas observados fueron necrosis en ápice de raíz, hipocótilo y/o cotiledones. Los aislamientos de F. oxysporum, P. capsici y R. solani resultaron patogénicos en las plántulas de chile manzano con variación temporal en la manifestación de los síntomas. La expresión de los síntomas con inóculo de F. oxysporum varió de 8 a 12 días después de la siembra de acuerdo a la cepa. En el caso de las plántulas inoculadas con P. capsici y R. solani los síntomas se presentaron a los 10 días después de la inoculación.
En incidencia y severidad se observaron diferencias estadísticas entre colonias de F. oxysporum (P≤ 0.01; con valores respectivos máximo y mínimo entre tratamientos de 34.4 y 92.8 % en incidencia y de 48.8 y 81.6 % en severidad) y entre colonias de P. capsici (P≤ 0.05; con valores respectivos máximo y mínimo entre tratamientos de 49.2 y 63.6 % en incidencia y de 69.3 y 90.9 % en severidad) asociadas al lugar de colecta, lo que posiblemente indique heterogeneidad intraespecífica, asociada entre otros factores a la dispersión natural de los patógenos, como la reportada para cenicilla (Leveillula taurica) en el cultivo de tomate (Solanum lycopersicum) (Guzmán-Plazola et al., 2011) y desarrollo de resistencia de los patógenos por la presión de selección ejercida con fungicidas (Silva-Rojas et al., 2009). La incidencia de los patógenos fue de 65 % en F. oxysporum, 56. 4 % en P. capsici y del 76 % para R. solani. Por otra parte, los valores de severidad fueron de 81.4 % para P. capsici, 64.6 % F. oxyspoum y 65. 5 % para R. solani lo que denota un efecto más devastador del oomiceto, el cual procede de una zona altamente productora de chile manzano, donde el control de enfermedades es por medio de productos químicos, lo cual de acuerdo a Silva-Rojas et al. (2009), trae como consecuencia la resistencia de P. capsici.
Los valores mayores a uno del cociente severidad/ incidencia (Figura 3), indican mayor patogenicidad, ya que aun cuando los patógenos mostraron incidencia relativamente similar, el proceso infeccioso en términos de superficie del tejido (severidad) fue más acelerado. En F. oxysporum El cociente severidad/ incidencia fue menor a 1.0 en cinco de nueve localidades donde se presentó (Figura 3), lo que representó mayores valores de incidencia que de severidad; sin embargo, el valor promedio del cociente de las nueve colonias de este patógeno fue muy cercano a uno, lo que sugiere una relación proporcional entre la incidencia y la severidad para este patógeno. Por el contrario, el cociente severidad/ incidencia de P. capsici muestra valores mayores a 1.0 en todas las colonias evaluadas (Figura 3), indicativo de que el grado de daño es más acelerado aun con menores valores de incidencia. En el caso de R. solani el valor del cociente fue similar al descrito para F. oxysporum.
Figura 3 Cociente de severidad/incidencia de F. oxysporum, P. capsici y R. solani en plántulas de chile manzano en 10 loca lidades productoras del sur del Estado de México.
Interacción en infecciones múltiples. El proceso infeccioso después de la inoculación se aceleró tanto en infecciones simples como combinadas, al manifestarse los síntomas tres días después de la inoculación (ddi) (Figura 4). Cinco ddi todas las plantas infectadas con P. capsici murieron (Figura 5). Resultados similares en Capsicum spp., ubican al patógeno como el más catastrófico a nivel mundial (Lamour et al., 2012). Adicionalmente, información de Sanzón et al. (2012), describe necrosis de raíz a 24 h de la inoculación y muerte posterior a los cinco días, con evidencias de invasión de micelio y esporangios en la planta. Sin embargo, una vez que P. capsici se combina con otro u otros patógenos, aun sin diferencia significativa en algunos tratamientos (Figura 5), el daño disminuye, lo cual puede deberse a la competencia por nutrimentos por parte de los patógenos (Abdullah et al., 2017). Los valores de severidad promedio de tres días de medición (Figura 5), denotaron variación significativa (p≤0.05) en la aceleración del proceso infeccioso entre tratamientos, marcando también al inóculo individual de P. capsici como el más severo al acumular más rápido el daño.
En el caso de F. oxysporum, cinco ddi el hipocótilo de las plántulas mostraron manchas color marrón, las cuales de acuerdo a Sanzón et al. (2012), se deben a la mayor acumulación de polifenoles en tejido del tallo, que ocasionan que las células en contacto mueran. La degradación de las paredes celulares posiblemente se debe a la actividad de enzimas líticas producidas por los patógenos (Feng et al., 2010).

Figura 4 Daños ocasionados en C. pubescens cinco ddi por: A) F. oxysporum, B) P. capsici, C) R. solani, D) P. capsici + R. solani, E) F. oxysporum + R. solani, F) P. capsici + F. oxysporum y G) F. oxysporum + P. capsici + R. solani.
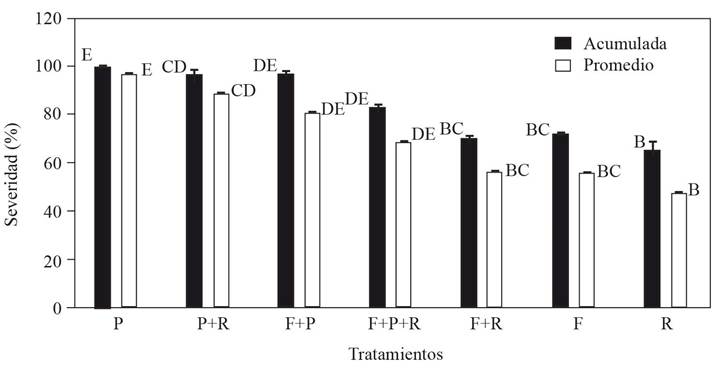
Figura 5 Severidad acumulada y promedio de organismos asociados con acción individual o combinada en plantas de C. pubescens 5 días después de la inoculación. P= P. capsici, P+R= P. capsici + R. solani, F+P= F. oxysporum + P. cap sici, F+P+R= F. oxysporum + P. capsici + R. solani, F= F. oxysporum y R= R. solani. Barras de error corresponden al error estándar. Columnas con la misma letra no difieren estadísticamente (p≤0.05).
En la combinación F. oxysporum + P. capsici + R. solani se observó una interacción de coinfección, donde la patogenicidad se redujo con respecto a P. capsici individual (Figura 5). En este complejo de interacción la respuesta provocada por un patógeno modificó la presencia del otro. Esta interacción compleja, tiende a alterar el curso de la enfermedad, ya que los patógenos coexistentes entran en competencia por crecimiento y por los nutrimentos en el mismo huésped, y la nutrición subóptima conduce a la competencia por la cual algunas especies pueden dominar (Abdullah et al., 2017). No obstante, la gravedad y el tipo de competencia se determinan por el consumo de nutrimentos a lo largo del tiempo (Chesson, 2000).
En la interacción F. oxyporum + R. solani, la patogenicidad fue similar a la correspondiente del inóculo individual F. oxysporum y ligeramente mayor a la de R. solani (Figura 5), lo que sugiere que entre estos dos patógenos la presencia de uno en términos generales no altera la presencia del otro. A este respecto Alizon et al. (2013), señalan que existen una amplia variedad de respuestas en las combinaciones de patógenos en un huésped determinado, las cuales tiene que ver con aspectos evolutivos y ecológicos entre ambas partes.
Interacción patógenos-genotipo. Los síntomas en las plantas inoculadas con patógenos individuales y combinados se observaron 15 ddi. Plantas con daños de P. capsici mostraron flacidez en la parte aérea y lesiones necróticas en la parte interna y externa de la corona del tallo, así como radícula necrótica. Plántulas con daño por R. solani presentaron clorosis en la parte aérea y necrosis en raíz; en daño más avanzado la radícula presentó estrangulamiento, González (2008), menciona una pudrición no compacta con desprendimiento de epidermis. Las plántulas inoculadas con F. oxysporum presentaron clorosis y en ocasiones rizados en el follaje y necrosis de la radícula. Las plántulas inocualadas con F. oxysporum + P.capsici mostraron clorosis foliar y marchitez, así como necrosis en corona del tallo y radícula.
En plántulas inoculadas con F. oxysporum + P.capsici + R. solani se observó clorosis en hojas, corona del tallo y radícula necróticas. De acuerdo a Velásquez-Valle et al. (2001) el síntoma inicial más evidente es una ligera flacidez foliar, que es más notable al avanzar el día, así como un ligero amarillamiento del follaje. Estos síntomas se asociaron con la podredumbre de la raíz y ablandamiento de las puntas de las raíces, lesiones de la raíz que varían en tamaño y color, de rojizo a marrón y negro, recorte de la raíz y pudrición (Hamon et al., 2011).
En daño por F. oxysporum se observaron diferencias altamente significativas (P≤ 0.01) entre genotipos, con variación del 0 a 70 % entre el menor y el mayor valor respectivamente, donde el genotipo M8 mostró resistencia y el genotipo M9 tolerancia a dicho patógeno (Cuadro 2). En plántulas inoculadas con R. solani se observaron diferencias altamente significativas (P≤0.01), con valores mínimo de 0 % en M8 y máximo de 76 % en M15. En inoculación con P. capsici hubo diferencias significativas (P≤0.05), con variación en la susceptibilidad del 81 al 95 % entre M8 y M7 respectivamente. En las combinaciones de patógenos, los intervalos entre valores máximo y mínimo disminuyeron. En la combinación F. oxysporum + P.capsici con diferencias significativas (P≤0.05), los valores máximo y mínimo fueron de 67 % en M8 y 93 % en M2; y en la combinación F. oxysporum + P.capsici + R. solani, con diferencias altamente significativas (P≤ 0.01), los valores mínimo y máximo fueron de 41 % en M8 y 95 % en nueve genotipos (Cuadro 2). El genotipo M8 que fue el que mostró menor susceptibilidad al daño por marchitez, también muestra otras diferencias fenotípicas distintivas de los demás genotipos analizados (datos no reportados), como ramificación densa y frutos pequeños, característicos de materiales rústicos.
Cuadro 2 Susceptibilidad de 16 genotipos de chile manzano a daño por marchitez.
| Genotipos | Susceptibilidadx | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| F | P | R | F*P | F*P*R | ||||||
| M8 | 0 | a | 81 | a | 0 | a | 67 | a | 41 | a |
| M9 | 29 | b | 91 | b | 38 | b | 90 | b | 81 | bc |
| M16 | 48 | c | 95 | b | 48 | bc | 90 | b | 95 | c |
| M15 | 48 | c | 95 | b | 76 | e | 90 | b | 95 | c |
| M11 | 48 | c | 93 | b | 48 | bc | 91 | b | 95 | c |
| M12 | 48 | c | 95 | b | 67 | cde | 85 | b | 83 | bc |
| M10 | 48 | c | 95 | b | 48 | bc | 90 | b | 95 | c |
| M3 | 48 | c | 93 | b | 48 | bc | 90 | b | 95 | c |
| M4 | 48 | c | 95 | b | 48 | bc | 90 | b | 75 | b |
| M5 | 48 | c | 95 | b | 48 | bcde | 90 | b | 93 | c |
| M6 | 48 | c | 95 | b | 73 | e | 85 | b | 90 | bc |
| M7 | 48 | c | 95 | b | 52 | bcd | 90 | b | 95 | c |
| M13 | 57 | c | 95 | b | 61 | cde | 90 | b | 95 | c |
| M2 | 57 | c | 95 | b | 69 | de | 93 | b | 95 | c |
| M14 | 70 | d | 95 | b | 70 | de | 90 | b | 95 | c |
| M1 | 70 | d | 93 | b | 66 | cde | 90 | b | 95 | c |
| p-valorz | 0.0001 | 0.0329 | 0.0001 | 0.0300 | 0.001 | |||||
xF= Fusarium oxysporum; P= Phytophthora capsici; R= Rhizoctonia solani; F*P= Fusarium oxysporum+ Phytophthora capsici; F*P*R= Fusarium oxysporum+ Phytophthora capsici+ Rhizoctonia solani. Medias con letras distintas son significativamente diferentes, de acuerdo a la prueba de Duncan (P≤0.05). zProbabilidad estadística / xF= Fusarium oxysporum; P= Phytophthora capsici; R= Rhizoctonia solani; F*P= Fusarium oxysporum+ Phytophthora capsici; F*P*R= Fusarium oxysporum+ Phytophthora capsici+ Rhizoctonia solani. Medians with different letters are significantly different, according to Duncan’s test P≤0.05). zStatistical probability.
El genotipo M8 y potencialmente el M9, ambos como los menos susceptibles a los daños por marchitez representan una potencial alternativa para introducir la resistencia observada en esta investigación a genotipos comerciales como el M3, el cual es el más cultivado en la región. Además, la respuesta diferencial de algunos de los genotipos de C. pubescens analizados a F. oxysporum, P. capscici y R. solani y sus combinaciones, sugieren variación en los mecanismos de defensa (Anaya-López, 2011).
Conclusiones
Se detectaron tres organismos causales de la marchitez de chile manzano del sur de México; de ellos Fusarium oxysporum fue el más frecuente, seguido por Phytophthora capsici y Rhizoctonia solani.
La identificación molecular permitió identidad de 88 % de los fragmentos amplificados de F. oxysporum con F. oxysporum f.sp. lycopersici raza 2. P. capsici tuvo identidad de 83 % con P. capsici_ LT1534, versión 11, y R. solani alcanzó identidad de 90% con el grupo anastómico 3 (AG-3).
De los tres patógenos encontrados, Phytophthora capsici es el que causa la mayor severidad en daño por marchitez en la región sur del Estado de México, aunque Fusarium oxysporum y Rhizoctonia solani también causan daños en la planta.
El genotipo M8 fue resistente a F. oxysporum y R. solani, y el genotipo M9 podría ser tolerante a F. oxysporum. El genotipo M8 fue tolerante a P. capsici y a la inoculación individual y en mezcla de los tres patógenos, por lo que podría representar un genotipo potencial para estudios sobre fuentes de genes de tolerancia útiles en programas de mejoramiento genético.











 text in
text in 


