La jamaica (Hibiscus sabdariffa L.) es un arbusto cuyos cálices deshidratados y tallos se utilizan para elaborar productos alimenticios, farmacéuticos, cosméticos y textiles. Los principales países productores de esta planta son China, India y Sudán (Galicia-Flores et al., 2008). México ocupa el séptimo lugar, siendo el estado de Guerrero el mayor productor, con una superficie sembrada de 14 274 ha (SIAP, 2014). El principal problema fitosanitario de este cultivo en México es la "pierna negra" causada por Phytophthora parasitica y actualmente la mancha foliar y de cálices ocasionada por Corynespora cassiicola (Ortega et al., 2015). A nivel mundial existen cuatro virus afectando jamaica: Cotton leafcurl virus (CLCuV), Mesta yellow vein mosaic virus (MeYVMV), Malva vein clearing virus (MVCV) y Okra mosaic virus (OkMV) (Fauquet et al., 2005; Roy et al., 2009). Durante los últimos años en algunos municipios del estado de Guerrero se ha detectado una enfermedad en jamaica de etiología desconocida, denominada localmente como "amarillamiento". Las plantas afectadas presentan síntomas consistentes en aclaramiento de nervaduras, mosaico y amarillamiento y su incidencia había sido muy baja. No obstante, se ha venido incrementando de manera considerable y en el ciclo otoño-invierno 2014 alcanzó valores de 90 a 100 % en cinco parcelas por lo que el objetivo del presente estudio fue conocer al agente asociado a esta enfermedad. Se colectaron 10 plantas de jamaica de dos meses de edad que presentaban aclaramiento de nervaduras, mosaico y amarillamiento, así como tres plantas asintomáticas en una parcela del municipio de Tecoanapa y cuatro parcelas del municipio de Ayutla, Guerrero (Figura 1A). Se inocularon mecánicamente cinco plantas de jamaica sanas obtenidas de semilla utilizando como fuente de inóculo hojas de jamaica con síntomas colectadas en campo maceradas en solución amortiguadora de fosfatos pH 7.2 y carborundum 400 mallas (Dijkstra y de Jager, 1998). Como testigo se tuvieron tres plantas de jamaica sanas frotadas solamente con la solución amortiguadora y el carborundum. Hojas de plantas con síntomas colectadas en campo se injertaron en cinco plantas de jamaica sanas de dos meses de edad, obtenidas a partir de semilla, y se mantuvieron en invernadero para registrar la aparición de síntomas cada dos días durante un mes. Como testigo se tuvo una planta sana de jamaica obtenida a partir de semilla sin injertar. Se extrajeron ácidos nucleicos totales de hojas de las plantas de jamaica asintomáticas y con síntomas colectadas en campo y se analizaron para fitoplasmas (Teixeira et al., 2008), virus de la familia Potyviridae (Chen et al., 2001), Okra mosaic virus (OkMV) (Stephan et al., 2008) y begomovirus. En este último caso se utilizó el kit TempliPhi 100 Amplification® (Amersham Biosciences) que amplifica DNA circular por círculo rodante (ACR) siguiendo las instrucciones del fabricante. Para el DNA-A de los begomovirus se diseñaron los iniciadores Sense DNA-AC (AAAACTCGAGGATGTGAAGGCCCATG) y Antisense DNA-AC (AAAAGGGAAGACG ATGTGGGC) que amplifican un fragmento de aproximadamente 1400 pb correspondiente a los genes AV1, AC3, AC2 y AC1. Para el DNA-B se utilizaron los iniciadores propuestos por Rojas et al., (1993) que amplifican un fragmento de 500 pb. La mezcla de reacción consistió en 1 μL de DNA obtenido por ACR, buffer de reacción de PCR (1X), 0.20 mM dNTPs, 2.0 mM MgCl2, 10 μM de cada iniciador, 0.5 U de Taq polimerasa (PROMEGA®) ajustando a un volumen final de 20 μL. La PCR se realizó con las siguientes condiciones: desnaturalización inicial 94 °C por 4 min, 30 ciclos desnaturalización de 94 °C por 1 min, 55 °C por 1 min, 72 °C por 1.5 min, un ciclo de extensión final de 72 °C por 3 min. Los productos amplificados de 1400 pb fueron secuenciados y comparados con la base de datos del GenBank.

Figura 1 Plantas de jamaica mostrando A. Mosaico amarillo (planta colectada en Tecoanapa, Guerrero). B. Mosaico (planta injertada en invernadero con hojas de plantas colectadas en campo). C. Testigo: planta sana obtenida a partir de semilla sin injertar.
Después de 30 días, las plantas inoculadas mecánicamente no mostraron síntomas, lo cual pudo deberse a una baja concentración de virus así como la presencia de inhibidores, taninos por ejemplo, en el material vegetal utilizado como fuente de inóculo que afectan la proteína de la cápside provocando la precipitación de los virus (Dijkstra y de Jager, 1998), o bien, de un virus no transmisible de esta forma. De La Torre-Almaraz et al., (2004) señalan que muchos virus con genoma RNA se transmiten fácilmente de forma mecánica y que la mayoría de los virus con genoma DNA no se transmiten de esta manera o su eficiencia de transmisión es muy baja. Cuatro de las plantas injertadas mostraron clorosis de venas y mosaico en las hojas más jóvenes a los 17 días después de realizado el injerto (Figura1B). Los síntomas observados en invernadero fueron distintos de los registrados en campo debido posiblemente a las diferentes condiciones ambientales, edad en que se inocularon las plantas (se desconoce el momento de infección en campo), la forma de inoculación (no se sabe si en campo ocurre por vectores o semilla por ejemplo), la carga de inóculo o la presencia de otro(s) virus en campo. Tejido foliar de las cuatro plantas de jamaica injertadas que presentaron síntomas fue usado para hacer extracción de DNA total, amplificación por círculo rodante y PCR para begomovirus de la manera antes descrita.
No se tuvo la amplificación del producto esperado para fitoplasmas, virus de la familia Potyviridae y Okra mosaic virus (OkMV). Las diez plantas de jamaica con síntomas colectadas en campo y cuatro injertadas que mostraron síntomas en invernadero amplificaron el fragmento del componente A del genoma de begomovirus (1400 pb) (Figura 2A). Siete plantas colectadas en campo y cuatro plantas injertadas que mostraron síntomas amplificaron el fragmento del componente B del genoma de begomovirus (500 pb) (Figura 2B). Estos resultados indican que la mayoría de las plantas muestreadas en Ayutla y Tecoanapa están infectadas con begomovirus bipartitas y que hay al menos uno monopartita. De las diez plantas con síntomas colectadas en campo, ocho tuvieron un porcentaje de similitud de 95 % con Okra yellow mosaic Mexico virus (OkYMMV), una tuvo un 91 % de similitud con el Chino del tomate virus (CdTV) y la restante tuvo un 88% de similitud con el Malachra alceifolia virus (MAV). Por otro lado, una de las plantas injertadas con síntomas tuvo un 91 % de identidad con el OkYMMV y las tres restantes un 86-87 % de similaridad con el Tobacco leaf curl Cuba virus (TbLCCV). Los bajos porcentajes de similaridad obtenidos en el caso del CdTV, MAV y TbLCCV posiblemente se deban a que se trata de begomovirus no descritos hasta el momento. En México se ha reportado al Hibiscus variegado virus (HVV) en Hibiscus sabdariffa en la península de Yucatán (Hernández- Zepeda et al., 2007), mientras que en la India, Roy et al., (2009) encontraron al begomovirus Mesta yellow vein mosaic virus (MYVMV) en Hibiscus cannabinus e H. sabdariffa, causando reducción del crecimiento y pérdidas en la producción. Inicialmente el MYVMV ocasiona una clorosis en las nervaduras seguido de un amarillamiento de la lámina foliar. Estos síntomas difieren de los observados en plantas de jamaica colectadas en Guerrero, en las cuales inicialmente se observa un aclaramiento de nervaduras seguido de un mosaico que con el tiempo desaparece y la hoja se torna amarilla con algunas áreas color verde oscuro o blanco. En la península de Yucatán se ha reportado al OkYMMV ocasionando mosaico amarillo y distorsión foliar en Abutilon permolle; mosaico amarillo, distorsión y moteado foliar en Corchorus siliquosus; y mosaico amarillo y moteado en Sida acuta (Hernández-Zepeda., et al 2007). En 2009, el OkYMMV fue reportado en Texas en el cultivo de ocra (Abelmoschus esculentus) causando manchas foliares irregulares de color amarillo, amarillamiento de los bordes de las hojas y clorosis en hojas maduras (Hernández-Zepeda et al., 2010). Los resultados obtenidos en el presente estudio indican que el amarillamiento de la jamaica en Guerrero, México, está asociado con begomovirus entre los cuales se encuentra el Okra yellow mosaic Mexico virus (OkYMMV).
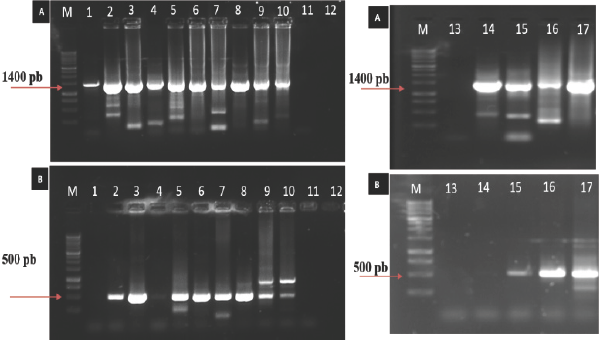
Figura 2 Productos de PCR obtenidos con A. iniciadores Sense DNA-AC/Antisense DNA-AC (1400 pb) para el segmento A y B. PBL1v2040/PCRc1 (500 pb) para el segmento B de begomovirus bipartitas, respectivamente, a partir de DNA circular amplificado por círculo rodante. Carriles 1-7, 14-16: Plantas de jamaica con síntomas colectadas en campo; Carriles 8-10 y 17. Plantas injertadas que mostraron mosaico; Carril 11: Testigo negativo (planta asintomática); Carriles 12 y 13: Testigo negativo (agua); M: Marcador de peso molecular 1Kb (Promega®).











 text in
text in 


