El Bajo Papaloapan es principal zona productora de piña (Ananas comosus (L.) Merr.) de México que incluye las regiones de Loma Bonita (Oaxaca), Linda Vista, Villa Azueta, El Zopilote, Isla, Juan Rodríguez Clara y Los Tigres (Veracruz), donde este cultivo representa una importante actividad económica. A nivel global se conoce un complejo viral relacionado con la piña (Sether et al., 2010), que consiste en Pineapple mealybug wilt associated virus-1 (PMWaV-1), Pineapple mealybug wilt associated virus-2 (PMWaV-2) y Pineapple mealybug wilt associated virus-3 (PMWaV-3) transmitido por los piojos harinosos Dysmicoccus neobrevipes y Dysmicoccus brevipes (Sether et al., 1998). El marchitamiento asociado al piojo harinoso en piña (MaPHP) es una de las enfermedades más destructivas de esta especie en muchas partes del mundo y se relaciona con la infección de PMWaV-2 en combinación con la alimentación del piojo harinoso (Sether et al., 2005). En Hawai, se encontró que sólo la alimentación del piojo harinoso o en combinación con PMWaV-1 o PMWaV-3 no causa MaPHP, y se requiere la presencia de PMWaV-2 para que se lleve a cabo (Sether y Hu, 2002). Los síntomas de la enfermedad consisten en un desecamiento severo, hojas de color rojizo y marchitamiento, que juntos causan el colapso de plantas adultas (Carter, 1945). También se ha reportado una coloración café de las plantas afectadas, flacidez, enroscado de las puntas de las hojas hacia abajo, reducción del sistema radical y frutas con pulpa fibrosa y de sabor agrio (Borroto et al., 1998). La detección de estos virus fue llevada a cabo con inmunoimpresión de tejido y con RT-PCR con indicadores específicos al gen hsp70 (Sether et al., 2001; Sether et al., 2005). En el área productora de piña de El Bajo Papaloapan, productores y técnicos han observado plantas con síntomas de flacidez, clorosis, ligero enrojecimiento o marchitamiento sin pudrición de la raíz o la necrosis de haces vasculares distribuidas al azar entre las parcelas. Debido a que no se ha observado daños del sistema radical o de los haces vasculares en las plantas afectadas, es posible que estos síntomas estén relacionados con PMWaV-1 o PMWaV-2 o PMWaV-3, agentes causales del MaPHP, una de las más importantes enfermedades de este cultivo en el mundo. Por lo tanto, el objetivo de este estudio fue determinar la presencia de estos virus en la región y conocer su relación con varios aislados del mundo.
Materiales y métodos
Reolección de muestras
En parcelas con diferentes sistemas de producción ubicadas en la región de Loma Bonita (Oaxaca), Linda Vista, Sabaneta, Ejido, Isla y Los Tigres (Veracruz), un muestreo dirigido fue llevado a cabo en Julio de 2011 para reunir tejido de hojas de plantas de piña var. Cayena o el híbrido MD2 con síntomas de flacidez, marchitamiento, coloración rojiza o café en las hojas, reducción general en el crecimiento, relacionados con el marchitamiento asociado al piojo harinoso de piña, así como plantas asintomáticas. Todas las plantas muestreadas fueron revisadas en busca de piojo harinoso, y en aquellas que presentaban marchitamiento, las raíces fueron desenterradas para observarlas y descartar que esta flacidez estuviera relacionada con la pudrición de la raíz o la necrosis de haces vasculares. El tejido vegetal fue colocado en bolsas de polietileno y etiquetadas para ser transportadas al laboratorio.
Extracción de RNA y RT-PCR
La extracción total del RNA de las hojas colectadas fue llevada a cabo con el método Trizol® (AFGC, 2002), según las instrucciones del fabricante. El RNA obtenido fue usado para generar cDNA que se usó para realizar PCR (se usaron la enzima MMLV y la Taq polimerasa de Promega®) con indicadores específicos de un segmento del gen hsp70 de PMWaV-1 (5'-ACAGGAAGGACAACACT-CAC-3'/5'-CGCACAAACTTCAAGCAATC-3'), PMWaV-2 (5'-CATACGAACTAGACTCATACG-3'/5'-TCATTCCACTCACTTATCGTTG-3') y PMWaV-3 (5'-AGTTCACTGTAGATTTCGGA-3'/5'-ATTCATGGATGTGTATCG-3 ), que amplifican 589, 609 y 495 bp, respectivamente (Sether et al., 2005; Sether et al., 2009). Se analizaron los productos PCR por electroforesis en un gel al 2 % de agarosa que contenía bromuro de etidio. Como referencia se usó un marcador de peso molecular de 100 bp, los geles fueron visualizados en un transiluminador UV Syngene© mod. Gene Snap. Luego fueron purificados usando el gel Wizard SV and PCR clean-up system© y secuenciados en el Instituto de biotecnología, UNAM.
Sequence analysis
Se usaron secuencias para obtener Contigs con el Ensamblador de Secuencias DNA Baser v2 (www.dnabaser.com). Los Contigs luego fueron analizados con el Basic Local Alignment Search Tool (BLAST) de NCBI (National Centre for Biotechnology Information, http://www.ncbi.nlm.nih.gov/BLAST).
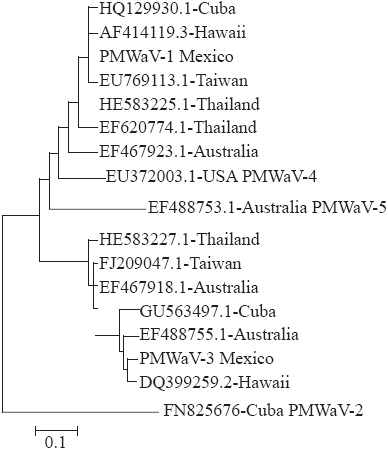
Las secuencias resultantes fueron comparadas con las 15 secuencias existentes halladas en el GenBank (NCBI), con los siguientes números de acceso de PMWaV-1: Cuba (HQ129930.1), Taiwán (EU769113.1), Tailandia (1583225.1 & EF620774.1), Hawai (AF414119.3) y Australia (EF467923.1); PMWaV-2: Cuba (FN825676); PMWaV-3: Cuba (GU563497.1), Hawai (DQ399259.2), Australia (EF488755.1 & EF467918.1), Taiwán (FJ209047.1) y Tailandia (HE583227.1); PMWaV-4: EEUU (EU372003.1); y PMWaV- 5: Australia (EF488753.1).
Para obtener una representación visual de la variabilidad de secuencia entre todos los aislados, determinamos porcentaje de identidad; se realizó un análisis de Neighbor-joining para generar árboles sin raíces de las relaciones entre las 15 secuencias. El conjunto de datos de cada uno de estos árboles fue remuestreado 1000 veces.
Resultados
Durante el muestreo no se observaron plantas con los síntomas típicos del marchitamiento asociado al piojo harinoso de la piña descritos o ilustrados en fotografías en diferentes publicaciones. Las alteraciones observadas con mayor frecuencia fueron flacidez, clorosis y una coloración rojiza en el centro de las hojas (Figura 1). No se observaron piojos harinosos en alguna de las plantas recolectadas, así como tampoco se registraron daños visibles o necrosis en las raíces en las que presentaban marchitamiento.

Figura 1 Plantas de piña cultivadas en la región de El Bajo Papaloapan con síntomas putativos de marchitamiento del piojo harinoso: A: necrosis del ápice foliar, clorosis y coloración rojiza; B: coloración rojiza en la parte central de las hojas y curvatura hacia abajo del ápice; C: planta asintomática; D: flacidez y necrosis de ápice foliar; E: flacidez, clorosis severa y enrojecimiento de la parte central de las hojas; F: manchas cloróticas amarillas, algunas con centro necrótico; G: planta asintomática; H: marchitamiento, clorosis en hojas de la parte central y enrojecimiento de hojas superiores; I: planta asintomática; J: reducción de crecimiento y manchas cloróticas irregulares; K: clorosis y enrojecimiento de hojas inferiores; L: reducción del crecimiento, clorosis de hojas superiores, enrojecimiento y flacidez de hojas inferiores. Plantas D y E fueron de MD2, el resto de Cayena.
PMWaV-1 fue hallado en una muestra (nombrada PMWaV-1Mexico) presentando reducción de crecimiento y manchas cloróticas irregulares (Figura 1J) y PMWaV-3 también estaba presente en una muestra (nombrada PMWaV-3Mexico) con clorosis y enrojecimiento de hojas inferiores (Figura 1K), ambas tomadas en Isla, Veracruz. PMWaV-2 no fue hallado en alguna de las muestras analizadas en este estudio. Ambos fragmentos genómicos de PMWaV-1Mexico (número de acceso KC800714.1) y PMWaV-3Mexico (número de acceso KC800715.1) secuenciados en este trabajo se encuentran dentro del gen hsp70, que codifica la proteína de choque térmico 70 en el ORF 3. La secuencia PMWaV-1 (589pb) correspondió con las 8.386 - 8.974 posiciones del genoma de un aislado PMWaV-1 hawaiano (número de acceso AF414119), y la secuencia PMWaV-3 (324pb) correspondió con las 7.004 - 7.327 posiciones del genoma de un aislado hawaiano PMWaV-3 (número de acceso DQ399259.2).
El aislado PMWaV-1Mexico mostró un 100 % de identidad con el aislado cubano y 98 % más alto que el resto de los aislados, excepto con el aislado australiano (88.6 % de identidad). Por otra parte, el aislado PMWaV-3Mexico mostró un 95.5 % de identidad mayor con el resto de los aislados de su grupo, excepto con el aislado de Tailandia (88.2 % de identidad). La Figura 2 muestra la semejanza de los aislados mexicanos en relación con los reportados en GenBank usados para la comparación. PMWaV-1Mexico y PMWaV-3Mexico se agruparon con los grupos 1 y 3, respectivamente y no con los grupos 2, 4 y 5.
Discusión
El marchitamiento asociado al piojo harinoso en piña (MaPHP) es una enfermedad que se caracteriza por un severo desecamiento, el enrojecimiento de las hojas, el marchitamiento y colapso de plantas maduras relacionados con los virus Pineapple mealybug wilt associated virus-1 (PMWaV-1), y Pineapple mealybug wilt associated virus-3 (PMWaV-3) (Sether y Hu, 2000). En este estudio no se observó en ninguna de las plantas los síntomas típicos de MaPHP descritos en la literatura. Se detectó a PMWaV-1 en una planta que presentaba reducción de crecimiento y manchas cloróticas irregulares en todas las hojas, especialmente en las maduras (Figura 1). Estos síntomas son diferentes a los observados por Hu et al., (1997) quienes también mencionaron que un alto porcentaje de plantas con MaPHP están infectadas con PMWaV-1 mientras otras permaneces asintomáticas. PMWaV-1 se limita al floema; no es transmitido de manera mecánica y en el campo es transmitido por los piojos harinosos Dysmicoccus brevipes y D. neobrevipes (Sether et al., 1998). En este estudio no se encontraron piojos harinosos en ninguna de las plantas muestreadas, incluyendo la que dio positivo para PMWaV-1, aunque este insecto es una plaga común en el área de estudio y esta forma de transmisión en el campo no queda descartada; es posible que su propagación también pueda ocurrir en una forma vegetativa (Sether et al., 2005), ya que este virus causa infecciones asintomáticas (Hu et al., 1997). En el área de estudio no se ha observado una reducción en el rendimiento del cultivo; sin embargo, la presencia de PMWaV-1 en la región podría, a la larga, afectar la producción si el manejo de los vectores y el suministro del agua no son adecuados, ya que se ha comprobado que la infección por este virus y un riego limitado producen un efecto negativo (6.7 y 4.2 %, respectivamente) y un efecto acumulativo (13.4 %) sobre el tamaño y peso de la fruta de la piña (Sether y Hu, 2001). El aislado de PMWaV-1 detectado en este estudio es similar al reportado en Cuba (Figura 2), quizá debido al mayor intercambio comercial de material propagativo entre ambos países y menos similar a los aislados de Australia y Hawai debido a diferencias en los sistemas de producción, al material vegetal cultivado y condiciones ambientales predominantes en los tres casos (Sether et al., 2010).
Así como el PMWaV-1, PMWaV-3 no induce la MaPHP por sí solo ni junto con la alimentación del de piojo harinoso en Hawai (Sether et al., 2005) y no se sabe cuál es el efecto en la producción de piña (Sether et al., 2009). Sólo una planta de la misma localidad que mostró diferentes síntomas salió positivo para PMWaV-3. Esta planta tenía una coloración roja en la parte central de las hojas maduras, mientras que las jóvenes tenían una verde oscura, y en general no mostraban una reducción en el crecimiento ni flacidez. Como ya se mencionó, el marchitamiento asociado al piojo harinoso en (Ma-PHP) es una de las enfermedades más devastadoras de este cultivo a nivel mundial y ha sido relacionado con cinco ampelovirus diferentes (designados como Pineapple mealybug wilt associated virus-1 al 5) (Gambley et al., 2008). Sin embargo, se ha demostrado que los síntomas típicos de la enfermedad sólo se producen cuando ocurren simultáneamente la infección de Pineapple mealybug wilt associated virus-2 y la alimentación de Dysmicoccus brevipes y/o D. neobrevipes (Sether et al., 1998). En este estudio no se observaron piojos harinosos y no se detectó PMWaV-2 en las muestras analizadas, lo cual es similar a lo reportado en Hawai, donde la incidencia de este virus va de 0 a 20 %, dependiendo del sistema de producción y el híbrido usado (Sether et al., 2001) y puede causar pérdidas de hasta 100 % en frutas cuando está presente (Sether y Hu, 2001). Sin embargo, es necesario analizar un mayor número de muestras para conocer la situación de PMWaV-2 en el área de estudio. Como PMWaV-1Mexico y PMWaV-3Mexico son más distantes y menos similares a los aislados australiano y tailandés, respectivamente, podría sugerir que estos aislados tuvieron diferentes orígenes geográficos. Sin embargo, sería necesario estudiar otros genes y mayor número de aislados para confirmar esta hipótesis.
Conclusiones
Pineapple mealybug wilt associated virus-1 (PMWaV-1) fue detectado en una planta de la piña que presentaba reducción de crecimiento y manchas cloróticas irregulares y Pineapple mealybug wilt associated virus-3 (PMWaV-3) en una planta que presentó una coloración rojiza en el centro de hojas maduras. El aislado PMWaV-1Mexico es similar a uno reportado en Cuba y algo distinto de los de Australia y Hawai, mientras que el aislado PMWaV-3Mexico muestra diferencias con otros aislados de PMWaV-3 reportados en el Genbank.











 text in
text in