Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de fitopatología
versión On-line ISSN 2007-8080versión impresa ISSN 0185-3309
Rev. mex. fitopatol vol.27 no.2 Texcoco ene. 2009
Artículos científicos
Distribución Espacio Temporal de la Marchitez del Chile (Capsicum annuum L.) en Chihuahua e Identificación del Agente Causal Phytophthora capsici Leo.
Spatio–Temporal Distribution of Pepper (Capsicum annuum L.) Wilt in Chihuahua and Identification of the Causal Agent Phytophthora capsici Leo.
Hilda Victoria Silva–Rojas1, Sylvia Patricia Fernández–Pavia2,Carlos Góngora–Canul3, Bertha Catalina Macías–López4 y Graciela Dolores Ávila–Quezada5
1 Colegio de Postgraduados, Producción de Semillas, km 36.5 Carr. México–Texcoco, Montecillo, Edo de México CP 56230.
2 Instituto de Investigaciones Agropecuarias y Forestales, UMSNH, km 9.5 Carr. Morelia–Zinapécuaro, Tarímbaro, Michoacán, México CP 58880.
3 Iowa State University, Department of Plant Pathology, 325 Bessey Hall, Ames, IA 50011.
4 Universidad Autónoma de Chihuahua, Facultad de Ciencias Agrícolas y Forestales, Km 2.5 Carr. Delicias–Rosales, Delicias, Chihuahua, México CP 33000.
5 Centro de Investigación en Alimentación y Desarrollo A.C. Av. 4 Sur No. 3820, Fracc. Vencedores del desierto, Delicias, Chihuahua, México CP 33089. Correspondencia: gavilaq@ciad.mx.
Recibido: Septiembre 10, 2009
Aceptado: Noviembre 10, 2009
Resumen
Phytophthora capsici es el oomyceto que causa pudrición de raíz y marchitez del chile jalapeño en la región Centro Sur del estado de Chihuahua. En el sistema de riego rodado que se emplea en esta área, los zoosporangios liberan zoosporas que pueden diseminarse por el movimiento superficial del agua ocasionando la diseminación del patógeno en lugares donde no había estado presente. Por esta razón, durante los años 2002 y 2003 se estudió la distribución espacio–temporal de la marchitez del chile jalapeño, en los municipios de Camargo y Delicias, Chih. y se identificó al agente causal. La distribución espacio–temporal se determinó mediante la distribución de Poisson y la autocorrelación espacial. Estos estudios mostraron que el patógeno se dispersó del primer foco de infección hasta diez plantas (4.5m) de manera continua con la misma trayectoria del riego rodado y hasta cuatro plantas contiguas (2m) a través del surco (agregados) en dirección del encharcamiento por falta de nivelación del terreno. El patógeno se dispersó de las plantas enfermas a las sanas por medio del agua. Gompertz fue el modelo que mejor describió el progreso de la enfermedad obteniendo tasas de intensidad aparente de 0,008 a 0,016 gompitz dia–1 (R2 = 0,75 a 0,95). Para identificar el agente causal de la marchitez del chile jalapeño, se aisló el patógeno de plantas enfermas y se probó su patogenicidad. Los aislamientos se identificaron como P. capsici mediante morfología y secuenciación de 796 bp de los espaciadores internos transcritos (ITS) del rDNA. La secuencia del aislamiento representativo se depositó en el GenBank con el número de accesión EF660564. En los aislamientos de P. capsici obtenidos se detectaron los tipos de compatibilidad A1 y A2 los cuales fueron sensibles a mefenoxam.
Palabras clave: Oomyceto, Capsicum annum, distribución de Poisson, autocorrelación espacial.
Abstract
Phytophthora capsici is the oomycete that causes root rot and wilting of jalapeño pepper in the South Central region of Chihuahua State. The zoosporangia release zoospores which can spread by water surface movement, resulting in pathogen dispersion in places where it was not present yet. Therefore, the spatio–temporal distribution of wilting on jalapeño pepper was studied in 2002 and 2003 in the municipalities of Camargo and Delicias, Chih. The spatio–temporal distribution was determined by the Poisson distribution and the spatial autocorrelation analysis. These studies revealed that the disease continuously spreads from a single infected plant up to ten nearest neighboring plants within the row (4.5m), and up to four continuous neighboring plants across the row (2m), this may indicate that the pathogen's dispersal followed the furrow irrigation path and aggregates manly in the waterlogged spots due to a lack of land leveling in the field. Gompertz was the model that best described the progress of the disease, reaching apparent intensity rates from 0,008 to 0,016 gompitz day–1 (R2 = 0,75 to 0,95). In order to determine the causal agent of the jalapeñño pepper wilt the pathogen was isolated from diseased plants and by pathogenicity test. The isolates were identified as P. capsici throughout morphological characteristics, and sequencing of796 bp of the internal transcribed spacers (ITS) of the rDNA. The representative isolate sequence was deposited in GenBank with the accession number EF660564. Compatibility types A1 and A2 were detected among the isolates, and they were sensitive to mefenoxam.
Key words: Oomycete, Capsicum annum, Poisson distribution, spatial autocorrelation.
INTRODUCCIÓN
Chihuahua es el segundo estado productor de chile jalapeño (Capsicum annum L.) en el país, el cultivo representa un valor comercial de 1779'593,000 pesos anuales (SIAP, 2007) y contribuye a la generación de empleos rurales y de otros sectores con más de 4'690,000 jornales (Orozco, Gamaliel. Comunicación personal). Estas cifras demuestran el impacto social y económico del cultivo en el estado. Una de las enfermedades más importantes del cultivo es la marchitez causada por el patógeno Phytophthora capsici Leon, el cual causa pudrición de la raíz. La enfermedad puede presentar incidencias altas cuando las condiciones ambientales son favorables para el desarrollo del oomyceto. En Chihuahua se considera a la marchitez como uno de los principales problemas fitosanitarios del chile jalapeño, debido a que ocasiona graves pérdidas en el rendimiento por el rápido progreso de la enfermedad (Gevens et al., 2007; Guigón y González, 2001).
Las oosporas invernan en el suelo e inician la primera infección en primavera (Erwin y Ribeiro, 1996; Hwang y Kim, 1995; Lamour y Hausbeck, 2001; Lamour y Hausbeck, 2003), estas se producen cuando el micelio de los tipos de compatibilidad A1 y A2 entran en contacto. El micelio y los zoosporangios se desarrollan en tejido enfermo a temperatura de 25 a 28 °C, en condiciones de humedad superior a 80% (Erwin y Ribeiro, 1996; Hausbeck y Lamour, 2004; Schlub, 1983). Los zoosporangios y las zoosporas son inóculo asexual secundario producido durante el ciclo agrícola, el cual ocasiona un progreso rápido de la enfermedad (Erwin y Ribeiro, 1996), además en agua libre los esporangios liberan de 20 a 40 zoosporas mótiles, cada una capaz de causar infección (Bernhardt y Grogan, 1982; Erwin y Ribeiro, 1996). La marchitez es considerada como una enfermedad policíclica debido a que completa más de un ciclo de enfermedad durante el ciclo del cultivo, en la cual, las plantas enfermas sirven de fuente de inóculo para causar infecciones secundarias en plantas vecinas por medio de esporangios y zoosporas (Bowers et al., 1990; Campbell y Madden, 1990; Larkin et al., 1995; Ristaino, 1991). Cuando se combinan herramientas estadísticas y biológicas es posible caracterizar el proceso policíclico de la enfermedad en una región, así como el proceso de diseminación espacial de ésta determinado por la capacidad del patógeno para dispersarse hacia las plantas vecinas en condiciones de campo. También, la asociación espacial de plantas enfermas permite localizar los focos de infección y determinar el área afectada para dirigir el manejo a los focos de plantas enfermas (Ávila–Quezada et al., 2002; 2003). Asimismo, la distribución de los patrones espaciales de plantas con síntomas, ayuda a entender el patosistema y permite elegir mejores estrategias de control o manejo integrado del cultivo.
El presente trabajo se realizó con la finalidad de caracterizar el progreso temporal de la enfermedad y la distribución de la marchitez del chile en la región productora de chile jalapeño en el estado de Chihuahua, específicamente i) determinar los patrones espaciales, intensidad de agregación o dependencia espacial entre plantas enfermas, y direccionalidad de la dispersión ii) caracterizar el desarrollo espacio–temporal de la enfermedad, iii) Identificar el patógeno causante de la marchitez mediante pruebas morfológicas y secuenciación del espacio transcrito interno del rDNA así como, determinar el tipo de compatibilidad y la reacción al mefenoxam y iv) asociar las herramientas epidemiológicas con posibles medidas de manejo.
MATERIALES Y MÉTODOS
Áreas de estudio. Durante los ciclos agrícolas 2002 y 2003 se muestrearon cuatro parcelas cultivadas con chile jalapeño en la región del centro–sur del estado de Chihuahua, en las localidades de Camargo en el 2002, rancho Cuatro vientos en Delicias en el 2002, rancho El Rosal en Camargo en el 2003 y Km 73 carretera Camargo–Conchos en el 2002.
Estudio temporal. En cada parcela se muestrearon 625 plantas, cada una considerada como una unidad experimental en un cuadrante de 25 x 25 plantas, donde la variable epidemiológica evaluada fue la incidencia de la marchitez. Esta se determinó visualmente cada ocho días, evaluando los síntomas típicos de marchitez en la planta completa durante todo el ciclo del cultivo. Consecuentemente, a las plantas con síntomas de marchitez se les asignó el valor 1, y 0 a las plantas asintomáticas. La incidencia total de la parcela se determinó obteniendo la proporción de plantas enfermas con respecto al total de las plantas de cada parcela/100. Los datos de incidencia/100 de cada parcela se graficaron con respecto al tiempo para obtener curvas de progreso de la enfermedad y se ajustaron a cuatro modelos linearizados; monomolecular (ln[1/(1 – y)] = ln[1/(1 – y0)] + rMt), logístico (ln[y/(1 – y)] = ln[y/(1 – y0)] + rLt), Gompertz (–ln[–lny] = –ln[–ln(y0)] + rGt) y exponencial (ln[y] = ln(y0) + rEt) para propósitos de predicción de futuros datos teóricos. Los criterios para determinar que modelo ajustó los datos del progreso de la enfermedad fueron el coeficiente de determinación (R2), significancia estadística (Pr>F), cuadrado medio del error (CME) y la prueba Shipiro–Wilk para evaluar normalidad de los residuales. El modelo que mejor ajustó los datos de progreso temporal de la enfermedad, permitió conocer la tasa de progreso de enfermedad o la velocidad del progreso temporal de la enfermedad (Campbell y Madden, 1990). El análisis temporal de los datos se realizó con el programa SAS para windows ver. 6.11.
El Área bajo la curva del progreso de la enfermedad ABCPE= Σ [{(yi + yi+1)/2} (ti+1–ti)] se determinó para las cuatro epidemias de las cuatro parcelas utilizando el método de integración trapezoidal (Campbell y Madden, 1990).
Estudio espacio–temporal. El tipo de patrón espacial, la intensidad de agregación y la direccionalidad se determinó por medio de autocorrelación espacial usando el modelo de Modjeska y Rawlings (1983) a través del programa LCOR2 (Gottwald et al., 1992), asimismo, se utilizó la distribución de probabilidad discreta Poisson para corroborar el tipo de patrón espacial no agregado y dado que los datos de la enfermedad fueron binarios (0 y 1). Para determinar si la distribución Poisson ajustó a los datos se utilizó la distribución Ji–cuadrada (χ2) como prueba de bondad de ajuste, si P < 0.05, se rechaza la hipótesis nula que establece que la distribución tiene una distribución aleatoria. La distribución Poisson, requirió un tamaño óptimo de cuadrante que incluyera frecuencias de plantas enfermas. El tamaño óptimo de cuadrante (TOC) utilizado para determinar la distribución, se obtuvo mediante el método Greig–Smith (1957) en tamaños de bloques de 4, 8, 16, 32, 64 y 128 plantas. El TOC se identificó con la varianza más alta que corresponde también al cuadrado medio más alto (Campbell y Madden, 1990).
Aislamiento del patógeno. Los patógenos involucrados en la marchitez del chile se aislaron de plantas de cuatro meses de las parcelas comprendidas en este estudio, con síntomas de decaimiento del área foliar y pudrición en el sistema radical. El tejido enfermo se lavó con agua de la llave, se cortó en pequeñas secciones de 0.3 cm2 en el límite del área sana y del área necrótica, se enjuagaron con agua destilada estéril y se desinfestaron con una solución de 1% de cloro comercial (hipoclorito de sodio) por 30 s, enjuagándose nuevamente con agua destilada estéril. Las porciones de tejido se secaron con papel estéril y se colocaron en cajas de Petri conteniendo medio selectivo PVPP (Papavizas et al., 1981). Posteriormente se transfirieron de forma aséptica a Papa Dextrosa Agar (PDA) y medio jugo de verduras (V–8). Se seleccionó un aislamiento de cada parcela.
Pruebas de patogenicidad. Los aislamientos obtenidos de Fusarium sp. y de Phytophthora sp.se inocularon utilizando dos métodos. Se enfrentaron a plantas de chile jalapeño var. Mitla, de 20 días, las cuales se mantuvieron en bolsas de plástico, con capacidad de 5 kg, con suelo estéril. Cuando el micelio de cada aislamiento cubrió la caja de Petri, se cortaron con un sacabocado 5 discos de 1cm de diámetro y se colocaron en el sustrato a una distancia de 0.3 cm de la raíz y 1 cm de profundidad de cinco plantas. Asimismo se preparó una suspensión de conidios de Fusarium que se colocaron en el suelo a la misma distancia de la raíz y profundidad en otras cinco plantas. El suelo se regó a capacidad de campo. Adicionalmente para probar la patogenicidad de Phytopthora se utilizó la variedad susceptible de chile Sonora, inoculando plántulas de 28 días, con una suspensión de 10,000 zoosporas mL–1 de acuerdo con el protocolo descrito por Fernández–Pavía etal. (2004).
Extracción del DNA genómico. Los aislamientos de Phytophthora sp. se cultivaron en medio sólido PDA y V–8, las cajas de Petri se colocaron a una temperatura de 20 a 25°C con luz blanca continua. Después de cuatro días, cuando se desarrolló el micelio, se tomó una porción de aproximadamente 5 mm de micelio y se colocó en un tubo Eppendorf de 200 μL conteniendo 30 μL de la solución de lisis, Lyse N Go (Pierce, USA). Posteriormente, se colocaron los tubos a 95°C durante 5 min, después se centrifugaron por 10 min a 5,000 xg. Posteriormente se tomó 5 μL del sobrenadante para las amplificaciones de los genes ribosomales mediante la PCR.
Amplificación por PCR del DNA ribosomal. Para la amplificación de la región ITS se utilizaron los iniciadores universales ITS5 (5'–GGAAGTAAAAGTCGTAACAAGG–3') e ITS4 (5'–TCCTCCGCTTATTGATATGC) (White et al., 1990), que amplifica un fragmento de 580 pares de bases aproximadamente (bp). Otro par de iniciadores utilizados fueron ITS5 y NL4 (5'–GGTCCGTGTTTCAAGACGG– 3') (O'Donnell, 1992), para amplificar un fragmento de 1,100 bp, que incluyó la región del ITS y ~600 bp del gen 28S rRNA. La mezcla de reacción para PCR se preparó en un volumen final de 25 μL conteniendo la enzima 1 x Taq DNA polimerasa, 0.8 mM deoxinucleosido trifosfatos (0.2 mM cada uno), 100 ng DNA, 20 pmol de cada iniciador y 2 unidades de GoTaq DNA (Promega, USA). Las amplificaciones se realizaron con un ciclo inicial de desnaturalización a 95°C por 2 min; 35 ciclos de desnaturalización a 95°C por 1 min, el alineamiento a 57°C por 1 min, y una extensión final a 72°C por 2 min; finalmente un ciclo de amplificación a 72°C por 10 min.
Todas las reacciones de PCR se llevaron a cabo en un Peltier Thermal Cycler PTC–200 (BIORAD, México), las amplificaciones se verificaron por electroforesis en un gel de agarosa al 1.2% preparado con 1x TAE búfer (Tris Acetate–EDTA) y corrido a 87 V cm–3 durante 1 h. El gel se tiñó con bromuro de etidio (3 mg L–1), y las bandas se visualizaron en un transiluminador Gel Doc 2000 UV (BIORAD, USA). Los productos amplificados se limpiaron con el kit de purificación QIAquick PCR (Qiagen, USA), siguiendo las instrucciones del fabricante. Estos productos se secuenciaron en ambas direcciones con un sistema automatizado de secuenciación de DNA de Applied Biosystems modelo 3730XL (Applied BioSystems, USA); para asegurar que no hubiera lecturas de nucleótidos incorrectas.
Análisis filogenético de la región del ITS y de nLSU rDNA. Las secuencias de ambas regiones se ensamblaron y editaron usando BioEdit versión 7.0.5 (Hall, 1999), con el cual se creó una secuencia consenso. Esta secuencia, se comparó con las secuencias depositadas en el GenBank del National Center for Biotechnology Information (NCBI), mediante la opción BLASTN 2.2.19 (Zhang et al., 2000).
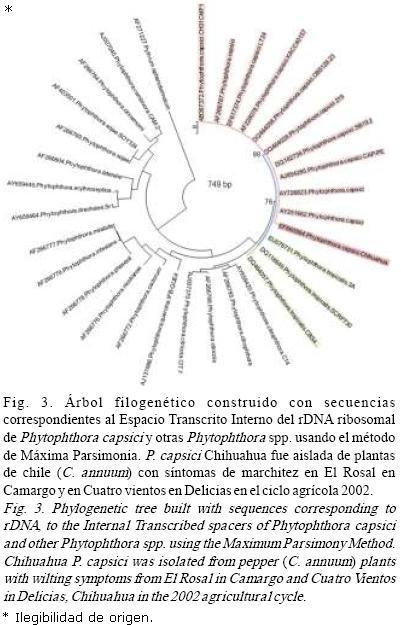
Para el análisis filogenético, la secuencia consenso se compiló en un archivo fasta y se alineó con el profile mode del Clustal W 1.8.1. (Thompson et al., 1994), incluido en el programa Mega 4.0.2 (Tamura et al., 2007) y analizada con el método de Máxima Parsimonia utilizando la opción Close Neighbour Interchange (CNI) search (nivel=1), con Initial tree por adición al azar (10 reps), y los gap/missing se consideraron como completas deleciones.
Para determinar los valores de confianza de los agrupamientos dentro del árbol resultante, un análisis de bootstrap se estimó con 1000 repeticiones (Felsestein, 1985). Secuencias de Phytophthora tropicalis, la especie filogenética más cercana y otras especies de Phytophthtora se obtuvieron del GenBank (NCBI), y se incluyeron como especies de referencia en el presente estudio. Pythium aphanidermatum número de acceso EF211227 se asignó como fuera de grupo para la construcción del árbol filogenético (Fig.3).
Tipo de compatibilidad y sensibilidad a mefenoxam. El tipo de compatibilidad de cada aislamiento se determinó realizando cruzas con cepas de P. capsici de tipos de apareamiento (A1 y A2) conocidos. Se colocaron en medio V–8 clarificado (CV–8) un disco de micelio del tipo de compatibilidad conocido y aproximadamente 2 cm aparte uno del tipo desconocido. Los cultivos se incubaron en oscuridad a 25º±1 C durante 15– 21 días, posteriormente se observó la formación de oosporas bajo el microscopio óptico colocando la parte inferior de la caja de Petri hacia arriba. El aislamiento se designó como A1 si éste formó oosporas cuando se cruzó con el tipo A2, y A2 si las produjo con el A1. Para determinar la sensibilidad a fungicidas se eligió mefenoxam por ser el ingrediente activo más recomendado en la región para el control de Phytophthora spp. Para este análisis se siguió el protocolo descrito por Fernández–Pavía et al. (2004) con modificaciones. Se utilizó medio de agar harina de maíz (CMA) adicionado con 0 y 100 g mL–1 de mefenoxam (Ridomil Gold– 4E, 46.2 i. a.), el cual se agregó al medio después de esterilizado. A partir de aislamientos de 5–7 días, crecidos en CMA se transfirió un disco con micelio de 3 mm de diámetro en el medio con fungicida. Se incubaron a 25º±1 en obscuridad y después de 5 días se midió el crecimiento radial en dos direcciones perpendiculares las cuales se promediaron y compararon con el testigo. El experimento se realizó dos veces con tres repeticiones por tratamiento. Los aislamientos se consideraron como sensitivos (S) si el crecimiento a 100 g mL–1 fue < 40%, como medianamente sensitivo (IS) si fue entre 40–60%, (I) y no sensitivo si fue >60%. Se utilizó un diseño completamente al azar.
RESULTADOS
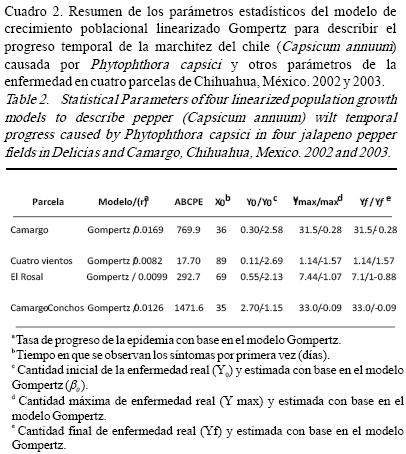
Estudio temporal. La incidencia de la enfermedad en el bloque de 625 plantas en la parcela de Camargo incrementó de 0.33% en mayo a 31% en agosto, de 2.73% en mayo a 33% en julio en la parcela Camargo–Conchos, las epidemias en estas dos parcelas fueron las que alcanzaron mayor incidencia final. Las otras dos parcelas tuvieron relativamente baja incidencia final (Fig. 1). El progreso temporal de la enfermedad tuvo un comportamiento irregular, se desarrolló con mayor intensidad al final del ciclo del cultivo (Fig. 1) coincidiendo con la época de lluvias y el periodo de encharcamiento en ciertos puntos de la parcela, estos resultados concuerdan con lo descrito por Bernhardt y Grogan, (1982) y Erwin y Ribeiro, (1996) quienes mencionan que en el agua libre los esporangios liberan zoosporas mótiles, cada una capaz de causar infección. El Área bajo la curva del progreso de la enfermedad (ABCPE), integrada en dos tiempos (mayo–agosto) fue mayor para la parcela Camargo–Conchos (1471), seguido por la parcela de Camargo (769) y las parcelas del rancho El Rosal y rancho Cuatro Vientos en este estudio presentaron menor área bajo la curva, menor incidencia final y las tasas de infección aparente más bajas (Cuadro 2). Se observó claramente que conforme se incrementa la incidencia en cada parcela, el área bajo la curva de progreso de la enfermedad se incrementó, al igual que las tasas de progreso de la enfermedad (r), el tiempo de inicio de la epidemia (X0) se acortó, la cantidad inicial de enfermedad (Y0) fue mayor, la cantidad máxima (Ymax) y la cantidad final de enfermedad se incrementaron (Yf) (Cuadro 2).
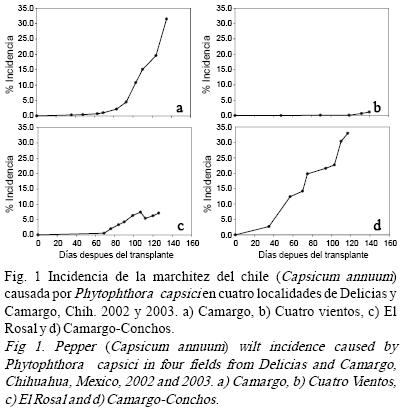
La mayor incidencia final produjo una mayor acumulación de ABCPE de mayo a agosto en las cuatro parcelas. En el rancho El Rosal se observó que la epidemia aparentemente se redujo, esto fue debido a que no se pudieron contabilizar las plantas muertas a partir de la séptima evaluación.
Dado que el progreso temporal de la incidencia de la epidemia varió en cuanto a su forma, más de un modelo ajustó la curva de progreso de la enfermedad en tres parcelas. En la parcela de Cuatro Vientos ninguno de los cuatro modelos ajustaron la curva de progreso de la enfermedad posiblemente dado a la forma bi–modal de la curva y a los valores bajos de incidencia (Fig. 1). En las parcelas de Camargo, El Rosal y Camargo–Conchos los cuatro modelos ajustaron a las curvas de progreso de la enfermedad. Sin embargo, para la parcela Camargo el modelo con más fortaleza estadística fue el Gompertz debido al valor del coeficiente de determinación (R2=95), significancia estadística (P<0.0001) y que no hubo violación de la normalidad de los residuales Shapiro–Wilk P=0.71 (Cuadro 1). Para la parcela Camargo–Conchos el modelo Monomolecular fue el que ajustó los datos, dado a los valores de los parámetros estadísticos (R2=93.7, P<0.0001, CME=0.001 y Shapiro–Wilk P=0.4325), seguido de modelo Gompertz (R2=92.2, P=0.0001, CME=0.0124 y Shapiro–Wilk P=0.7394). En la epidemia de la parcela de El Rosal, el modelo que mejor se ajustó fue el Gompertz, (R2=75.4, P=0.0025, CME=0.0145 y Shapiro–Wilk P=0.5538), seguido del Monomolecular (R2=73.7, P=0.0015, CME=0.0002 y Shapiro–Wilk P=0.899), en ambos modelos no existió violación de la normalidad de los residuales. En general, el modelo Gompertz ajustó mejor las curvas de progreso de la enfermedad, el cual coincide con el comportamiento policíclico de la enfermedad.
Las tasas promedio de infección aparente fueron de 0.008 a 0.016 gompitz día–1 las cuales se incrementaron conforme incrementó la incidencia (Cuadro 2).
Se ha reportado que la marchitez del chile es una enfermedad de rápida dispersión (Gevens et al., 2007), esto coincide con las tasas de infección aparente observadas de 0.016 y 0.012 gompitz dia–1 en las parcelas de Camargo y Camargo–Conchos respectivamente, y el incremento rápido en la incidencia de mayo (0.33%) a agosto (31%) en la parcela de Camargo. En esta parcela el progreso de la enfermedad tuvo un comportamiento exponencial al inicio, después aparentemente una forma monomolecular para terminar al final de manera exponencial (Fig. 1).
Estudio espacio–temporal. El tamaño óptimo de cuadrante (TOC) de 16 (4 x 4) plantas marchitas fue consistente en las parcelas de Camargo y El Rosal en todo el ciclo del cultivo; el TOC de 32 plantas enfermas fue consistente en la parcela Camargo–Conchos en las ocho evaluaciones y el TOC fue variable en la cuarta parcela en las diferentes fechas de evaluación. El tipo de patrón espacial determinado con la distribución Poisson coincidió con el tipo de patrón espacial determinado con el análisis de autocorrelación espacial en el sentido de que las epidemias tuvieron un patrón al azar al inicio de las epidemias y conforme pasó el tiempo las epidemias se presentaron en agregados (Cuadro 3). Se presentó autocorrelación espacial de plantas continuas, en las cuatro parcelas, es decir una planta enferma logró enfermar a la planta vecina dentro del surco (0º) (Fig. 2) y a través del surco (90º), sin embargo, la diseminación dentro de los surcos fue mayor con rangos de 2 hasta 8 cuadrantes continuos comparado a la diseminación a através de los surcos con rangos de 1–3 cuadrantes (Fig. 2).
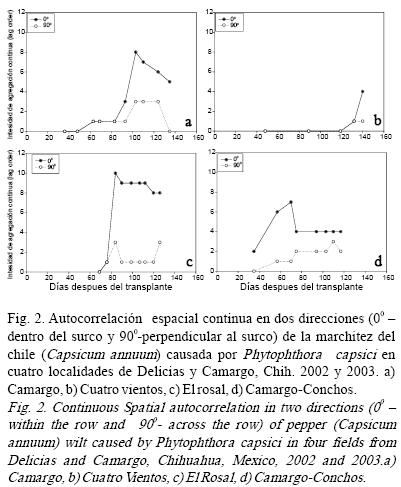
Al inicio de la epidemia en Camargo se observó que el primer brote apareció en la parte más baja de la parcela de acuerdo a la pendiente en dirección del riego. Asimismo en la última fecha de evaluación (agosto) la mayor intensidad de la marchitez se presentó en la parte con mayor depresión, esta parte de la parcela correspondió al área con inundación.
Esto puede estar relacionado al tipo de riego rodado aplicado al cultivo que disemina al patógeno en dirección al riego (pendiente). Conforme la incidencia de la enfermedad incrementó, la agregación incrementó del mismo modo, esto puede indicar la formación de focos secundarios hasta cierto punto en el tiempo; ya que un incremento en la incidencia no siempre está relacionado a un tipo de patrón espacial en agregados, porque un valor específico de incidencia o cierto número de plantas enfermas pueden concentrarse en un área específica en el terreno (agregados) o ese mismo número de plantas en todo el terreno (uniforme). En las cuatro localidades se ve una estabilización o incluso una reducción de la intensidad de agregación o número de cuadrantes contiguos, lo que indicó que el tipo de patrón en agregados puede convertirse en un tipo de patrón uniforme.
Aislamiento del patógeno y pruebas de patogenicidad. Especies de los géneros Phytophthora spp. y Fusarium spp., se aislaron de raíces enfermas de chile. Los síntomas de marchitez se observaron dos semanas después de la inoculación con micelio del aislamiento de Phytophthora sp., y 7 días después en las inoculadas con zoosporas. No se observaron síntomas en las plantas inoculadas con Fusarium, por esta razón se consideró solo a Phytophthora sp. para la identificación genético–molecular y caracterización de la especie.
Identificación del agente causal de la marchitez. Las cepas presentaron colonias estrelladas en V–8, en las que se desarrollaron zoosporangios papilados de forma variable (redondos, elipsoides, ovoides, ocasionalmente bipapilados), caducos y con pedicelo largo y heterotálicos. Las características mencionadas concuerdan con la descripción de Erwin y Ribeiro (1996) para P. capsici.
Las amplificaciones realizadas con los iniciadores ITS5/ITS4 amplificaron el fragmento esperado de 580 bp. Asimismo, se obtuvo un fragmento de 1,100 bp con los iniciadores ITS5/NL4. Sin embargo, para la construcción de árbol filogenético las secuencias se cortaron a una longitud de 796 bp, debido al diferente tamaño que tenía las secuencias depositadas en el GenBank.
El resultado de BLASTN, así como el árbol filogenético construido con el método de Máxima Parsimonia, confirmó que la cepa representativa, aislada de la parcela de chile del Rancho El rosal en Chihuahua correspondía a P. capsici con una identidad del 98% con respecto a los aislamientos de diversos hospedantes, chile entre ellos. La secuencia obtenida en este estudio se depositó en el GenBank–NCBI bajo el número de acceso EF660564.
Tipo de compatibilidad y sensibilidad a fungicidas. Se detectaron los dos tipos de compatibilidad A1 y A2. Las oosporas fueron pleróticas y se observaron anteridios anfíginos. Asimismo los aislamientos fueron sensibles al mefenoxam (crecimiento < 40%), ya que el rango de crecimiento de los aislamientos en 100 g mL–1 con respecto al testigo varió del 6.7% al 14%.
DISCUSIÓN
El patógeno causante de la marchitez del chile en la zona centro–sur de Chihuahua se identificó por análisis morfológico y molecular como P.capsici. Las epidemias causadas por P.capsici en Camargo y Camargo–Conchos presentaron las tasas más altas de progreso de la enfermedad con base al modelo Gompertz, esto posiblemente influenciado por la superficie irregular en la que estaba sembrado el cultivo y por los consecuentes encharcamientos que facilitaron la rapidez de la movilidad de las zoosporas y acelerar las infecciones (Erwin y Ribeiro, 1996). El modelo de Gompertz describió curvas sigmoidales, sin embargo, la exploración gráfica mostró que la última fase de la epidemia en Camargo fue exponencial (del 15 de julio al 9 de agosto) esto demuestra que la epidemia progresó con mayor intensidad al final del ciclo de cultivo, similar al inicio, probablemente porque la enfermedad es policíclica y las zoosporas encontraron un ambiente favorable para dispersarse cuando el agua se estancó en algunas depresiones dentro de la parcela.
Las tasas de infección aparente de las parcelas de Camargo y Camargo–Conchos caracterizaron epidemias explosivas propiciadas por factores como el hospedante susceptible, la facilidad de dispersión del inóculo y su alta eficiencia, suficiente humedad por precipitación pluvial y temperatura óptima. Además entre los factores que dependen del productor se encuentran la frecuencia e intensidad del riego. El agua (de riego o lluvia) se identificó como una importante fuente potencial para la diseminación de P. capsici coincidiendo este resultado con reportes previos (Ávila–Quezada et al., 2005; Bernhardt y Grogan, 1982; Erwin y Ribeiro, 1996). Debido a la falta de nivelación del terreno se observaron encharcamientos dentro de la parcela. Sin embargo, surgen algunas interrogantes como; si el inóculo está presente en el agua del canal éste puede introducirse en la parcela de chile e infectar las plantas, aún cuando en la parcela no se haya plantado chile en años anteriores. Es probable que en años anteriores el inóculo haya sido arrastrado por el agua y haya permanecido latente en el suelo hasta que el cultivo de chile fue establecido en el predio.
La lluvia o riego rodado produjo inundaciones en la parcela de Camargo, asociado al mayor foco de infección detectado por autocorrelación espacial y exploración gráfica. El agua contaminada acarreará al patógeno hacia la pendiente más baja (Jung y Blaschke, 2004), concordando esto con los resultados obtenidos en este trabajo. En este estudio, se observó que al inicio de la epidemia se presentó una distribución al azar, posiblemente por la presencia del patógeno en el suelo o en el agua como inóculo inicial local con bajas densidades insuficientes para causar una alta incidencia, sin embargo, la enfermedad se dispersó en forma de agregados sobre el predio debido a la diseminación por el riego y la producción de inóculo secundario. Con los resultados de este trabajo se muestra que la enfermedad inicia al azar, y que el productor puede asumir que el inóculo está presente en el suelo o en el agua por lo que deberá tomar medidas antes de establecer el cultivo en lo que concierne a la nivelación del terreno.
Una solución dentro del programa de manejo de esta enfermedad podría ser la implementación de drenes para eliminar el exceso de agua y evitar inundaciones en la parcela. Evitar inundaciones es prioridad debido a la motilidad de este patógeno por medio de las zoosporas (Bernhardt y Grogan, 1982).
En estudios previos se ha encontrado que las oosporas de P. capsici pueden sobrevivir en el suelo durante tres años (Lamour y Hausbeck, 2003) y pueden persistir a pesar de no tener el tejido hospedante (French–Monar et al., 2006; Lamour y Hausbeck, 2003). Los resultados obtenidos en este estudio sugieren que la reproducción sexual se está presentando en los campos analizados la cual contribuye a que la enfermedad se presente año con año ya que se podrán formar oosporas que servirán como inóculo primario. La presencia de estos tipos de apareamiento se ha reportado en otros estados del país donde se cultiva chile como son: Aguascalientes y Guanajuato (Pérez–Moreno et al., 2003; Rodríguez–Moreno et al., 2004), siendo este el primer reporte para Chihuahua. Por lo que la rotación de cultivos podría tener sus limitantes, si se pretende sembrar nuevamente chile jalapeño en menos de cuatro años en la misma parcela. La rotación podría funcionar si después de detectarse P. capsici se establece algún cultivo no hospedante de este patógeno por un periodo de al menos cinco años.
No existen variedades de chile resistentes a P. capsici por lo que es indispensable que se lleve a cabo un manejo integrado de la enfermedad para reducir las pérdidas ocasionadas por este patógeno, además de establecer el cultivo del chile en suelos bien drenados y bien nivelados. Es recomendable limitar el riego cerca de la cosecha (Hausbeck y Lamour, 2004). El uso constante de fungicidas trae como consecuencia la resistencia a estos, sin embargo, aun no se detectó en los aislamientos de P. capsici de las localidades muestreadas resistencia a mefenoxam como se ha reportado en otros países (Fernández–Pavía et al., 2004; Parra y Ristaino, 2001) por lo que podría incluirse en el control tomando en cuenta que su efectividad en campo es baja por lo que se recomienda implementar un sistema de manejo integrado de la enfermedad.
CONCLUSIONES
En el presente estudio se determinó que Phytophthora capsici es el agente causal de la marchitez del chile en los municipios de Camargo y Delicias del estado de Chihuahua. Este oomyceto presenta los tipos de compatibilidad A1 y A2, además de mostrar sensibilidad a mefenoxam.
Los patrones de distribución espacial de la enfermedad revelaron de manera general una agregación al final del ciclo de cultivo debido que la diseminación del patógeno se vió favorecida por el riego rodado, por lo que con estos resultados se recomendaría establecer el cultivo de chile en suelos bien drenados y nivelados.
La aplicación de un manejo integrado de la enfermedad donde se considere una rotación con cultivos no hospedantes por un periodo de cinco años o más, será la única forma en que se lograrán reducir las pérdidas ocasionadas por este patógeno.
LITERATURA CITADA
Ávila–Quezada, G.D., Téliz–Ortiz, D., González–Hernández, H., Vaquera–Huerta, H., Tijerina–Chávez, L., Johansen–Naime, R., y Mojica–Guzmán, A. 2002. Dinámica espacio–temporal de la roña (Elsinoe perseae), el daño asociado a trips y antracnosis (Glomerella cingulata) del aguacate en Michoacán, México. Revista Mexicana de Fitopatología 20:77–87. [ Links ]
Ávila–Quezada, G.D., Téliz–Ortiz, D., Mora–Aguilera, G., Vaquera–Huerta, H., y Tijerina–Chávez, L. 2003. Spatial and temporal dynamic of scab (Sphaceloma perseae Jenk.) on avocado (Perseae americana Mill.). Revista Mexicana de Fitopatología 21:152–160. [ Links ]
Ávila–Quezada, G.D., Gardea, A., Pedroza–Sandoval, A., Silva–Rojas, H.V., and Fernández–Pavía, S. 2005. Spatial dynamic of pepper wilt. Phytopathology 95:149 (Abstract). [ Links ]
Bernhardt, E.A., and Grogan, R.G. 1982. Effect of soil matric potential on the formation and indirect germination of sporangia of Phytophthora parasitica, Phytophthora capsici, and Phytophthora capsici cryptogea rots of tomatoes, Lycopersicon esculentum. Phytopathology 72:507–511. [ Links ]
Bowers, H.H., Sonoda, R.M., and Mitchell, D.J. 1990. Path coefficient analysis of the effect of rainfall variables on the epidemiology of Phytophthora capsici. Phytopathology 80:1439–1446. [ Links ]
Campbell, C.L., and Madden, L.V. 1990. Introduction to Plant Disease Epidemiology. John Wiley and Sons, Inc. New York, USA. 532 p. [ Links ]
Erwin, D.C., and Ribeiro, O.K. 1996. Phytophthora Disease Worldwide. The American Phytopathological Society, St. Paul, MN., USA. 562 p. [ Links ]
Felsenstein, J. 1985. Confidence limits on phylogenies: an approach using the bootstrap. Evolution 39:783–791. [ Links ]
Fernández–Pavía, S.P., Biles, C.L., Waugh, M.E., Onsurez–Waugh, K., Rodriguez–Alvarado, G., and Liddell, C.M. 2004. Characterization of southern New Mexico Phytophthora capsici Leon isolates from pepper (Capsicum annuum L.). Revista Mexicana de Fitopatología 22:82–89. [ Links ]
Fernández–Pavía, S.P., Rodríguez–Alvarado, G., and Sánchez–Yáñez, J.M. 2003. Buckeye rot of tomato caused by Phytophthora capsici in Michoacán, México. Plant Disease 87:872 (Abstract). [ Links ]
French–Monar, R.D., Jones, J.B., and Roberts, P.D. 2006. Characterization of Phytophthora capsici associated with roots of weeds on Florida vegetables farms. Plant Disease 90:345–350. [ Links ]
Gevens, A.J., Donahoo, R.S., Lamour, K.H., and Hausbeck, M.K. 2007. Characterization of Phytophthora capsici from Michigan surface irrigation water. Phytopathology 97:421–428. [ Links ]
González, M., Rodríguez, R., Zavala, M.E., and Jacobo, J.L. 1998. Characterization of Mexican isolates of Colletotrichum lindemuthianum by using differential cultivars and molecular markers Phytopathology 88:292–299. [ Links ]
Guigón–López, C., y González–González, P. 2001. Estudio regional de las enfermedades del chile (Capsicum annuum L.) y su comportamiento temporal en el sur de Chihuahua, México. Revista Mexicana de Fitopatología 19:49–56. [ Links ]
Gottwald, T.R., Richie, S.M., and Campbell, C.L. 1992. LCOR2 Spatial correlation analysis software for the personal computer. Plant Disease 76:213–215. [ Links ]
Hall, T.A. 1999. BioEdit: a user–friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucleic Acids Symposium Series 41:95–98. [ Links ]
Hausbeck, M.K., and Lamour, K.H. 2004. Phytophthora capsici on vegetables crops: research progress and management challenges. Plant Disease 88:1292–1303. [ Links ]
Hwang, B.K., and Kim, C.H. 1995. Phytophthora blight of pepper and its control in Korea. Plant Disease 79:221–227. [ Links ]
Jung, T., and Blaschke, M. 2004. Phytophthora root and collar rot of alders in Bavaria: distribution, modes of spread and possible management strategies. Plant Pathology 53:197–208. [ Links ]
Lamour, K.H., and Hausbeck, M.K. 2001. Investigating the spatio temporal genetic structure of Phytophthora capsici in Michigan. Phytopathology 91:973–980. [ Links ]
Lamour, K.H., and Hausbeck, M.K. 2003. Effect of crop rotation on the survival of Phytophthora capsici in Michigan. Plant Disease 87:841–845. [ Links ]
Larkin, R.P., Gumpertz, M.L., and Ristaino, J.B. 1995. Goestatistical analysis of Phytophthora epidemic development in commercial bell pepper fields. Phytopathology 85:191–203. [ Links ]
Modjeska, J.S., and Rawlings, J.O. 1983. Spatial correlation analysis of uniformity data. Biometrics 39:373–384. [ Links ]
O'Donnell, K. 1992. Ribosomal DNA internal transcribed spacer are highly divergent in the phytopathogenic ascomycete Fusarium sambucinum (Gibberella pulicaries). Current Genetics 22:213–220. [ Links ]
Papavizas, G.C., Bowers, J.H., and Johnston, S.A., 1981. Selective medium for Phytophthora capsici from soils. Phytopathology 71:129–33. [ Links ]
Parra, G., and Ristaino, J.B. 2001. Resistance to mefenoxam and metalaxyl among field isolates of Phytophthora capsici causing phytophthora blight of bell pepper. Plant Disease 85:1069–1075. [ Links ]
Pérez–Moreno, L., Duran–Ortiz, L.J., Ramírez, R., Sánchez–Pale, R. Olalde–Portugal, V. 2003. Compatibilidad fisiológica y sensibilidad a fungicidas de aislamientos de Phytophthora capsici Leo. Revista Mexicana de Fitopatología 21:19–25. [ Links ]
Ristaino, J.B. 1991. Influence of rainfall, drip irrigation and inoculum density on the development of Phytophthora root and crown rot epidemics and yield in bell pepper. Phytopathology 81:922–929. [ Links ]
Rodríguez, V.M., Luna–Ruiz, J.J., Valle–García, P., Tiscareño–López, M., y Ruiz–Corral, J.A. 2004. Caracterización patogénica y sexual de Phytophthora capsici Leonian y análisis de su distribución espacial en el Centro–Norte de México mediante un sistema de información geográfica. Revista Mexicana de Fitopatología 22:72–81. [ Links ]
Schlub, R.L. 1983. Epidemiology of Phytophthora capsici on bell pepper. Journal of Agricultural Science 100:7–11. [ Links ]
SIAP, 2007. Servicio de Información Agroalimentaria y Pesquera, SAGARPA. Acceso en julio 2009. [ Links ]
Tamura, K., Dudley, J., Nei, M., and Kumar, S. 2007. MEGA4: Molecular evolutionary genetics analysis (MEGA) software ver. 4.0. Molecular Biology Evolution 24:1596–1599. [ Links ]
Thompson, J.D., Higgins, D.G., and Gibson, T.J. 1994. Clustal W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, positions–specific gap penalties and weight matrix choice. Nucleic Acids Research 22:4673–4680. [ Links ]
White, T.J., Bruns, T.J., Lee, S., and Taylor, J (eds.). 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. pp. 315–322. In: M.A. Innis, D.H. Gelfand, J.J. Sninsky and T.J. White (eds.). PCR Protocols. A Guide to Methods and Amplifications. Academic Press. San Diego, California, USA. 355 p. [ Links ]
Zhang, Z., Schwartz, S., Wagner, L., and Miller, W. 2000. A greedy algorithm for aligning DNA sequences. Journal of Computational Biology 7:203–214. [ Links ]




![Incidencia de Inóculo y Variables Climáticas como Herramientas en la Toma de Decisiones del Manejo del Tizón de Fuego [Erwinia amylovora (Burill) Winslow et al.] Durante la Floración del Manzano [Malus sylvestris (L.) Mill. var. domestica (Borkh.) Mansf.]](/img/es/prev.gif)
![Reacción de Variedades de Sorgo [Sorghum bicolor (L.) Moench] para Grano a Macrophomina phaseolina (Tassi) Goid](/img/es/next.gif)








