Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de fitopatología
versión On-line ISSN 2007-8080versión impresa ISSN 0185-3309
Rev. mex. fitopatol vol.26 no.1 Texcoco ene. 2008
Artículos científicos
Actividad Antifúngica de Polvos, Extractos y Fracciones de Cestrum nocturnum L. Sobre el Crecimiento Micelial de Rhizopus stolonifer (Ehrenb.:Fr.) Vuill.
Antifungal activity of powders, estracts, and fractions of Cestrum nocturnum L. on mycelial growth of Rhizopus stolonifer (Ehrenb.:Fr.)Vuill.
Laura Leticia Barrera–Necha y Silvia Bautista–Baños
Instituto Politécnico Nacional, Centro de Desarrollo de Productos Bióticos, Apdo. Postal 24, km 8.5 Carr. Yautepec–Jojutla San Isidro, Yautepec, Morelos, México CP 62731. Correspondencia: lbarrera@ipn.mx
Recibido: Agosto 29, 2007
Aceptado: Enero 16, 2008
Resumen
Se evaluó el efecto antifúngico de polvos, extractos y fracciones de hojas de Cestrum nocturnum del estado de Morelos, México, mediante bioensayos de inhibición micelial de tres aislados de Rhizopus stolonifer. Se observó una curva de dosis efecto de los polvos a las concentraciones de 0.5, 2, 5 y 10 mg/mL en los aislados de Cuautla y San Carlos. Los polvos tuvieron un efecto inhibitorio significativo de 10 a 44%. Los extractos etanólicos y acuosos no tuvieron efecto sobre la inhibición micelial de los tres aislados a las tres dosis probadas. Los extractos acetónicos tuvieron un efecto inhibitorio de 2 a 22%. Los extractos metanólicos tuvieron un efecto inhibitorio significativo a dosis de 5 y 10 mg/mL sobre los aislados de Cuautla (18 y 62%) y San Carlos (14 y 76%), respectivamente. El aislado de Yautepec presentó un mayor efecto a las tres dosis ensayadas con una inhibición del crecimiento micelial de 46 a 94%. El extracto de metanol se sometió a una cromatografía en columna aislándose dos fracciones 8–11 y 12–19, las cuales presentaron una inhibición del crecimiento micelial de 6 a 66% y de 8 a 50%, respectivamente, sobre los tres aislados de R. stolonifer. Estudios preliminares mostraron que estas fracciones corresponden a saponinas esteroidales.
Palabras clave: Biofungicidas, fracciones, actividad biológica, huele de noche.
Abstract
The antifungal effects of leaf powders, extracts, and fractions of Cestrum nocturnum from Morelos state, Mexico, were evaluated on three isolates of Rhizopus stolonifer using mycelial inhibition bioassays. A dose–effect curve at concentrations of 0.5, 2, 5, and 10 mg/mL was observed in isolates from Cuautla and San Carlos. Leaf powders had a significant inhibitory effect from 10 to 44%. Ethanolic and aqueous extracts did not have effect on mycelial inhibition in any of the isolates at the three rates tested. Acetonic extracts had an inhibitory effect from 2 to 22%. Methanolic extracts had a significant inhibitory effect on isolates from Cuautla (18 and 62%) and San Carlos (14 and 76%), respectively, at 5 and 10 mg/mL. The isolate from Yautepec showed a greater effect at the three rates tested with a mycelial inhibition from 46 to 94%. The methanolic extract was subjected to chromatography column, where two fractions 8–11 and 12–19 were isolated; these showed mycelial growth inhibition from 6 to 66% and from 8 to 50%, respectively, on the three isolates of R. stolonifer. A preliminary study showed that these fractions corresponded to steroidal saponins.
Key words: Biofungicides, fractions, biological activity, night blooming jessamine.
El uso de fungicidas sintéticos ha originado perjuicios en los consumidores de frutos y hortalizas tratados con dichas sustancias, porque los residuos persisten en altas concentraciones, tóxicas para el ser humano. La resistencia química que tienen estos compuestos a la degradación ha causado contaminación por su acumulación en suelos, plantas, animales y en el mismo hombre, lo que ocasiona alteraciones en los procesos bioquímicos normales y por lo tanto, graves enfermedades. Debido a todos los inconvenientes que presenta el manejo de compuestos sintéticos, se han desarrollado alternativas naturales, entre las cuales se encuentra el uso de extractos vegetales, con los que se han obtenido resultados prometedores. Además, los extractos vegetales tienen las ventajas de poseer un origen biológico, ser biodegradables y manifestar un mínimo impacto negativo sobre la salud humana y el medio ambiente (Bravo et al., 2000; Montes, 1996; Vázquez et al., 1996). En México existe una gran diversidad de especies botánicas que se emplean comúnmente para el control de enfermedades en humanos; sin embargo, su uso en el control de fitopatógenos es escaso. Entre ellas se encuentra la especie botánica llamada "huele de noche" (Cestrum nocturnum L.), la cual se encuentra ampliamente distribuida en las zonas tropicales y es común en varios estados de la República como Guerrero, Jalisco y Oaxaca (Rwedowsky, 1983). Esta planta además de ser de ornato por su característico aroma, se utiliza en la herbolaria mexicana como antiespasmódico contra erupciones cutáneas y especialmente en tratamientos de epilepsia (Buznego et al., 1997; Martínez, 1994). En el aspecto fitopatológico pocos estudios se han realizado con esta planta; sin embargo, Bravo et al. (2000) reportan que C. nocturnum sobresalió entre 97 especies botánicas por su efecto fungicida sobre Fusarium moniliforme Sheldon. También Hernández–Albíter et al. (2007) mencionan la actividad fungicida de extractos crudos de C. nocturnum contra Colletotrichum gloeosporioides (Penz.) Penz. y Sacc. Igualmente hemos encontrado que polvos y extractos metanólicos de C. nocturnum inhiben el crecimiento micelial y esporulación de Fusarium spp. aislado de ciruela mexicana (Spondias purpurea L.) (datos no publicados). Rhizopus stolonifer (Ehrenb.:Fr.) Vuill. es el agente causal de enfermedades postcosecha de varios frutos y vegetales, es un hongo de crecimiento rápido que se desarrolla en un amplio intervalo de temperaturas y humedades relativas (Nishijima et al., 1990). Para Rhizopus se han reportado 10 diversas especies vegetales con actividad antifúngica. Extractos de semilla de Citrus paradisi Macfad inhibieron el crecimiento micelial en un 87% e inhibieron en un 100% la infección en tomate (Lycopersicon esculentum Mill.) (Gerardo et al., 1995). Extractos acuosos y polvos de hojas de Annona cherimola Mill., A. reticulata L., Bromelia hemisphaerica Lam., Carica papaya L., Citrus limon (L.) N.L. Burm., Pithecellobium dulce (Roxb.) Benth., Crataegus mexicana Moc y Sess y Pouteria sapota Jacques inhibieron en 100% la esporulación de R. stolonifer aislado de ciruela mexicana (Bautista–Baños et al., 2000a, b). Polvo de hojas de Pithecellobium dulce inhibieron en un 80% el crecimiento micelial de R. stolonifer aislado de fresa (Fragaria x ananassa Duch.) y los extractos acuosos de esta especie vegetal inhibieron en un 44% la infección de frutos de fresa (Bautista–Baños et al., 2003). El presente estudio evalúa el efecto antifúngico de polvos, extractos acuosos, etanólicos, metanólicos y acetónicos y fracciones de hojas de C. nocturnum en el desarrollo micelial de tres aislados de R. stolonifer.
MATERIALES Y MÉTODOS
Material vegetal. La colecta de hojas frescas de Cestrum nocturnum se realizó en junio y julio en el campo experimental del Centro de Desarrollo de Productos Bióticos (CEPROBI) del Instituto Politécnico Nacional en San Isidro Yautepec, Morelos, México. En el Laboratorio Fitosanitario del CEPROBI, las hojas fueron seleccionadas desechándose las que presentaron daños mecánicos, enfermas o con plagas. Se desinfectaron con una solución de hipoclorito de sodio al 1% y posteriormente se lavaron con agua destilada. Se secaron con papel secante y se procedió a cortarlas en cuadros de aproximadamente 5 mm. Para la obtención de los polvos, las hojas se secaron al aire y después se molieron finamente y se almacenaron a temperatura ambiente (26°C) en botellas de color ámbar hasta su uso.
Extracción y aislamiento de fracciones metanólicas. Preparación de extractos acuosos, etanólicos, metanólicos y acetónicos. Estos extractos de hojas frescas fueron preparados siguiendo la metodología de Ahmad y Prasad (1995): se pesaron 200 g de cada muestra adicionándoles 1000 mL de cada uno de los disolventes en matraces separados (2:10 p/v), y se dejaron reposar durante 48 h a temperatura ambiente. Luego se filtraron en papel Whatman No. 10, se concentraron en un rotavapor (Buche Waterbath B–480) y se obtuvieron los siguientes rendimientos: extracto acuoso (59.55%), etanólico (48.0%), metanólico (37.15%) y acetónico (20.15%). El extracto metanólico (1 g) fue sometido a una cromatografía en columna (CC) con Sílica Gel 60 (Merck, 100 g) y eluída con una mezcla de cloroformo metanol aumentando la polaridad (9:1, 8:2, 7:3, 6:4, 5:5, 4:6, 3:7, 2:8, 1:9 y 0:10). Se obtuvieron 35 fracciones las cuales fueron analizadas por cromatografía en capa fina (CCF) usando placas de Sílica Gel (Merck, 0.25 mm) y eluídas con cloroformo:metanol (1:9). Las placas fueron evaluadas en luz visible después de asperjarlas con ácido sulfúrico:etanol (1:19) y calentadas sobre una parrilla a 150°C por 1 min. Las fracciones con patrones cromatográficos similares se mezclaron. Se obtuvieron ocho mezclas y la fracción 8–11 produjo un polvo verde oscuro (compuesto 1, Rf = 0.4) y la fracción 12–19 produjo un líquido amarillo (compuesto 2, Rf = 0.3).
Microorganismos. Se realizó el aislamiento de cepas de R. stolonifer a partir de jitomate infectado naturalmente, cosechado en tres sitios diferentes del estado de Morelos: Cuautla (R1), San Carlos (R2) y Yautepec (R3). Los frutos se colocaron en cámara húmeda a 25°C hasta la aparición de los síntomas (cuatro días). Fragmentos de tejido infectado se colocaron en cajas de petri conteniendo el medio de papa–dextrosa–agar (PDA). La caracterización morfológica se realizó considerando la morfología colonial en este medio y la presencia de micelio aéreo no septado, esporangióforos delgados erectos, esporangios globosos, de paredes delgadas, columela prominente y de color blanco cuando son jóvenes y negro al madurar. Las esporangiosporas fueron globosas a ovales o angulares lisas y con estrías longitudinales (Schipper, 1984).
Bioensayo. Los polvos de hojas fueron preparados a cuatro concentraciones (0.5, 2.0, 5.0 y 10.0 mg/mL) y se adicionaron a PDA. Cada uno de los extractos y fracciones metanólicas se adicionaron por separado en medio de crecimiento de PDA para obtener una concentración final de 2, 5 y 10 mg/mL de los extractos, 30 y 50 μg/mL de las fracciones. Todas las mezclas fueron esterilizadas a 15 lb/cm2 a 121°C y vaciadas en cajas de petri (60 x 15 mm). Se usaron seis repeticiones para los polvos y extractos y tres repeticiones para las fracciones. Un disco de agar de 5 mm conteniendo el respectivo patógeno se colocó en el centro de cada caja. Las cajas fueron incubadas en la oscuridad por un día a 25°C y el crecimiento micelial se midió en cm con un vernier. Las placas de Petri testigo contenían únicamente PDA. Todos los bioensayos fueron llevados a cabo por triplicado. El efecto inhibitorio del crecimiento micelial se calculó como sigue: % inhibición = crecimiento micelial del testigo – crecimiento micelial del tratamiento / crecimiento micelial del testigo x 100.
Análisis estadístico. Los tratamientos fueron arreglados en un diseño completamente al azar. Se realizó un análisis de varianza con los datos obtenidos.
RESULTADOS YDISCUSIÓN
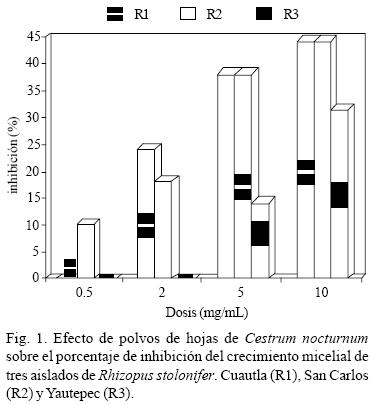
Efecto antifúngico de polvos. Se observó una curva de respuesta dosis–efecto a las tres y cuatro concentraciones sobre R. stolonifer aislado de Cuautla y San Carlos, respectivamente. Para el aislado de Yautepec se tuvo un efecto inhibitorio de 14 a 32% a dosis de 5 y 10 mg/mL. Los polvos de hojas de C. nocturnum tuvieron un efecto inhibitorio significativo de 10 a 44% sobre R. stolonifer (Fig. 1). En este estudio se observó que los aislados de R. stolonifer mostraron diferente susceptibilidad debido probablemente a la diversidad metabólica intrínseca de los diferentes aislados. Estos resultados concuerdan con nuestras observaciones sobre la inhibición que los polvos de C. nocturnum tienen sobre el crecimiento de Fusarium spp. aislado de ciruela mexicana (datos no publicados).
Efecto antifúngico de extractos. Existieron diferencias altamente significativas entre los tratamientos. Los extractos etanólicos y acuosos no tuvieron ningún efecto sobre el crecimiento micelial de los tres aislados a las tres dosis ensayadas. Previamente Bautista–Baños et al. (2003) reportaron que los extractos acuosos y etanólicos de hojas de Pithecellobium dulce no tuvieron efecto sobre la inhibición del crecimiento micelial de R. stolonifer aislado de fresa. El extracto acetónico inhibió el crecimiento micelial de los aislados de Cuautla (6%) y San Carlos (2%) a dosis de 10 mg/mL, y al aislado de Yautepec a dosis de 5 (6%) y 10 mg/mL (22%). Los extractos metanólicos tuvieron un efecto estadísticamente significativo a dosis de 5 y 10 mg/mL sobre los aislados de Cuautla (18 y 62%) y San Carlos (14 y 76%). Para el aislado de Yautepec se observó un mayor efecto a las tres dosis ensayadas presentándose una inhibición del crecimiento micelial de 46 a 94% (Fig. 2). Previamente se ha reportado inhibición del crecimiento micelial de diversos hongos con extractos metanólicos de diferentes especies botánicas. Barrera et al. (2002) reportaron la disminución del crecimiento micelial de Botrytis cinerea Pers.:Fr., C. gloeosporioides y R. stolonifer con extractos metanólicos de semillas de Pithecellobium dulce los cuales contenían diversas saponinas triterpénicas (Barrera–Necha et al., 2003). Gamboa et al. (2003) reportaron inhibición del crecimiento micelial de Rhizoctonia solani Kühn y Phytophthora infestans (Mont.) de Bary con extractos metanólicos de Fluorensia cernua DC. Extractos con metanol de Larrea tridentata (Seesé y Moc. ex D.C.) Coville y Euphorbia eriantha Benth. inhibieron el crecimiento micelial de Aspergillus flavus Link:Fr. y A. parasiticus Speare a dosis de 500 ppm (Vargas–Arispuro et al., 1997). Igualmente, extractos metanólicos de C. nocturnum inhibieron el crecimiento micelial y esporulación de dos cepas de Fusarium spp. aisladas de frutos de papaya (Caricapapaya L.) y ciruela mexicana. El metanol es un disolvente de compuestos polares diversos, como alcaloides, azúcares y saponinas. El extracto de metanol puede contener una mezcla de estos compuestos y es necesario el aislamiento y purificación del compuesto activo biológicamente mediante técnicas de cromatografía en columna y en capa fina (Chang, 1998).
Efecto antifúngico de fracciones. Las ocho subfracciones obtenidas del extracto metanólico sometido a CC fueron probadas con los tres aislados de R. stolonifer. Existieron diferencias altamente significativas entre los valores obtenidos, e inhibieron el crecimiento micelial entre un 4 a 66% a dosis de 30 y 50 μg/mL. El aislado más sensible fue el de Yautepec cuyo crecimiento fue inhibido por cuatro subfracciones a las dosis de 30 y 50 μg/mL (F 8–11 y F 12–19) y a 50 μg/mL (F 20–26 y F 27–35). El aislado de Cuautla fue el menos sensible, sólo dos subfracciones (F 8–11 y F 12–19) inhibieron su crecimiento a las dos dosis. El aislado de San Carlos presentó inhibición del crecimiento micelial con tres subfracciones (F 8–11, F 12–19 y F 20–26). Cuatro fracciones no presentaron efecto sobre el crecimiento micelial de los tres aislados (Fig. 3). En este estudio se observó que las fracciones más polares mostraron mayor inhibición del crecimiento micelial de R. stolonifer (F8–35). Estudios preliminares mostraron que las fracciones 8–11 y 12–19 corresponden a saponinas esteroidales. Se han reportado en la literatura 16 saponinas esteroidales en hojas frescas de C. nocturnum y ocho de ellas presentaron actividad citotóxica sobre células cancerígenas (Mimaki et al., 2001, 2002; Viqar et al., 1991). No hay reportes en la literatura sobre la actividad antifúngica de saponinas esteroidales sobre hongos fitopatógenos.
CONCLUSIONES
Este es el primer estudio sobre la actividad antifúngica de polvos, extractos y fracciones de Cestrum norcturnum. Los polvos, los extractos metanólicos y las fracciones 8–11 y 1219 tuvieron propiedades antifúngicas efectivas. Es necesario realizar mayores investigaciones para determinar el efecto de estos componentes sobre frutos en estudios in situ.
AGRADECIMIENTOS
Este trabajo fue apoyado por la Secretaría de Investigación y Posgrado, el proyecto 20060084 y por la Comisión de Operación y Apoyo a las Actividades Académicas del Instituto Politécnico Nacional.
LITERATURA CITADA
Ahmad, S.K., and Prasad, J.S. 1995. Efficacy of foliar extracts against pre– and postharvest diseases of spongegourd fruits. Letters in Applied Microbiology 21:373–375. [ Links ]
Barrera–Necha, L.L., Bautista–Baños, S., Jiménez–Estrada, M., and Reyes–Chilpa, R. 2002. Influence of leaf, fruit and seed powders and extracts of Pithecellobium dulce (Roxb.) Benth (Fabaceae) on the in vitro vegetative growth of seven postharvest fungi. Revista Mexicana de Fitopatología 20:66–71. [ Links ]
Barrera–Necha, L.L., Bautista–Baños, S., Bravo–Luna, L., Bermúdez–Torres, K., García–Suárez, F.J., Jiménez–Estrada, M., and Reyes–Chilpa, R. 2003. Antifungal activity against postharvest fungi by extracts and compounds of Pithecellobium dulce seeds (Huamúchil). ISHS Acta Horticulturae 628:761–766. [ Links ]
Bautista–Baños, S., García–Domínguez, E., Barrera–Necha, L.L., Reyes–Chilpa, R., and Wilson, C.L. 2003. Seasonal evaluation of the postharvest fungicidal activity of powders and extracts of huamuchil (Pithecellobium dulce) action against Botrytis cinerea, Penicillium digitatum and Rhizopus stolonifer of strawberry fruit. Postharvest Biology and Technology 29:81–92. [ Links ]
Bautista–Baños, S., Hernández–López, M., and Barrera–Necha, L.L. 2000a. Antifungal screening of plants of the state of Morelos, Mexico, against four postharvest pathogens of fruits and vegetables. Revista Mexicana de Fitopatología 18:36–41. [ Links ]
Bautista–Baños, S., Hernández–López, M., Díaz–Pérez, J.C., and Cano–Ochoa, C.F. 2000b. Evaluation of the fungicidal properties of plant extracts of ciruela fruit (Spondias purpurea L.) during storage. Postharvest Biology and Technology 20:99–106. [ Links ]
Bravo, L.L., Bermúdez, T.K. y Montes, B.R. 2000. Inhibición de Fusarium moniliforme mediante polvos vegetales y algunos de sus componentes químicos. Manejo Integrado de Plagas 57:29–34. [ Links ]
Buznego, R.M.T., León, A.N., Acevedo, G.M., Llanio, V.M., Fernández, P.M.D. y Pérez Saad, H. 1997. Perfil neurofarmacológico de Cestrum nocturnum L. (galán de noche). Revista Cubana Planta Medica 2:30–34. [ Links ]
Chang, R. 1998. Chemistry. 6th ed. McGraw–Hill. New York, USA. 734 p. [ Links ]
Gamboa–Alvarado, R., Hernández–Castillo, F.D., Guerrero–Rodríguez, E., Sánchez–Arizpe, A. y Lira–Saldívar, R.H. 2003. Inhibición del crecimiento micelial de Rhizoctonia solani Kühn y Phytophthora infestans Mont. (de Bary) con extractos vegetales metanólicos de Hojasén (Flourensia cernua DC), Mejorana (Origanum majorana L.) y Trompetilla (Bouvardia ternifolia Ca. Schlecht). Revista Mexicana de Fitopatología 21:13–18. [ Links ]
Gerardo, A.M., Apodaca, M.A. y Quintero, J.A. 1995. Control de patógenos del tomate en postcosecha con extracto de semilla de toronja. Memoria del XXII Congreso de la Sociedad Mexicana de Fitopatología. Guadalajara, Jalisco, México. Resumen, p. 87. [ Links ]
Hernández–Albíter, R.C., Barrera–Necha, L.L., Bautista–Baños, S., and Bravo–Luna, L. 2007. Antifungal potential of crude plant extracts on conidial germination of two isolates of Colletotrichum gloeosporioides (Penz.) Penz. and Sacc. Revista Mexicana de Fitopatología 25:180–185. [ Links ]
Martínez, M. 1994. Catálogo de Nombres Vulgares y Científicos de Plantas Mexicanas. Fondo de Cultura Económica. Tercera reimpresión. México, D.F. 1247 p. [ Links ]
Mimaki, Y., Watanabe, K., Ando, Y., Sakuma, C., Sashida, Y., Furuya, S., and Sakagami, H. 2001. Flavonol glycosides and steroidal saponins from the leaves of Cestrum nocturnum and their cytotoxicity. Journal of Natural Products 64:17–22. [ Links ]
Mimaki, Y., Watanabe, K., Sakagami, H., and Sashida, Y 2002. Steroidal glycosides from the leaves of Cestrum nocturnum. Journal of Natural Products 65:1863–1868. [ Links ]
Montes, B.R. 1996. Productos naturales de origen vegetal para el combate de fitopatógenos. Revista Mexicana de Fitopatología 14:9–14. [ Links ]
Nishijima, W.T., Ebersole, S., and Fernandez, J.A. 1990. Factors influencing development of postharvest incidence of Rhizopus soft rot of papaya. Acta Horticulturae 269:495–502. [ Links ]
Rwedowski, J. 1983. Vegetación de México. Editorial Limusa. México, D.F. 432 p. [ Links ]
Schipper, M.A. 1984. A Revision of the Genus Rhizopus. Studies in Mycology. Serie No. 25. Centraalbureau voor Schimmelcultures. Baarn, The Netherlands. 34 p. [ Links ]
Vargas–Arispuro, I., Araujo–Bernal, S., Martínez–Téllez, M.A. y Ortega–Niebla, M. 1997. Efecto de extractos de plantas sobre el crecimiento y producción de aflatoxinas de Aspergillus flavus y Aspergillus parasiticus. Revista Mexicana de Fitopatología 15:91–95. [ Links ]
Vázquez, M.M., Rodríguez, G.R. y Silva, G.J. 1996. Efecto de extractos de plantas sobre el crecimiento de hongos patógenos de la raíz. Memorias del XXIII Congreso de la Sociedad Mexicana de Fitopatología. Guadalajara, Jalisco, México. Resumen, p. 44. [ Links ]
Viqar, U.A., Fehmida, T.B., Iqbal, F., and Roshan, A. 1991. A spirostanol glycoside from Cestrum nocturnum. Phytochemistry 30:3057–3061. [ Links ]














