Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta zoológica mexicana
versión On-line ISSN 2448-8445versión impresa ISSN 0065-1737
Acta Zool. Mex vol.28 no.1 Xalapa abr. 2012
Artículos originales
Diversidad de Scarabaeoidea (Coleoptera) en las principales condiciones de hábitat de Montebello, Chiapas, México
Diversity of scarab beetles (Coleoptera) in the main habitat conditions of Montebello, Chiapas, Mexico
Juan Manuel DELGADO,1 Adriana Elena CASTRO–RAMÍREZ,1 Miguel Ángel MORÓN2 & Lorena RUIZ–MONTOYA1
1 El Colegio de La Frontera Sur (ECOSUR). Carretera Panamericana y Periférico Sur s/n. San Cristóbal de Las Casas, Chiapas, 29290 México.<joanmanuelds@gmail.com>; <acastro@ecosur.mx>.
2 Instituto de Ecología, A.C. A. P. 63 Xalapa, Veracruz, México.
Recibido: 20/06/2011;
aceptado: 17/01/2012.
RESUMEN
El Parque Nacional Lagunas de Montebello, Chiapas, se considera una zona de importancia para la conservación de la biodiversidad en México, por lo cual se estudió la diversidad de Scarabaeoidea en las principales condiciones de hábitat del parque: mesófilo de montaña (BMM), pino–encino–liquidámbar (BPEL) y pino (BP), durante febrero a agosto de 2010. Los escarabajos se obtuvieron mediante el uso de 27 carpotrampas cebadas con plátano fermentado (Musa paradisiaca), nueve coprotrampas cebadas con excremento humano, 27 necrotrampas cebadas con carne de calamar, tres trampas de luz fluorescente blanca, tres trampas de luz negra, así como la captura directa de escarabajos. Se obtuvieron un total de 67 especies pertenecientes a tres familias y 31 géneros. El tipo de vegetación con mayor riqueza fue el BMM con 46 especies, seguido del BPEL y el BP con 41 y 35 especies respectivamente. No obstante, el exponencial del índice de Shannon–Wiener obtuvo su valor más alto en el BP registrando 10.91 especies. La ecuación de Clench y el modelo de Dependencia Lineal estimaron una eficiencia de captura del 68% y 94% respectivamente. La diversidad beta se calculó mediante los coeficientes de similitud de Jaccard y Complementariedad. Se registró la mayor similitud entre las faunas del BPEL y BMM (0.49), mientras que la mayor disimilitud se presentó en la relación BMM–BP (0.62). Las correlaciones de Spearman demostraron la influencia de la precipitación en la riqueza de especies en todos los tipos de vegetación: BMM (Rho = 0.73; p = 0.007), BPEL (Rho = 0.67; p = 0.018) y BP (Rho = 0.68; p = 0.015), mientras que la abundancia de organismos se correlacionó significativamente con la precipitación en el BMM (Rho = 0.61; p = 0.035). Es de importancia la conservación de zonas como el Parque Nacional Lagunas de Montebello, el cual presenta un gradiente de diferentes tipos de bosques y un aumento en la intensidad de actividades antrópicas durante los últimos años, incluso en las zonas sujetas a preservación, posiblemente afectando a las especies con especificidad de hábitat.
Palabras clave: Escarabajos, Lamellicornia, bosque mesófilo de montaña, bosque pino–encino–liquidámbar, riqueza, precipitación.
ABSTRACT
Lagunas de Montebello National Park in Chiapas, is considered an important area for biodiversity conservation in Mexico, so we was studied the fauna of Scarabaeoidea in the main habitat conditions: montane rain (MRF), pine–oak–sweetgum (POSF) and pine (PF), during February to Au–gust 2010. The beetles was obtained using 27 traps baited with ferments of banana (Musa paradisiaca), nine pitfall traps baited with human feces, 27 pitfall traps baited with squid meat, three white fluorescent light traps, three black light traps and the direct capture of individuals. We obtained a total of 67 species belonging to three families and 31 genera. The type of vegetation richer was MRF with 46 species, followed by POSF and PF with 41 and 35 species respectively. However, the exponential of the Shan–non–Wiener index obtained its highest value in the PF recording 10.91 species. Clench's equation and the linear dependence model estimated a capture effort of 68% and 94% respectively. The estimation of beta diversity was calculated using Jaccard's Coefficient and Complementarity. We was recorded the biggest similarity between the faunas of POSF and MRF (0.49), while the highest dissimilarity was presented at the MRF–PF ratio (0.62). The influence of precipitation was determined with Spearman correlations, being significant with the species richness of the MRF (Rho = 0.73; p = 0.007), POSF (Rho = 0.67; p = 0.018) y PF (Rho = 0.68; p = 0.015), while the abundance was significantly correlated with precipitation in the MRF (Rho = 0.61, p = 0.035). It is important conservation areas such as the Lagunas de Montebello National Park, which has a different forest types and an increase in the intensity of human activities in recent years, even in areas subject to preservation possibly affecting species with habitat specificity.
Keywords: Beetles, Lamellicornia, montane rain forest, pine–oak–sweetgum forest, richness, precipitation.
INTRODUCCIÓN
Chiapas es uno de los estados mejor conocidos en cuanto a su fauna de Scarabaeoidea (Morón et al. 1985, Thomas 1993, Morón–Ríos & Morón 2001, Pacheco–Flores et al. 2008), considerándose la entidad que registra la mayor riqueza de especies (455) de esta superfamilia en México (Morón 2003a). No obstante, a pesar del estudio intensivo que se ha llevado a cabo durante los últimos años, aún se desconoce mucho de la diversidad de Scarabaeoidea en Chiapas, como lo demuestran los frecuentes nuevos registros para la entidad, el país o, en su caso, el hallazgo de nuevas especies (Micó et al. 2006, Navarrete–Gutiérrez & Halffter 2008, Halffter & Halffter 2009). Esto se debe a que aún existen regiones con climas característicos y tipos de vegetación pobremente muestreados que ameritan ser exploradas.
En diferentes estudios se ha observado que el tipo de vegetación influye directamente en la riqueza de Scarabaeoidea, de tal forma que existe un gradiente de mayor a menor riqueza del bosque mesófilo de montaña al bosque de pino (Delgado & Márquez 2006, Morón 1981, Morón 1994, Morón–Ríos & Morón 2001, Morón & Zaragoza 1976, Muñoz–Hernández et al. 2008, Reyes–Castillo 2000). Por otra parte, la precipitación y temperatura varían de acuerdo al tipo de vegetación cuyos rangos se consideran determinantes en la diversidad de Scarabaeoidea, observándose mayor abundancia y riqueza de especies durante los meses con lluvia intensa y temperatura media mensual alta (Morón 1981, Morón & Deloya 1991, Morón–Ríos & Morón 2001, Rzedowski 2006).
La diversidad de insectos en Montebello es escasamente conocida, ya que mientras para mamíferos y aves se tienen inventarios completos (Horváth et al. 2001, Rangel–Salazar et al. 2009), para Scarabaeoidea se registra una lista preliminar de 65 especies, basada en esfuerzo de captura insuficiente, esporádico y enfocado en las familias Melolonthidae y Passalidae (CONANP 2007).
Considerando que Montebello es una de las 152 zonas terrestres prioritarias en México (CONABIO 2000) con un valor alto para su conservación (CONABIO–RTP–137 El Momón–Montebello) y que incluye una variedad de ecosistemas como es el bosque mesófilo de montaña, el cual presenta el mayor número de especies endémicas de Scarabaeidae en Chiapas (Thomas 1993), resultó trascendental el estudio de Scarabaeoidea en ésta zona. La presente investigación tuvo los propósitos de determinar la diversidad alfa y beta de Scarabaeoidea en los bosques de pino (BP), pino–encino–liquidámbar (BPEL) y mesófilo de montaña (BMM) de la zona de Montebello, los cuales muestran un marcado gradiente de conservación y antropización, así como evaluar la influencia de la precipitación en la diversidad de Scarabaeoidea registrada en estos tipos de bosques.
MATERIAL Y MÉTODOS
Área de estudio. El Parque Nacional Lagunas de Montebello (PNLM) se localiza en la región sur–sureste del estado de Chiapas, en la frontera con Guatemala (16°04'30"–16°09'45" N y 91°38'04"–91°43'00" O), a una altitud promedio de 1500 m (CONANP 2007, Fig. 1). El clima es templado con lluvias todo el año C(fm), con temperatura media mensual de 23.6 °C y precipitación total anual de 1862 mm, distribuida en dos períodos bien definidos, uno de alta humedad y otro de relativasequía (CONANP 2007, García 1981).
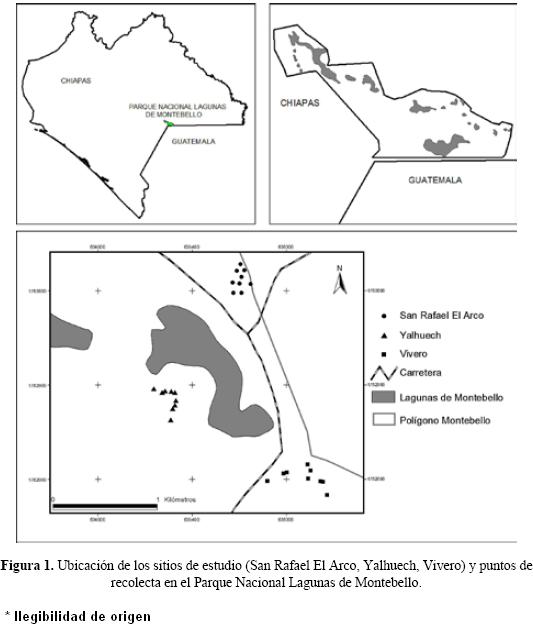
Los principales tipos de vegetación que se reconocen son el bosque mesófilo de montaña (BMM), bosque de pino–encino–liquidámbar (BPEL) y bosque de pino (BP). El primero se restringe a áreas con topografía abrupta y laderas protegidas a la exposición solar directa, predominando Malmea sp, y Parathesis bellizensis en el estrato arbóreo y Podocarpus matudai en el estrato arbustivo. El BPEL se considera una fase secundaria de la sucesión del bosque mesófilo donde se registran Quercus laurina y Clethra suaveolens mientras que Calliandra houstoniana, Pallicourea pasiflora y Miconia mexicana predominan en el estrato arbustivo. El BP es una comunidad con gran parte de sus especies asociadas a sitios muy perturbados y adaptadas a condiciones extremas de temperatura y radiación solar, registrándose C. suaveolens y Pinus oocarpa en el estrato arbóreo y Verbesina apleura y Eupatorium semialatum en el estrato arbustivo (Carlson 1954, Zarco–Mendoza 2000, CONANP 2007).
Captura de escarabajos. Se establecieron tres sitios de estudio cada uno representando un tipo de hábitat con actividades antrópicas, ya que de acuerdo a Rangel–Salazar et al. (2009), en estos sitios se realiza quema, ocoteo, extracción de madera, ganadería y cacería en distinta escala.
La zona de Vivero presentó altitudes de 1495 a 1575 m y BPEL como vegetación principal, mientras que Yalhuech incluyó al BP en altitudes de 1482 a 1498 m.
Finalmente, en San Rafael El Arco se registró BMM en altitudes de 1459 a 1495 m. Rangel–Salazar et al. (2009), señalan que en San Rafael El Arco únicamente se practica cacería a ligera escala. No obstante en Vivero, el ocoteo, la extracción de madera y la cacería se realizan de forma intensa, mientras que en Yalhuech aunado a estas últimas actividades se efectúa la quema intencional de zonas de bosque para la ganadería. El trabajo de campo comprendió las temporadas de secas (febrero–abril) y lluvias (mayo–agosto) en 2010. En cada sitio se instaló un pluviómetro efectuándose sus lecturas cada 15 días. Se realizaron dos recolectas de escarabajos al mes, con duración de seis días cada una, efectuando muestreos por dos días consecutivos en cada sitio de estudio. Se colocaron tres coprotrampas temporales cebadas con excremento humano y separación de 330 m; nueve necrotrampas permanentes (NTP–80) cebadas con carne de calamar y nueve carpotrampascebadas con plátano fermentado (Musa paradisiaca) separadas por 110 m entre ellas (Deloya et al. 2007, Morón & Terrón 1984, 1988). A lo largo del trayecto entre trampas (1000 m) se recolectó en troncos derribados, debajo de excrementos y cadáveres, en follaje y flores de arbustos y árboles, así como en acumulaciones de restos vegetales. Asimismo, en cada sitio se instaló una trampa de luz blanca fluorescente (febrero–agosto) y una trampa de luz negra (mayo–agosto) tipo pantalla de 40 watts de potencia, manteniéndose activas durante dos horas a partir del crepúsculo y estando en actividad en dos sesiones de dos días/ mes por sitio. Los ejemplares capturados se procesaron con las técnicas propuestas por Morón & Terrón (1988), y fueron debidamente etiquetados e identificados para su incorporación en las colecciones entomológicas de El Colegio de la Frontera Sur (ECOSUR–SC–E) y del Instituto de Ecología, Xalapa (IEXA). La identificación se basó en la clasificación supragenérica de Endrödi (1966), Morón (2003a), Morón et al. (1997) y Reyes–Castillo (2003).
Análisis de datos. Se realizaron curvas de dominancia/diversidad o Whittaker plots, mediante log10 de la proporción de individuos de cada una de las especies, con la finalidad de conocer la distribución en términos de abundancia que siguen las especies dominantes en las comunidades estudiadas (Magurran 2004). Se estimó la diversidad alfa para cada comunidad (tipo de vegetación) mediante el uso de la riqueza específica y el exponencial del índice de Shannon–Wiener (eH') (Moreno 2001). La estimación de la eficiencia de captura y predicción de riqueza total se realizó por tipo de vegetación y familia taxonómica mediante curvas de acumulación de especies, utilizando como esfuerzo el número de días de recolecta. Las curvas de acumulación fueron realizadas con el software EstimateS versión 8.0, previa aleatorización de los datos 100 veces para después realizar el ajuste de datos a los modelos de Dependencia Lineal y de Clench mediante el procedimiento de regresión no lineal (Colwell 2006, Moreno 2001, StatSoft 2004, Soberón & Llorente–Bousquets 1993). Asimismo, se determinó la confiabilidad de las estimaciones realizadas para estos modelos mediante el cálculo de las pendientes de las curvas de acumulación y los coeficientes de determinación (R2) (Jiménez–Valverde & Hortal 2003). Estos coeficientes describen la proporción de varianza explicada por la función, de tal manera que cuanto más cercano a 1, es mejor el ajuste de los datos (Zar 2010).
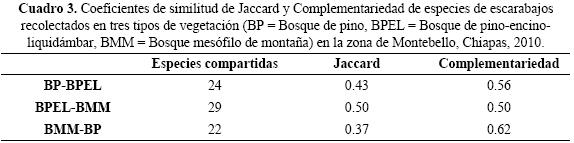
Se calcularon los métodos no paramétricos para la estimación de la riqueza de especies Jackknife1 y Bootstrap, así como el número de singletons y doubletons (especies representadas por solo uno y dos individuos, respectivamente), especies únicas (especies representadas en solo una muestra) y duplicadas (especies representadas en exactamente dos muestras) (Colwell & Coddington 1994, Moreno 2001). La diversidad beta se calculó mediante los coeficientes de similitud de Jaccard (Ij) y Complementariedad (CAB) (Colwell & Coddington 1994, Moreno 2001). Se realizó un análisis de varianza (ANOVA) mediante el programa SPSS para Windows (SPSS, 2006), utilizando la abundancia de especies como variable respuesta y los tipos de vegetación como variable categórica. Se realizaron correlaciones de Spearman con la finalidad de analizar la relación de la abundancia y riqueza de Scarabaeoidea con la precipitación de cada sitio (Zar 2010).
RESULTADOS
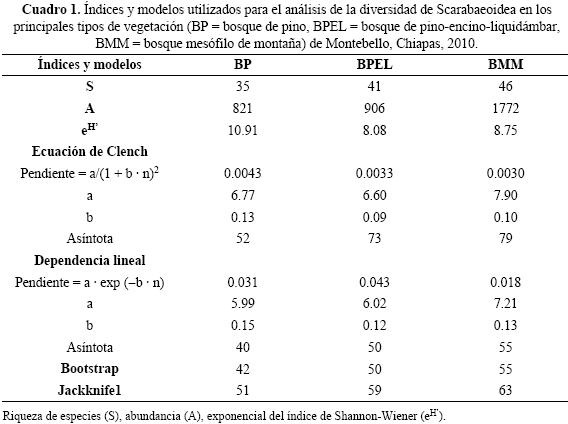
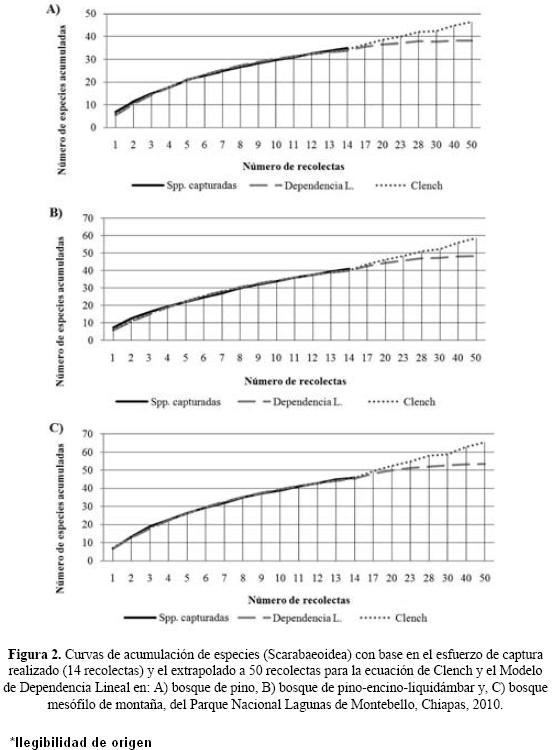
Eficiencia del muestreo. El modelo de Clench indicó una efectividad menor al 67%, mientras que para el modelo de Dependencia Lineal esta fue superior al 79% en los diferentes sitios de estudio. La menor estimación para el modelo de Clench se registró en el BPEL con el 56%, mientras que para el modelo de Dependencia Lineal esta se obtuvo en el BMM con el 79% de las especies estimadas. Por otra parte, las mayores estimaciones se registraron en BP con el 67% y 87% de eficiencia de acuerdo a los modelos de Clench y Dependencia lineal, respectivamente. En cuanto a los modelos no paramétricos, Bootstrap indicó la captura del 83% de las especies estimadas para el BP y BMM, mientras que Jackknife1 señaló la mayor eficiencia en el BMM (73%). Las pendientes estimadas para el modelo de Clench fueron mayores con respecto a las obtenidas en el modelo de Dependencia Lineal. Asimismo, el BMM registró pendientes menores en comparación al BPEL y BP (Cuadro 1, Fig. 2). En cuanto a los coeficientes de determinación (R2), estos registraron un valor de 0.99 en los tres tipos de vegetación.
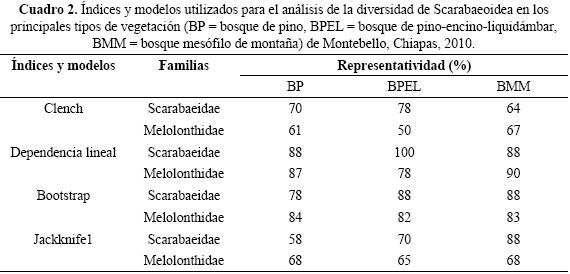
Las estimaciones de eficiencia de muestreo por familia taxonómica varió de acuerdo al modelo empleado. Dependencia Lineal y Bootstrap en general indicaron mayor eficiencia de muestreo y alta representatividad de Scarabaeidae principalmente en BPEL y BMM. Por otra parte, las estimaciones del modelo de Clench señalaron mayor efectividad en la captura de Scarabaeidae mientras que Jackknife 1 señaló mejor representatividad para Melolonthidae. En el caso de Passalidae su reducido número de capturas impidió realizar estimaciones de representatividad (Cuadro 2).
Diversidad alfa. Se capturaron 3499 especímenes de Scarabaeoidea que representan a 67 especies, pertenecientes a tres familias, 10 subfamilias y 34 géneros. Se recolectaron 2657 individuos de Melolonthidae que se distribuyen en 21 géneros y 50 especies. Scarabaeidae obtuvo 837 ejemplares de seis géneros y 13 especies, mientras que Passalidae registró cinco individuos de tres géneros y cuatro especies. Los géneros con mayor riqueza fueron Phyllophaga (16) y Cyclocephala (6), pertenecientes a Melolonthidae. El método de captura con mayor abundancia de individuos fue la trampa de luz blanca y la trampa de luz negra con el 56% y 35% de la captura total, respectivamente, mientras que la riqueza fue de 34 especies para cada tipo de luz (Anexo 1).
La mayor riqueza y abundancia de especies se registró en el BMM con 46 especies y 1772 individuos. Las especies con mayor abundancia en este tipo de vegetación fueron Phyllophaga rugipennis (754), Paranomala cupricollis (237) y Xyloryctes lobicollis (158). El BPEL registró 41 especies y 906 individuos de Scarabaeoidea, de las cuales las más abundantes fueron Onthophagus rhinolophus (357), Diplotaxis hirsuta (202) y Diplotaxis simplex (96). La menor abundancia y riqueza se obtuvo en el BP con 35 especies y 821 individuos registrando a Onthophagus rhinolophus (245), Phyllophaga tenuipilis (102) y Diplotaxis hirsuta (85) como las especies más abundantes (Anexo 1). En general, las curvas de dominancia/diversidad (Whittaker Plots, Magurran 2004), presentaron semejanzas en cuanto al registro de pocas especies abundantes y un mayor número de especies raras. Las curvas del BPEL y BMM, señalaron un patrón con similares números de especies acumuladas, mientras que la curva obtenida para el BP registró riquezas y abundancias menores desde los intervalos iniciales. No obstante, el BPEL y BP señalaron dominancia de O. rhinolophusy abundancias semejantes para D. hirsuta (D.HIR) y D. simplex (D.SIM) (Fig. 3). Las estimaciones más altas del exponencial de Shannon–Wiener se obtuvieron en el BP con 10.91 especies, mientras que el BPEL y BMM registraron estimaciones similares (Cuadro 1). La comparación estadística mediante ANOVA no halló diferencias significativas en la abundancia entre tipos de vegetación (F = 0.40; p = 0.60).
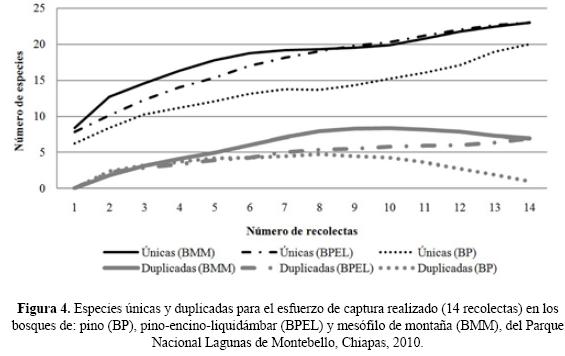
Diversidad beta. Las comunidades de escarabajos con mayor similitud (índice de Jaccard) correspondieron a la relación BPEL–BMM, lo cual indica que casi el 50% de la composición de especies es la misma entre estos dos hábitats, mientras que la mayor disimilitud (Complementariedad) se registró en la relación BMM–BP con el 62% (Cuadro 3). En cuanto a la rareza de las especies se registró el mayor número de singletons en el BMM (15), y el mayor número de doubletons en BMM y BPEL (6). De la misma forma las especies únicas (23) y duplicadas (7) presentaron su máxima abundancia en el BMM y BPEL. Para el BMM y BP se observó una disminución en el número de especies duplicadas, mientras que las especies únicas en los tres tipos de vegetación se incrementaron (Fig. 4).
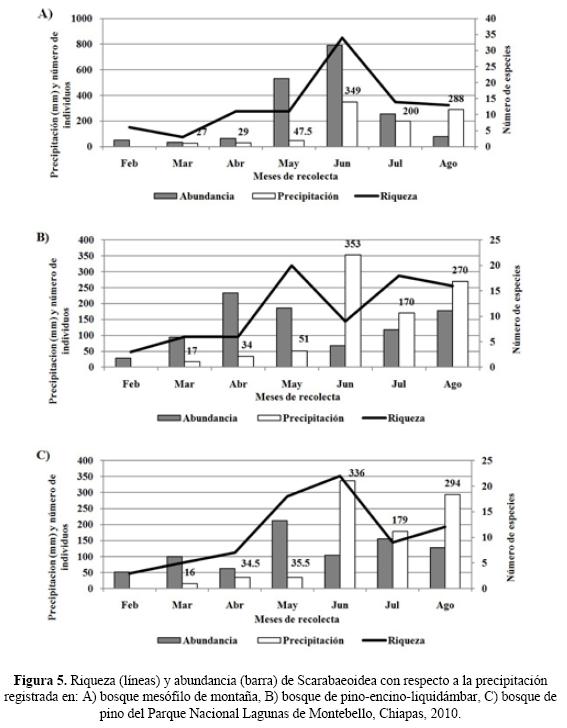
Fenología y precipitación. El registro más alto de precipitaciones totales se obtuvo en el BMM (965.5 mm), seguido del BPEL (935 mm) y BP (925 mm). Para los tres tipos de vegetación tanto la menor como la mayor precipitación total mensual se presentaron en marzo y junio, respectivamente. En el BMM las mayores abundancias y riquezas de especies se registraron en sincronía con las precipitaciones mensuales más altas, de tal manera que en junio se capturó a 790 individuos de 34 especies (Fig. 5A). En el BPEL, las mayores abundancias se registraron en abril (233), mientras que la mayor riqueza se obtuvo en mayo (20) (Fig. 5B). En el BP, las mayores abundancias de Scarabaeoidea se presentaron en mayo (212) y los mayores números de especies en junio (22) (Fig. 5C). La precipitación se correlacionó significativamente con la abundancia de organismos registrada en el BMM (Rho = 0.61; p = 0.035), mientras que la riqueza de Scarabaeoidea presentó significancia estadística (p < 0.05) para los tres tipos de vegetación (Cuadro 4).

DISCUSIÓN
Diversidad y abundancia. Los coeficientes de determinación obtenidos demostraron un buen ajuste de los datos a los modelos utilizados, mientras que las pendientes calculadas (<0.1) indicaron un inventario suficientemente fiable (Jiménez–Valverde & Hortal 2003, Zar 2010). Con base en los resultados se puede señalar que la riqueza de Scarabaeoidea en BMM de Montebello se encuentra entre las 55 y 63 especies, mientras que para el BPEL es de 50 a 59 especies y para el BP entre 40 y 42 especies.
A pesar de la frecuente variación en el esfuerzo de muestreo realizado en estudios faunísticos las estimaciones registradas se corresponden con las obtenidas en comunidades similares en otras entidades del país. En el caso del BMM las especies obtenidas en este tipo de vegetación superan las 43 especies registradas por Morón (1994) en Hidalgo, así como las 33 especies señaladas por Deloya (2006) y Deloya et al. (2007) en Veracruz, a pesar de que en estos el trabajo de campo fue anual. Asimismo, la riqueza de Melolonthidae en este tipo de vegetación (168 h/trampa de luz) supera a las 25 especies (156 h/trampa de luz) registradas por López–Vieyra & Rivera–Cervantes (1998) y a las 40 especies (165 h/trampa de luz) señaladas por Morón–Ríos & Morón (2001) en BMM de Jalisco y Chiapas, respectivamente. En cuanto al BPEL, el inventario obtenido es menor al registrado por Muñoz–Hernández et al. (2008) en Teziutlán (Puebla), donde se registraron 59 especies durante un periodo fenológico de 15 meses. En este tipo de vegetación con un esfuerzo de 168 h/trampa se capturó a 38 especies de Melolonthidae, mientras que en Teziutlán mediante un esfuerzo menor (140 h/trampa) se obtuvieron 46 especies de esta familia.
La riqueza de Scarabaeoidea obtenida en BP de Montebello fue consistente con la registrada en localidades del Puebla y Tlaxcala donde se obtuvo la captura de 23 a 42 especies en un periodo fenológico anual (Morón & Zaragoza 1976, Percino 2002, Chacón 2005, García 2006, Salamanca 2006, Delgado 2007). En el caso de la riqueza de Melolonthidae en este tipo de vegetación se capturaron 27 especies en Montebello mediante un esfuerzo de 168 h/trampa mientras que en los estudios de Puebla y Tlaxcala se registraron 18 a 28 especies utilizando un esfuerzo de capturas de 102 a 144 h/trampa de luz. Con los datos antes señalados se puede observar la importancia del ciclo de vida de Melolonthidae, de tal manera que su inventario debe incluir un esfuerzo de captura representativo así como considerar el aspecto fenológico de las especies con la finalidad de evitar la exclusión de especies con emergencia efímera.
La mayor abundancia registrada de Scarabaeoidea mediante trampa de luz blancaes explicada debido al mayor esfuerzo de muestreo de este método. No obstante, se registraron especies atraídas exclusivamente por luz blanca o negra, por lo cual se consideran métodos complementarios para obtener inventarios representativos de la fauna de escarabajos nocturnos (Morón & Terrón 1988).
A pesar de las riquezas semejantes de Scarabaeoidea entre comunidades, el exponencial del índice de Shannon–Wiener indicó diferencias entre los diferentes tipos de vegetación, lo cual se debió a diferencias en la abundancia proporcional de las especies. De tal forma, que aunque el BP fue la comunidad con menor riqueza, esta registró la mayor diversidad ecológica indicando ser más equitativa en la abundancia de sus especies, ya que únicamente Onthophagus rhinolophus registró más de 200 individuos, mientras que en BPEL y BMM al menos dos especies superaron esa abundancia y otras más alcanzaron abundancias proporcionales altas. Por lo anterior es importante considerar la abundancia relativa de cada especie, ya que mediante el cálculo de índices se pueden observar cambios en el número de especies, en la distribución de la abundancia de estas o en su dominancia (Magurran 1988). Los resultados obtenidos demostraron una tendencia de incremento de riqueza de especies de Scarabaeoidea del BP hacia el BMM. Esta riqueza de escarabajos fue coincidente con la de especies vegetales en la zona de estudio ya que, de acuerdo a Zarco–Mendoza (2000), en ese BMM se registraron 69 especies vegetales, mientras que en BPEL y BP se obtuvieron 43 y 23 especies, respectivamente. Los resultados obtenidos indican un alto porcentaje de especies registradas tanto en sitios con evidente deterioro como en zonas con mayor conservación, tal es el caso del BMM. No obstante, de esta aparente similitud entre la riqueza de hábitats, un 21% de las especies se registró exclusivamente en BMM, lo cual demuestra la importancia de este tipo de vegetación para las poblaciones de Scarabaeoidea en Montebello. Por otra parte, la mayor similitud se registró en las zonas mejor conservadas (BPEL–BMM), lo cual coincide con Thomas (1993), quien señala una similitud del 39% entre la fauna de Scarabaeoidea registrada en "cloud forest" (considerado en este estudio como BMM) y la de bosques con predominancia de pino y encino, siendo el caso del BPEL.
Aunado a la importancia de la composición vegetal para las especies de Scarabaeoidea, se suma el deterioro de sus hábitats, el cual es evidente en el aumento de áreas abiertas o con claros bien diferenciados en BP y en menor proporción en BPEL. Esta degradación puede influir en los tamaños poblacionales de algunas especies, especialmente las oportunistas o las que se ven favorecidas por ambientes abiertos. Una de estas especies es O. rhinolophus cuya mayor abundancia se registró en BPEL y es una especie que se puede encontrar en terreros abiertos de la selva (Deloya et al. 2007, Halffter & Matthews 1966). En zonas tropicales se ha documentado que la reducción en la cobertura arbórea tiene un fuerte efecto en la riqueza de Scarabaeinae (especies estenotópicas) ya que disminuye la riqueza y abundancia de escarabajos y, por otra parte, incentiva la dominancia de solo algunas especies más tolerantes a esos cambios (Halffter & Arellano 2002, Morón 1987, Nestel et al. 1993). En el mismo sentido, estudios como el de Deloya et al. (2007), indican menores riquezas en pastizales con respecto a hábitats donde la cobertura arbórea es mayor, tal es el caso de cafetales asociados a BMM.
De igual forma para los Melolonthidae, factores como la cobertura arbórea y herbácea, condicionan la riqueza de especies por tratarse en su mayoría de especies rizófagas y saprófagas, observándose un incremento de estas especies conforme la estructura vegetal se hace más compleja (Deloya & Ordónez–Resendiz 2008, Magaña–Cuevas & Rivera–Cervantes 1998, Morón 2006).
Es de vital importancia disminuir el deterioro de estos bosques ya que aunado a las ventajas de mantener un ecosistema saludable (con representación de los diferentes tipos de vegetación, alta riqueza y roles ecológicos distintos), se suman la disminución de invasiones por especies exóticas, así como la mayor estabilización en respuesta a los disturbios y variación en las condiciones abióticas (Halffter & Moreno 2005, Hooper et al. 2005).
Ecología. El género Phyllophaga fue el de mayor riqueza en los tres tipos de vegetación y el de mayor abundancia para el BP y BMM. Esta mayor representación de Phyllophaga ha sido constatada en otros estudios realizados en bosques de pino, pino–encino, pino–encino–liquidámbar y mesófilo de montaña de Jalisco, Hidalgo, Chiapas y Puebla (López–Vieyra & Rivera–Cervantes 1998, Magaña–Cuevas & Rivera–Cervantes 1998, Morón 1994, Morón–Ríos & Morón 2001, Muñoz–Hernández et al. 2008). La alta abundancia de P. rugipennis (24.9% de la captura total), es posible que se deba a su preferencia por sitios con alta humedad ya que es una especie que habita laderas de montañas con alta precipitación y neblina frecuente (Morón 2003b), registrándose una disminución en su abundancia en años con escasa precipitación (Castro–Ramírez et al. 2005).Asimismo es posible que la densidad poblacional de P. rugipennis esté influida por el hecho de que sus larvas no son estrictamente rizófagas, ya que de acuerdo a Morón (2003b), éstas se alimentan principalmente de materia orgánica del suelo, por lo cual disponen de abundantes recursos en la zona. Por otra parte, la especie más abundante entre los Scarabaeidae fue O. rhinolophus equivalente al 21% de la captura total. La alta abundancia de esta especie, es semejante a la reportada por Deloya et al. (2007) en Veracruz, donde alcanzó el 20% en ambientes con similar estado de conservación a los del presente estudio. En el mismo estudio se señala que O. rhinolophus presentó la mayor abundancia en sitios con cobertura vegetal intermedia, lo cual coincide con lo obtenido en el presente estudio ya que en BPEL se capturó el 49% de su abundancia total. En el caso de Passalidae los escasos ejemplares capturados no permitieron señalar la dominancia de ninguna especie, ya que se examinó un escaso número de troncos. No obstante, en la lista preliminar de especies elaborada en 1996 para el Programa de Conservación y Manejo del PNLM, se registran 14 especies de Passalidae (CONANP 2007), de las cuales sólo Odontotaenius striatopunctatus fue registrada en el presente estudio, posiblemente por ser uno de los pasálidos con más amplia distribución en México y de las pocas especies que son atraídas a la luz blanca y ultravioleta (Reyes–Castillo 2000, 2003). De acuerdo a los resultados obtenidos, se podría esperar que las especies faltantes posiblemente sean pasálidos, así como algunos escarabeidos coprófagos y melolóntidos fitófagos o florícolas con períodos de actividad breve, tal es el caso de Yaaxkumukia ephemera Morón y Nogueira, registrada originalmente en las cercanías de la Laguna de Tziscao (Morón–Ríos & Morón 2001). Asimismo en esta lista se incluyen especies con rareza demográfica como Dynastes hercules septentrionalis Lachaume, la cual se presume exista en la zona debido a las condiciones ambientales similares a sus localidades de recolecta en Centroamérica (Morón 2009) y a las capturas efectuadas en las cercanías de Comitán durante 1950 y 1951 (Bolívar y Pieltaín et al. 1963). Por otra parte, es relevante mencionar la posibilidad que tanto las especies inventariadas como aquellas no registradas hayan sido afectadas por la pérdida de vegetación primaria debido a los incendios ocurridos en 1998, que dañaron aproximadamente el 50% de la superficie del PNLM (CONANP 2007). En el mismo sentido, la plaga del descortezador de pinos (Dendroctonus frontalis) ha provocado fuertes afectaciones en la superficie del BP y BPEL ya que su saneamiento obliga a la tala de los árboles infestados. Otros factores que pueden estar influyendo son la recolección de madera caída por parte de los pobladores para su uso como combustible y la caza de vertebrados mayores, lo cual incide en la disponibilidad de alimento para escarabajos Passalidae y Scarabaeidae, respectivamente.
Relación entre fenología y precipitación. En la temporada de lluvias el registro de especies de Scarabaeoidea aumentó coincidiendo con resultados obtenidos en otras localidades semicálidas o subhúmedas como la región central de Veracruz, Durango, Edo. de México, Jalisco y Puebla (Deloya 2006, Morón & Deloya 1991, Morón & Zaragoza 1976, Morón et al. 1988, 2000). En general el inicio del temporal de lluvias influyó en la riqueza y diversidad ecológica de Scarabaeoidea para el BP y BPEL en Montebello, lo cual coincide con lo señalado por Chacón (2005), Delgado (2007), García (2006), Morón & Zaragoza (1976), Muñoz–Hernández et al. (2008), Percino (2002) y Salamanca (2006) para bosques con pino y sus asociaciones con encino–liquidámbar donde, en esa temporada, se incrementó en más del 50% la riqueza y abundancia de especies.
Las primeras precipitaciones no influyeron en la riqueza del BMM, lo cual contrasta con otros estudios realizados en este tipo de vegetación donde se registraron importantes abundancias de Melolonthidae con las primeras precipitaciones (Deloya 2006, García–Montiel et al. 2003, Morón–Ríos & Morón 2001). Sin embargo, las correlaciones obtenidas en el BMM coinciden con la importancia de este periodo de humedad en la riqueza y abundancia de especies de Melolonthidae y Scarabaeidae en Veracruz (Deloya 2006, Deloya et al. 2007). La posible explicación a la emergencia tardía en el BMM puede deberse a que las lluvias ocurridas en mayo no fueron de tal intensidad para alcanzar la humedad edáfica necesaria en la emergencia y vuelo de Melolonthidae. Asimismo, es posible que las especies en BMM registren preferencia a condiciones de alta humedad, la cual de acuerdo a Challenger (1998) y Volgemann (1973) es favorecida por la densa cobertura arbórea que reduce la radiación solar y el déficit de vapor, llegando a disminuir los procesos de evapotranspiración.
Por otra parte, se debe considerar la influencia de los ciclos de vida y hábitos alimentarios de las especies. De tal forma que los registros constantes de Scarabaeidae pueden obedecer a ciclos de vida multivoltinos, disponiendo de adultos activos durante todo el año que aprovechan recursos alimentarios con distribución espacio–temporal irregular y efímera (excremento, carroña o restos vegetales), los cuales no son influidos por el inicio de la época de lluvias (Carrillo–Ruiz & Morón 2003). Por otra parte, las especies de Melolonthidae con ciclos vitales de uno o dos años posiblemente estén favorecidas por la abundancia de adultos en la época con mejores condiciones ambientales (temporada de lluvias) en la cual disponen de una importante oferta de alimento (flores, frutos, follaje), lo cual se traduce en recursos necesarios para la reproducción y el desarrollo inicial de las larvas.
Los resultados obtenidos en ésta investigación indican un esfuerzo de captura representativo con mayor diversidad ecológica para el BP pero mayor riqueza en el BMM, coincidente con la dominancia de algunas especies de escarabajos y la riqueza vegetal de estas comunidades. A pesar del estado de degradación del BP y BPEL, el 10% de las especies inventariadas son exclusivas para estos tipos de vegetación y un número importante de especies se comparten con el BMM. La disminución de actividades antrópicas debe ser prioritaria ya que un aumento en la intensidad de estas puede amenazar a especies que presentan especificidad de hábitat. La fenología de Scarabaeoidea obedeció en general a la presencia de lluvias las cuales influyen en la disponibilidad de alimento de estos escarabajos.
AGRADECIMIENTOS
Se agradece al Consejo Nacional de Ciencia y Tecnología (CONACYT) por la beca de Maestría 228389 otorgada al primer autor, así como al Colegio de la Frontera Sur (ECOSUR) por el financiamiento concedido mediante el Programa de Apoyo a Tesis de Maestría. Asimismo, se reconoce al personal del Parque Nacional Lagunas de Montebello el apoyo logístico durante el trabajo de campo.
LITERATURA CITADA
Bolívar y Pieltaín C., L. Jiménez–Asúa & A. Martínez. 1963. Notas sobre Dynastinaeneo tropicales con especial referencia a especies mexicanas. Ciencia, 22: 181–190. [ Links ]
Carlson, M.C. 1954. Floral elements of the pine–oak–liquidambar forest of Montebello, Chiapas, Mexico. Bulletin of Torrey Botanical Club, 81: 387–399. [ Links ]
Carrillo–Ruiz, H & M.A. Morón. 2003. Fauna de Coleoptera Scarabaeoidea de Cuetzalan del Progreso, Puebla, México. Acta Zoológica Mexicana (n. s.), (88): 87–121. [ Links ]
Castro–Ramírez, A.E., H. Delfín–González, V. Parra–Tabla & M.A. Morón. 2005. Fauna de Melolóntidos (Coleoptera: Scarabaeoidea) asociados al maíz (Zea mays L.) en los Altos de Chiapas. México. Folia Entomológica Mexicana, 44: 339–365. [ Links ]
Chacón, A.L. 2005. Fauna de Coleoptera Lamellicornia del municipio de San Felipe Teotlalcingo, Puebla, México. Tesis inédita de licenciatura, Escuela de Biología, Benemérita Universidad Autónoma de Puebla, México. [ Links ]
Challenger, A. 1998. Utilización y conservación de los ecosistemas terrestres de México. Pasado, presente y futuro. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad; Instituto de Biología (UNAM) y Agrupación Sierra Madre, México, D.F. [ Links ]
CONABIO. 2000. Región Terrestre Prioritaria 137 El Momón–Montebello. Pp. 534–536. In: L. Arriaga, J.M. Espinoza, C. Aguilar, E. Martínez, L. Gómez & E. Loa. (Coord.). Regiones terrestres prioritarias de México. Comisión Nacional para el Conocimiento y uso de la Biodiversidad. México. [ Links ]
CONANP. 2007. Programa de conservación y manejo del Parque Nacional Lagunas de Montebello. Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT), Comisión Nacional de Áreas Naturales Protegidas (CONANP), México. [ Links ]
Colwell, R.K. 2006. EstimateS: Statistical estimation of species richness and shared species from samples. Version 8. User's Guide and application published at: http://purl.oclc.org/estimates. [ Links ]
Colwell, R.K. & J.A. Coddington. 1994. Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions of the Royal Society of London Series B, 345:101–118. [ Links ]
Delgado, J.M. 2007. Fauna de Coleoptera Lamellicornia en el municipio de Chignahuapan, Puebla, México. Tesis inédita de licenciatura, Escuela de Biología. Benemérita Universidad Autónoma de Puebla, México. [ Links ]
Delgado, L. & J. Márquez. 2006. Estado del conocimiento y conservación de los coleópteros Scarabaeoidea (Insecta) del estado de Hidalgo, México. Acta Zoológica Mexicana (n. s.), 22: 57–108. [ Links ]
Deloya, C. 2006. Escarabajos fitófagos del bosque mesófilo de montaña y comunidades derivadas en el centro de Veracruz, México (Coleoptera: Scarabaeoidea). Pp. 81–98. In: A.E. Castro–Ramírez, M.A. Morón & A. Aragón (Eds.). Diversidad, importancia y manejo de escarabajos edafícolas. Publicación especial de El Colegio de la Frontera Sur, la Fundación PRODUCE Chiapas, A.C. y la Benemérita Universidad Autónoma de Puebla, México. [ Links ]
Deloya C. & M.M. Ordónez–Resendiz. 2008. Escarabajos (Insecta: Coleoptera). Pp. 123–134. In: R.H. Manson, V. Hernández–Ortiz, S. Gallina & K. Mehltreter (Eds.). Agroecosistemas cafetaleros de Veracruz: biodiversidad, manejo y conservación. Instituto de Ecología A.C. (INECOL) e Instituto Nacional de Ecología (INE–SEMARNAT), México. [ Links ]
Deloya, C., V. Parra–Tabla & H. Delfín–González. 2007. Fauna de Coleópteros Scarabaeidae Laparosticti y Trogidae (Coleoptera: Scarabaeoidea) asociados al bosque mesófilo de montaña, cafetales bajo sombra y comunidades derivadas en el centro de Veracruz, México. Neotropical Entomology, 36: 005–021. [ Links ]
Endrödi, S. 1966. Monographie der Dynastinae. (Col. Lam.). I Teil. Entomologische Abhandlungen Museum Tierkunde Dresden, 33: 1–457. [ Links ]
García, E. 1981. Modificaciones al sistema de clasificación climática de Kõeppen. Instituto de Geografía, UNAM. México. [ Links ]
García, S. 2006. Estudio faunístico de Coleoptera Lamellicornia de la región La Malinche, Tlaxcala, México. Tesis inédita de licenciatura, Escuela de Biología, Benemérita Universidad Autónoma de Puebla, México. [ Links ]
García–Montiel, J.C., L.E. Rivera–Cervantes & M.A. Morón. 2003. Composición y abundancia estacional de los Melolonthidae nocturnos (Insecta: Coleoptera) asociados a un bosque mesófilo de montaña en el municipio de Minatitlán, Colima, México. Pp. 115–127. In: A. Aragón, M.A. Morón & J. Marín. (Eds.). Estudios sobre coleópteros del suelo en América. Publicación especial de la Benemérita Universidad Autónoma de Puebla y la Sociedad Mexicana de Entomología. A.C., México. [ Links ]
Halffter, G. & L. Arellano. 2002. Response of dung beetle diversity to human–induced changes in a tropical landscape. Biotropica, 34: 144–154. [ Links ]
Halffter, V. & G. Halffter. 2009. Nuevos datos sobre Canthon (Coleoptera: Scarabaeinae) de Chiapas, México. Acta Zoológica Mexicana (n. s.), 25: 397–407. [ Links ]
Halffter, G. & E.G. Matthews. 1966. The natural history of the dung beetle of the subfamily Scarabaeinae (Col. Scarab.). Folia Entomológica Mexicana, (12–14): 312. [ Links ]
Halffter, G. & C.E. Moreno. 2005. Significado biológico de las diversidades alfa, beta y gamma. Pp. 5–18. In: G. Halffter, J. Soberón, P. Koleff & A. Melic. (Eds.) Sobre diversidad biológica: El significado de las diversidades. Monografías Tercer Milenio SEA, vol. 4. Zaragoza, España. [ Links ]
Hooper, D.U., F.S. Chapin, J.J. Ewel, A. Hector, P. Inchausti, S. Lavorel, J.H. Lawton, D.M. Lodge, M. Loreau, S. Naeem, B. Schmid, H Setálá, A.J. Dymstad, J. Vandermeer & D.A. Wardle. 2005. Effects of biodiversity of ecosystem functioning: A consensus of current knowledge. Ecological Monographs, 75: 3–35. [ Links ]
Horváth, A., I.J. March & J.H.D. Wolf. 2001. Rodent diversity and land use in Montebello, Chiapas, Mexico. Studies on Neotropical Fauna and Environment, 36: 169–176. [ Links ]
Jiménez–Valverde, A. & J. Hortal. 2003. Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos. Revista Ibérica de Aracnología. Sección Boletín, 8: 151–161. [ Links ]
López–Vieyra, M. & L.E. Rivera–Cervantes. 1998. Abundancia estacional de los coleópteros Melolonthidae (Insecta: Lamellicornia), asociados a un bosque mesófilo de montaña en la Estación Científica Las Joyas, Sierra de Manantlán, Jalisco, México. Pp. 61–70. In: M.A. Morón & A. Aragón. (Eds.). Avances en el estudio de la diversidad, importancia y manejo de los coleópteros edafícolas americanos. Publicación especial de la Benemérita Universidad Autónoma de Puebla y la Sociedad Mexicana de Entomología. A.C., México. [ Links ]
Magaña–Cuevas, B. & L.E. Rivera–Cervantes. 1998. Abundancia estacional de los coleópteros nocturnos de la familia Melolonthidae (Insecta: Lamellicornia), asociados a un bosque de pino–encino en el municipio de Atenguillo, Jalisco, México. Pp. 51–60. In: M.A. Morón & A. Aragón. (Eds.). Avances en el estudio de la diversidad, importancia y manejo de los coleópteros edafícolas americanos. Publicación especial de la Benemérita Universidad Autónoma de Puebla y la Sociedad Mexicana de Entomología. A.C., México. [ Links ]
Magurran, A.E. 1988. Ecological diversity and its measurement. Princeton University Press, New Jersey. [ Links ]
Magurran, A.E. 2004. Measuring biological diversity. Blackwell Science Ltd., Oxford, UK. [ Links ]
Micó, E., B. Gómez y Gómez & E. Galante. 2006. The Mesoamerican genus Yaaxkumukia: Biogeography and descriptions of new species (Coleoptera: Rutelidae). Annals of the Entomological Society of America, 99: 1–6. [ Links ]
Moreno, C.E. 2001. Métodos para medir la biodiversidad. M & T–Manuales y Tesis SEA, vol. 1. Zaragoza, España. [ Links ]
Morón, M.A. 1981. Fauna de Coleoptera Melolonthidae de la Reserva de la Biosfera "La Michilía", Durango, México. Folia Entomológica Mexicana, (50): 3–69. [ Links ]
Morón, M.A. 1987. Thenecrophagous Scarabaeinaebeetles (Coleoptera: Scarabaeidae) from a coffee plantation in Chiapas, Mexico: Habits and Phenology. The Coleopterists Bulletin, 41: 225–232. [ Links ]
Morón, M.A. 1994. Fauna de Coleoptera Lamellicornia en las montañas del noreste de Hidalgo, México, Acta Zoológica Mexicana (n. s.), 63: 7–59. [ Links ]
Morón, M.A. 2003a. Atlas de los escarabajos de México. Coleoptera: Lamellicornia, Vol II. Familias Scarabaeidae, Trogidae, Passalidae y Lucanidae. Targania, Barcelona. [ Links ]
Morón, M.A. 2003b. Las especies de Phyllophaga (s.str.) del grupo rugipennis (Coleoptera: Melolonthidae). Pp. 19–34. In: G. Onore, P. Reyes–Castillo & M. Zunino (Comp.). Escarabeidos de Latinoamérica: estado del conocimiento. Monografías Tercer Milenio SEA, vol. 3. Zaragoza, España. [ Links ]
Morón, M.A. 2006. Composición de comunidades de Phyllophaga en México (Coleoptera: Melolonthidae: Melolonthinae. Pp. 11–36. In: A.E. Castro–Ramírez, M.A. Morón & A. Aragón. (Eds.). Diversidad, importancia y manejo de escarabajos edafícolas. Publicación especial de El Colegio de la Frontera Sur (ECOSUR), la Fundación PRODUCE, Chiapas, A.C. y la Benemérita Universidad Autónoma de Puebla, México. [ Links ]
Morón, M.A. 2009. El género Dynastes Mac Leay, 1819 en la Zona de Transición Mexicana (Coleoptera: Melolonthidae: Dynastinae). Boletín Sociedad Entomológica Aragonesa, 45: 23–38. [ Links ]
Morón, M.A. & C. Deloya. 1991. Los Coleoptera Lamellicornia de la reserva de la biosfera "La Michilía", Durango, México. Folia Entomológica Mexicana, (81): 209–283. [ Links ]
Morón, M.A. & R. Terrón. 1984. Distribución altitudinal de los insectos necrófilos en la Sierra Norte de Hidalgo, México. Acta Zoológica Mexicana (n. s.), (3): 1–47. [ Links ]
Morón, M.A. & R. Terrón. 1988. Entomología Práctica. Instituto de Ecología A.C. Sociedad Mexicana de Entomología, México. [ Links ]
Morón, M.A. & S. Zaragoza. 1976. Coleópteros Melolonthidae y Scarabaeidae de Villa de Allende, México. Anales del Instituto de Biología Serie Zoológica, 47: 83–118. [ Links ]
Morón, M.A., C. Deloya & L. Delgado–Castillo. 1988. Fauna de Coleópteros Melolonthidae, Scarabaeidae y Trogidae de la región de Chamela, Jalisco, México. Folia Entomológica Mexicana. 77: 313–378. [ Links ]
Morón, M.A., B.C. Ratcliffe & C. Deloya. 1997. Atlas de los escarabajos de México, Coleoptera Lamellicornia Vol. I. Familia Melolonthidae. Comisión Nacional para el Conocimiento de la Biodiversidad y Sociedad Mexicana de Entomología A.C. México, D.F. [ Links ]
Morón, M.A., F.J. Villalobos & C. Deloya. 1985. Fauna de coleópteros Lamellicornios de Boca de Chajul, Chiapas, México. Folia Entomológica Mexicana, (66): 55–118. [ Links ]
Morón–Ríos, A., & M.A. Morón. 2001. La fauna de Coleoptera Melolonthidae de la Reserva de la Biosfera "El Triunfo", Chiapas, México. Acta Zoológica Mexicana (n. s.), (84): 1–25. [ Links ]
Morón, M.A., A. Aragón, A.M. Tapia & R. Rojas. 2000. Coleoptera Lamellicornia de la Sierra del Tentzo, Puebla, México. Acta Zoológica Mexicana (n. s.), (79): 77–102. [ Links ]
Muñoz–Hernández, A., M.A. Morón & A. Aragón. 2008. Coleoptera Scarabaeoidea de la región de Teziutlán, Puebla, México. Acta Zoológica Mexicana (n. s.), 24: 55–78. [ Links ]
Navarrete–Gutiérrez, D.A. & G. Halffter. 2008. Nuevos registros de escarabajos copro–necrófagos (Coleoptera: Scarabaeidae: Scarabaeinae) para México y Chiapas. Acta Zoológica Mexicana (n. s.), 24: 247–250. [ Links ]
Nestel, D., F. Dickschen & M.A. Altieri. 1993. Diversity patterns of soil macro–Coleoptera in Mexican shaded and unshaded coffee agroecosystems: an indication of habitat perturbation. Biodiversity and Conservation, 2: 70–78. [ Links ]
Pacheco–Flores, C., A.E Castro–Ramírez, M.A. Morón & B. Gómez y Gómez. 2008. Fauna de escarabajos melolóntidos (Coleoptera: Scarabaeoidea) en el municipio de Villaflores, Chiapas, México. Acta Zoológica Mexicana (n. s.), 24: 139–168. [ Links ]
Percino, S.M. 2002. Fauna de Coleoptera Lamellicornia del municipio de Zacatlán, Puebla, México. Tesis inédita de licenciatura, Escuela de Biología, Benemérita Universidad Autónoma de Puebla, México. [ Links ]
Rangel–Salazar, J.L., P.L. Enríquez & E. Sántiz–López. 2009. Variación de la diversidad de aves de sotobosque en el Parque Nacional Lagos de Montebello, Chiapas, México. Acta Zoológica Mexicana (n. s.), 25: 479–495. [ Links ]
Reyes–Castillo P. 2000. Coleoptera Passalidae de México. Pp. 171–182. In: F. Martín–Piera, J.J. Morrone & A. Melic. (Eds.) Hacia un proyecto CYTED para el inventario y estimación de la diversidad entomológica en Iberoamérica: PrIBES–2000. Monografías Tercer Milenio SEA, vol. 1. Zaragoza, España. [ Links ]
Reyes–Castillo, P. 2003. Familia Passalidae. Pp. 135–168. In: M.A. Morón (Ed.). Atlas de los escarabajos de México. Coleoptera: Lamellicornia, Vol II. Familias Scarabaeidae, Trogidae, Passalidae y Lucanidae. Targania, Barcelona. [ Links ]
Rzedowski, J. 2006. Vegetación de México. 1ra. edición digital, Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO), México. [ Links ]
Salamanca, C. 2006. Fauna de Coleoptera Lamellicornia en la región de Tlachichuca y Ahuatepec del Camino (Ciudad Serdán), Puebla, México. Tesis inédita de licenciatura, Escuela de Biología, Benemérita Universidad Autónoma de Puebla, México. [ Links ]
Soberón, J.M. & J. Llorente–Bousquets. 1993. The use of species accumulation functions for the pre–diction of species richness. Conservation Biology, 7: 480–488. [ Links ]
SPSS. 2006. Version 15.0 para Windows, SPSS, Inc. [ Links ]
StatSoft, Inc. 2004. STATISTICA (data analysis software system), version 7. http://www.statsoft.com. [ Links ]
Thomas, D.T. 1993. Scarabaeidae (Coleoptera) of the Chiapanecan Forests: A faunal survey and chorographic analysis. The Coleopterists Bulletin, 47: 363–408. [ Links ]
Volgemann, H.B. 1973. Fog precipitation in the cloud forest of eastern Mexico. Bioscience, 23: 96–100. [ Links ]
Zar, J.H. 2010. Biostatistical analysis. Prentice Hall, New Jersey. [ Links ]
Zarco–Mendoza, P. 2000. Análisis de la vegetación y fauna asociada en bosques templados del Parque Nacional Lagunas de Montebello, Chiapas. Tesis inédita de Licenciatura en Biología, Universidad Nacional Autónoma de México, Campus Iztacala, Los Reyes Iztacala, México. [ Links ]














