Introducción
La endocarditis infecciosa en neonatos es más frecuente que en niños mayores y representa 7% del total de endocarditis en la edad pediátrica. Está muy relacionada con las cardiopatías congénitas dado que causan flujos turbulentos, pero sobre todo con la presencia prolongada de catéteres intravenosos. Este artículo es una revisión sobre el proceso para llevar al diagnóstico basado en el cumplimiento de criterios clínicos, microbiológicos y de imagen; además, se presentan las recomendaciones para el tratamiento.
Definiciones
La estructura básica del corazón consiste en pericardio, miocardio y endocardio. Este último está compuesto por una capa de endotelio en contacto con el fluido sanguíneo. A partir del endocardio se forman las válvulas cardiacas.1 El endotelio tiene un epitelio plano simple con funciones activas en la fisiología cardiovascular: 1) función anti-trombogénica por diversos mecanismos, como la secreción de prostaciclina, factor activador de plasminógeno y degradación de trombina, entre otros. 2) Regulación de lípidos plasmáticos, por el rol en el metabolismo de lipoproteínas de baja y muy baja densidad. 3) Regulación del tono vascular que actúa como intermediario hormonal y sustancias vasoactivas que metabolizan noradrenalina o que transforman angiotensina en angiotensina II.2
La endocarditis se define como la inflamación valvular o mural del endocardio por cualquier causa; mientras que la endocarditis infecciosa (EI) es la causada por bacterias u hongos, e involucra el corazón o los grandes vasos (endarteritis) y puede incluir la formación de abscesos.3 Los niños con mayor riesgo de desarrollarla son quienes presentan cardiopatía congénita de alto flujo, los sometidos a cirugía cardiaca, quienes requieren la colocación de catéteres intravasculares y pacientes inmunodeprimidos.4
Patogenia y fisiopatología
Se sabe que hay dos condiciones necesarias para la endocarditis: el daño endotelial y los microorganismos que expresan múltiples adhesinas. El daño endotelial ocurre como resultado de flujos turbulentos por estructuras anormales, como prótesis, cardiopatías o por algún dispositivo como catéteres o marcapasos, los cuales pueden causar daño directo por “raspado” de la superficie endotelial o por efecto indirecto debido a flujos turbulentos en la válvula tricúspide. El daño endotelial causa una respuesta de adhesión plaquetaria y depósito de fibrina, lo que produce la formación de un trombo endocárdico no bacterial (TENB) que sirve como nido para el depósito de bacterias u hongos.5
Al existir alguna condición que genere bacteriemia o fungemia transitoria, los gérmenes se alojan en la lesión y dan origen a lo que se conoce como vegetación. La vegetación tiende a crecer por la respuesta inmunológica que se agrega al trombo y fibrina. Las vegetaciones suelen formarse en el lado de baja presión del defecto, que las “protege” del contacto con antibióticos. Las bacterias atrapadas proliferan y hacen crecer la vegetación, liberando constantemente bacterias que, a su vez, producen bacteriemias continuas de bajo grado.4
Epidemiología
La incidencia anual de la EI en Estados Unidos de Norteamérica (EUA) entre 2003 y 2010 se reportó entre 0.05 y 0.12 casos, por cada 1,000 niños hospitalizados.6 En niños, durante las últimas dos décadas, las cardiopatías congénitas se han convertido en la enfermedad subyacente principal (hasta 90%), a diferencia del pasado, cuando la fiebre reumática era la condición que predominaba. En corazones estructuralmente sanos, el uso de líneas de acceso vascular central, en especial en neonatología, constituye un factor de riesgo importante.3
La incidencia de esta complicación en los últimos 20 años se ha incrementado, debido al uso de técnicas invasivas para tratar diversos problemas médicos, siendo el principal el uso de catéteres centrales. Por lo anterior, las lesiones en recién nacidos (RN) son más comunes en las estructuras derechas del corazón.
La mortalidad por EI en niños oscila entre 5 y 10%, pero es mayor en pacientes prematuros (13.3%) que en niños mayores (4.5%).7 En una revisión de 1983 a 1995 de un hospital en Australia, de 12,249 RN atendidos en la unidad neonatal, ocho (0.07%) tuvieron endocarditis y, la mayoría fue en prematuros menores de 30 semanas de gestación.8
Si bien, las cardiopatías congénitas constituyen uno de los factores de riesgo más importantes, por lo general la endocarditis se presenta fuera del periodo neonatal, es decir, durante la infancia o incluso en la vida adulta.9 La cirugía cardiaca correctiva de cardiopatías congénitas sin duda reduce el riesgo de EI, especialmente en valvulopatías; sin embargo, la cirugía también puede aumentar el riesgo, sobre todo cuando se realizan cortocircuitos o se colocan prótesis valvulares.10
En RN, la prematurez por sí misma es un factor de riesgo, no sólo por su vulnerabilidad a infecciones, sino por la frecuente necesidad de colocar líneas centrales, para nutrición parenteral o administración de medicamentos.11 Sin embargo, se ha observado que la formación de TENB puede darse posterior al síndrome de dificultad respiratoria (SDR), en la persistencia de circulación fetal o cuando ocurre coagulación intravascular diseminada (CID), ya que todas causan aumento de sustancias vasoactivas que incrementan la agregación plaquetaria.12
Diagnóstico
En general, la presentación clínica de la EI puede ser con síntomas inespecíficos, o bien, con datos de sepsis franca o choque séptico. Los cuatro tipos de presentación clínica de la endocarditis son: 1) cuadro de sepsis por bacteriemia o fungemia, 2) cambios en los ruidos cardiacos por valvulitis o presencia de TENB o vegetaciones, 3) lesiones de Roth (raras en niños y excepcionales en neonatos), y 4) embolia renal, abdominal, osteomielitis, meningitis o neumonía, con la sintomatología propia de cada problema.13
Los RN suelen tener presentación clínica insidiosa con hiporexia, pérdida de peso, dificultad respiratoria o datos francos de choque séptico. Por ello, en esta etapa el diagnóstico de la endocarditis bacteriana requiere de un alto índice de sospecha, tomando en cuenta los datos clínicos y los factores de riesgo.14
Desde 1909, en Inglaterra Thomas Horder describió los signos y síntomas de la EI, pero fue hasta 1981 cuando Von Reyn propuso sus criterios para facilitar el diagnóstico, clasificándolo en definitivo, probable, posible y rechazado.15 En 1994, en la Universidad de Duke se proponen nuevos criterios (criterios de Duke), con tres opciones: endocarditis definitiva, posible o rechazada.16 En 2000, Li y colaboradores presentan criterios modificados y más estrictos, conocidos como criterios de Duke modificados, en donde solo se cambió la manera de llegar al diagnóstico posible.17
La Tabla 1 detalla las diferencias entre los criterios de Duke y de Li así como los criterios menores y mayores que se usan para ambos. En la columna central de la Tabla se muestran los dos criterios mayores y los seis criterios menores, que se usan tanto para Duke como para Li. En los criterios de Duke (descritos en la columna izquierda) para llegar al diagnóstico definitivo de endocarditis se requieren dos criterios mayores, un criterio mayor y dos menores o cinco criterios menores. Se rechaza el diagnóstico si se encuentra un diagnóstico alterno, se resuelve el problema tras cuatro días de tratamiento antibiótico, o bien, cuando no hay evidencia de endocarditis tras cirugía o autopsia. En los casos que no se establece el diagnóstico definitivo, pero tampoco se rechaza, queda como diagnóstico posible. En cambio, en los criterios de Li el diagnóstico definitivo se hace con los mismos requisitos que en los de Duke, pero se considera diagnóstico posible si tiene un criterio mayor y uno menor, o tres menores. Se rechaza el diagnóstico si no cumple con los criterios de diagnóstico definitivo ni posible, o bien, al cumplir con la definición de rechazo con los criterios de Duke.14 Los criterios de Duke tienen una sensibilidad de 80% y, aunque se describieron para adultos, siguen siendo un punto de referencia aun en niños y neonatos.
Tabla 1: Criterios de Duke y Li (Duke modificado) para diagnóstico de endocarditis infecciosa (EI).14
| Criterios de Duke | Criterios mayores y menores | Criterios de Li (Duke modificados) |
|---|---|---|
| EI definitiva | Criterios mayores | EI definitiva |
| — 2 criterios mayores, o | Hemocultivo positivo | — 2 criterios mayores, o |
| — 1 mayor y 3 menores, o | — Microorganismo típico en 2 hemocultivos diferentes: S. viridans, S. bovis, Staphylococcus aureus, Enterococcus, grupo HACEK, o | — 1 mayor y 3 menores, o |
| — 5 criterios menores | — Microorganismo persistente positivo en dos hemocultivos separados de 12 horas, o tres hemocultivos separados de una hora, o un positivo para Coxiella burnetii | — 5 criterios menores |
| EI posible | Alteración endocárdica | EI posible |
| No se confirma EI definitiva ni se rechaza | — Ecocardiograma positivo: vegetación móvil en válvula, estructura cardiaca, flujo de regurgitación o material implantado, o absceso, o nueva dehiscencia de la válvula prostética | — 1 criterio mayor y 1 menor, o |
| — Nuevo soplo de regurgitación | — 3 criterios menores | |
| EI rechazada | Criterios menores | EI rechazada |
| — Diagnóstico alternativo confirmado o, | — Condición cardiaca previa o uso de drogas IV | — Diagnóstico alternativo confirmado o, |
| — Resolución con antibióticos en 4 días o menos, o | — Fiebre igual o mayor a 38 oC | — Resolución con antibióticos en 4 días o menos, o |
| — No hay evidencia de endocarditis en cirugía o autopsia | — Fenómeno vascular | — No hay evidencia de endocarditis en cirugía o autopsia o, |
| — Fenómeno inmunológico | — No hay criterios para EI posible | |
| — Hemocultivo positivo que no satisface criterios mayores | ||
| — Ecocardiograma positivo que no satisface criterios mayores |
Adaptado de: Carceller A. Endocarditis infecciosa. An Pediatr (Barc). 2005; 63 (5): 383-389.
El diagnóstico se basa en datos clínicos, de imagen y microbiológicos.18 En todas las edades, el ecocardiograma es el estándar de oro para la identificación de la vegetación; en la mayoría, la ecocardiografía transtorácica es suficiente, pero a veces la transesofágica puede ser de utilidad. La Figura 1 muestra el caso de una vegetación de 8.4 x 4.9 mm de nuestra institución en el que se cumplieron los dos criterios mayores para hacer diagnóstico definitivo. Recientemente se ha descrito la utilidad de la tomografía por emisión de positrones, en particular en las endocarditis relacionadas a cardiopatías congénitas.19
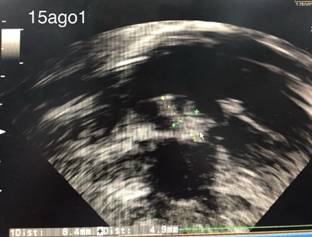
Figura 1: Vegetación de 8.4 x 4.9 mm en válvula tricúspide en neonato de 29 semanas de gestación (35 corregidas).
La documentación microbiológica se realiza por hemocultivo. Si bien las nuevas técnicas de reacción en cadena de polimerasa (PCR) han avanzado, permitiendo mayor rapidez para la identificación del agente causal y de algunas especies resistentes, como mecA de Staphylococcus aureus, estas técnicas aún no sustituyen el hemocultivo.20
Los hemocultivos deben ser periféricos y no de catéteres; la toma requiere de al menos tres cultivos en 24 a 48 horas. Cabe señalar que hasta en 10% de los casos no se obtienen hemocultivos positivos.21 Con respecto a la toma de hemocultivos, las recomendaciones (incluyendo pacientes pediátricos) más aceptadas son:
Tomar hemocultivos en todo paciente con fiebre y datos de sepsis sin origen claro y con soplo; o bien, pacientes con historia de cardiopatía o endocarditis previa.
Deben tomarse al menos tres cultivos, de diferentes punciones, en el primer día y si no hay crecimiento en el primer día, obtener dos o más de tres hemocultivos.
En pacientes que no parecen enfermos y los cultivos permanecen negativos por más de 48 horas, es razonable retrasar el inicio de antibióticos y obtener nuevos cultivos.
En pacientes severamente enfermos, se deben obtener tres hemocultivos con separación de una hora e iniciar tratamiento empírico inmediato.
No es recomendable tomar hemocultivos arteriales.
En RN, especialmente en prematuros de bajo peso, el volumen de extracción puede limitarse a sólo 1 mL y el número de cultivos puede ser menor de tres, en las primeras 48 horas.5
Agentes causales
En todas las edades, los géneros Staphylococcus y Streptococcus son responsables de 55-95% de las EI de válvulas nativas. La Tabla 2 muestra también que los Streptococcus son menos comunes en los neonatos que en el resto de la edad pediátrica, mientras que los Staphylococcus aureus y coagulasa negativo tienen más frecuencia en la edad neonatal. Los bacilos Gram negativos y los hongos también son más frecuentes en RN que en niños mayores de dos meses. Enterococcus se presentan en menos de 1% de las endocarditis neonatales y hasta en 6% del resto de los niños.
Tabla 2: Frecuencia de agentes causales en diferentes edades para válvulas nativas.22
| Microorganismo | Neonatos % | 2 meses-15 años % | 16-60 años % |
|---|---|---|---|
| Streptococcus spp. | 15-20 | 40-50 | 45-65 |
| Staphylococcus aureus | 40-50 | 22-27 | 30-40 |
| Staphylococcus coagulasa negativo | 8-12 | 4-7 | 4-8 |
| Enterococcus spp. | < 1 | 3-6 | 5-8 |
| Bacilos Gram negativos | 8-12 | 4-6 | 4-10 |
| Hongos | 8-12 | 1-3 | 1-3 |
| Cultivos negativos y organismos HACEK | 2-6 | 0-15 | 3-10 |
| Difteroides | < 1 | < 1 | < 1 |
| Polimicrobianos | 3-5 | < 1 | 1-2 |
Adaptado de: Mylonakis E, Calderwood SB. Infective endocarditis in adults. N Eng J Med. 2001; 345 (18): 1318-1330.
Los bacilos conocidos como grupo HACEK (Haemophilus parainfluenzae, H. aphrophilus, H. paraphrophilus, H. influenzae, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae, K. denitrificans), así como aquéllos con hemocultivo negativo, se presentan en 2 a 6% de los neonatos y, de 0 a 16% de los niños. Por último, los hemocultivos polimicrobianos suceden en 3 a 5% en RN, pero en menos de 1% de los niños.22
La virulencia de algunas especies como estafilococos, enterococos y estreptococos es mayor debido a las adhesinas que son clave para el desarrollo de la endocarditis. Las adhesinas del Staphylococcus aureus han sido las más estudiadas, referidas como MSCRAMM (Microbial Surface Components Recognizing Adhesive Matrix Molecules). Se fijan a colágeno, laminina, fibrinógeno y fibronectina, componentes presentes en el endocardio lesionado.5
La endocarditis fúngica es relevante, pues representa de 8 a 10% del total. En una revisión sistemática, publicada en el 2017, se buscaron todas las referencias sobre endocarditis por hongos en niños. Se encontró que, de 93 casos reportados en menores de un año, 60 fueron neonatos (64%) y de ellos, 57 fueron prematuros (95%) con una media de edad gestacional al nacer de 27 semanas y peso de 860 g promedio. Los factores de riesgo más importantes fueron la prematurez, aplicación de catéteres centrales, uso previo de antibióticos y la cirugía de corazón abierto. El sitio de infección más frecuente fue el corazón derecho. El pronóstico de la endocarditis fúngica sigue siendo malo; en esta serie la tasa de fatalidad fue de 56%, aunque esto ha mejorado después del año 2000 cuando se reporta tasa de mortalidad de 33%. Candida albicans (60%) es lo más frecuente en RN, seguida de C. parapsilosis (12%), Candida spp. (10%) y C. tropicalis (5%).23 Algunas características biológicas únicas de la población pediátrica, pero especialmente la neonatal, ayudan al desarrollo de fungemias: los menores diámetros vasculares que obligan al uso de catéteres de poco calibre proveen un nido para tromboflebitis y endocarditis. Además, la inmadurez inmunológica monocítica y de la fagocitosis polimorfonuclear los pone en situación especial de vulnerabilidad.24
Tratamiento
La EI es un problema complejo y requiere la intervención de varias especialidades como infectología, cardiología y cirugía cardiovascular. El tratamiento consiste principalmente en antibióticos por tiempo prolongado, pero se puede requerir cirugía en casos de falla cardiaca, infección fuera de control o prevención de embolismo inminente. Aún quedan muchas áreas de incertidumbre sobre el tratamiento de la EI, entre las cuales está la correcta duración del tratamiento, el uso de tratamiento oral, el momento apropiado para iniciarlo y el momento óptimo de realizar la cirugía.18
Terapia antimicrobiana
El tratamiento de la EI consiste en antibióticos por periodos prolongados, debido a que las bacterias alojadas en el trombo endocárdico no reciben flujo sanguíneo directo, por lo que el acceso del medicamento es limitado. Además algunos microorganismos en esas circunstancias forman un biofilm que les confiere cierta protección incluso contra antibióticos. Existen cinco principios básicos para el tratamiento antibiótico de la EI:5,20,25
De los medicamentos empleados, al menos uno debe ser bactericida.
El tratamiento es necesariamente prolongado, de cuatro a ocho semanas.
Debe privilegiarse la vía intravenosa sobre la intramuscular.
Tanto el tratamiento empírico como el dirigido deben adaptarse a las necesidades de resistencia de la unidad médica local, usando las guías internacionales.
Al completar el tratamiento, es innecesario tomar hemocultivos cuando no hay síntomas sugestivos. Al iniciar tratamiento, deben tomarse hemocultivos todos los días hasta que sean negativos, para documentar el momento en que cesó la bacteriemia.
Las recomendaciones para el tratamiento publicadas por la Asociación Americana del corazón (AHA) y por la Sociedad Europea de Cardiología (ESC) son muy similares, pero varían en algunos detalles. La Tabla 3 muestra dichas diferencias.5,26
Tabla 3: Diferencias en las recomendaciones de 2015 de la AHA y la ASC para el tratamiento de la endocarditis infecciosa (EI) en niños.
| American Heart Association (AHA) | European Society of Cardiology (ASC) |
| Tratamiento de Streptococcus spp. | |
| No se recomienda tratamiento corto (2 semanas) en EI no complicada | El tratamiento corto (2 semanas) en EI no complicada no se descarta |
| MIC para alta susceptibilidad a penicilina < 0.1 mg/L | MIC para alta susceptibilidad a penicilina < 0.0125 mg/L |
| MIC para cepa relativamente resistente > 0.2 mg/L | MIC para cepa relativamente resistente de 0.250 a 2.0 mg/L |
| Tratamiento de Staphylococcus spp. | |
| EI de válvula nativa: oxacilina en cepas susceptibles a meticilina; se puede usar gentamicina en los primeros 3 a 5 días | EI de válvula nativa con oxacilina en cepas susceptibles a meticilina; gentamicina no se recomienda por otoxicidad y nefrotoxicidad |
| No se menciona la necesidad del retraso de la rifampicina en prótesis valvulares | Con prótesis valvular, la adición de rifampicina puede retrasarse de 3 a 5 días de terapia efectiva con oxacilina o vancomicina |
| La daptomicina se recomienda como agente alterno para pacientes con alergia a betalactámicos y como alternativa a vancomicina | La daptomicina se recomienda como agente alterno para pacientes con alergia a betalactámicos y como alternativa a vancomicina, dado que es superior a vancomicina para Staphylococcus aureus susceptible y resistente a meticilina con MIC a vancomicina > 0.1 mg/L |
| Tratamiento de Enterococcus spp. | |
| Ampicilina y ceftriaxona se recomienda en cepas con resistencia o intolerancia a aminoglucósidos durante todo el tratamiento | Ampicilina y ceftriaxona para EI por E. faecalis puede usarse con o sin resistencia a aminoglucósidos. En cepas susceptibles, algunos expertos recomiendan dos semanas de gentamicina una vez al día |
La bacteriemia por Staphylococcus aureus a menudo es causada por dispositivos centrales, por lo que los catéteres deben removerse para acelerar la resolución, ya que de lo contrario la bacteriemia puede perdurar, aumentando el riesgo de siembras extracardiacas.25 Las infecciones por Staphylococcus aureus resistente a meticilina (MSRA), comunes en algunas unidades hospitalarias y de transmisión habitual por el personal de salud, requieren tratamiento con vancomicina y rifampicina debido a que la primera no es bactericida; se recomienda daptomicina como alternativa a rifampicina.27
La EI por enterococos tiene tasas de mortalidad elevadas. Enterococcus faecalis y E. faecium son las especies más relevantes, aunque 97% son por E. faecalis y es menos frecuente su resistencia antibiótica. Sin embargo, su habilidad para formar biofilm la hace de difícil tratamiento al ocasionar resistencia a aminoglucósidos en más de 50% de las ocasiones.28,29 En 2015 las guías europeas para EI recomiendan el esquema de ampicilina y cefotaxima contra E. faecalis resistente y no resistente a aminoglucósidos en clase IIa y nivel B de evidencia.5
En las endocarditis causadas por el grupo de bacterias HACEK se recomienda un curso de cuatro semanas de ceftriaxona con otra cefalosporina de tercera generación, o bien, ampicilina y gentamicina. En los casos de otros microorganismos Gram negativos como Pseudomonas sp. Escherichia coli o Serratia sp. se recomienda una combinación de penicilina de espectro extendido (piperacilina/tazobactam), o bien, cefalosporina (ceftazidima o ceftriaxona) más aminoglucósido, por un mínimo de seis semanas.5
Las endocarditis con cultivo negativo son un problema serio porque el tratamiento empírico empleado puede no cubrir la sensibilidad del germen y porque el mismo tratamiento puede causar efectos adversos. Por esta razón, el comité de la AHA recomienda no iniciar antibióticos hasta tener un cultivo positivo o suspender cualquier antibiótico que se haya iniciado en los cuatro días previos. El tratamiento empírico debe basarse en el evento pivote que probablemente haya desencadenado el evento, así como la exposición previa a antibióticos, si la infección es adquirida en comunidad o nosocomial, el tipo de válvula afectada (nativa o de prótesis), y el tipo de infección (aguda o subaguda). El consenso de los expertos es que el régimen inicial sea con ampicilina/sulbactam más gentamicina por cuatro a seis semanas, o vancomicina más gentamicina igualmente por cuatro a seis semanas y ciprofloxacina para válvulas nativas. En el caso de prótesis valvulares, se debe considerar vancomicina por seis semanas, adicionando gentamicina por dos semanas más cefepime por seis semanas, más rifampicina por seis semanas.5
Las endocarditis fúngicas se tratan típicamente con anfotericina B, a pesar de su mala penetración en la vegetación y por la posibilidad de afectar la función renal. Para pacientes con daño renal se recomienda la forma liposomal de anfotericina; las equinocandinas (caspofungina) tienen menos nefrotoxicidad y teóricamente mejores resultados en los biofilms de Candida, pero los resultados de su uso in vivo son contradictorios y aún faltan estudios comparativos.23 El fluconazol oral y otros antimicóticos se han usado como tratamiento profiláctico postendocarditis por seis a 12 meses e incluso usándola de manera sinérgica con anfotericina. En una revisión de Pana y colaboradores se reporta que la combinación de antifúngicos se asocia a menos mortalidad que la monoterapia.30
Cirugía
La intervención quirúrgica de la EI puede salvar la vida del paciente y si bien hay indicaciones (Tabla 4), la decisión debe ser individual. Las indicaciones comunes incluyen insuficiencia cardiaca, obstrucción valvular, extensión perivalvular de la infección, endocarditis fúngica, bacteriemia persistente, prótesis inestable, ruptura del seno de Valsalva o septum y eventos embólicos. La cirugía no debe retrasarse por no haber terminado el curso de antibiótico o por continuar con bacteriemias. Algunos pacientes con absceso miocárdico o extensión perianular de la infección pueden no requerir cirugía, especialmente ante la ausencia de bloqueo cardiaco, dehiscencia valvular o insuficiencia cardiaca.31
Tabla 4: Indicaciones para cirugía por endocarditis.
| Vegetación |
| — Vegetación persistente y embolización sistémica: |
| • Tamaño mayor de 10 mm en válvula mitral anterior |
| • Un evento embólico sistémico en las primeras 2 semanas de tratamiento |
| • Dos eventos embólicos durante o después del tratamiento |
| — Aumento del tamaño de vegetación después de 4 semanas de tratamiento |
| Disfunción valvular |
| — Insuficiencia mitral o tricuspídea aguda con falla ventricular |
| — Insuficiencia cardiaca que no responde a tratamiento médico |
| — Perforación o ruptura de válvula |
| Extensión perivalvular |
| — Dehiscencia valvular, ruptura o fístula |
| — Bloqueo cardiaco nuevo |
| — Absceso grande o extensión del absceso a pesar de tratamiento apropiado |
Otro manejo
La terapia trombolítica suele considerarse cuando hay indicaciones quirúrgicas. Existen la uroquinasa, la estreptoquinasa y el activador de plasminógeno tisular recombinante (rTPA), pero los dos primeros no son específicos a fibrina y son altamente antigénicos, por lo que están contraindicados en neonatos. El rTPA cataliza la conversión de plasminógeno en plasmina con una vida media muy corta, dando una fibrinólisis sin proteinolisis. No debe iniciarse si el paciente ha tenido crisis convulsivas en las últimas 48 horas, sangrado activo, deficiencias de coagulación, procedimientos invasivos en los últimos tres días, trombocitopenia, niveles bajos de fibrinógeno, hipertensión o sepsis severa. La dosis habitual es de 0.1 a 0.6 mg/kg/hora por seis a 12 horas por tres días.32











 nueva página del texto (beta)
nueva página del texto (beta)


