Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de investigación clínica
versión On-line ISSN 2564-8896versión impresa ISSN 0034-8376
Rev. invest. clín. vol.58 no.1 Ciudad de México ene./feb. 2006
Artículo original
Correlación del polimorfismo (I/D) del gen de la ECA y la función ventricular en pacientes con miocardiopatía dilatada de origen isquémico e idiopático
ACE gene polymorphysm correlation (I/D) with the ventricular function in patients with ischemic and dilate idiopathic cardiomyopathy
Nydia Avila–Vanzzini,* Nilda Espínola–Zavaleta,* Felipe Masso–Rojas,** Elvira Varela–López,** José Miguel Casanova–Garcés,*** Jorge Kury–Alfaro,* Héctor Herrera–Bello****
* Departamento de Consulta Externa,
** Departamento de Biología Celular.
*** Departamento de estadística. Instituto Nacional de Cardiología Ignacio Chávez.
**** Terapia intensiva. Hospital Médica Sur.
Reimpresos:
Dra. Nydia Avila–Vanzzini
Instituto Nacional de Cardiología Ignacio Chávez Ecocardiografía Consulta Externa
Juan Badiano No. 1 Col. Sección XVI Tlalpan
14080, México, D.F.
Tel: 5573–2911 Extensión 1194
Correo electrónico: vazzny74@yahoo.com
Recibido el 18 de enero de 2005.
Aceptado el 1 de diciembre de 2005.
ABSTRACT
Dilated cardiomyopathy is a myocardial disease, characterized by biventricular expansion. Renin–angiotensin–aldosterone system (RAAS) is closely related with the progress of this pathology. Has been shown that angiotensin converting enzyme (ACE) gene insertion/deletion (I/D) polymorphism influences as much in the plasmatic concentration as in activity of ACE. In addition, ACE I/D polymorphism has been associated with remodeling phenomena and an increased risk to develop several cardiovascular diseases. On virtue of the influence of ACE gene polymorphism on RAAS, we studied the correlation between ACE I/D polymorphism with morphologic and functional clinical alterations in ischemic or idiopathic dilated cardiomyopathy in one attempt to establish its utility as prognosis factor.
Methods and results. We studied 30 patients of The National Institute of Cardiology. Ventricular function was evaluated by transthoracic echocardiography. ACE genotype was determined by polymerase chain reaction (PCR). Results for left ventricle shown: Tei Index was increased in patients with II genotype (0.84 vs. 0.48) when were compared to patients with DD genotype p < 0.01. Eccentricity Index was lesser in the group with II genotype (0.64), than in the group DD (0.86) p < 0.01. Ventricular mass was increased in DD patients when was compared with II group (174 g vs. 133 g) Isovolumetric contraction time was shorter in group DD than in II (45 mseg vs. 139 mseg) p < O.OB. These findings denote better preservation of left ventricular function in patients with DD genotype. In opposition, right ventricle shown an increased Tei Index in the group with DD genotype (1.01) when was compared with II genotype (0.55), p < 0.05. Pulmonary artery systolic pressure tended to be higher in DD genotype group without reach statistic significance.
Conclusions. In our group of study, patients with DD genotype shown better left ventricular function in ischemia or idiopathic dilated cardiomyopathy. On the opposite right ventricular function were more deteriorated in patients with ACE DD genotype.
Key words. Dilated cardiomyopathy. ACE (I/D) polymorphism. Echocardiography.
RESUMEN
La miocardiopatía dilatada es una enfermedad primaria del miocardio, caracterizada por dilatación biventricular. El sistema renina–angiotensina–aldosterona (SRAA) está estrechamente relacionado con el progreso de esta patología. Se ha demostrado que el polimorfismo inserción/deleción (I/D) del gen de la enzima convertidora de angiotensina (ECA) influye en la concentración plasmática y la actividad de esta enzima, además este polimorfismo se ha asociado con fenómenos de remodelación e incremento en el riesgo de padecer diferentes enfermedades cardiovasculares. En virtud de la influencia de las variantes polimórficas del gen de la ECA sobre la respuesta del SRAA, en el presente trabajo se estudió la posible correlación del polimorfismo I/D del gen de la ECA con las alteraciones clínicas morfológicas y funcionales de la cardiomiopatía dilatada tanto de origen isquémico como de origen idiopático con el fin de establecer su posible utilidad como factor pronóstico.
Métodos y resultados. El estudio incluyó a 30 pacientes seleccionados de la consulta externa del Instituto Nacional de Cardiología <<Ignacio Chávez>>, la función ventricular se valoró mediante ecocardiografía transtorácica. El genotipo de la ECA se determinó por reacción en cadena de la polimerasa (PCR). Resultados para el ventrículo izquierdo: El índice de Tei se observó visiblemente incrementado en los pacientes con genotipo II 0.84 vs. 0.48 de los pacientes con genotipo DD p < 0.01. El índice de excentricidad fue menor en los casos con genotipo II: 0.64, comparado con aquellos con genotipo DD: 0.86 p < 0.01. La masa ventricular tendió a ser mayor en el grupo DD en relación con el II (174 g vs. 133 g). El tiempo de contracción isovolumétrica fue menor en el grupo DD en comparación al II (45 mseg vs. 139 mseg) p < 0.05, estos hallazgos denotan una mejor preservación de la función ventricular izquierda en los pacientes con genotipo DD. Por otra parte, el ventrículo derecho mostró un comportamiento distinto al observado para el ventrículo izquierdo, pues el índice de Tei fue mayor para los pacientes con el genotipo DD (1.01) comparado con el grupo del genotipo II (0.55), p < 0.05. La presión sistólica de la arteria pulmonar tendió a ser mayor en los pacientes con genotipo DD sin alcanzar una significancia estadística.
Conclusión. El genotipo DD se asocia con una mejor función ventricular izquierda en los pacientes con miocardiopatía dilatada de origen tanto isquémico como idiopático; por el contrario, la función ventricular derecha de los pacientes con genotipo DD muestra una mayor alteración en el índice de Tei en esta patología.
Palabras clave. Miocardiopatía dilatada. Polimorfismo (I/D) del gen de la ECA. Ecocardiografía.
INTRODUCCIÓN
La miocardiopatía dilatada es una enfermedad primaria del miocardio. Se trata de una patología común, pero pobremente entendida; el grupo de desórdenes al que conlleva, finalmente da como resultado la falla cardiaca y la muerte prematura.1
Las causas que originan la miocardiopatía dilatada son múltiples.1 Recientemente se han descrito varias mutaciones en genes que codifican para proteínas estructurales propias de la sarcómera o proteínas reguladoras como posibles responsables del desarrollo de cardiomiopatía dilatada.2–8 Sin embargo, la influencia de otras variantes genéticas, que pueden afectar el remodelamiento y la contractilidad del miocardio, sin afectar la estructura intrínseca del cardiomiocito, en particular aquellas que alteran el sistema renina angiotensina aldosterona (SRAA), como las variantes genotípicas del gen de la enzima convertidora de angiotensina (ECA), han sido poco estudiadas como un factor que pudiera influir sobre la evolución de la miocardiopatía dilatada.
En el año de 1990 Rigat, et al.,9 identificaron el gen de la ECA, el cual se localiza en la región q23 del cromosoma 17, este gen presenta diversos polimorfismos, uno de los mejor estudiados es el denominado inserción/deleción (I/D), el cual consiste en la presencia o ausencia de 287 pares de bases en el intrón 16 del gen que codifica para esta enzima.10 Se ha demostrado que en el humano la concentración plasmática de la ECA está asociada a las variantes alélicas I/D, en particular el genotipo DD, esto es, la homocigocia del gen deletado D, se ha asociado con una mayor concentración plasmática y una mayor actividad de la ECA.10–12
El genotipo DD también se ha asociado con un mayor riesgo para presentar infarto agudo del miocardio13,14 o reestenosis después de angioplastia percutánea transluminal.15,16 La tendencia familiar a desarrollar miocardiopatía isquémica también se ha asociado con el genotipo DD.15,16
En pacientes hipertensos del sexo masculino, se ha encontrado una mayor incidencia del genotipo DD,17,18 lo mismo que en la hipertrofia ventricular tanto izquierda como derecha.19–22 Reynolds11 ha reportado que existe una fuerte asociación entre la miocardiopatía dilatada de origen idiopático o isquémico y el alelo D en ambas etiologías. Sin embargo, Vancura et al.23 al comparar un grupo de pacientes con miocardiopatía dilatada contra un grupo control, no lograron encontrar ninguna diferencia significativa en la frecuencia del alelo D del gen de la ECA en esta patología. Montgomery et al.24 encontraron una tendencia a presentar un mayor deterioro de los parámetros hemodinámicos en presencia de este alelo, sin significancia estadística. En el presente trabajo reportamos la asociación del alelo D con algunos índices ecocardiográficos especiales de función ventricular en la cardiomiopatía dilatada tanto de origen idiopático como de origen isquémico.
PACIENTES Y MÉTODOS
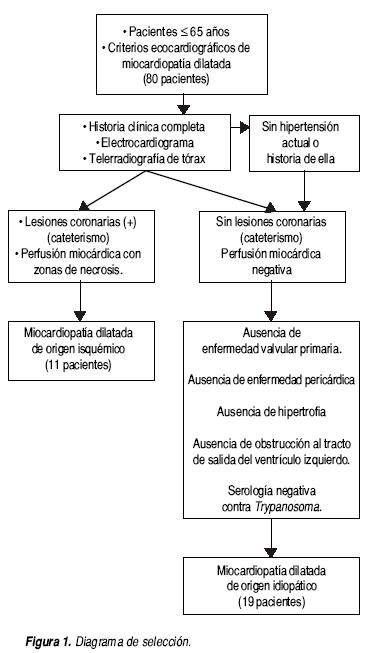
Durante el periodo de marzo del 2003 a marzo del 2004, acudieron al Departamento de Ecocardiografía remitidos por el Servicio de Consulta Externa del Instituto Nacional de Cardiología Ignacio Chávez, 80 pacientes con diagnóstico de miocardiopatía dilatada. El diagnóstico fue corroborado con base en criterios ecocardiográficos previamente establecidos como: dilatación del ventrículo izquierdo o ambas cavidades, disminución del engrosamiento sistólico de las paredes, hipocinesia global y/o segmentaria, fracción de eyección menor o igual a 40%. Se incluyó en el estudio a los pacientes menores de 65 años de edad que aceptaron participar en el protocolo bajo consentimiento informado. Para el grupo de miocardiopatía dilatada de origen isquémico, se eligieron pacientes con historia de cardiopatía isquémica, la cual fue corroborada por clínica, electrocardiograma, estudio de medicina nuclear y cateterismo cardiaco. La selección de los pacientes del grupo de miocardiopatía dilatada de origen idiopático incluyó datos clínicos y electrocardiográficos. Se excluyeron aquellos pacientes con historia de hipertensión o presencia de tensión arterial elevada en el momento de la selección, pacientes con patología valvular primaria, datos ecocardiográficos sugestivos de patología pericárdica y obstrucción del tracto de salida o hipertrofia. Se realizó además una determinación de anticuerpos contra Trypanosoma y fueron excluidos los pacientes que resultaron positivos (Figura 1).
El ecocardiograma transtorácico realizado valoró minuciosamente la función sistólica y diastólica de acuerdo con parámetros previamente establecidos.25,27 Algunas mediciones especiales para este estudio fueron: el índice de Tei para el ventrículo izquierdo,28 cuyo valor normal es 0.39 ± 0.05. El tiempo de contracción isovolumétrica29 con valor normal de 40 mseg. y el índice de excentricidad cuyo valor normal en diastole es de 1.00 ± 0.01 y en sístole 1.01 ± 0.01.29
Un parámetro para evaluar la función ventricular derecha fue medir el descenso de anillo tricuspídeo en diastole y en sístole, para calcular la fracción de eyección del ventrículo derecho. Para evaluar la presión sistólica de la arteria pulmonar se midió con el método de insuficiencia tricuspídea 30 Se valoró la movilidad global del ventrículo derecho y se valoró el índice de Tei para este ventrículo cuyo valor normal es 28 ± 0.04 (Tei VD).31
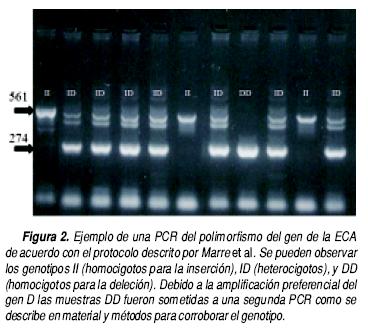
Para determinar el polimorfismo I/D del gen de la ECA se aisló DNA genómico empleando un kit comercial (Wizard Genomics Promega, Madison WI. USA). El protocolo para la PCR fue el descrito por Marre et al.32 En breve, este método consiste en una PCR anidada que amplifica la inserción en el intrón 16 del gen de la ECA empleando los cebadores GIIS (5–CTC AAG CAC GCC CCT CAC AGG ACT G– 3) y GAS (5– GAT GTG GCC ATC ACÁ TTC GTC AGA T– 3'), el protocolo fue el siguiente: desnaturalización del ADN 1.5 min a 95 °C, se amplificó durante 15 ciclos (95 °C 1 min, 62 °C 1 min, 72 °C 1 min en 50 |^L de solución amortiguadora con 2 Mm de Mg. Cl2 y 0.25% de DMSO usando 2.5 U de DNA polimerasa y 400 pM de cebadores), concluidos estos primeros 15 ciclos, la muestra se enfrió a 4 °C y se agregó el cebador FYM (5'–ATC ACG AGG TCA GGA GAT CGA GAC–3') y nuevamente el cebador GIIS la PCR se continuó otros 15 ciclos adicionales, el par de cebadores GIIS y GAS generan un producto de 274 pares de bases cuando existe deleción o 561 pares de bases cuando existe inserción, el par de cebadores GIIS y FYM generan un producto específico para la secuencia de inserción de 376 pares de bases con lo que se verifica la secuencia de inserción en el mismo ensayo. Debido a que se ha reportado que en muestras heterocigotas existe una amplificación pre–ferencial del alelo D y a pesar de que el protocolo de Marre descrito anteriormente contempla la verificación del gen de inserción en el mismo ensayo, se realizó una segunda PCR de corroboración en las muestras con genotipo DD, empleando los cebadores descritos por Lindpaintner33 que reconocen una secuencia específica de la región de inserción (5'–TGG GAC CAC AGC GCC CGC CAC TAC–3' Y 5 –TCG CCA GCC CTC TGC CCA TAA–3'), y que por lo tanto aparecen como ngativos en las muetsras DD.
ANÁLISIS ESTADÍSTICO
Las variables cualitativas se presentan como frecuencia, proporciones y razones. Para la comparación y/o asociación de variables cualitativas se utilizó la prueba exacta de Fisher y prueba de hipótesis con %2, que puede ser corregida por Yates según sea necesario.
Las variables cuantitativas se presentan como media y desviación estándar. Para la comparación de promedios, se aplicó la prueba de "t" de Student, o análisis de varianza, siempre y cuando la distribución fuera normal o Gaussiana; si la distribución era anormal, entonces se aplicó prueba no paramétrica de U de Man Whitney o suma de rangos, en el caso de ser más de dos grupos se aplicó Kruskal Wallis.
RESULTADOS
Se incluyeron en el estudio 30 pacientes, 10 del sexo femenino y 20 el sexo masculino. Con un promedio de edad de 52 ± 7 años, tenían un tiempo promedio de aparición de síntomas de 3.5 ±1.1 años, y tiempo de diagnóstico de 3.2 ± 0.7 años, los datos generales y tratamiento de los pacientes se muestran en los cuadros 1 y 2. En total fueron 11 pacientes con miocardiopatía dilatada de origen isquémico y 19 pacientes con miocardiopatía dilatada de origen idiopático. A todos los pacientes se les realizó PCR de ADN genómico para determinar el genotipo I/D del gen de la ECA (Figura 2).
Los hallazgos clínicos no mostraron significancia estadística, siendo muy similares en ambos grupos, comparados tanto por diagnóstico como por el genotipo encontrado.
Comparación ecocardiográfica por grupos de acuerdo con el diagnóstico
La función diastólica del ventrículo izquierdo se mostró más afectada en el grupo de miocardiopatía isquémica, en comparación con los pacientes con miocardiopatía de origen idiopático, relación E/A 3.3 vs. 2.5, respectivamente (Cuadro 3). La presión sistólica de la arteria pulmonar mostró una tendencia a ser mayor en el grupo de cardiomiopatía isquémica comparada con el otro grupo, sin que exista significancia estadística, 60.4 vs. 49.8 mm Hg (Cuadro 3). Respecto al índice de Tei para el ventrículo izquierdo, los pacientes con cardiomiopatía isquémica mostraron mayor disfunción ventricular con un índice de 1.1, mientras que los pacientes con miocardiopatía de origen idiopático mostraron menor disfunción con un índice de Tei de 0.72 sin alcanzar significancia estadística (Cuadro 3).
Correlación de acuerdo con el polimorfismo I/D del gen de la ECA
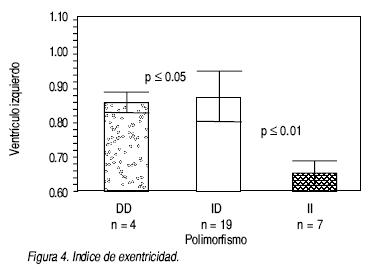
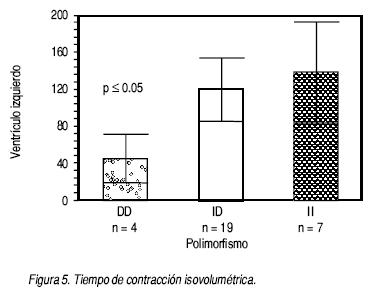
• Para el ventrículo izquierdo. El índice de Tei se mostró visiblemente alterado en los pacientes con genotipo II (0.84 = disfunción moderada), mientras que en el grupo DD la disfunción es ligera (0.48) p < 0.01 (Figura 3). El índice de excentricidad del ventrículo izquierdo mostró al grupo II más afectado con 0.64, comparado con el grupo DD con 0.86 p < 0.01 (Figura 4). En relación con la masa ventricular, el grupo II tendió a presentar una menor masa cuando se comparó con el grupo de DD; sin embargo, no alcanzó significancia estadística (133 g vs. 174 g) (Cuadro 4). Cuando medimos el tiempo de contracción isovolumétrica, se observó que en el grupo II el tiempo necesario para alcanzar la presión de la aorta es mayor, comparado con el grupo DD (139 mseg. vs. 45 mseg.), con una p < 0.05. (Figura 5).

• Para el ventrículo derecho los hallazgos fueron. La función diastólica del ventrículo derecho se mostró más alterada en el grupo DD, cuando se comparó con el II, con relación E/A de 4.2 vs. 2.1 (Cuadro 4).
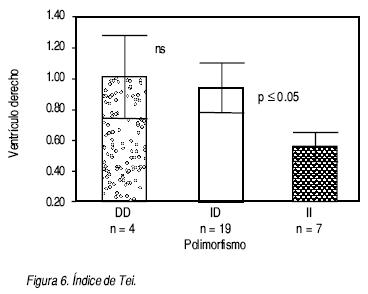
El índice de Tei para el ventrículo derecho mostró una disfunción severa en el grupo DD y moderada a ligera en el grupo II (1.01 vs. 0.55, respectivamente), con una p < 0.05 (Figura 6). En cuanto a la presión sistólica de la arteria pulmonar el promedio fue de 62.1 mm Hg en el grupo DD y de 44.0 mm Hg en el grupo II, sin significado estadístico (Cuadro 4).
DISCUSIÓN
El pronóstico de los pacientes con cardiomiopatía dilatada está estrechamente relacionado con la severidad de la disfunción ventricular. La búsqueda exhaustiva de causas que contribuyen al deterioro de la función ventricular ha llevado a buscar factores genéticos que pudieran predisponer o influir en el desarrollo de esta disfunción; sin embargo, hasta la fecha, no contamos con resultados concluyentes. Una de las asociaciones más interesantes es aquella entre la hipertrofia ventricular y el alelo D del gen de la ECA; en este contexto, los pacientes hipertensos con genotipo DD desarrollan más hipertrofia que los pacientes con genotipo II19 y tienen menor respuesta al tratamiento con inhibidores de la ECA en cuanto a la reducción de la hipertrofia.34 Estos hallazgos no son difíciles de entender si recordamos que el SRAA está fuertemente implicado en la hipertrofia ventricular.
Sabemos que el genotipo DD se asocia con una mayor concentración plasmática de ECA y una mayor actividad de la misma, por lo tanto, es de esperarse que la remodelación ventricular creada bajo estas condiciones no sea igual para los diferentes genotipos.
A diferencia de otras patologías como el infarto agudo al miocardio, en el cual la zona de dilatación corresponde primordialmente al tejido cicatricial, la cardiomiopatía dilatada tanto de origen isquémico como idiopático presenta un adelgazamiento ventricular izquierdo más generalizado. En estas condiciones el presentar una mayor masa ventricular izquierda (174 us. 133 g), aunada con una mejor fuerza contráctil (tiempo de contracción isovolumétrica 45 us. 139 mseg.), en los pacientes con genotipo DD podría explicar la aparente mejor función del ventrículo izquierdo en nuestro grupo de estudio. Ha sido reportado que en el infarto agudo al miocardio el genotipo DD parece ser deletéreo, a pesar de que este genotipo también favorece una mayor hipertrofia ventricular izquierda en estos casos. La ausencia total de contractilidad en la zona cicatricial, con el consecuente incremento del estrés sistólico, el aumento en las demandas de oxígeno, y otros factores hemodinámicos que conducen a un incremento en la poscarga harían diferencias importantes en cuanto al efecto funcional de la hipertrofia favorecida por el genotipo DD en ambas patologías. Por otra parte, resulta igualmente interesante la observación de Abraham,35 quien estudió pacientes con hipertensión pulmonar primaria y demostró que los pacientes con genotipo no DD (ID e II), tienen menor fracción de expulsión, que se origina a partir de una función contráctil disminuida del ventrículo derecho, presentándose además una disminución del volumen latido en estos pacientes; asimismo, este grupo tiene mayor deterioro de la capacidad funcional en comparación con los pacientes DD.
De esta manera todo parece indicar que no es en sí la mayor hipertrofia favorecida por el genotipo DD la que determina la mejor funcionalidad en los pacientes, sino más bien su interdependencia con otros factores hemodinámicos presentes en distintas patologías como han sugerido Kuznetsova et al.,19 quienes han reportado que la promoción de la hipertrofia no se debe exclusivamente a la presencia del alelo D, sino que se requiere de otros factores asociados.
Nuestros datos difieren en cuanto a lo reportado para la función del ventrículo derecho en pacientes con genotipo DD en hipertensión pulmonar primaria, en la cual se menciona que existe mayor hipertrofia y mejor función ventricular;35 sin embargo, ante la presencia de hipertensión pulmonar secundaria el comportamiento no parece ser el mismo. Van Suylen et al.31 no observaron ninguna asociación entre la hipertrofia ventricular derecha y el genotipo DD en pacientes con enfermedad pulmonar obstructiva crónica,36 lo cual sugiere que el efecto inducido por el genotipo DD sobre el sistema renina angiotensina aldosterona es diferente en la hipertensión pulmonar primaria con respecto a la secundaria, de la misma manera estudios realizados en animales han mostrado un comportamiento distinto de la presión arterial pulmonar. En cuanto a la posible utilidad de emplear el genotipo del polimorfismo I/D del gen de la ECA como factor pronóstico, existe el antecedente de que el genotipo DD se encuentra asociado a una pobre sobrevida en pacientes con insuficiencia cardiaca congestiva.38
El presente trabajo tiene la limitante de contar con pocos casos y dado que la frecuencia del alelo DD es relativamente baja en nuestra población, se requiere incrementar el número de pacientes para validar estas primeras observaciones, no obstante es de llamar la atención que en nuestra población no se encontró incrementada la frecuencia del genotipo DD ni se observaron diferencias clínicas entre los grupos; sin embargo, al evaluar los índices ecocardiográficos especiales para determinar con mayor precisión la función ventricular, pudieron encontrarse algunas diferencias estadísticamente significativas.
CONCLUSIÓN
En nuestro grupo de pacientes con miocardiopatía dilatada tanto de origen idiopático como isquémico, aquellos que poseen el genotipo DD del gen de la ECA mostraron un comportamiento diferente en la remodelación ventricular izquierda con tendencia a tener mayor masa muscular, preservando una mejor función, opuesto a lo observado para los pacientes con genotipo II. El comportamiento variable de las resistencias pulmonares ante distintas patologías como la miocardiopatía dilatada estudiada en este trabajo y la hipertensión pulmonar primaria reportada previamente en la literatura, pudiera explicar la aparente discordancia de los hallazgos funcionales desde el punto de vista ecocardiográfico en el ventrículo derecho descritos en este estudio.
REFERENCIAS
1. Dec GW, Fuster V. Idiopathic dilated cardiomyopathy. N Engl J Med 1994; 331: 1564–75. [ Links ]
2. Kamisago M, Sharma SD, De Palma SR, Solomon S, Sharma P, McDonough B, et al. Mutations in sarcomere protein genes as a cause of dilated cardiomyopathy. N Engl J Med 2000; 343: 1688–96. [ Links ]
3. Bowles R, Gajarski R, Porter P, Goytia V, Bachinski L, Roberts R, et al. Gene mapping of familial autosomal dominant dilated cardiomyopathy to chromosome 10q 21–23. J Clin Invest 1996; 98: 1355–60. [ Links ]
4. Berko BA, Swift M. X Linked dilated cardiomyopathy. N Engl J Med 1987; 316: 1186–91. [ Links ]
5. Siu BL, Niimura H, Osborne JA, Fatkin D, MacRae C, Solomon S, Benson DW, et al. Familial dilated cardiomyopathy locus map to cromosome 2q31. Circulation 1999; 99: 1022–6. [ Links ]
6. Muntoni F, Cau M, Ganau A, Congiu R, Arvedi G, Mateddu A, et al. Brief report: Deletion of the dystrophin muscle–promoter region associated with X–linked dilated cardiomyopathy. N Engl J Med 1993; 329: 921–5. [ Links ]
7. Oslon TM, Illenberg S, Kishimoto NY, Huttelmaier S, Keating MT, Jockusch BM. Metavinculin mutations alter actin interaction in dilated cardiomyopathy. Circulation 2002; 105: 431–7. [ Links ]
8. Tsubata S, Bowles KR, Vatta M, Zintz C, Titus J, Muhonen L, et al. Mutations in the human (delta)–sarcoglycan gene In familial and sporadic dilated cardiomyopathy. J Clin Invest 1997; 106: 655–62. [ Links ]
9. Rigat B, Hubert C, Alhenc–Gelas F, Cambien F, Corvol P, Soubrier F. An insertion/deletion polymorphism in the angiotensin I converting enzyme gene accounting for half the variance of serum enzyme levels. J Clinic Invest 1990; 86: 1343–6. [ Links ]
10. Chiang FT, Hsu KL, Chen WM, Tseng CD, Tseng YZ. Determination of angiotensin–converting enzyme gene polymorphisms: stepdown PCR increases detection of heterozygotes. Clinical Chemistry 1998; 44: 1353–6. [ Links ]
11. Raynolds MV, Bristow MR, Bush EW, Abraham WT, Lowes BD, Zisman LS, Taft CS, Perryman MB. Angiotensin converting enzyme DD genotype in patients with ischaemic or idiopathic dilated cardiomyopathy. Lancet 1993; 342: 1073–5. [ Links ]
12. Tiret L, Rigat B, Visvikis S, Breda C, Corvol P, Cambien F, Soubrier F. Evidence, from combined segregation and linkage analysis, that a variant of the angiotensin I converting enzyme (ACE) gene controls plasma ACE levels. Am J Hum Genet 1992; 51: 197–205. [ Links ]
13. Samani NJ, Thompson JR, O'Toole L, Channer K, Woods KL. A meta–analysis of the association of the deletion allele of the angiotensin converting enzyme gene with myocardial infarction. Circulation 1996; 94: 708–12. [ Links ]
14. Tiret L, Kee F, Poirier O, Nicaud V, Lecerf L, Evans A, et al. Deletion polymorphism in angiotensin–converting enzyme gene associated with history of myocardial infarction. Lancet 1993; 341: 991–2. [ Links ]
15. Ohishi M, Fujii K, Minamino T, Higaki J, Kamitani A, Rakugi H, Zhao Y, Mikami H, Miki T, Ogihara T. Potent genetic risk factor for restenosis. Nat Genet 1993; 5: 324–5. [ Links ]
16. Amant C, Bauters C, Bodart JC, Lablanche JM, Grollier G, Danchin N, et al. D allele of the angiotensin I converting enzyme is a major risk factor for restenosis after coronary stenting. Circulation 1997; 96: 56–60. [ Links ]
17. O'Donnell CJ, Lindpaintner K, Larson MG, Rao VS, Ordovas JM, Schaefer EJ, et al. Evidence for association and genetic linkage of the angiotensin converting enzyme locus with hypertension and blood pressure in men but not in women in the Framingham heart study. Circulation 1998; 97: 1766–72. [ Links ]
18. Higaki J, Baba S, Katsuya T, Sato N, Ishikawa K, Mannami T, et al. Deletion allele of angiotensin converting enzyme gene increases risk of essential hypertension in Japanese men. Circulation 2000; 101: 2060–5. [ Links ]
19. Kuznetsova T, Staessen JA, Wang JG, Gasowski J, Nikitin Y, Ryabikov A, Fragard R. Antihypertensive treatment modulates the association between the D/I ACE gene polymorphism and left ventricular hypertrophy: a meta–analysis. J Hum Hypertens 2000; 14: 447–54. [ Links ]
20. Abraham WT, Raynolds MV, Gottschall B, Badesch DB, Wynne KM, Groves BM, et al. Importance of angiotensin converting enzyme in pulmonary hypertension. Cardiology 1995; 86 Suppl 1: 9–15. [ Links ]
21. Celentano A, Mancini FP, Crivaro M, Palmieri V, Ferrara LA, De Stefano V, et al. Cardiovascular risk factor, angiotensin converting enzyme gene I/D polymorphism, and left ventricular mass in systemic hypertension. Am J Cardiol 1999; 83: 1196–2000. [ Links ]
22. Dellgren G, Eriksson MJ, Blange I, Brodin LA, Radegran K, Sylven C. Angiotensin converting enzyme gene polymorphism influences degree of left ventricular hypertrophy and its regression in patients undergoing operation for aortic stenosis. Am J Cardiol 1999; 84: 909–13. [ Links ]
23. Vancura V, Hubacek J, Malek I, Gebauerova M, Pitha D, Dorazilova Z, et al. Does angiotensin converting enzyme polymorphism influence the clinical manifestation and progression of heart failure in patients with dilated cardiomyopathy? Am J Cardiol 1999; 83: 461–2. [ Links ]
24. Montgomery HE, Keeling PJ, Goldman JH, Humphries SE, Talmud PJ, McKenna WJ. Lack of association between the insertion/deletion polymorphism of the angiotensin converting gene and idiopathic dilated cardiomyopathy. J Am Coll Cardiol 1995; 25: 1627–31. [ Links ]
25. Sahn DJ, DeMaria A, Kisslo J, Weyman A. The commite on standardization of echocardiography: recommendations regarding quantitation In M–mode echocardiography, results of a surgery of the echocardiography measurements. Circulation 1978; 58: 1072–83. [ Links ]
26. Oh JK, Appleton CP, Hatle LK, Nishimura RA, Seward JB, Tajik AJ. The noninvasive assessment of left ventricular diastolic function with two–dimensional and Doppler echocardiography. J Am Soc Echocardiogr 1997; 10: 246–70. [ Links ]
27. Kurtoglu N, Akdermir R, Yuce M, Basaran Y, Dindar I. Left ventricular inflow normal or pseudonormal. A new echocardiographic method: diastolic change of left atrial diameter. Echocardiography 2000; 17: 653–8. [ Links ]
28. Tei C, Nishimura RA, Seward JB, Tajik AJ. Noninvasive Doppler–derived myocardial performance index: correlation with simultaneous measurements of cardiac catheterization measurements. J Am Soc Echocardiogr 1997; 10: 169–78. [ Links ]
29. Schereiber TL, Felbenbaum H, Weyman AE. Effect of atrial septal defect repair on left ventricular geometry and degree of mitral valve prolapse. Circulation 1980; 61: 888–96. [ Links ]
30. Otto CM. Valvular regurgitation: diagnosis, quantitation and clinical approach. Textbook of clinical echocardiography. Second edition. Saunders Company; 2000, pp. 265–300. [ Links ]
31. Tei C, Dujardin KS, Hodge DO, Bailey KR, McGoon MD, Tajik AJ, Seward SB. Doppler echocardiographic index for assessment of global right ventricular function. J Am Soc Echocardiogr 1996; 9: 838–47. [ Links ]
32. Marre M, Jeunemaitre X, Gallois Y, Rodier M, Chatellier G, Sert C, et al. Contribution of genetic polymorphism in the renin–angiotensin system to the development of renal complications in insulin–dependent diabetes. Genetique de la Nephropathie Diabetique. J Clinic Invest 1997; 99: 1585–95. [ Links ]
33. Lindpaintner K, Pfeffer MA, Kreutz R, Stampfer MJ, Grodstein F, LaMotte F, et al. A prospective evaluation of an angiotensin–converting–enzyme gene polymorphism and the risk of ischemic heart disease. N Engl J Med 1995; 332: 706–11. [ Links ]
34. Kohno M, Yokokawa K, Minami M, Kano H, Yasunari K, Hanehira T, Yashikawa J. Association between angiotensin–converting enzyme gene polymorphism and regression of left ventricular hypertrophy in patients treated with angiotensin–converting enzyme inhibitors. Am J Med 1999; 106: 544–9. [ Links ]
35. Abraham WT, Raynolds MV, Badesch DB, Wynne KM, Groves BM, Roden RL, et al. Angiotensin converting enzyme DD genotype in patients with primary pulmonary hypertension: increased frecquency and association with preserved haemodynamics. J Renin Angiotensin Aldosterone Syst 2003; 4: 27–30. [ Links ]
36. Van Suylen RJ, Wouters EF, Pennings HJ, Cheriex EC, van Pol PE, Ambergen AW, et al. The DD genotype of the angiotensin converting enzyme gene is negatively associated with right ventricular hypertrophy in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1999; 159: 1791–5. [ Links ]
37. Van Suylen RJ, Smits JF, Daemen MJ. Pulmonary artery remodeling differs in hypoxia and monocrotaline–induced pulmonary hypertension. Am J Respir Crit Care Med 1998; 157: 1423–8. [ Links ]
38. Andersson B, Sylven C. The DD genotype of the angiotensin–converting enzyme gene is associated with increased mortality in idiopathic heart failure. J Am Coll Cardiol 1996; 28: 162–7. [ Links ]














