INTRODUCCIÓN
En diciembre del 2019, un nuevo síndrome neumónico fue identificado en pacientes aglutinados alrededor del mercado de productos marinos de Wuhan, China. Este cuadro es causado por un nuevo coronavirus, denominado síndrome respiratorio agudo severo por coronavirus (SARS-CoV-2), un betacoronavirus que es transmitido principalmente por microgotas. La infección por este agente lleva al síndrome de enfermedad por coronavirus 2019 (COVID-19).
El espectro clínico de los pacientes sintomáticos varía de casos leves a pacientes críticamente enfermos. La mayoría de los pacientes tiene síntomas leves sin neumonía o neumonía leve, 14% presentan neumonía severa y 5% desarrollaran una enfermedad grave (crítica) con síndrome de insuficiencia respiratoria aguda, lesión cardiaca, lesión renal y disfunción multiorgánica. Mientras que el COVID-19 está considerado como una infección primariamente respiratoria, hay un incremento en la evidencia de complicaciones multisistémicas de la enfermedad. Con más series de casos publicados, un sin número de manifestaciones hematológicas han salido a la luz, dichas alteraciones incluyen neutrofilia, linfopenia, trombocitopenia leve, monocitopenia, DHL elevada, linfocitos reactivos y plasmacitoides en el frotis de sangre periférica, ferritina elevada, coagulopatía inducida por COVID-19, dímeros D elevados, TP y TTPa prolongados y elevación del fibrinógeno por citar algunas. La evidencia anecdótica ha mostrado que el COVID-19 puede causar un descenso progresivo en la hemoglobina, la anemia es consecuencia de inflamación aguda, la cual es resultado, en parte, de la homeostasia interrumpida del hierro y la supresión de la eritropoyesis. Varios reportes muestran que los individuos infectados con SARS-CoV-2 desarrollan anemia hemolítica autoinmune, esta es un desorden raro y heterogéneo caracterizado por la destrucción de eritrocitos a través de anticuerpos fríos o calientes.
El 30 de enero del 2020, la epidemia por COVID-19 fue declarada como emergencia de salud pública de preocupación internacional. El 11 de marzo, la Organización Mundial de la Salud (OMS), a través de su director general, anunció que la nueva enfermedad puede caracterizarse como una pandemia. En nuestro país el primer caso confirmado se presentó el 27 de febrero en la Ciudad de México. Hasta el 3 de junio del 2021, el total de casos confirmados es de 2’426,822 con 228,362 defunciones18.
El objetivo del presente trabajo es dar a conocer un caso de anemia hemolítica autoinmune desencadenada por la infección por SARS-CoV-2.
CASO CLÍNICO
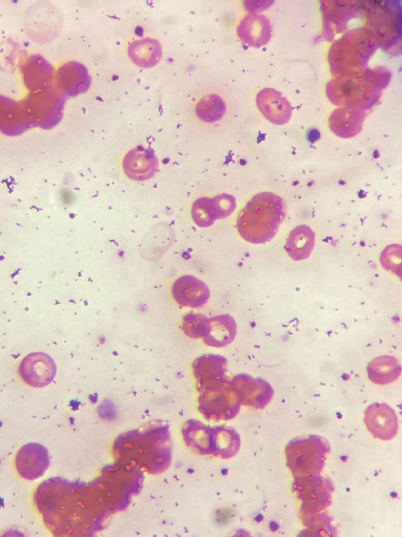
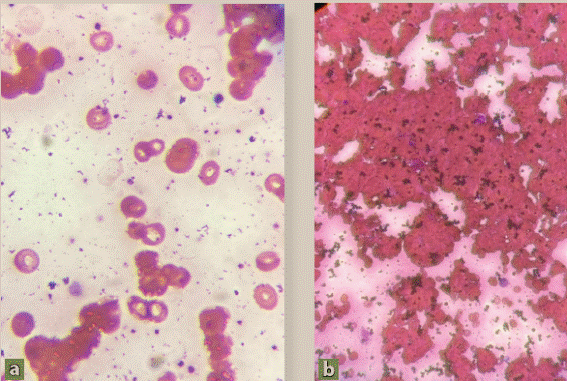
Paciente del sexo masculino, de 87 años de edad, originario y residente del estado de Puebla. Sin ocupación. Se negaron diabetes e hipertensión. Fue llevado al hospital por cuadro de evolución mal precisado, caracterizado por astenia, adinamia y disnea; previamente había recibido atención médica extrainstitucional, le prescribieron prednisona y levotiroxina a dosis no conocidas; al no mejorar, fue trasladado a nuestra unidad. La exploración física inicial mostró tensión arterial (TA) 112/63 mmHg, frecuencia cardiaca (FC) 89 latidos por minuto (lpm), frecuencia respiratoria (FR) 32 respiraciones por minuto (rpm), 36 °C. Se encontró postrado en silla de ruedas, pálido, con ictericia escleral, pupilas simétricas reactivas a la luz, con aleteo nasal, sin uso de músculos respiratorios accesorios, los campos pulmonares se encontraron hipoaereados, el precordio con ruidos cardiacos rítmicos, abdomen con cicatriz subcostal derecha, depresible, sin crecimientos, peristalsis normal, edema de miembros pélvicos, pulsos palpables, simétricos. La saturación periférica de O2 respirando aire ambiente fue del 70%, misma que incrementó hasta 93% con el uso de mascarilla bolsa reservorio. Los primeros estudios de laboratorio mostraron anemia macrocítica normocrómica con hemoglobina (Hb) de 5.6 g/dL, leucocitosis de 18,900 con neutrofilia de 14,500, 3,600 linfocitos, 700 monocitos y 100 basófilos. La glucemia fue de 118 mg/dL, hubo azoemia con elevación prerrenal e hiperuricemia de 11.95 mg/ dL. El sodio fue de 133.3 mmol/L, el resto de los iones medidos se reportaron dentro de los límites normales. Las pruebas funcionales hepáticas con hiperbilirrubinemia de 6.20 mg/dL con predominio de la indirecta (5.09 mg/dL), transaminasemia a expensas de AST, hipoalbuminemia de 3.2 g/L. El dímero D fue de 2,586.80 ng/mL. La gasometría inicial (FIO2 66%) reportó pH 7.46, PCO2 26.6 mmHg, PO2 61.90 mmHg, HCO3 19.10 mEq/L, el índice de Kirby fue de 93.78. Se sospechó anemia hemolítica por lo que se solicitó prueba de Coombs directa, la cual fue reportada como positiva (los estudios de laboratorio se muestran en la tabla 1). El frotis de sangre periférica reportó hipocromía, anisocitosis, esferocitos +, macrocitos + y agregados de glóbulos rojos (figura 1a-1b). La radiografía de tórax mostró imagen en vidrio despulido e infiltrado micronodular difuso, escala RALE 5/8. Con los resultados de la prueba de Coombs directa positiva se decidió iniciar tratamiento a base de prednisona 1 mg/kg/día. Los controles de laboratorio después de iniciado el tratamiento mostraron mantenimiento del nivel de Hb y descenso de las bilirrubinas, además de aumento en el número de leucocitos, por lo que se decidió transfusión de concentrados eritrocitarios. La prueba de reacción en cadena de la polimerasa (PCR) para detección de SARS-CoV-2 se informó positiva 2 días después de su ingreso. Se comunicó a los familiares acerca de la necesidad de someterse a estudios adicionales de laboratorio, determinando postergar la realización de los mismos. Evolucionó hacia el deterioro con progresión de las manifestaciones de insuficiencia respiratoria y desarrollo de acidosis respiratoria en la gasometría; se propuso intubación orotraqueal y asistencia mecánica ventilatoria, lo cual fue desaprobado. A los 5 días de ingreso se encontró con ausencia de respuesta a estímulos verbales y nociceptivos, anisocoria por midriasis izquierda, sin respuesta a estímulos luminosos, ausencia de reflejos oculocefálicos y oculovestibulares, arreflexia osteotendinosa y patrón respiratorio tipo Biott. Se propuso de nueva cuenta intubación y asistencia mecánica ventilatoria; después de haberlo consultado con los familiares, se optó por ofrecer confort. Falleció 6 días después de haber ingresado, sin someterse a estudios adicionales de laboratorio y gabinete
Tabla 1 Estudios de laboratorio
| Parámetro | Ingreso | Día 2 | Día 5 | Día 6 |
|---|---|---|---|---|
| Hb | 5.6 g | 5.8 g | 7.6 g | 6.5 g |
| Hto | 13.40% | 15.90% | 20.20% | 19.20% |
| VGM | 118.4 FL | 111 FL | 117.9 FL | 117.3 FL |
| MCH | 49.3 pg | 40.7 pg | 44.3 pg | 39.3 pg |
| MCHC | 41.7 g/L | 36.6 g/L | 37.6 g/L | 34.0 g/L |
| RDW | 18.10% | 19.30% | 23.10% | 22.90% |
| Plaquetas | 631,000 | 647,000 | 561,000 | 489,000 |
| Leucocitos | 18,900 | 18,100 | 61,100 | 42,500 |
| Neutrófilos | 14,500 | 14,800 | 50,100 | 33,800 |
| Basófilos | 100 | 100 | 0 | 100 |
| Linfocitos | 3,600 | 2,600 | 17,500 | 17,600 |
| Eosinófilos | 0 | 0 | 0 | 0 |
| Monocitos | 700 | 600 | 600 | 2,800 |
| BT | 6.20 mg | 2.66 mg | 4.07 mg | 3.08 mg |
| BD | 1.11 mg | 0.77 mg | 1.64 mg | 1.42 mg |
| BI | 5.09 mg | 1.89 mg | 2.43 mg | 1.66 mg |
| AST | 64 U | 64 U | 52 U | 61 U |
| ALT | 21 U | 23 U | 35 U | 32 U |
| Albúmina | 3.2 g | 2.7 g | 2.6 g | 2.3 g |
| GGT | 36 U | 29 U | 42 U | 37 U |
| DHL | 641 U | 640 U | 618 U | 591 U |
| Dímero D | 2,586.8 ng | |||
| FIO2 | 66% | 66% | ||
| pH | 7.46 | 6.84 | ||
| PCO2 | 26.6 | 163.6 | ||
| PO2 | 61.9 | 70.6 | ||
| HCO3 | 19.1 | 29.8 | ||
| Sat O2 | 93.10% | 72.90% | ||
| PO2/FIO2 | 93.8 | 107 |
ALT: Alaninoaminotransferasa; AST: Aspartato aminotransferasa; BD: Bilirrubina directa; BI: Bilirrubina indirecta; BT: Bilirrubina total; DHL: Deshidrogenasa láctica; FIO2: Fracción inspirada de oxígeno; GGT: Gamma glutamiltransferasa; Hb: Hemoglobina; HCO3: Bicarbonato Sat O2: Saturación de Oxígeno; Hto: Hematocrito; MCH: Hemoglobina corpuscular media; MCHC: Concentración de hemoglobina corpuscular media; PCO2: Presión parcial de Dióxido de carbono; PO2: Presión parcial de Oxígeno; PO2/FIO: Índice de Kirby; RDW: Amplitud de distribución eritrocitaria; VGM: Volumen globular medio; VPM: Volumen plaquetario medio.
DISCUSIÓN
El término hemólisis se refiere a la destrucción de los eritrocitos y acontece en un amplio rango de condiciones clínicas. Si la destrucción de los eritrocitos es lo suficientemente importante para disminuir los valores de hemoglobina, por debajo de lo normal, ocurre anemia hemolítica; entonces la anemia hemolítica se define como anemia debida a sobrevida reducida de los eritrocitos circulantes, antes de concluir su vida circulante de 120 días. Existen numerosas causas, incluyendo congénitas y adquiridas, procesos agudos y crónicos, casos leves y hasta casos que ponen en peligro la vida1-3.
La destrucción prematura de los eritrocitos puede ocurrir de forma intra o extravascular en el sistema reticuloendotelial, aunque lo último es más común.
El mecanismo primario extravascular es el secuestro y fagocitosis debido a la pobre deformabilidad de los eritrocitos. El mecanismo intravascular incluye destrucción celular directa, fragmentación y oxidación. Las anemias hemolíticas autoinmunes (AHAI) se clasifican, usualmente, causadas ya sea por anticuerpos calientes o anticuerpos fríos. La incidencia exacta en adultos no es clara, en Francia, en menores de 18 años, se estima una incidencia de 0.81/100,000 por año. Puede ocurrir en 10% de los pacientes con lupus eritematoso sistémico (LES) y en 5-10% de pacientes con leucemia linfocítica crónica. La AHAI por anticuerpos calientes, está caracterizada por la unión de inmunoglobulinas policlonales (frecuentemente IgG) a los antígenos de los eritrocitos (Rh o glicoporinas A-D), esta unión es referida como caliente ya que reacciona con la membrana de los eritrocitos a temperaturas corporales normales, siendo máxima a los 37 °C. La densidad de estos antígenos a los eritrocitos no es suficiente, usualmente, para fijar complemento. Los eritrocitos opsonizados son modificados y convertidos en esferocitos y eventualmente depurados por FC RIII o receptores C3b en los macrófagos, esto ocurre fuera de la circulación (destrucción extravascular). La aglutinación de los eritrocitos es observada raramente en el frotis. En contraste, la enfermedad por aglutininas frías, el subtipo menos común, es causada por un anticuerpo IgM (clonal u oligoclonal) que se une a los antígenos de los eritrocitos (frecuentemente cadena ramificada “I” adulto) a bajas temperaturas, causando lisis al recalentamiento por fijación del complemento. La unión del complemento ocurre debido a la estructura de la IgM y a la alta densidad del antígeno sobre los eritrocitos, llevando a la agregación de eritrocitos en el frotis de sangre periférica y acrocianosis clínica, así como a activación del complemento, esta puede ser completa hasta C9 o incompleta, con eritrocitos marcados con C3, siendo depurados por los macrófagos en sitios extravasculares1,2,4.
La historia natural de la AHAI no ha sido aún completamente detallada; la relacionada a infección o exposición a drogas es con frecuencia clínicamente leve y de corta duración, en tanto la AHAI crónica algunas veces está relacionada con un proceso linfoproliferativo subyacente, como probablemente ocurrió con nuestro paciente, dado el aumento en el número de leucocitos que presentó, o con enfermedad autoinmune. Hay una asociación entre AHAI con linfoma no Hodgkin y leucemia linfocítica crónica, es rara en pacientes con enfermedad de Hodgkin. El trasplante de células madre hematopoyéticas alogénico puede incrementar el riesgo de AHAI4.
Cuando un paciente se presenta con anemia, un enfoque escalonado debe ser hecho. Las investigaciones iniciales simples deben alertar al médico para sugerir hemólisis como causa de la anemia5. Los estudios iniciales de laboratorio son usados para confirmar el diagnóstico de anemia hemolítica y para determinar la causa probable. Se han descrito varios marcadores de hemólisis, los cuales están alterados en diferentes formas; entonces ayudan en el diagnóstico diferencial y para evaluar la eficacia del tratamiento1,5.
Las pruebas para confirmar hemólisis pueden ser hechas simultánea o secuencialmente para determinar la causa, en algunos casos, incluso pueden omitirse si los estudios específicos están disponibles de manera rápida y puedan ser definitivos. Ahora bien, algunos pacientes con anemia severa o con otros hallazgos que pongan en peligro la vida, pueden requerir intervenciones para salvarla, antes de que incluso la hemólisis haya sido identificada al igual que la causa; dichas intervenciones incluyen de acuerdo a la condición, transfusión, plasmaféresis o hidratación vigorosa, las cuales no pueden detenerse mientras se confirma el diagnóstico3.
Aun cuando se han descrito varios marcadores de hemólisis, no existe una prueba diagnóstica sencilla y específica para anemia hemolítica. Muchos expertos consideran que el diagnóstico será acertado si hay mayoría de los siguientes hallazgos3:
a)Anemia no debida a causa obvia
El abordaje diagnóstico inicia con citometría hemática, que revela anemia normocítica/macrocítica; la hemólisis induce reticulocitosis, la cual a su vez provoca macrocitosis. El nivel de Hb es el marcador más directo de la severidad clínica en enfermedades hemolíticas. Sus niveles pueden estar cerca de los valores normales en formas leves o reducidos de manera importante en formas moderadas (Hb de 8-10 g/dL) y en aquellas muy severas (Hb menor de 6 g/dL) como ocurrió con nuestro paciente en que se encontró anemia normocrómica macrocítica con niveles de Hb de 5.6 g/dL. En un estudio retrospectivo de 308 casos, se demostró que el valor de la hemoglobina al momento del diagnóstico fue el predictor más importante del resultado, incluyendo el riesgo de muerte y requerimiento de múltiples líneas de tratamiento. Está descrito que el desarrollo agudo es observado más frecuentemente en enzimopatías y en formas hemolíticas autoinmunes, el descenso rápido provoca síntomas relevantes1,2.
Los niveles de Hb deben monitorearse estrechamente en pacientes hemolíticos, es el pivote para evaluar la respuesta al tratamiento. En la AHAI la respuesta a la terapia se define como completa con valores de Hb mayores a 12 g/dL y la normalización de los marcadores de hemólisis o parcial con niveles de Hb mayores de 10 g/dL o el incremento de 2 gramos respecto de los valores basales y la reducción de los marcadores, sin necesidad de transfusión1.
b)Incremento en el conteo de reticulocitos
El cual no es explicado por sangrado reciente, repleción de hierro, vitamina B12, cobre o administración de eritropoyetina. Implica una producción acelerada de eritrocitos en la médula ósea. Es un hallazgo típico, pero no específico. Puede haber incremento en respuesta a sangrado, repleción de nutrientes o administración de eritropoyetina y en otras condiciones (embarazo). Los reticulocitos están elevados en el momento de la presentación de manera habitual. Son precursores directos no nucleados de los eritrocitos, representan una pequeña porción de eritrocitos periféricos (valores cercanos al 1%). Dado que el conteo de reticulocitos es un número relativo que puede estar artificialmente incrementado o disminuido, se requiere el porcentaje de reticulocitos corregido, que se obtiene mediante la siguiente fórmula: reticulocitos (%) × Hto del paciente/Hto normal. Así, en nuestro caso, el porcentaje de reticulocitos fue de 7.62% × (13.4/45) =7.62 × 0.29 = 2.2%. El porcentaje sin corregir fue de 7.62% y el corregido de 2.2%, lo que cumplió el criterio de reticulocitosis. Se ha propuesto emplear el conteo absoluto de reticulocitos, que se corrige empleando la esperanza de vida estimada del reticulocito, que es de 1.0, 1.5, 2.0 y 2.5 días para un nivel de Hto de 45, 35, 25 y 15%, respectivamente. El conteo absoluto de reticulocitos en nuestro caso fue el siguiente: conteo absoluto de reticulocitos/ esperanza de vida, esto es 1’302,000; Hto 13.4%, esperanza de vida 2.5; entonces 1’302,000/2.5 = 520,800 microL (lo que resulta elevado), o algunos autores sugieren emplear el índice de respuesta de la médula ósea (BMRI por sus siglas en inglés), que se obtiene de la multiplicación de los reticulocitos absolutos corregidos por el resultado de dividir la Hb del paciente/Hb normal, en el caso que reportamos fue de 41,780; un valor de corte menor de 121 discrimina hemólisis con reticulocitopenia in- adecuada1,3.
En AHAI los reticulocitos permanecen elevados por varios días hasta que los niveles de Hb se recuperan; son útiles para monitorear la recuperación o la respuesta al tratamiento. Esta respuesta requiere típicamente de 3 a 5 días para que ocurra.
c)DHL y bilirrubina elevada, haptoglobina baja
Las otras alteraciones que parecen ser típicas, mayores de anemia hemolítica, además de la reticulocitosis, son las manifestaciones de destrucción eritrocitaria con la consecuente liberación de productos3.
Deshidrogenasa láctica
Enzima que cataliza la conversión de lactato en ácido pirúvico, localizada en el citoplasma y distribuida en varios órganos (corazón, músculo, hígado y cerebro). Se puede medir en suero debido al recambio celular fisiológico. Se conocen hasta ahora 5 isoenzimas, las tipo 1 y 2 se expresan en los eritrocitos, estando frecuentemente incrementadas en hemólisis; pueden ser útiles para distinguir la hemólisis extra de la intravascular. Si bien su elevación junto con el resto de las alteraciones puede sugerir hemólisis, no es específica; puede incrementarse en otras condiciones, las cuales involucran necrosis celular e incremento en la renovación de tejidos. Es un indicador de la respuesta al tratamiento. Nuestro paciente tuvo un valor inicial de DHL de 641 UI, dicha elevación pudo haber sido consecuencia tanto de la hemólisis como de la infección por SARS-CoV-2 que está reconocida como parámetro de severidad de la infección1,3.
Bilirrubina
Cuando la elevación de la bilirrubina es consecuencia de hemólisis, el aumento es predominantemente a expensas de la indirecta. La bilirrubina Xa deriva del metabolismo del anillo de la protoporfirina IX del hem; 85% de la bilirrubina circulante deriva del catabolismo de la Hb en los órganos reticuloendoteliales; la eritropoyesis ineficaz constituye un foco adicional. Es un buen marcador para hemólisis extravascular y en menor grado para intravascular. El paciente objeto del reporte presentó hiperbilirrubinemia de 6.20 mg/dL con 5.09 mg/dL de la fracción indirecta, lo que apoyó hemólisis. Es un marcador temprano de la respuesta a la terapia, regresa a lo normal o entre el 10% de los valores normales 4 horas después del cese de la hemólisis1,3,4.
Haptoglobina baja
Es una proteína sintetizada en el hígado que se clasifica dentro de las alfa-2 globulinas en la electroforesis. Se le confieren propiedades antioxidantes e inmunomoduladoras, actúa como un eliminador al unirse con la Hb sérica circulante liberada por la hemólisis o por renovación de los eritrocitos normales, previniendo la liberación del hem reactivo altamente tóxico. El complejo que resulta es depurado por el sistema reticuloendotelial a través de los receptores CD/63. Después de la endocitosis, el complejo haptoglobina-hemoglobina es degradado por lisosomas, causando así depleción de haptoglobina. Una haptoglobina baja o ausente suele ser vista en hemólisis de cualquier causa; la sensibilidad y especificidad de valores por debajo de 25 mg/dL fue del 83 y 96%, respectivamente. Sin embargo, un valor normal o alto no elimina la posibilidad de hemólisis, ya que es un reactante de fase aguda y puede aumentar si coexiste con inflamación1,3.
La combinación de DHL aumentada y haptoglobina baja fue 90% específica para diagnosticar hemólisis; desafortunadamente no se pudo hacer la determinación de haptoglobina en nuestro paciente. Los valores bajos también se observan en enfermedad hepática, transfusión previa y ahaptoglobinemia, mientras que valores elevados se presentan en enfermedades inflamatorias, tabaquismo y síndrome nefrótico.
Una vez que se ha considerado anemia hemolítica, enseguida debe practicarse la prueba de antiglobulina directa (DAT, por sus siglas en inglés), esta es la piedra angular del diagnóstico. La enfermedad hemolítica autoinmune, además de la supervivencia acortada de los eritrocitos requiere de evidencia serológica de respuesta inmune contra antígenos autólogos de los eritrocitos; esta se consigue mediante la prueba de antiglobulina directa positiva, descrita por Coombs en 1945, conocida frecuentemente como prueba de Coombs. En la prueba los autoanticuerpos se unen a los eritrocitos del paciente in vivo y son detectados al adicionar un reactivo, globulina antihumana poliespecífica, la cual puede detectar IgG y complemento, pero no IgA o IgM. El reactivo es suficientemente grande para aglutinar a los eritrocitos4,6,7
Para tener mayor especificidad, la prueba de antiglobulina directa actualmente emplea anticuerpos monoclonales específicos para IgG, IgM, IgA, así como para fracciones C3c y C3d del complemento. La prueba de antiglobulina directa puede dar falsos negativos por la presencia de anticuerpos unidos a los eritrocitos por debajo del umbral de la prueba. La prueba en tubo diagnóstica efectivamente AHAI cuando por lo menos 500 moléculas de anticuerpos están unidos a los eritrocitos, en tanto que las pruebas de microcolumna y de fase sólida requieren de 200 a 300 moléculas para producir un resultado positivo. Recientemente la prueba en tubo fue reportada con mayor especificidad aunque con menor sensibilidad, mientras que la de microcolumna y de fase sólida reducen especificidad, pero aumentan sensibilidad. Otras técnicas más sofisticadas y no disponibles de manera rutinaria pueden detectar cantidades pequeñas de anticuerpos. Es importante notar que un pequeño pero significativo número de pacientes tiene una prueba positiva sin hemólisis, se ha reportado en 1:14,000 donadores sanos y de 1-15% en pacientes hospitalizados4. Otros autores consideran menos de 0.1% y de 0.3-8%, respectivamente.
Una prueba positiva también puede ocurrir en otras circunstancias, tales como administración exógena de inmunoglobulina, trasplante reciente de órganos sólidos o de células madre hematopoyéticas, LES, mononucleosis infecciosa y enfermedades hematológicas entre las que se incluyen enfermedades linfoproliferativas.
Otras razones por las que se obtiene un resultado positivo pueden ser la presencia de aloanticuerpos en pacientes recientemente transfundidos, en reacciones transfusionales hemolíticas retardadas y en la enfermedad hemolítica del recién nacido. Una de las causas más comunes es la AHAI, esta se clasifica sobre la base de la amplitud térmica de los autoanticuerpos; cuando es causada por IgG se llama AHAI por anticuerpos calientes, mientras que la AHAI por anticuerpos fríos es causada, típicamente, por IgM que fija complemento a la superficie del eritrocito. La AHAI por anticuerpos calientes es más común que la fría (48-70% de los pacientes), puede ser diagnosticada con una presentación clínica consistente y una DAT positiva a IgG sola o cuando la prueba es positiva a C3d + IgG. La enfermedad por aglutininas frías es responsable de alrededor del 20% de los casos (15-25%), es causada por anticuerpos IgM que son más activos a bajas temperaturas, causando lisis por fijación del complemento y hemólisis intravascular, estos anticuerpos se unen a los eritrocitos en la circulación periférica más fría causando aglutinación que provoca acrocianosis o fenómeno de Raynaud.
En algunos pacientes la IgM se une a C1q en la membrana del eritrocito activando la vía clásica del complemento llevando a la prueba que típicamente es positiva para C3d, aunque a veces se puede detectar un pico IgG. Este proceso conduce a la remoción extracelular de C3b (que recubre a los eritrocitos) por el sistema reticuloendotelial. Sin embargo, las exacerbaciones pueden activar a C5 llevando a hemólisis intravascular. Aquellos pacientes que son positivos a C3d +/- IgG tienen que someterse a una prueba de aglutinación directa que sirve como prueba de escrutinio, y una aglutinina fría clínica- mente significativa puede excluirse si los eritrocitos suspendidos en solución salina no son aglutinados después de incubación a temperatura ambiente por 30-60 minutos; si esta prueba es positiva, entonces se puede proceder a la titulación de anticuerpos. El diagnóstico se puede hacer en pacientes con AHAI y DAT positiva para C3d ± IgG con una presentación clínica coherente y títulos de anticuerpos fríos igual o mayor de 1:64 a 4 °C. Cuando se somete a electroforesis puede ser detectada una paraproteína monoclonal, usualmente IgM k.
Las formas mixtas son causadas por una combinación de anticuerpos calientes IgG y anticuerpos fríos IgM (10% de los casos); la prueba es positiva para IgG y C3d. Los síntomas asociados con el frío aparecen raramente y los anticuerpos fríos tienen títulos menores de 1:64, pero con una amplitud térmica superior (30-37 °C), el diagnóstico se establece con una prueba positiva para IgG y C3d, un anticuerpo frío con amplitud térmica superior y una presentación clínica acorde. Si bien estas 3 formas son las más comunes hay un aumento reportado de formas atípicas o de difícil clasificación con DAT negativa, frecuentemente severas, refractarias a tratamiento o con recaídas frecuentes, y por lo regular con desenlace fatal. Adicionalmente, existen casos reportados por anticuerpos IgM con actividad térmica estrecha a temperatura fisiológica que tiene un curso severo y mortalidad cercana al 20%2,4-7.
En el caso que reportamos, la prueba de Coombs fue positiva, lo que corroboró el diagnóstico de anemia hemolítica autoinmune, empero, al tener una prueba poliespecífica y carecer de una monoespecífica y al no contar con la aprobación de más estudios serológicos para determinar el tipo de autoanticuerpo o fracción del complemento involucrado, permaneció sin ser identificado y llegar por ende a una adecuada clasificación.
Cuando la prueba DAT es positiva, deben ser considerados forzosamente fármacos, ya que se ha demostrado asociación con una prueba positiva con o sin anemia hemolítica. Los fármacos involucrados incluyen penicilinas y otros antibióticos, así como alfa metil dopa(6), fármacos que nuestro paciente no recibió.
Una vez que la prueba DAT es positiva y los marcadores de hemólisis corroboran dicha entidad, es preciso hacer una revisión del frotis de sangre periférica, aun cuando no se hace de manera rutinaria hoy en día. De hecho, la búsqueda de la causa subyacente de anemia hemolítica inicia con este estudio en busca de eritrocitos anormales, tales como esferocitos, esquistocitos, degmacitos o eritrocitos con vejigas. En muchos casos, los hallazgos son esenciales para proveer un tratamiento que salve la vida (por ejemplo, microangiopatías trombóticas como PTT o inducidas por drogas o infecciones como malaria o babesiosis). La esferocitosis no es diagnóstica de anemia hemolítica, ya que tanto la forma hereditaria como la adquirida de naturaleza autoinmune causan esferocitosis. Los esquistocitos son células fragmentadas que resultan de destrucción intravascular, los degmacitos o con vejigas resultan de fagocitosis parcial por causas oxidativas. Los acantocitos sugieren enfermedad hepática, los eritrocitos fantasmas indican hemólisis intravascular severa asociada con infección bacteriana mortal. Los eliptocitos sugieren mielodisplasia2-4. En nuestro caso, el frotis de sangre periférica reveló anisocitosis, esferocitos +, macrocitos + y aglutinación de glóbulos rojos; los hallazgos del frotis pueden sugerir AHAI por anticuerpos fríos (aglutinación de eritrocitos) o incluso una forma mixta; dada la evolución clínica la posibilidad más fuerte de la causa de anemia hemolítica es la de enfermedad por anticuerpos fríos (aglutininas frías).
La anemia hemolítica puede ser primaria o secundaria a síndromes linfoproliferativos, infecciones, inmunodeficiencia y tumores. La serología para Mycoplasma pneumoniae, virus Epstein-Barr, citomegalovirus, hepatitis B y C, VIH, anticuerpos antinucleares, anti-DNA, antinuclear extractable, anticoagulante lúpico, anticardiolipina y anti beta 2 son recomendables2,4,5. En nuestro paciente no pudimos llevar a cabo estos estudios para descartar causas secundarias. El único proceso infeccioso documentado fue la infección por SARS-CoV-2.
Con el advenimiento de la pandemia SARS- CoV-2, han aparecido varios reportes de anemia hemolítica autoinmune en este contexto. Mientras muchas complicaciones hematológicas de la infección han sido descritas, el hallazgo de AHAI es nuevo8. El espectro de las complicaciones es amplio e incluye entre otros varios desórdenes autoinmunes tales como trombocitopenia autoinmune, síndrome de Guillain-Barré y síndrome antifosfolípidos. Lazarian y colaboradores describen 7 casos de AHAI en relación con SARS-CoV-2, el tiempo medio de los síntomas fue de 9 días (4-13 días), el nivel de Hb al momento del diagnóstico fue de 7 g/dL (3.8- 10-8 g/dL). Todos los pacientes tuvieron signos de hemólisis. La prueba DAT fue positiva para todos los casos, IgG (2), C3d (3) y 3 con IgG/C3d. Los anticuerpos anti eritrocito fueron anticuerpos calientes en 4 casos y aglutininas frías en 3. En el momento del diagnóstico todos tenían marcadores de inflamación elevados. En el grupo de anticuerpos calientes 2 pacientes tuvieron leucemia linfocítica crónica, uno con gammapatía monoclonal IgG k. En 2 pacientes con aglutininas frías el inmunotipo de linfocitos demostró la presencia de población linfoide B compatible con linfoma de zona marginal9. Hindilerden y colaboradores reportaron un paciente de 56 años positivo a COVID-19 con DAT positiva a IgG/C3 que respondió favorablemente a esteroides10. López y colegas a su vez reportaron un caso semejante8. Sankaran y su grupo reportan el caso de un paciente de 17 años portador de trombocitopenia crónica refractaria positivo a IgG/C3 y que respondió a esteroides; ellos concluyeron que la infección por SARS-CoV-2 actúo como desencadenante en un paciente con disregulación inmunitaria11.
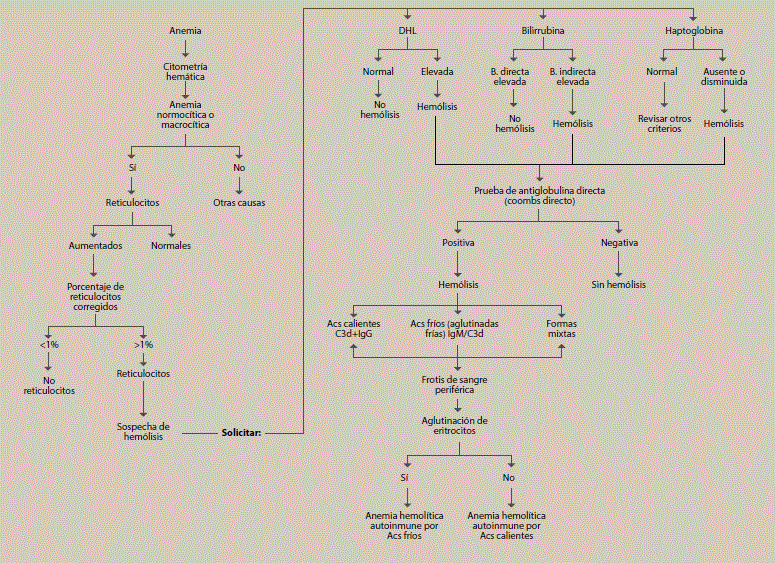
Cuando las aglutininas frías son producidas en asociación con malignidad hematológica o infección se denomina síndrome de aglutininas frías, son producidas cuando las células B producen autoanticuerpos entre 0 a 4 °C12. Son anticuerpos IgM que tienen la habilidad para aglutinar eritrocitos sobre el antígeno de superficie I. La enfermedad primaria es definida por hemólisis crónica, un título significativo de aglutininas frías (igual o mayor de 1:64 a 4 °C), hallazgos típicos en la DAT (prueba monoespecífica para C3d); sin embargo, hasta un 20% de los casos puede ser débil positivo para IgG en adición a C3d. El grupo de expertos que redactaron las recomendaciones del primer consenso internacional reconocen que puede haber casos ocasionales de enfermedad por aglutininas frías con títulos menores de 1:64. Los mismos criterios aplican para el síndrome de aglutininas frías complicando un linfoma agresivo o infecciones específicas. El mismo grupo recomendó también la realización de estudios adicionales para descartar casos secundarios a malignidad (figura 2)4, los cuales en nuestro paciente no se pudieron llevar a cabo.
La patogénesis detrás de las causas infecciosas del síndrome de aglutininas frías permanece indeterminado, se postula que la activación del complemento está asociado con estados inflamatorios, incluyendo la sobrerregulación de citoquinas proinflamatorias, esto puede crear el marco perfecto para hemólisis, especialmente en caso de infección proinflamatoria como es el COVID-1913. Angieleri y su grupo consideran que el mimetismo molecular puede ser la base de las complicaciones más severas en la enfermedad inducida por SARS-CoV-2; los anticuerpos contra las proteínas virales pueden presentar reacción cruzada con las proteínas del endotelio vascular si comparten epítopos antigénicos, esto puede originar vasculitis intensa seguida de trombosis y CID con disfunción multiorgánica. También formularon la hipótesis de que el mimetismo molecular es determinante en la AHAI en pacientes con COVID-19 con ANK-1, esta es una proteína de membrana del eritrocito que provee la conexión entre el esqueleto de la membrana y la membrana plasmática. ANK- 1 comparte un epítopo inmunogénico/antigénico (aminoácido LLLQY) con 100% de identidad con la glucoproteína del SARS-CoV-2 llamada proteína Spike 75014.
Los niveles altos de dímeros D y la coagulopatía han sido reportados frecuentemente en pacientes con enfermedad severa; la prevalencia de enfermedad tromboembólica venosa en pacientes hospitalizados con COVID-19 es del 25-31%. En un estudio de 84 pacientes la incidencia acumulada fue del 31%. La tromboembolia pulmonar fue la complicación más frecuente. Patil y su grupo describen el caso de una paciente de 51 años de edad con enfermedad por aglutininas frías que desarrolló anemia hemolítica y embolismo pulmonar como presentación del COVID-1915. A su vez, Capes reportó un paciente de 62 años de edad que presentó AHAI con aglutininas frías con títulos de 1:16384 y anti-I de 1:102416. El grupo de Jensen reportó 2 casos, uno positivo a C3b/C3d y otro positivo a anticuerpos que reaccionaron al frío; su anticuerpo reaccionó con todos los pacientes y donadores de eritrocitos a temperaturas frías, pero no a temperaturas fisiológicas. En 3 de 4 casos el frotis de sangre periférica reportó de aglutinación de eritrocitos17; de manera semejante ocurrió en nuestro paciente. Chibane y colegas reportan un caso con involucramiento neurológico, ellos documentaron infarto cerebral hiperagudo; un ecocardiograma que se le realizó mostró una masa hiperdensa en cámaras derechas y vena cava inferior; hallazgo reportado en aglutininas frías y anemia hemolítica por Kangal y Dogan14. Nuestro paciente cursó con deterioro neurológico muy sugestivo de infarto cerebral, probablemente extenso, que le provocó herniación uncal y a la postre la muerte.
Se conoce bien la asociación entre anemia hemolítica y trombosis, la cual puede ser vista, ya sea en hemólisis intra o extravascular. El mecanismo no está bien comprendido; los factores postulados incluyen el efecto del hem plasmático libre o Hb, depleción de óxido nítrico, anticuerpos antifosfolípidos en algunos pacientes con hemólisis autoinmune y cambios protrombóticos en la superficie de los eritrocitos, lo que provoca un estado de hipercoagulabilidad. La tromboprofilaxis está recomendada para pacientes con exacerbación aguda, debiéndose considerar en pacientes ambulatorios durante estas (Hb menor de 8.5g/dL)3,5. La Sociedad Internacional de Trombosis y Hemostasia han emitido guías donde se recomienda anticoagulación a dosis profilácticas en todos los pacientes hospitalizados con COVID-19. Algunos centros consideran anticoagulación a dosis completas en pacientes con enfermedad severa, especialmente en aquellos con niveles altos de dímeros D y coagulopatía15.
CONCLUSIONES
El espectro de las alteraciones hematológicas causadas por el SARS-CoV-2 se extiende más allá de las reportadas inicialmente, entre otras, destaca la anemia hemolítica autoinmune. El diagnóstico requiere de la presencia de una serie de anomalías de laboratorio bien definidas. El esclarecimiento del tipo y la etiología obliga a la realización de múltiples estudios adicionales de laboratorio a las cuales deberían someterse los pacientes en la medida de lo posible.











 nueva página del texto (beta)
nueva página del texto (beta)