INTRODUCCIÓN
¿Qué es la EPOC?
La enfermedad pulmonar obstructiva crónica (EPOC) es una enfermedad crónico-degenerativa que se presenta en adultos mayores de 45 años y representa una de las principales causas de morbilidad y mortalidad. Clínicamente se caracteriza por enfisema y bronquitis crónica que conducen al desarrollo de la obstrucción de las vías respiratorias. Los nombres que recibió previamente son: enfermedad broncopulmonar obstructiva crónica, obstrucción crónica del flujo aéreo, enfermedad pulmonar crónica inespecífica y síndrome pulmonar obstructivo difuso. Actualmente se define como una enfermedad frecuente, prevenible y tratable, caracterizada por persistentes síntomas respiratorios y limitación del flujo aéreo debido a anomalías de las vías respiratorias o alveolares, causadas por la exposición a partículas o gases nocivos. La limitación crónica del flujo aéreo característica de la EPOC es producida por una combinación de enfermedad de vías aéreas pequeñas y destrucción de parénquima, que varían de un individuo a otro1.
EPIDEMIOLOGÍA
La EPOC actualmente ocupa el cuarto lugar entre las principales causas de morbilidad y mortalidad en el mundo. Su prevalencia depende del país, la edad y el sexo, pero se aproxima a 10% en personas mayores de 40 años. En 2012 fallecieron más de 3 millones de personas por esta causa y se prevé que para el año 2030 sea la tercera causa de muerte debido a la exposición continua a los factores de riesgo y al envejecimiento de la población2.
Los datos reportados sobre la prevalencia de la EPOC dependen de la zona geográfica y de los criterios diagnósticos utilizados. Afecta más a hombres que a mujeres, pero esta diferencia puede cambiar, ya que en los países desarrollados cada vez más mujeres han adquirido el hábito de fumar; y en los países en desarrollo, las mujeres no fumadoras están expuestas a productos de la combustión de biomasa3.
Se han realizado varios estudios para determinar la prevalencia mundial de la EPOC, como el de Halbert y su equipo de trabajo, quienes encontraron una prevalencia en adultos mayores de 40 años de 9 a 10%; sus resultados estuvieron basados en estimaciones espirométricas4. Adeloye y colaboradores realizaron un metanálisis a nivel global, utilizando datos basados en espirometría, y estimaron una prevalencia del 10.7% (7.3 a 14%) en 1990 y el 11.7% (8.4 a 15.0%) en 2010, correspondientes a 227 y 384 millones de casos afectados5.
En África, la prevalencia de EPOC es difícil de calcular, por varias razones, a saber: la población está más expuesta a enfermedades pulmonares como la tuberculosis; el consumo de tabaco se ha incrementado en los últimos años; hay estándares inadecuados de promoción de la salud; la evaluación de la función pulmonar está escasamente disponible porque no cuentan con espirómetros, y los tratamientos están basados principalmente en las exacerbaciones5.
En América Latina, se realizó un estudio multicéntrico denominado PLATINO, en el que se reportaron datos de 5 ciudades (São Paulo, Ciudad de México, Montevideo, Santiago de Chile y Caracas) sobre la situación epidemiológica de la EPOC, que van desde 7.8% en México, hasta 19.7% en Montevideo6.
En México existen muy pocos estudios relacionados con la EPOC. Uno de ellos se realizó en el año 2008; se reclutaron pacientes en 27 ciudades de 20 estados, se les aplicaron encuestas y se realizó espirometría. De los 2,293 sujetos incluidos, 472 (20.6%) fueron positivos a obstrucción de flujo de aire. De la población estudiada, los pacientes que presentaron obstrucción fueron los que habían fumado más cigarrillos por más años, y las mujeres presentaron mayor exposición a humo de biomasa que los hombres7. El Instituto Nacional de Enfermedades Respiratorias (INER) ubicó a la EPOC, en 2016, en el cuarto lugar en la tabla de morbimortalidad anual8.
FACTORES DE RIESGO
Los factores de riesgo tienen que ver con la interacción entre la predisposición genética y la exposición a factores ambientales. La prevalencia de la EPOC y la del tabaquismo están directamente relacionadas; sin embargo, el desarrollo de la enfermedad es multifactorial: uno de los factores de riesgo más importantes es la contaminación atmosférica en el exterior, en el espacio laboral y en espacios interiores.
Tabaco
El tabaco contiene nicotina, ésta se evapora al encender el cigarrillo, se deposita en el pulmón, se absorbe y llega al cerebro. El daño producido en el pulmón está mediado por el alquitrán. La inhalación del humo del tabaco es el principal factor de riesgo en los países desarrollados. El 27% de las muertes por esta enfermedad están relacionadas con el tabaco, aunque no todos los pacientes que fuman la desarrollan9. Las causas del desarrollo de la EPOC por tabaco son múltiples. Se han identificado datos de daño oxidante, respuesta inflamatoria con liberación de mediadores como citosinas inflamatorias (células epiteliales y macrófagos alveolares), proteasas y apoptosis, que conducen a un daño pulmonar que no puede ser reparado adecuadamente. La respuesta inflamatoria mediada por los linfocitos T presentes en el pulmón de un fumador es un componente clave de la EPOC que no está presente en los fumadores que no desarrollan la enfermedad10.
Factores genéticos
El factor genético más conocido en el desarrollo de la EPOC es la deficiencia de la enzima alfa1-antitripsina (AAT), que es el inhibidor de proteasa más importante en el organismo humano. Entre el 1 y el 2% de los pacientes desarrollan EPOC por esta causa. El gen de la AAT se transmite por herencia autosómica codominante, de manera que cada alelo recibido de cada progenitor se expresa independientemente al 50%. La AAT en el pulmón inhibe la elastasa de neutrófilos, una de varias enzimas proteolíticas liberadas por los neutrófilos activados durante la inflamación. La ausencia o deficiencia de la AAT conduce a un desequilibrio entre la elastasa y la actividad antielastasa, lo que provoca la destrucción progresiva e irreversible de tejido pulmonar y el posible desarrollo de la EPOC con enfisema de inicio temprano11.
Factores ambientales
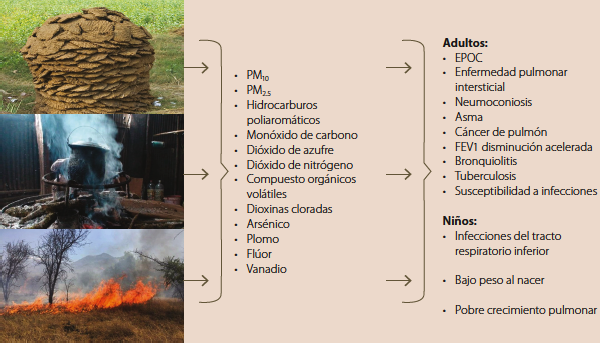
La biomasa es la materia orgánica utilizada como fuente de energía proveniente de animales o vegetales y puede usarse como combustible. Los materiales más utilizados son: madera, ramas, hierbas secas, estiércol y carbón. La exposición al humo de leña al cocinar tiene un gran potencial como agente causal de EPOC, especialmente para las mujeres de áreas rurales que pasan el 70% de su tiempo en un ambiente interior contaminado12. Alrededor de 3 mil millones de personas en todo el mundo están expuestas al humo de este combustible, comparado con 1.01 mil millones que fuman tabaco. Casi 2 mil millones de kg de biomasa se queman todos los días en los países en desarrollo, lo que sugiere que la exposición a este humo podría ser el factor de riesgo global más importante para la EPOC. En países de América Latina las cocinas de leña emiten importantes cantidades de humo. Se considera que el 50% de la población mundial recurre a la biomasa como fuente de energía. En las zonas rurales de México, la biomasa se utiliza en el 69% de los hogares (figura 1) 13,14.
En el año 2013 se encontró que la exposición a humo de biomasa promueve un estado inflamatorio en el pulmón; las mujeres expuestas presentan un mayor número de neutrófilos, eosinófilos, monocitos, mastocitos, linfocitos y macrófagos alveolares, así como niveles superiores de IL-6 y 8 y factor de necrosis tumoral en esputo, comparadas con aquellas que usan otro tipo de combustible15. El humo que emite la quema de biomasa contiene alrededor de 250 compuestos orgánicos como monóxido de carbono, amoníaco, ácido cianhídrico, formaldehído, óxidos de nitrógeno y azufre, etc., además de otros compuestos como el benceno e hidrocarburos aromáticos como el benzopireno, así como partículas sólidas y líquidas de número, tamaño, superficie y composición química diferentes, llamadas partículas de materia (PM) 16. Las PM son constantemente respiradas y se clasifican de acuerdo con su diámetro aerodinámico en PM10 (partículas gruesas de diámetro de 10µm o menos), PM2.5 (partículas finas de diámetro de 2.5 µm o menos) y PM0.1 (partículas ultrafinas de diámetro de 0.1 µm o menos) 17. Las partículas de menos de 10 µm se pueden inhalar fácilmente y llegar a las partes más profundas del pulmón; las de menos de 2.5µm son aún más dañinas para la salud, pues pueden atravesar la barrera pulmonar y entrar en el sistema sanguíneo y, por lo tanto, tener efectos más dañinos en otros órganos y sistemas del cuerpo18.
PATOLOGÍA
Los 2 fenotipos más conocidos de la EPOC son la bronquitis obstructiva crónica y el enfisema. La bronquitis se define por la presencia de tos y esputo en la mayoría de los días durante al menos 3 meses al año, durante 2 o más años consecutivos, y el enfisema por espacios aéreos distales patológicamente agrandados (figura 2) 19.
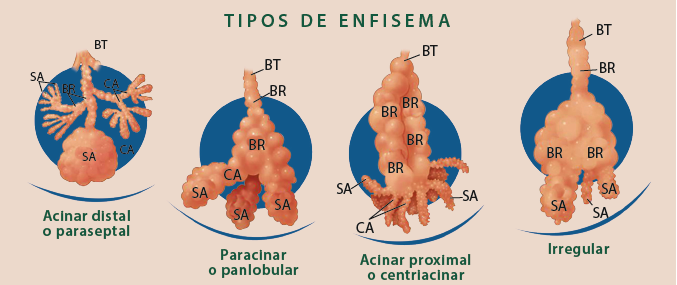
Figura 2 Tipos de enfisema: el bronquiolo terminal (BT) delimita las partes del lobulillo pulmonar secundario que son afectadas en los diferentes tipos de enfisema. El enfisema compromete a los bronquiolos respiratorios (BR), que son los principalmente afectados por enfisema centrilobulillar. Conductos alveolares periféricos (CA), sacos alveolares (SA) y alveolos en el enfisema paraseptal; todos los componentes en enfisema panlobulillar y cualquier parte en el enfisema irregular.
La obstrucción del flujo aéreo surge por los grados de estrechamiento, la hipertrofia del músculo liso, la fibrosis en los bronquiolos respiratorios, y la pérdida de la presión elástica de retroceso debido al enfisema pulmonar. El proceso inflamatorio de la EPOC se inicia por la inhalación de gases nocivos, y se caracteriza por el aumento del número de macrófagos alveolares, neutrófilos, linfocitos T (predominantemente Tc1, TH1 y TH12), y células linfoides innatas que secretan una variedad de mediadores proinflamatorios, citocinas, quimiocinas, factores de crecimiento y mediadores lipídicos20.
Con la presencia de irritantes en el tracto respiratorio, se activan los macrófagos que se ubican sobre la superficie de las células epiteliales de las vías respiratorias que liberan múltiples mediadores quimiotácticos. Todas las vías respiratorias, incluidas las vías aéreas centrales, se inflaman, lo que provoca hiperplasia de las glándulas mucosas e hipersecreción. Las células epiteliales que recubren las vías respiratorias cumplen funciones de protección. El epitelio produce mucinas que se hidratan y forman un gel viscoelástico que se extiende sobre la superficie epitelial21.
Los materiales extraños que se inhalan quedan atrapados en el moco y se eliminan mediante el transporte mucociliar y la tos. La hiperplasia de las células mucoproductoras es una característica de muchos pacientes con EPOC. Los receptores del factor del crecimiento epitelial (EGFR) pueden ser activados por la inflamación neutrofílica mediante la secreción de la elastasa de neutrófilos que liberan TGF-α; el estrés oxidante también puede activar EGFR e inducir la hipersecreción de moco22.
Polverino y su grupo de investigación propusieron el proceso inflamatorio de la EPOC y detallan lo siguiente: en respuesta a las agresiones ambientales, el epitelio de las vías respiratorias y los macrófagos expresan citoquinas que reclutan células B y T inmaduras y células dendríticas (CD). Cuando la inflamación se vuelve crónica debido a la exposición persistente al antígeno o a la lesión tisular, los linfocitos activados que expresan linfotoxina-α-β-heterotrímero interactúan con el receptor de linfotoxina-β en las células estromales vecinas. La estimulación de las células estromales induce la expresión de quimiocinas linfoides y moléculas de adhesión que promueven el reclutamiento adicional de linfocitos B y T y de CD23.
El factor activador de células B de la familia FNT activa las células B, lo que lleva a un aumento en el número de éstas en el pulmón y una expansión en folículos linfoides pulmonares. Las células B activadas liberan interleucina 10, que activa a los macrófagos para liberar las metaloproteinasas 9 y 12 de la matriz, que degradan las proteínas de la matriz extracelular pulmonar, lo que lleva al desarrollo de enfisema y a la generación de fragmentos de matriz que reclutan neutrófilos polimorfonucleares (PMN) en los pulmones. Las PMN liberan la elastasa de neutrófilos, que contribuyen a la pérdida de las paredes alveolares. Las células B activadas proliferan y maduran a células plasmáticas23.
DIAGNÓSTICO Y SÍNTOMAS CLÍNICOS
Para el diagnóstico de la EPOC es importante conocer los antecedentes de exposición a factores de riesgo, y la presencia de los principales síntomas (disnea, tos, producción de esputo, opresión torácica, sibilancias y congestión del pecho); es esencial una historia clínica bien detallada donde se recabe la mayor cantidad de datos de todo nuevo paciente en el que se conozca o se sospeche de EPOC, y una espirometría para establecer el diagnóstico (figura 3).
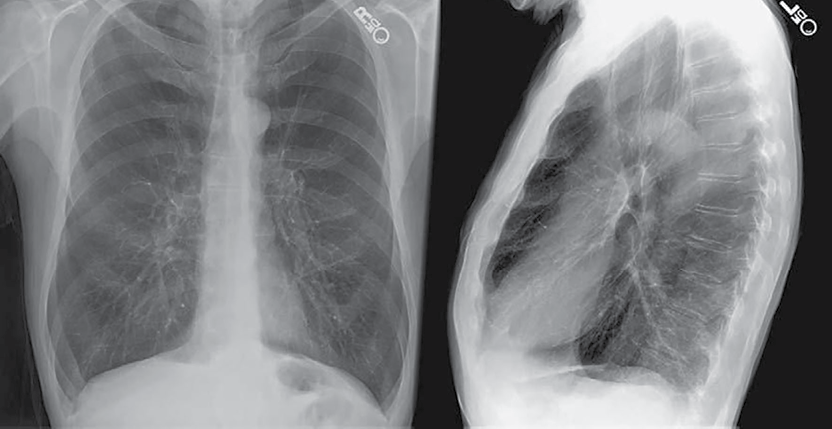
Foto: Martínez et al.
Figura 3 Enfisema: radiografía de tórax, en dirección postero-anterior y lateral, donde se muestra hiperinflación pulmonar (diafragmas aplanados y espacio retroesternal amplio), así como aumento de la radiolucidez en los ápices pulmonares con atenuación de los trayectos vasculares con arborización distorsionada.
Los síntomas asociados con la función pulmonar contribuyen a un aumento del riesgo de exacerbaciones y a un peor pronóstico de la enfermedad. Las exacerbaciones son episodios de inestabilidad que favorecen su progresión, disminuyen la calidad de vida del paciente y aumentan el riesgo de defunción. Se deben a infecciones bacterianas y virales, y a factores estresantes medioambientales. Enfermedades concomitantes, pulmonares y otros procesos sistémicos pueden desencadenar o complicar estas agudizaciones24.
Por otro lado, se ha demostrado que el sueño influye sobre la respiración, que incluye cambios tales como su control central, la mecánica pulmonar y la contractilidad del músculo, que no tienen un efecto adverso en los individuos sanos, pero pueden dar lugar a hipoxemia e hipercapnia significativa en pacientes con EPOC, particularmente durante el sueño de movimientos oculares rápidos (MOR) 25.
Los síntomas de EPOC tienen variabilidad a lo largo del día: hay alteraciones nocturnas en el control de la ventilación y los pacientes pueden tener dificultad para dormir, lo que afecta el sueño. En un estudio de población holandesa se demostró una variación diurna en el tamaño de las vías respiratorias en sujetos sanos, en los que se ha encontrado una variación de aproximadamente 4% del nivel promedio de la madrugada en FEV1 y de aproximadamente 8% del nivel promedio en el flujo espiratorio máximo. Esto significaría un cambio diurno en el FEV1 de 140 mL para un hombre sano de 44 años. Sin embargo, aún no se ha demostrado la variación diurna en la función pulmonar en pacientes con EPOC26.
Todas las investigaciones que se han realizado en relación con los síntomas de la EPOC nos llevan a darle una gran importancia a la evaluación de la calidad del sueño, con el objetivo de saber cuál es la causa de la dificultad al iniciarlo, del mayor consumo de hipnóticos, de los despertares frecuentes y de una prevalencia mayor de somnolencia excesiva durante el día.
Espirometría
La espirometría es la principal prueba de función pulmonar, y resulta imprescindible para la evaluación y el seguimiento de las enfermedades respiratorias; es una prueba accesible y no invasiva, y es la medición más reproducible y objetiva de la limitación del flujo aéreo.
Las principales variables de la espirometría son la capacidad vital forzada (CVF) y el volumen espiratorio forzado en el primer segundo (FEV1). La CVF representa el volumen máximo de aire exhalado en una maniobra espiratoria de esfuerzo máximo, iniciada tras una maniobra de inspiración máxima, expresado en litros. El FEV1 corresponde al volumen máximo de aire exhalado en el primer segundo de la maniobra de FVC, también expresado en litros. A su vez, el cociente FEV1/CVF muestra la relación entre ambos parámetros27.
La espirometría puede realizarse después de la administración de una dosis de un broncodilatador inhalado de acción corta, lo que reduce la variabilidad. La presencia de un valor de volumen espiratorio máximo en un segundo entre la capacidad vital forzada FEV1/CVF posbroncodilatador < 0.70, confirma la existencia de una limitación persistente del flujo aéreo1.
Clasificación de la enfermedad
La EPOC puede clasificarse de acuerdo con la gravedad de la obstrucción del flujo aéreo. Se usan valores de corte espirométricos específicos (tabla 1). Debe señalarse que la correlación existente entre el FEV1, los síntomas y el deterioro del estado de salud del paciente es poca1.
Tabla 1. Clasificación de la gravedad de la limitación del flujo aéreo de la EPOC, basada en el Fev1 posbroncodilatador (Global Initiative for Chronic Obstructive Lung Disease [GOLD])
| En pacientes con un valor de Fev1/FVC < 0.70: | ||
| GOLD 1 | Leve | Fev1 ≥ 80% del valor predicho |
| GOLD 2 | Moderada | 50% ≤ Fev1 < 80% del valor predicho |
| GOLD 3 | Grave | 30% ≤ Fev1 < 50% del valor predicho |
| GOLD 4 | Muy grave | Fev1 < 30% del valor predicho |
TRATAMIENTO
Se ha documentado que existe gran variabilidad entre los pacientes con EPOC; por lo tanto, sería necesario un tratamiento farmacológico individualizado. Los fármacos utilizados en el tratamiento de la EPOC reducen los síntomas, la frecuencia y la gravedad de las exacerbaciones. Hasta la fecha, no hay ningún medicamento que modifique el deterioro a largo plazo de la función pulmonar. Las medicaciones comúnmente usadas son broncodilatadores, agonistas beta 2, antimuscarínicos, metilxantinas, corticosteroides o terapias combinadas con estos fármacos1. Recientemente se han estado estudiando nuevas vías por las cuales tratar el proceso inflamatorio que ocurre en la EPOC; una de las que han sido aprobadas es la dirigida a inhibir la fosfodiesterasa de tipo 4 (PDE4).
Las PDE son una familia de enzimas que catalizan la inactivación de los nucleótidos cíclicos adenosín monofosfato (AMPc) y guanosín monofosfato (GMPc), controlan la concentración de estos nucleótidos y la actividad que ejercen sobre las cascadas de señalización intracelular. La fosforilación de las PDE favorece la transcripción de cAMP que inducen la síntesis de citocinas antiinflamatorias y la inhibición indirecta del factor de transcripción nuclear kappa β (NF-kβ). Las bajas concentraciones de AMPc favorecen la inflamación por incremento de IL-8, 12, 17, 22, 23, factor de necrosis tumoral alfa, interferón gamma, CXCL9 y 10, y cuando esa concentración aumenta, se induce una respuesta antiinflamatoria de citocinas antiinflamatorias por producción de IL-6 e IL-10. 28
CONCLUSIÓN
Las enfermedades crónico-degenerativas no trasmisibles, en este caso la EPOC, generan invalidez en el paciente y alteraciones en la organización familiar, así como altos gastos en la atención médica.
El diagnóstico o la sospecha de este en el primer nivel de atención médica es primordial para ofrecer un tratamiento que retarde la evolución de la enfermedad hacia el compromiso respiratorio.
Además, el conocimiento de la etiología le permite al médico de primer contacto realizar actividades de orientación y promoción de la salud, para evitar o disminuir la exposición a los agentes que desencadenan esta enfermedad.
Finalmente podemos comentar que la EPOC en poco tiempo será un problema de salud mundial debido a la exposición a los altos índices de contaminación atmosférica, así como al alto índice de fumadores jóvenes y a la tendencia de la población hacia el envejecimiento, pues es una enfermedad de prevalencia y desarrollo en la edad adulta.











 nueva página del texto (beta)
nueva página del texto (beta)