*Publicado en el Boletín de Información Clínica Terapéutica de la ANMM a
Cuando se aborda por primera vez el estudio de la epilepsia, sin perder de vista las características fundamentes de su definición, dentro de las que resalta la presencia de episodios de descarga encefálica de inicio súbito con automatismo propio y regular, pero definitivamente desligado del ritmo de despolarización de las neuronas del sistema reticular ascendente, se tiende a considerar su fisiopatología como un fenómeno de naturaleza exclusivamente eléctrica cuya actividad produce manifestaciones clínicas estrechamente ligadas con la función que cotidianamente desempeñan las redes neuronales por donde se distribuyen los estímulos anormales de trenes de potenciales propagados, generando la activación de sistemas motores y sensitivos que pueden, incluso, involucrar la participación de grupos neuronales relacionados con los mecanismos de percepción y pensamiento en sí mismos (figura 1).
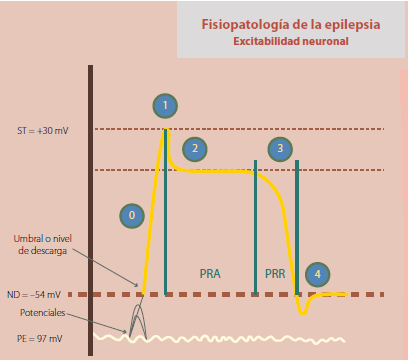
Figura 1 El foco de epileptogénesis equivale a una pequeña área tridimensional localizada en alguna zona de la masa celular encefálica, de la cual parten potenciales propagados que recorren distancias variables en todas direcciones y sentidos, simulando una esfera irregular diminuta, cuyos límites corresponden a un frente de onda en período refractario ya sea absoluto (PRA) o relativo (PRR), que le impide su expansión más allá de sus fronteras (bloqueo de salida) pero que al mismo tiempo evita que estímulos externos invadan su territorio (bloqueo de entrada), al encontrar prolongada de manera infinita su velocidad de conducción en los límites impuestos por ese mismo frente de onda.
Sin embargo, a medida que se profundiza en su estudio y se analiza la serie de fenómenos que en su conjunto desencadenan esta entidad nosológica, difícilmente se puede sustentar la idea inicial que minimiza su fisiopatología a una serie de despolarizaciones y repolarizaciones sucesivas que producen episodios súbitos de actividad eléctrica organizada, pero al mismo tiempo carente de sincronía con relación al resto de las funciones que desempeña el sistema nervioso central (SNC); es decir, en esta entidad nosológica se generan descargas rítmicas, pero asincrónicas.
No obstante que clínicamente las crisis pueden ser generalizadas, focalizadas o secundariamente generalizadas, resulta muy difícil aceptar que la actividad eléctrica de una crisis generalizada dependa de despolarizaciones que en tiempo y en espacio se generan repentinamente en forma simultánea y coordinada, con varias áreas de distintas zonas del encéfalo y en ambos hemisferios, y que de la misma manera se recuperen, restableciendo su actividad y ritmo de descarga.
Con base en esto podemos afirmar que todas las crisis tienen un origen focal y que, en el caso de las crisis generalizadas, el punto de origen se distribuye casi instantáneamente al resto del encéfalo. Éstas, de hecho, parten de un grupo muy específico de neuronas cuya actividad focalizada y anormal produce las señales necesarias en cuanto a magnitud, velocidad de desplazamiento y espacio, para reclutar a otras redes neuronales en el SNC, con las que en coordinación, generan una descarga generalizada.
En contraste con lo anterior, las alteraciones que sufre la actividad eléctrica de una neurona como unidad no pueden dar lugar a la aparición de un foco de descarga capaz de influenciar la función del resto del encéfalo; para que esto ocurra es necesario que la alteración funcional que esa neurona presenta la padezcan en forma simultánea otras neuronas que le rodean, ya que una sola célula aislada no puede desencadenar un fenómeno eléctrico de esta magnitud.
Cuando un grupo de neuronas contiguas comparten la misma alteración, al sumar sus potenciales en espacio y tiempo, pueden en un momento dado influenciar la actividad eléctrica y la función de otros complejos neuronales, que sin presentar la alteración que produjo el proceso original, contribuyen con la generación y propagación del fenómeno.
EXCITABILIDAD NEURONAL
Las neuronas anormales que forman parte del foco de epileptogénesis muestran alteraciones estructurales en su membrana que condicionan modificaciones sustanciales en sus características electrotónicas y, por ende, en su potencial de equilibrio y velocidad de conducción. Los procesos moleculares que convergen con la aparición de esta serie de alteraciones dieléctricas, dependen fundamentalmente de la actividad de receptores tanto ionotrópicos como metabotrópicos, los que no solo condicionan severas modificaciones en los flujos iónicos, sino en la transmisión sináptica y en la comunicación intracelular.
El nivel de descarga, por ejemplo, se acerca al potencial de equilibrio, por lo que en comparación con lo que sucede con una neurona en condiciones normales, la cantidad mínima de energía que se requiere para desencadenar una respuesta propagada es menor (figura 2); en estas circunstancias, los prepotenciales que antes eran incapaces de alcanzar el umbral de estimulación, ahora lo alcanzan, despertando respuestas propagadas sobre un axón cuya velocidad de conducción es también muy superior a la de una neurona del mismo tipo en condiciones normales. De tal manera que en este proceso juega un papel preponderante la actividad de canales o túbulos iónicos, tanto voltaje dependientes (ionotrópicos) como receptor dependientes (metabotrópicos).
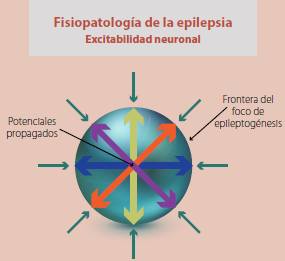
Figura 2 La sumación espacial o temporal de los prepotenciales puede desencadenar respuestas propagadas que se diseminan a través de circuitos neuronales no involucrados con el foco de epileptogénesis. De la misma manera, la disminución del umbral de estimulación o nivel de descarga facilita que estímulos que antes eran incapaces de provocar una respuesta, desencadenen ahora potenciales propagados, provocando el cuadro clínico de epilepsia.
A lo largo del fenómeno disminuye la actividad de las neuronas inhibitorias aferentes al foco de epileptogénesis y se incrementa la aferentación de las neuronas excitatorias, desencadenando brotes de descargas epileptiformes breves, autolimitadas y de alta frecuencia.
Es en esta forma como se puede considerar que las crisis no principian de manera abrupta, sino que se desarrollan paulatinamente, a partir de cambios en la actividad eléctrica del encéfalo.
Estos brotes de descargas regulares y rítmicas de alta frecuencia se autolimitan cuando los potenciales propagados que se generan encuentran a la neurona postsináptica en estado de hiperpolarización; período que al finalizar facilita el disparo de descargas anormales, que en asincronía con el ritmo de descarga de otros conglomerados neuronales se diseminan rápidamente por el encéfalo. Así las crisis no principian abruptamente, sino que se desarrollan a partir de una serie de cambios paulatinos que en un momento dado sufre la actividad eléctrica en el SNC.
RECEPTORES Y NEUROTRANSMISORES
No obstante que la liberación presináptica de acetilcolina puede ser el estímulo desencadenante del fenómeno dieléctrico, es el ácido glutámico (Glu) el que refuerza y sostiene el proceso. Cuando la interneurona facilitatoria libera Glu y este actúa sobre un receptor específico, se activa una proteincinasa que al promover un influjo sostenido de Ca++, da lugar a la formación del complejo Ca++/calmodulina, el que estimula a su vez a otros receptores facilitatorios que además de incrementar la liberación de más neurotransmisores al medio, produce alteraciones en la función mitocrondial que repercuten en la supervivencia de la célula.
Durante el proceso de epileptogenesis, disminuye también la actividad del ácido γ-amino butírico (GABA), el que como neurotransmisor, inhibe la actividad de las neuronas postsinápticas en condiciones homeostáticas.
De tal forma, que cuando se abate su liberación o síntesis o bien, disminuye el número de receptores postsinápticos sobre los cuáles actúa, decrece la electronegatividad del potencial de equilibrio, permitiendo que estímulos de menor intensidad, desencadenen la despolarización de la membrana, con la consecuente formación de potenciales de acción que se propagan rápidamente a través de la neurona postsináptica (figura 2).
De la misma manera, el incremento de la excitabilidad de la neurona postsináptica promueve, a su vez, la liberación de los ácidos Glu y aspártico (Asp).
PROPAGACIÓN DEL ESTÍMULO
Como se señalaba en párrafos previos, del foco de epileptogenesis emergen constantemente breves brotes de descargas de potenciales propagados, que son disparados de manera rítmica y sincrónica, por grupos de células anormales que toman la función de marcapaso.
Estos trenes de descarga pueden en un momento dado potenciar sus estímulos, los que al hacer crecer su frente de onda, despolarizan áreas circunvecinas conformadas por estructuras neuronales anatómica y funcionalmente normales, que se prestan por sus características dieléctricas a la conducción y propagación del estímulo anormal (figura 1).
De esta forma el foco de epileptogénesis estructura y organiza sus propios circuitos, que siendo anormales, los conecta con redes neuronales normales ya establecidas, y que no obstante que su función es por completo distinta e independiente a la de las neuronas que forman parte del proceso patológico, permiten que el estímulo circule de manera reverberante o repetitiva, hasta que los cambios dieléctrios que sufren las membranas de las neuronas involucradas provocan el desgaste y la suspensión del proceso, a través de fenómenos como:
La disminución de la velocidad de conducción.
La producción de períodos refractarios absolutos o relativos, con duración variable, en distintas zonas del circuito involucrado.
La hiperpolarización de las neuronas postsinápticas.
La disminución en cuanto al número de quanta del neurotransmisor liberado.
La disminución de la permeabilidad a los iones.
LA PARTICIPACIÓN DEL SISTEMA INMUNE
Resulta imposible sustraernos de la influencia que los procesos inmunes ejercen sobre el organismo en sí mismo y, sobre todo, sobre el sistema nervioso tanto central como periférico, a pesar de la protección que la evolución le ha proporcionado al dotarlo de una barrera vascular y de un fluido periencefálico.
Inmersos en este contexto unitario, podemos considerar que la presencia en el espacio interneuronal o intersticial de neurotransmisores neuroexcitatorios por ejemplo, o simplemente de substancias capaces de relajar al músculo liso produciendo vasodilatación, o bien la síntesis, liberación o activación de sustancias mediadoras del dolor, como las bradicininas, el tromboxano A2 o el neuropéptido Y logran en un momento dado producir una reacción neuroquímica-inmunológica característica, a la que en muchas ocasiones incluso se le otorga el papel principal dentro del mecanismo fisiopatológico de la epilepsia, sin que su intervención represente en realidad el eje central del fenómeno.
De modo que la simple asociación entre la presencia de algunos de los mediadores de la inflamación con crisis convulsivas no necesariamente implica que, dentro de su fisiopatología, sea la inmunidad la que juega el papel preponderante, ya que su activación también podría ser el resultado indirecto de la participación de otra serie de fenómenos ajenos a los desencadenados por este sistema biológico.
Con base en lo anterior, difícilmente podríamos aceptar que las crisis convulsivas descontroladas y repetitivas pudieran condicionar un proceso inflamatorio crónico en el SNC, el que más bien es el resultado de la activación de vías de señalización capaces de promover cambios en los potenciales electrotónico, de equilibrio y propagado; además de inducir modificaciones fenotípicas, desencadenadas por la activación de genes específicos de apoptosis y migración celular.
Este proceso no necesariamente es el resultado de la activación del sistema inmune ni de la participación de mediadores de la inflamación, cuya influencia dentro del SNC no se limitaría a la producción de crisis epilépticas, sino que potencialmente podría provocar, incluso, encefalitis.
Lo que si es factible es que la producción de factores neuroquímicos que fuera del SNC intervienen en la activación de cascadas proteicas de inflamación, participen dentro del mismo en la producción de focos de epileptogénesis sin desencadenar, necesariamente, un fenómeno de naturaleza inflamatoria.
Estos elementos explican las alteraciones que sufre la función del SNC y desencadenan el cuadro clínico de epilepsia; objetivos precisos a los que se dirigen las acciones terapéuticas de distintos fármacos que producen:
Disminución del influjo del Na+, con lo que se logra conseguir un retardo en la despolarización.
Activación de receptores inhibitorios de la neuroconducción (GABARA), lo que produce potenciales inhibidores postsinápticos.
Disminución del influjo de Ca++, para evitar la liberación de las vesículas sinápticas y, por ende, del neurotransmisor.
La activación los túbulos iónicos voltajedependientes del K+, lo que prolonga la duración de los períodos refractario absoluto y relativo del potencial de acción.
El bloqueo de receptores que facilitan la transmisión sináptica y la transducción de la señal.y
La inactivación de los receptores del Glu, para disminuir la excitabilidad neuronal.
Una vez establecido el diagnóstico y la clasificación de la enfermedad, y habiendo descartado un posible factor etiológico, es imperativo considerar, antes de decidir una intervención terapéutica, el riesgo de recurrencia, la edad de aparición y el pronóstico, y sopesar objetivamente las ventajas y desventajas de la prescripción farmacológica a largo plazo.
La selección de la droga antiepiléptica deberá sustentarse, por un lado, en su efecto químico, que debe estar dirigido al control específico de la alteración fisiopatológica que se desea modificar, de acuerdo al diagnóstico y clasificación de la enfermedad; y por el otro, en la efectividad, seguridad y tolerabilidad del fármaco, considerando, invariablemente, que la monoterapia representa siempre la meta a alcanzar y que debe prescribirse la dosis más baja sugerida en la literatura, antes de incrementarla y alcanzar con ello, su máxima concentración orgánica, de acuerdo a su vida media y tiempo de eliminación; con ello se podrá asegurar una mejor calidad de vida y un adecuado desarrollo intelectual y social.











 nueva página del texto (beta)
nueva página del texto (beta)