Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Medicina (México)
versión On-line ISSN 2448-4865versión impresa ISSN 0026-1742
Rev. Fac. Med. (Méx.) vol.55 no.3 Ciudad de México may./jun. 2012
Artículo de revisión
Enfermedad vascular cerebral
Cerebrovascular disease
Antonio Arauza, Angélica Ruíz–Francob
a Clínica de Enfermedad Vascular Cerebral.
b Instituto Nacional de Neurología y Neurocirugía Manuel Velasco Suárez. México, DF.
Resumen
La enfermedad vascular cerebral (EVC) es un problema de salud pública. De acuerdo con la organización mundial de la salud, la EVC constituye la segunda causa global de muerte (9.7%), de las cuales 4.95 millones ocurren en países con ingresos medios y bajos12. Su tasa de recurrencia a 2 años, va del 10 al 22%, pero puede reducirse hasta en 80% con la modificación de factores de riesgo3. De no existir intervenciones de prevención adecuadas, se calcula que para el año 2030, su incidencia se incrementará hasta 44%4. Datos de la Secretaría de Salud de México muestran que en nuestro país la tasa de mortalidad por EVC se ha incrementado a partir del año 2000, particularmente en menores de 65 años5. Durante el 2007 del total de egresos en hospitales públicos el 1% fue atribuido a EVC, mientras que en el 2008, la tasa de mortalidad fue de 28.3/100,000 habitantes6.
En la presente revisión se abordan los aspectos más relevantes de los principales tipos de EVC; isquemia, hemorragia intracerebral y hemorragia subaracnoidea.
Palabras clave: Infarto cerebral, hemorragia Intracerebral, hemorragia subaracnoidea.
Abstract
Cerebrovascular Disease (CVD) is a public health problem. According to World Health Organization, stroke is the second leading cause of overall death (9.7%), of which 4.95 million occur in countries with low and middle income. The rate of recurrence at two years, ranges from10 to 22%, but it can be reduced by up to 80%, with the modification of risk factors. In the absence of appropriate preventive interventions, it is estimated that by 2030, its incidence will increase up to 44%.4 Data from the ministry of health of Mexico show that in our country stroke mortality rate has increased from the year 2000, particularly in adults younger than 65. In 2007 the total number of discharges in public hospitals 1% was attributed to stroke, while in 2008 the mortality rate was 28.3/100,000.
The present review addresses the most relevant aspects of the main types of stroke, ischemia, intracerebral hemorrhage and subarachnoid hemorrhage.
Key words: stroke, intracerebral hemorrhage, subarachnoid hemorrhage.
DEFINICIÓN Y CLASIFICACIÓN
La enfermedad vascular cerebral (EVC) es un síndrome clínico caracterizado por el rápido desarrollo de signos neurológicos focales, que persisten por más de 24 h, sin otra causa aparente que el origen vascular1–2. Se clasifica en 2 subtipos: isquemia y hemorragia. La isquemia cerebral es la consecuencia de la oclusión de un vaso y puede tener manifestaciones transitorias (ataque isquémico transitorio) o permanentes, lo que implica un daño neuronal irreversible. En la hemorragia intracerebral (HIC) la rotura de un vaso da lugar a una colección hemática en el parénquima cerebral o en el espacio subarac–noideo4–5. En la figura 1 se muestran los principales subtipos y la frecuencia de cada unos de ellos.
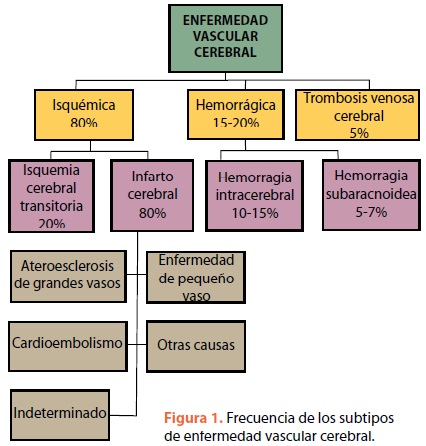
Isquemia cerebral
En el ataque isquémico transitorio (AIT) no existe daño neuronal permanente. La propuesta actual para definir al AIT establece un tiempo de duración de los síntomas no mayor a 60 min, recuperación espontánea, ad–integrum y estudios de imagen (de preferencia resonancia magnética), sin evidencia de lesión6. Estudios recientes muestran que los pacientes con AIT tienen mayor riesgo de desarrollar un infarto cerebral (IC) en las 2 semanas posteriores, por lo que se han diseñado escalas de estratificación de riesgo. La escala ABCD27 se basa en 5 parámetros (por sus siglas en inglés), a los que se asigna un puntaje de entre 0 y 2, de acuerdo a si está o no presente: A, edad (> 60 años = 1 punto); B, presión arterial (= 1); C, características clínicas (hemiparesia = 2, alteración del habla sin hemiparesia = 1, otros = 0); D, duración del AIT (> 60 min = 2; 10–59 min = 1; < 10 min = 0); D, diabetes (2 puntos si está presente). De acuerdo a sus resultados se identifican 3 grupos principales:
1. Bajo riesgo: 1 a 3 puntos; riesgo de IC a 2 días de 1.0%, riesgo de IC a 7 días: 1.2%.
2. Riesgo moderado: 4 a 5 puntos; riesgo de IC a 2 días de 4.1%, riesgo de IC a 7 días 5.9%
3. Alto riesgo: 6 a 7; riesgo de IC a 2 días de 8.1%; riesgo de IC a 7 días de 11.7%.
Aunque aun no existen guías de tratamiento basadas en el resultado de esta escala, los pacientes con alto riesgo son los que principalmente podrían beneficiarse de hospitalización, realización de estudios y establecimiento temprano de prevención secundaria.
Fisiopatología del infarto cerebral. Una vez que existe oclusión de un vaso cerebral con la consecuente obstrucción del flujo sanguíneo cerebral (FSC), se desencadena una cascada de eventos bioquímicos que inicia con la pérdida de energía y que termina en muerte neuronal. Otros eventos incluyen el exceso de aminoácidos excitatorios extracelulares, formación de radicales libres, inflamación y entrada de calcio a la neurona. Después de la oclusión, el núcleo central se rodea por un área de disfunción causada por alteraciones metabólicas e iónicas, con integridad estructural conservada, a lo que se denomina "penumbra isquémica". Farmacológicamente esta cascada isquémica puede ser modificada y disminuir sus efectos deletéreos, lo que representa en la actualidad una de las áreas de investigación más activa8.
Manifestaciones clínicas. La principal característica clínica de un IC es la aparición súbita del déficit neurológico focal, aunque ocasionalmente puede presentarse con progresión escalonada o gradual. Las manifestaciones dependen del sitio de afección cerebral, frecuentemente son unilaterales e incluyen alteraciones del lenguaje, del campo visual, debilidad hemicorporal y pérdida de la sensibilidad9.
Subtipos de infarto cerebral. Los IC pueden subdividirse con base en diferentes parámetros; 1) anatómico; circulación anterior o carotidea y circulación posterior o vertebrobasilar, y 2) de acuerdo con el mecanismo que lo produce, lo que permite establecer medidas de prevención secundaria. La clasificación de TOAST11, es la más utilizada, y define 5 grupos, que a continuación se detallan:
a) Ateroesclerosis de grandes vasos. Es el mecanismo más frecuente. La ateroesclerosis extracraneal afecta principalmente la bifurcación carotidea, la porción proximal de la carótida interna y el origen de las arterias vertebrales. El IC secundario a ateroesclerosis es el resultado de la oclusión trombótica (aterotrombosis) o tromboembólica (embolismo arteria–arteria) de los vasos8. Debe sospecharse en pacientes con factores de riesgo vascular y puede confirmarse a través de Doppler carotideo, angioresonancia (AIRM) o angiotomografía (ATC) y en algunos casos con angiografía cerebral. Los siguientes hallazgos apoyan ateroesclerosis: a) estenosis sintomática > 50% en una de las principales arterias cerebrales, b) IC mayor de 1.5 cm, y c) exclusión de otras etiologías probables10.
b) Cardioembolismo. Se debe a la oclusión de una arteria cerebral por un embolo originado a partir del corazón. Se caracteriza por: a) signos neurológicos de aparición súbita con déficit máximo al inicio (sin progresión de síntomas y mejoría espontánea), b) IC múltiples en diferentes territorios arteriales, c) IC superficial, cortical o con transformación hemorrágica (por recanalización), d) fuente cardioembólica y e) ausencia de otras causas posibles de IC10. Las enfermedades cardíacas embolígenas, se catalogan como de alto (embolismo > 6% por año) y bajo riesgo (< 1% anual)11. Es de especial importancia la fibrilación auricular no valvular debido a su alta frecuencia. Es un fuerte predictor de infarto cerebral y de recurrencia12, algunos estudios13 muestran que es la principal causa de embolismo cardiaco, lo que explica más de 75,000 casos de IC por año con alto riesgo de recurrencia temprana.
c) Enfermedad de pequeño vaso cerebral. El infarto lacunar (IL) es un IC menor de 15 mm de diámetro, localizado en el territorio irrigado por una arteriola. Explica alrededor del 25% de los IC, son más frecuentes en hispanoamericanos y pueden asociarse con demencia vascular14. Ocurren principalmente en las arterias lenticuloestriadas y talamoperforantes15. Aunque se han descrito por lo menos 20 síndromes lacunares, los 5 más frecuentes son: hemiparesia motora pura, síndrome sensitivo puro, síndrome sensitivo–motor, disartria–mano torpe y hemiparesia atáxica16. Los principales factores de riesgo asociados a IL son hipertensión arterial (HAS) y diabetes mellitus17–19. Los hallazgos que apoyan la enfermedad de pequeño vaso son: a) síndrome lacunar, b) historia de diabetes o HAS, c) IC menor de 1.5 cm localizado en estructuras profundas y, c) exclusión de otras causas10.
d) Otras causas. Se presentan principalmente en menores de 45 años, aunque no son exclusivas de este grupo. Las más frecuentes son vasculopatías no ateroesclerosas como; disección arterial cervico–cerebral (DACC), fibrodisplasia muscular, enfermedad de Takayasu, vasculitis del sistema nervioso central (SNC) y enfermedad de Moya–Moya20. De ellas, la más frecuente en nuestro medio es la DACC que representa hasta 25% de los IC en menores de 45 años. Se produce por desgarro de la pared arterial, dando lugar a la formación de un hematoma intramural. Puede manifestarse con síntomas locales, IC o ser asintomática21. La displasia fibromuscular22, la vasculitis del sistema nervioso central23, las trombofilias (deficiencia de proteína C, S, y de antitrombina III) y el síndrome antifosfolípidos24 son menos frecuentes, pero deben investigarse en sujetos jóvenes, sin causa evidente del IC.
e) Etiología no determinada. Incluye los IC con más de una etiología posible o aquellos en los que a pesar de una evaluación completa, no se puede determinar la causa, o que tienen una evaluación incompleta.10
Abordaje diagnóstico. Se han desarrollado varias escalas para cuantificar la gravedad del paciente. La escala de los Institutos Nacionales de la Salud (NIHSS) es la más utilizada25. Se basa en 11 parámetros que reciben un puntaje de entre 0 a 4. Su resultado oscila de 0 a 39 y según la puntuación se cataloga la gravedad en varios grupos: < 4 puntos: déficit leve; 6–15 puntos: déficit moderado; 15–20 puntos: déficit importante; y > 20 puntos: grave.26
En el paciente con sospecha de IC, los estudios de imagen son indispensables; la tomografía axial (TC) simple es el estudio de elección ya que es accesible y rápida27. Tanto la TC como la imagen de resonancia magnética (IRM) tienen una alta sensibilidad, aunque la IRM puede detectar IC aun en fases hiperagudas y los localizados en la circulación posterior28. La angiografía cerebral, la ATC y la AIRM permiten la visualización de la circulación intra y extracraneal, y en algunos casos de la arteria ocluida, lo que puede tener utilidad terapéutica, y en el diagnóstico de vasculopatía no ateroesclerosa29.
En la valoración del paciente en la fase aguda son necesarios también los siguientes estudios: glucosa sérica (la hipo e hiperglucemia son simuladores del IC), biometría hemática y tiempos de coagulación y electrocardiograma27.
Tratamiento. El único tratamiento de eficacia probada durante la fase aguda, es la administración de activador tisular del plasminógeno humano (rt–PA) intravenoso. La evidencia de ensayos clínicos muestra que los pacientes tratados con rt–PA, a dosis de 0,9 mg/kg, tienen una evolución funcional con recuperación completa o casi completa, significativamente mayor que los tratados con placebo30. El riesgo de hemorragia intracerebral (HIC) sintomática después de su administración es también mayor, especialmente en pacientes graves (NIHSS > 20) y datos tomográficos de IC en la valoración inicial31. Estudios recientes32–35 y metaanálisis30 de los datos disponibles sugieren que los pacientes con beneficio potencial son aquellos en los que el tiempo establecido de evolución es de hasta 4.5 h, sin signos tempranos de IC por TC y con IC con NIHSS de entre 4 y 20. Los pacientes que se excluyen son aquellos con factores que incrementan el riesgo de hemorragia, tales como ingesta de anticoagulantes, descontrol hipertensivo, cuenta plaquetaria baja, e historia de hemorragia. Por desgracia, en nuestro país menos del 1% de los casos con IC agudo reciben trombolisis36. Las medidas generales como el manejo soluciones, de la presión arterial, de la glucosa y de las complicaciones tempranas, logran disminuir la morbimortalidad, por lo que resultan de gran importancia. En la tabla 1 se resumen las recomendaciones de la Asociación Americana de Corazón (American Heart Association) para el manejo de la EVC aguda37.
Prevención secundaria. Se refiere a la modificación y tratamiento de factores que contribuyen a incrementar la recurrencia. Son de especial importancia el manejo de la HAS, diabetes y dislipidemia38. Los antiagregantes plaquetarios constituyen la piedra angular en los IC por ateroesclerosis, en los IL e IC de causa no determinada39. Los antiagregantes plaquetarios con evidencia probada son: aspirina a dosis de 75 a 325 mg, clopidogrel 75 mg, y la combinación de aspirina más dipiridamol de liberación prolongada27. La anticoagulación a largo plazo, en los IC cardioembólicos y por estados hipercoagulables, reduce significativamente el riesgo de recurrencia18,19. Se sugiere mantener un índice internacional estandarizado (INR) de 2.5 (rango de 2 a 3)39.
Las estatinas reducen los niveles de colesterol total y de lipoproteína de baja densidad, y tienen diferentes efectos pleiotrópicos40. En el metaanálisis que analizó el efecto de las estatinas en la prevención secundaria, se confirmo que la reducción del riesgo relativo de recurrencia de EVC es del 18%41. La principal evidencia es con atorvastatina 80 mg/día42. En análisis subsecuentes del estudio SPARCL43, se confirmó que la eficacia se mantiene entre personas de edad avanzada y en ambos géneros. Se recomienda mantener en forma indefinida el uso de estatinas ya que existe evidencia que su suspensión se asocia a riesgo de recurrencia de eventos vasculares42.
Hemorragia intracerebral
Representa 10–15% de toda la EVC, y según su localización puede ser intraparenquimatosa o intraventricular44. La hemorragia intraparenquimatosa se define como la extravasación de sangre dentro del parénquima, en el 85% de los casos es primaria, secundaria a HAS crónica o por angiopatía amiloidea45.
Epidemología de la HIC. Su incidencia es de 10 a 20 casos/100,000 habitantes/año, y se duplica cada 10 años después de los 3546. Tiene una morbimortalidad elevada; sólo 38% de los casos sobrevive al pasar 1 año, mientras que el 30% logra ser independiente a los 3 meses47. En México, en el Registro Nacional Mexicano de Enfermedad Vascular Cerebral (RENAMEVASC)48 su prevalencia fue del 29% de un total de 2,000 pacientes con EVC aguda.
La HAS es el factor de riesgo más claramente asociado (55–81%), y su localización más frecuente es en los ganglios basales. Se sabe que la HAS incrementa hasta 4 veces el riesgo de HIC49, que el 91% de los pacientes están hipertensos en el momento de la HIC y que el 72% de los casos son hipertensos conocidos y mal controlados50.
El depósito de proteína β–amiloide en la pared de los vasos corticoleptomeningeos, es causa de HIC lobar, recurrente y se presenta en sujetos mayores de 55 años sin historia de HAS. En la tabla 2 se muestran las principales causas de HIC47.
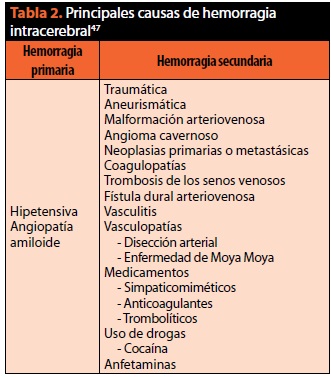
Fisiopatología. La HIC hipertensiva es el resultado de la ruptura de la pared de pequeñas arterias penetrantes en los sitios correspondientes a los microaneurismas de Charcot y Bouchard44. En estas arterias existe degeneración de la media y de la capa muscular, con hialinización de la íntima y formación de microhemorragias y trombos intramurales. La ruptura del vaso ocurre frecuentemente en los sitios de bifurcación, en donde la degeneración de sus capas es más prominente47,49,50.
Manifestaciones clínicas. Al igual que otros subtipos de EVC, se presenta de forma súbita o con síntomas rápidamente progresivos. Es frecuente el déficit neurológico máximo al inicio, así como síntomas acompañantes sugestivos de aumento de la presión intracraneal (PIC) tales como cefalea, nausea y vómito51. La HIC supratentorial puede presentarse con déficit neurológico sensitivo–motor contralateral y las infratentoriales con compromiso de nervios craneales, ataxia, nistagmus o dismetría52. Las crisis convulsivas aparecen en el 5–15% de las HIC supratentoriales y los signos meníngeos se presentan en HIC con apertura al sistema ventricular o espacio subaracnoideo53.
Uno de cada 4 pacientes sufre de deterioro neurológico en las primeras 24 h, secundario a extensión del hematoma, aumento de sangre ventricular o edema, aunque pueden presentarse también entre la segunda y tercera semana44. Como se muestra en la tabla 3, la localización del hematoma y sus características de presentación pueden orientan a su posible etiología52.
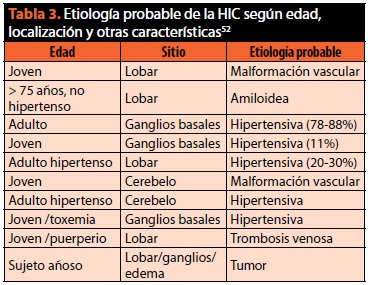
Diagnóstico. La TC y la IRM son de gran utilidad para confirmar su diagnóstico, determinar su tamaño y localización28. La TC sigue siendo el estudio de elección por su alta sensibilidad y especificidad. La ATC puede identificar otras causas, tales como malformación arteriovenosa (MAV) o aneurismas, mientras que la IRM permite identificar cavernomas y delimitar el edema perihematoma. La angiografía está indicada en casos de HIC de localización no habitual, y cuando no se identifica su etiología, especialmente en jóvenes. En ocasiones, es necesario repetir estudios entre las 2 y 4 semanas posteriores46.
Tratamiento. Puede ser médico o quirúrgico e idealmente debe ofrecerse en unidades de terapia intensiva. Para su elección debe considerarse la edad, escala de Glasgow, tamaño y localización del hematoma, desplazamiento de la línea media, apertura ventricular, hidrocefalia y etiología45. El objetivo principal del tratamiento es reducir la PIC y prevenir complicaciones. Se basa en protección de la vía aérea, reemplazo del factor apropiado, transfusión de plaquetas, uso de vitamina K en algunos pacientes y manejo de la presión arterial, para lo que se sugiere el esquema referido en la tabla 1 37, considerando siempre que la reducción brusca de las cifras tensionales reduce la PPC, empeora el daño cerebral y se asocia con mayor mortalidad, por lo que no se recomienda54.
Otras medidas recomendadas incluyen: 1) manitol para el manejo de la PIC, manteniendo osmolaridad sérica de 300–320 mOsm/kg y evitar la hipovolemia51.
Tratamiento quirúrgico. El manejo quirúrgico de la HIC supratentorial sigue siendo controvertido. La ausencia de estudios con metodología adecuada ha tenido como principal inconveniente el origen de las evidencias a partir de series de casos46,51. El estudio STICH (Surgical Treatment in Intracerebral Haemorrhage)55 asignó en forma aleatoria a pacientes con HIC supratentorial para ser tratados con evacuación del hematoma, o tratamiento médico. La evaluación de mortalidad y estado funcional de los sobrevivientes a los 6 meses produjo valores semejantes en los 2 grupos (mortalidad: 36% en el grupo quirúrgico, 37% en el no quirúrgico). El único grupo que mostró un posible beneficio del tratamiento quirúrgico fue el de pacientes con hematomas lobares ubicados a 1 cm o menos de la superficie cortical. Debido a este resultado, el estudio STICH–2 está actualmente en curso, así como otras alternativas quirúrgicas56.
Existe consenso generalizado en que pacientes con hemorragia cerebelosa y deterioro neurológico se benefician de evacuación quirúrgica, al igual que aquellos con HIC secundaria a ruptura de aneurisma, MAV o angioma cavernoso, especialmente en pacientes con expectativa de vida favorable y lesiones accesibles57. Se sugiere también tratamiento quirúrgico en pacientes jóvenes con HIC lobar de tamaño moderado a severo con deterioro neurológico progresivo.51
Hemorragia subaracnoidea (HSA)
Se define como la presencia de sangre en el espacio subaracnoideo. El 80% de los casos son secundarios a ruptura de un aneurisma sacular, representa entre el 4 y 7% de toda la EVC y tiene una alta morbimortalidad: el 45% de los pacientes fallece en los primeros 30 días y el 50% de los supervivientes evolucionan con secuelas irreversibles58. Su incidencia es de 10.5 casos por 100,000 personas/ año y afecta principalmente a la población menor de 65 años59. En México, en el RENAMEVASC60 representó el 15% del total de EVC.
Su principal factor de riesgo es la HAS, así como el tabaquismo, etilismo intenso, historia de HSA en familiares en primer grado y enfermedades hereditarias del tejido conjuntivo61. Además de la ruptura aneurismática, otras causas incluyen la ruptura de MAV, de aneurismas micóticos, disección de arterias intracraneales, coagulopatías y vasculitis del SNC62.
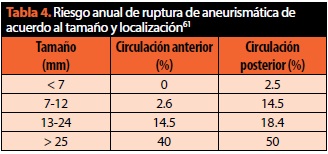
Los aneurismas se localizan en la circulación anterior en 80 a 90% de los casos, con mayor frecuencia en bifurcaciones arteriales; en la circulación posterior, son frecuentes en la arteria basilar. En 15% de los casos se encuentran aneurismas múltiples. El riesgo de ruptura de un aneurisma depende de su tamaño y localización, como se muestra en la tabla 461.
Fisiopatología de la formación de aneurismas. La elevación del FSC produce cambios en la remodelación de los vasos63, dilatación y cambios en el grosor de la pared, remodelación excéntrica y remodelación asimétrica, con aumento del flujo sanguíneo en el segmento distal del cuello del aneurisma, lo que se denomina "zona de Impacto"64. Esta alteración se presenta como recirculación dentro del saco aneurismático, transformándolo de un flujo alto a un flujo bajo con cambios de dirección dentro del mismo. Los componentes sanguíneos permanecen en las regiones de bajo flujo durante más tiempo, lo que favorece la adhesión de leucocitos y plaquetas al endotelio, y expresión de moléculas de adhesión celular tipo 1 (ICAM–1) y citocinas65. Estas moléculas atraen neutrófilos y monocitos circulantes, que facilitan la infiltración de la pared del vaso por polimorfonucleares, los que a su vez secretan metaloproteinasas, elastasas y citocinas, que favorecen la remodelación excéntrica66,67.
Manifestaciones clínicas. El síntoma cardinal de la HSA es la cefalea severa de inicio súbito, que el paciente describe como "la peor de su vida", acompañada de náusea, vómito, fotofobia y alteración de la conciencia. En el examen pueden encontrarse hemorragias subhialoideas en el fondo de ojo, signos meníngeos o focales, tales como parálisis del III o VI nervios craneales, paraparesia, pérdida del control de esfínteres o abulia (arteria comunicante anterior) o la combinación de hemiparesia, afasia o negligencia visuoespacial (arteria cerebral media)58. La HSA no logra diagnosticarse hasta en el 50% de los casos en la primera valoración, en el 40% se presentan síntomas precedentes como "cefalea centinela" o cefalea "en estallido", con duración de minutos a horas en las semanas previas59.
La TC confirma el diagnóstico de HSA desde las primeras 12 h en todos los casos; en el 93% entre las 12 a 24 h y en 50% en los 7 días posteriores68. Aunque la angiografía cerebral se sigue considerando el estándar de oro para detectar aneurismas cerebrales, la ATC se utiliza con mayor frecuencia por su alta sensibilidad y especificidad (85 y 98% respectivamente)69. En los pacientes con diagnóstico confirmado de HSA y estudio de imagen negativo para aneurisma, éste debe repetirse en los siguientes 7 a 14 días, o debe considerarse etiología no aneurismática68. La punción lumbar está indicada en casos con sospecha de HSA y TAC normal. El liquído cefaloraquídeo (LCR) hemorrágico, la presencia de eritrocitos y la xantocromia confirman el diagnóstico de HSA. Una TC negativa y LCR normal descartan HSA59.
Tratamiento. Todos los pacientes deben recibir medidas generales, preferentemente en centros especializados con equipos de neurocirugía, terapia endovascular y unidad de cuidados intensivos. Se sugiere mantener un aporte hídrico y de sodio adecuados, evitar esfuerzos, de ser necesario manejo de analgesia y de hipertensión arterial, tratando de mantener TA media menor a 125 mmHg70. De forma arbitraria, se considera un máximo de 180/100 mmHg antes de iniciar antihipertensivos.
Una vez tratado el aneurisma, se permite hipertensión, aunque no hay aun acuerdo en el rango. La hiperglucemia y la hipertermia se asocian con un mal pronóstico y deben evitarse. La profilaxis para trombosis venosa profunda debe iniciarse con aditamentos de compresión y heparina subcutánea una vez que el aneurisma fue tratado59. La nimodipina 60 mg cada 4 h vía oral durante 21 días, reduce el riesgo de mal pronóstico por isquemia secundaria a vasoespasmo en un 40% y la mortalidad en un 10%70.
Cuando existen signos de focalización por vasoespasmo puede utilizarse la terapia "Triple H" (hipertensión inducida, hipervolemia y hemodilución), que incrementa la PPC, aunque no hay evidencia clara sobre su beneficio.71 Si no hay mejoría, puede considerarse angioplastía química con infusión de vasodilatadores. En estudios fase II las estatinas disminuyeron la frecuencia de vasoespasmo, aunque no hay evidencia clara de su beneficio. Se recomienda profilaxis con antiepilépticos70.
Existen 2 opciones para asegurar un aneurisma roto: el clipaje quirúrgico y el manejo con terapia endovascular (TEV). La opción quirúrgica se determina valorando la edad del paciente, condición médica, localización, morfología y relación con vasos adyacentes del aneurisma. Se considera mejor opción en los aneurismas con cuello ancho, asociados a hematomas intraparenquimatosos o con efecto de masa. Los estudios clínicos aleatorizados muestran que la cirugía temprana tiene una menor tasa de resangrado, de complicaciones y mayor tasa de oclusión completa72. La TEV se realiza con coils que se depositan por catéteres en el aneurisma para excluirlo de la circulación. Algunos estudios muestran que la TEV tiene un pronóstico favorable con menor discapacidad a un año, menor riesgo de epilepsia y se prefiere en los pacientes ancianos o en aneurismas de la circulación vertebrobasilar o de localización profunda73.
Las complicaciones más importantes de la HSA son el resangrado, el vasoespasmo e hidrocefalia. La primera, puede presentarse desde los primeros días y tiene una mortalidad elevada. En los casos no tratados, el riesgo de resangrado en las primeras 4 semanas es del 35 al 40%.74
El vasoespasmo es también frecuente y puede llevar a la isquemia. Su incidencia es directamente proporcional al volumen de sangre. El diagnóstico se sospecha por incremento de la cefalea, alteraciones de conciencia, focalización, fiebre y leucocitosis. Los métodos de estudio recomendados para su detección son el Doppler transcraneal, la ATC y la angiografía cerebral75,76. Se presenta entre el cuarto y el décimo día, y puede persistir hasta por un periodo de 2 a 4 semanas.77 En su fisiopatología interviene la oxihemoglobina que libera endotelina, generando radicales libres de oxígeno que producen peroxidación de lípidos y contracción del músculo liso, inhibiendo al mismo tiempo la acción vasodilatadora del óxido nítrico78. Existe también un incremento en la actividad de la proteincinasa C, con liberación del calcio intracelular79.
Las complicaciones sistémicas llegan a ser graves en el 40% de los casos e incluyen edema pulmonar cardiogénico o neurogénico en el 23%, arritmias cardiacas en el 35% y desequilibrio hidroelectrolítico en el 28%74. La hiponatremia se produce por secreción inapropiada de hormona antidiurética o por síndrome cerebral perdedor de sal y se asocia con mal pronóstico. Pueden también ocurrir disminución del gasto cardiaco con inversión simétrica de la onda T y prolongación del segmento QT en el EKG, lo que lleva a disminución en la PPC con incremento del riesgo de complicaciones59.
El principal factor pronóstico es la severidad de la hemorragia inicial, por lo que es de gran importancia el uso de escalas de valoración clínica como la Escala de Coma de Glasgow, la escala de Hunt y Hess o la de la World Federation of Neurological Surgeons (WFNS), o la escala tomográfica de Fisher que se muestran en la Tabla 561.
CONCLUSIONES
Como se ha mostrado, la EVC representa una entidad heterogénea, constituida por diferentes subtipos, cada uno de los cuales tienes diferentes manifestaciones clínicas, diferente forma de abordaje diagnóstico y quizá lo más importante; requiere de diferentes tratamientos tanto durante la fase aguda como de prevención secundaria. De ahí radica la importancia de categorizar adecuadamente a los diferentes trastornos neurovasculares.
REFERENCIAS BIBLIOGRÁFICAS
1. Alwan A. Global status report on noncommunicable diseases 2010. Geneva. World Health Organization 2011 [ Links ]
2. Lopez A, Mathers C, Ezzati M, et al. Global and regional burden of disease and risk factors, 2001: systematic analysis of population health data. Lancet. 2006;367:1747–57. [ Links ]
3. Kolominsky–Rabas P, Weber M, Gefeller, et al. Epidemiology of ischemic stroke subtypes according to TOAST criteria: incidence, recurrence, and long–term survival in ischemic stroke subtypes: a population–based study. Stroke. 2001;32:2735–40. [ Links ]
4. Strong K, Mathers C, Bonita R. Preventing stroke: saving lives around the world. Lancet Neurol. 2007;6:182–87. [ Links ]
5. Chiquete E, Ruíz J, Murillo B, et al. Mortalidad por enfermedad vascular cerebral en México, 2000–2008: Una exhortación a la acción. Rev Mex Neuroci. 2011;12:235–41 [ Links ]
6. Easton J, Saber J, Albers G, et al. Definition and evaluation of transient ischemic attack: a scientific statement for healthcare professionals from the American heart association/American stroke association stroke council. Stroke. 2009;40:2276–93. [ Links ]
7. Johnston S, Rothwell P, Nguyen–Huynh M, et al. Validation and refinement of scores to predict very early stroke risk after transient ischemic attack. Lancet. 2007;369:283–92. [ Links ]
8. Van der Worp H, Van Gijn J. Acute Ischemic Stroke. N Engl J Med. 2007;357:572–9 [ Links ]
9. Brott T, Adams H, Olinger CP, et al. Measurements of acute cerebral infarction: a clinical examination scale. Stroke. 1989;20:864–70. [ Links ]
10. Adams H, Bendixen B, Kapelle L, Love B, Gordon D, Marsh E. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of org 10172 in acute stroke treatment. Stroke. 1993;24:35–41. [ Links ]
11. Asinger R, Dyken M, Hart R. Cardiogenic Brain Embolism: the Second Report of the cerebral embolism task force. Arch Neurol. 1989;46:727–43. [ Links ]
12. Lip G, Lim H. Atrial fibrillation and stroke prevention. Lancet Neurol. 2007;6:981–93. [ Links ]
13. Aguilar M, Hart R, Pearce L. Oral anticoagulants versus antiplatelet therapy for preventing stroke in patients with non–valvular atrial fibrillation and no history of stroke or transient ischemic attacks. Cochrane Database Syst Rev. 2007;18:3–7. [ Links ]
14. Bamford J, Sandercock P, Jones L, Warlow C. The natural history of lacunar infarction: the Oxfordshire Community Stroke Project. Stroke. 1987;18:545–51. [ Links ]
15. Fisher C. Lacunes: small, deep cerebral infarcts. Neurology. 1965; 5:774–84. [ Links ]
16. Fisher C. Lacunar strokes and infarcts: a review. Neurology. 1982;32:871–6. [ Links ]
17. Lammie A, Brannan F. Nonhypertensive cerebral small–vessel disease. Stroke 1997;28:2222–9. [ Links ]
18. Mast H, Thompson J, Lee S, Mohr J, Sacco R. Hypertension and diabetes mellitus as determinants of multiple lacunar infarcts. Stroke. 1995;26:30–33. [ Links ]
19. Arboix A, Martí–Vilalta J. New concepts in lacunar stroke etiology: the constellation of small vessel arterial disease. Cerebrovasc dis. 2004;17:58–62. [ Links ]
20. Biller J. Non–atherosclerotic cerebral vasculopathies in the young. J Stroke Cerebrovasc Dis. 1997;6:173–7. [ Links ]
21. Arauz A, Hoyos L, Espinoza C, Cantú C, Barinagarrementería F, Román G. Dissection of cervical arteries: long–term follow–up study of 130 consecutive cases. Cerebrovasc Dis. 2006;22:150–4. [ Links ]
22. Touzé E, Oppenheim C, Trystam D, et al. Fibromuscular dysplasia of cervical and intracranial arteries. Int J Stroke. 2010;5:296– 305. [ Links ]
23. Scolding N. Central nervous system vasculitis. Semin Immunopathol. 2009; 31:527–36. [ Links ]
24. Ferro J, Massaro A, Mas J. Aetiological diagnosis of ischaemic stroke in young adults. Lancet Neurol. 2010;9:1085–96. [ Links ]
25. Brott T, Adams H, Olinger C, et al. Measurements ofacute cerebral infarction: a clinical examination scale. Stroke.1989;20:864–70. [ Links ]
26. Muir K, Weir J, Murray D, Povey C, Lees K. Comparison of neurological scales and scoring systems for acute stroke prognosis. Stroke. 1996;27:1817–20. [ Links ]
27. Swain S, Turner C, Tyrrell P, Rudd A. Diagnosis and initial management of acute stroke and transient ischaemic attack: summary of NICE guidance. BMJ. 2008;337–786 [ Links ]
28. Chalela J, Kidwell C, Nentwich L, et al. Magnetic resonance imaging and computed tomography in emergency assessment of patients with suspected acute stroke: a prospective comparison. Lancet. 2007;369:293–8. [ Links ]
29. Muir K, Buchan A, Von Kummer R, Rother J, Baron J. Imaging of acute stroke. Lancet Neurol. 2006;5:755–68. [ Links ]
30. Hacke W, Donnan G, Fieschi C, et al. Association of outcome with early stroke treatment: pooled analysis of ATLANTIS, ECASS, and NINDS rt–PA stroke trials. Lancet. 2004;363:768–74. [ Links ]
31. Khatri P, Wechsler L, Broderick J. Intracranial hemorrhage associated with revascularization therapies. Stroke. 2007;38:431–40. [ Links ]
32. Hacke W, Kaste M, Bluhmki E, et al. Thrombolysis with al–teplase 3 to 4.5 hours after acute Ischemic stroke. New Engl J Med. 2008;359:1317–29. [ Links ]
33. Wahlgren N, Ahmed N, Davalos A, et al. Thrombolysis with alteplase for acute ischaemic stroke in the safe implementation of thrombolysis in stroke–monitoring study (SITS–MOST): an observational study. Lancet. 2007;369:275–82. [ Links ]
34. Wahlgren N, Ahmed A, Eriksson N, et al. Multivariable analysis of outcome predictors and adjustment of main outcome results to baseline data profile in randomized controlled trials; safe Implementation of thrombolysis in stroke monitoring study (SITS–MOST). Stroke. 2008;39:3316–22. [ Links ]
35. Wahlgren N, Ahmed N, Dávalos A, et al. Thrombolysis with alteplase 3–4.5 h after acute ischaemic stroke (SITS–ISTR): an observational study. Lancet. 2008;372:1303–9. [ Links ]
36. Cantú C, Chiquete E, Ruiz–Sandoval J, Arauz A, Murillo–Bonilla L, Bariangarrementeria F. Manejo agudo y pronóstico a un año en pacientes mexicanos con un primer infarto cerebral: resultados del estudio multicéntrico PREMIER. Rev Neurol. 2010;51:641–9. [ Links ]
37. Harold P. Adams J, Gregory Z, et al. Guidelines for the early management of adults with ischemic stroke: A guideline from the American heart association/American stroke association. Circulation. 2007;115:478–534. [ Links ]
38. Barinagarrementeria F, Arauz A, Ruiz J, et al. Antiplaquetarios en la prevención del infarto cerebral o isquemia cerebral transitoria aterotrombótica. Rev Invest Clin. 2010;62:135–40. [ Links ]
39. Alegría M, Arauz A, Roa F, et al. Anticoagulación en la prevención secundaria de la enfermedad vascular cerebral. Rev Invest Clin. 2010;62:141–51. [ Links ]
40. Ridker P, Danielson E, Fonseca F, et al. Rosuvastatin to prevent vascular events in men and women with elevated C reactive protein (JUPITER Study). N Engl J Med. 2008;359:2195–207. [ Links ]
41. Amarenco P, Labreuche J. Lipid management in the prevention of stroke: review and updated meta–analysis of statins for stroke prevention. Lancet Neurol. 2009;8:453–63. [ Links ]
42. Cantú C, Villarreal J, Barinagarrementeria F, et al. Estatinas en la prevención secundaria de enfermedad vascular cerebral. Rev Invest Clin. 2010;62:162–9. [ Links ]
43. Amarenco P, Bogousslavsky J, Callahan A, et al. High–dose atorvastatin after stroke or transient ischemic attack. N Engl J Med. 2006;355:549–59. [ Links ]
44. Qureshi A, Tuhrim S, Broderick J, Batjer H, Hondo H, Hanley D. Spontaneous intracerebral hemorrhage. N Engl J Med. 2001;344:1450–60. [ Links ]
45. Láinez J, Pareja A. The medical treatment of intracerebral hemorrhage. Rev Neurol. 2000;31:174–9. [ Links ]
46. Ruiz J, Colorado H, Loy M, et al. Diagnosis and treatment of intracerebral hemorrhage. Rev Invest Clin. 2002;54:275–80. [ Links ]
47. Grysiewicz R, Thomas K, Pandey D. Epidemiology of ischemic and hemorrhagic stroke: incidence, prevalence, mortality and risk factors. Neurol Clin. 2008;26:871–95. [ Links ]
48. Ruiz–Sandoval JL, Chiquete E, Garate–Carrillo A, et al. Spontaneous intracerebral hemorrhage in Mexico: results from a multicenter nationwide hospital–based registry on cerebrovascular disease (RENAMEVASC). Rev Neurol. 2011;16(53):705–12. [ Links ]
49. Feldmann E, Broderick J, Kernan W, et al. Major risk factors for intracerebral hemorrhage in the young are modifiable. Stroke. 2005;36:1881–5. [ Links ]
50. Ariesen M, Claus S, Rinkel G, Algra A. Risk factors for intracerebral hemorrhage in the general population: a systematic review. Stroke. 2003;34:2060–5. [ Links ]
51. Broderick J, Connolly S, Feldmann E, et al. Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update: a guideline from the American heart association/American stroke association/stroke council. Stroke. 2007;38:2001–23. [ Links ]
52. Woo D, Broderick J. Spontaneous intracerebral hemorrhage: epidemiology and clinical presentation. Neurosurg Clin North Am. 2002;13:265–79. [ Links ]
53. NINDS ICH workshop participants. Priorities for clinical research in intracerebral hemorrhage: report from a national institute of neurological disorders and stroke workshop. Stroke. 2005;36:23–41. [ Links ]
54. Rincon F, Mayer S. Novel therapies for intracerebral hemorrhage. Curr Opin Crit Care. 2004;10:94–100. [ Links ]
55. Mendelow A, Gregson B, Fernandez H, Murray GD. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial intracerebral haematomas in the international surgical trial in intracerebral haemorrhage (STICH): a randomised trial. Lancet. 2005;365:387–97. [ Links ]
56. Auer L, Deinsberger W, Niederkorn K, et al. Endoscopic surgery versus medical treatment for spontaneous intracerebral hematoma: a randomized study. J Neurosurg. 1989;70:530–5. [ Links ]
57. Escudero A, Marqués A, Taboada C. Actualización en hemorragia cerebral espontánea. Med Intensiva. 2008;32:282–95 [ Links ]
58. Sacco R, Wolf P, Bharucha N, et al. Subarachnoid and intracerebral hemorrhage: natural history, prognosis, and precursive factors in the Framingham study. Neurology. 1984 Jul;34:847–54. [ Links ]
59. Van Gijn J, Kerr R, Rinkel G. Subarachnoid Hemorrhage. Lancet. 2007;369:306–18. [ Links ]
60. Ruiz–Sandoval J, Cantú C, Chiquete E, et al. Aneurysmal subarachnoid hemorrhage in a Mexican multicenter registry of cerebrovascular disease: the RENAMEVASC study. J Stroke Cerebrovasc Dis. 2009;18:48–55. [ Links ]
61. Feigin V, Rinkel G, Lawes C, et al. Risk factors for subarachnoid hemorrhage: an updated systematic review of epidemiological studies. Stroke. 2005;36:2773–80. [ Links ]
62. Ferro J, Canhão P, Peralta R. Update on subarachnoid hemorrhage. J Neurol. 2008;255:465–79. [ Links ]
63. Gibbons G, Dzau V. The emerging concept of vascular remodeling. N Engl J Med. 1994;330:1431–8. [ Links ]
64. Hoi Y, Meng H, Woodward S. Effects of arterial geometry on aneurysm growth: Three–dimensional computational fluid dynamics study. J Neurosurg. 2004;101:676–81. [ Links ]
65. Chiu J, Chen N, Lee P. Analysis of the effect of disturbed flow on monocytic adhesion to endothelial cells. J Biomech. 2003;36:1883–95. [ Links ]
66. Hoefer I, van Royen N, Rectenwald J. Arteriogenesis proceeds via ICAM–1/Mac–1 mediated mechanisms. Circ Res. 2004;94:1179–85. [ Links ]
67. Shyy Y, Chien S. Role of integrins in cellular responses to mechanical stress and adhesion. Curr Opin Cell Bio.1997;9:707–13. [ Links ]
68. Provenzale J, Hacein–Bey L. CT evaluation of subarachnoid hemorrhage: a practical review for the radiologist interpreting emergency room studies. Emerg Radiol. 2009;16:441–51. [ Links ]
69. Bracard S, Anxionnat R, Picard L. Current diagnostic modalities for intracraneal aneurysms. Neuroimaging clinics of north america. 2006;16:397–411. [ Links ]
70. Diringer M, Bleck T, Hemphill J, et al. Critical care management of patients following aneurysmal subarachnoid hemorrhage: recommendations from the neurocritical care society's multidisciplinary consensus conference. Neurocrit Care. 2011;15:211–40 [ Links ]
71. Kimball M, Velat G, Hoh B, et al. Critical care guidelines on the endovascular management of cerebral Vasospasm. Neurocrit Care. 2011;15:336–41. [ Links ]
72. Britz GW. ISAT Trial: coiling or clipping for intracranial aneurysms. Lancet. 2005;366:783–5. [ Links ]
73. Johnston S, Higashida R, Barrow D, et al. Recommendations for the endovascular treatment of intracranial aneurysms. A statement for the healthcare professionals from the committee on cerebrovascular imaging of the American heart association council on cardiovascular radiology. Stroke. 2002;33:2536–44. [ Links ]
74. Hidjra A, Braakman R, Van Gijn J, Vermeulen M, Van Crevel H. Aneurysmal subarchnoid hemorrhage. complications and outcome in a hospital population. Stroke. 1987;18:1061–7. [ Links ]
75. Lysakowski C, Walder B, Costanza M. Transcranial Doppler versus angiography in patients with vasospasm due to a ruptured cerebral aneurysm: A systematic review. Stroke. 2001;32:2292–8. [ Links ]
76. Binaghi S, Colleoni M, Maeder P, et al. CT angiography and perfusion CT in cerebral vasospasm after subarachnoid hemorrhage. Am J Neuroradiol. 2007;28:750–8. [ Links ]
77. Heros R, Zervas N, Varsos V. Cerebral vasospasm after subarachnoid hemorrhage: an update. Ann Neurol. 1983;308:619–24. [ Links ]
78. Pluta R. Dysfunction of nitric oxide synthases as a cause and therapeutic target in delayed cerebral vasospasm after SAH. Neurol Res. 2006;28:730–7. [ Links ]
79. Zhang Z, Macdonald R. Contribution of the remodeling response to cerebral vasospasm. Neurol Res. 2006;28:713–20. [ Links ]














