Introducción
La distribución de micro y macronutrientes en sistemas acuáticos se ve afectada por diversos procesos fisicoquímicos relacionados con la influencia de actividades naturales o antropogénicas, siendo las reacciones de complejación de las más importantes. Dichas reacciones pueden ocurrir entre la materia orgánica y metales (incluyen tejidos de organismos) presentes en la columna de agua (Rocha et al., 2000, Chen et al., 2007, Liu et al., 2010).
Las sustancias húmicas acuáticas (SHA) son consideradas como el principal reservorio de carbono en medios acuáticos. Éstas son macromoléculas producto de la degradación de biomoléculas y posterior polimerización; de acuerdo con su caracterización la concentración de heteroátomos se ve disminuida a medida que aumenta el peso molecular y el grado de polimerización. Las SHA han sido clasificadas por su grado de polimerización como: ácidos fúlvicos, ácidos húmicos y huminas. El último grupo por sus características de polimerización, alto peso molecular y baja o nula solubilidad no son encontradas en la columna de agua (Camargo y Cruz, 1999, Motuzova et al., 2012).
Las SHA poseen grupos funcionales como fenoles, aminas, ácidos carboxílicos entre otros, que involucran la presencia de heteroátomos como O, N y S (Camargo y Cruz, 1999, Motuzova et al., 2012). Estos grupos pueden reaccionar y formar complejos con metales y metaloides, especialmente por átomos de oxígeno. Las SHA pueden formar complejos polinucleares y reaccionar simultáneamente con diferentes elementos, en función de las condiciones ambientales que prevalezcan en el cuerpo de agua. La formación de estos compuestos es muy importante para la movilidad de los elementos (Munier et al., 1986, Chen et al., 2007, Lippold y Lippmann-Pipke, 2009).
La movilidad de los metales en los sistemas acuáticos es relevante debido a que juegan un rol importante dentro de los procesos metabólicos. Una concentración deficiente de los metales considerados esenciales implica que las condiciones ambientales no sean favorables para el desarrollo de los organismos, pero por otro lado si las concentraciones son excesivas pueden ser tóxicos e inhibir los procesos biológicos. Por esto es muy importante la cuantificación e identificación de la presencia y especie química en la que se encuentran (Elkins y Nelson, 2001, Cabaniss, 2009).
La identificación correcta de la especie química del metal es esencial para determinar su disponibilidad, toxicidad y movilidad. La especiación depende de las condiciones fisicoquímicas del cuerpo de agua, que están relacionadas con la variación de la geología de la cuenca, tipo de cuenca, profundidad, oleaje, aportes antropogénicos o naturales, organismos que habitan ahí además del proceso fotosíntesis-respiración.
Los valores de pH de los sistemas acuáticos se encuentran en un intervalo muy amplio variando desde muy ácido (2) hasta valores superiores a 8. Las variaciones de este parámetro pueden ser temporales, por ejemplo: en un mismo día dependiendo si prevalece el proceso de respiración o fotosíntesis, de la misma forma pueden ser variaciones estacionales (estiaje o lluvias), también existe la posibilidad en sistemas profundos que se genere estratificación, evento que produce que las condiciones fisicoquímicas no sean iguales en toda la columna de agua (Margalef, 1983, Laglera y Van Den Berg, 2009, Su et al., 2012).
El estudio de las posibles reacciones entre las sustancias presentes en ambientes acuáticos bajo diferentes condiciones fisicoquímicas para identificar los patrones de comportamiento es relevante debido a que el conocimiento de esta información puede generar modelos que permitan la predicción de los posibles procesos que ocurren en el sitio a partir de un monitoreo de rutina.
La capacidad de los metales alcalinos, alcalinotérreos y de la primera serie de transición de formar compuestos con materia orgánica se ha determinado en diversos estudios, e indican que los elementos alcalinos y alcalinotérreos son menos reactivos que los de transición, estos últimos incrementan la reactividad con el número atómico (Shuman y Cromer, 1979, Davidge et al., 2001, Elkins y Nelson, 2001).
Se han efectuado experimentos de complejación bajo diferentes condiciones de pH (3-6) empleando disoluciones amortiguadoras, como acetatos y boratos. Los resultados muestran ligeras modificaciones en la reacción de los elementos de transición, pero no así en los elementos alcalinos y alcalinotérreos (Shuman y Cromer, 1979, Ryan y Weber, 1982, John et al., 1988, Davidge et al., 2001, Elkins y Nelson, 2001). Para la extrapolación de los resultados en ambientes naturales es muy importante estudiar las reacciones bajo condiciones similares a las ambientales.
El objetivo de este trabajo es analizar las reacciones de complejación de SHA de Xochimilco con los metales Cu, Mn, Pb y Zn en condiciones de pH similares a las del sitio, así como el análisis de lo que puede ocurrir en ausencia de una disolución amortiguadora de pH.
Sitio de muestreo
Las muestras de agua fueron colectadas en el Lago de Xochimilco, las cuales contienen SHA. Este cuerpo de agua se localiza en el sur de la Ciudad de México en las coordenadas 19.552’ N, 99.05265 O. En la época prehispánica tenía un rol importante en agricultura y transportación. Desgraciadamente sus dimensiones se han visto disminuidas a canales debido al crecimiento poblacional y al uso excesivo del recurso agua. Sin embargo, el sitio se emplea en el desarrollo de agricultura tradicional “chinampas” y también como atracción turística. Además, cuenta con la presencia de especies endémicas como el “axolotl”, por lo que se puede considerar que el Lago de Xochimilco tiene una gran importancia ecológica y preservarlo es de suma importancia.
El axolotl (del náhuatl cabeza de perro) es un anfibio, especie endémica de los lagos prehispánicos de la zona central de México, que posee la capacidad de regenerar los tejidos de manera natural, lo que lo ha llevado a ser empleado con propósitos médicos, fue declarado especie en peligro de extinción por La Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO) de acuerdo con la norma oficial mexicana 059-ECOL-2010. Además, estudios han mostrado el efecto de diferentes contaminantes como plaguicidas, fertilizantes, detergentes y metales pesados sobre el axolotl, de ahí que encontrar una técnica adecuada para el restablecimiento del equilibrio de dicho ecosistema se vuelva trascendental (Robles-Mendoza et al., 2009, Robles-Mendoza et al., 2011, Chaparro-Herrera et al., 2013, Zapata- Gutiérrez y Solís-Juárez, 2013).
En el Lago de Xochimilco existen diferentes áreas de acuerdo con el tipo de actividades que se realizan, lo que se ve reflejado en la variación de condiciones fisicoquímicas. De acuerdo con López-López et al. (2006) zonas de alta producción primaria (alta concentración de clorofilas) se encuentran en las zonas urbana y turística (139.4 y 150 mg L-1 de clorofila respectivamente) pero hay un decremento en la zona agrícola (48.9 mg L-1).
Metodología
Se colectaron muestras de agua en el canal Caltongo dentro del Lago de Xochimilco, se determinaron los parámetros fisicoquímicos, posteriormente el agua se filtró a través de malla 40 y enseguida por la de 0.45 µm, una porción de la muestra fue acidificada con ácido nítrico concentrado a un pH de 2, para poder realizar la cuantificación de cationes mayores. Las concentraciones de Ca y Mg se determinaron por valoración complejométrica con EDTA. Los contenidos de Na y K se obtuvieron por Espectroscopia de Absorción Atómica y Emisión con el equipo Perkin Elmer 2380 en las longitudes de onda de 589 nm y 768 nm respectivamente, con curvas de calibración que se encuentran en el intervalo entre 5-30 mg L-1 .
Se determinó la concentración de aniones por valoraciones ácido-base con HCl (0.02 N) para CO3 2- y HCO3, y de electrodo de ión selectivo para Cl- y F- con el potenciómetro Thermo Scientific Orion 5 Star con disoluciones de referencia en el intervalo 1-10 mgL-1. Las concentraciones de SO4 2- se analizaron por turbidimetría, con la reacción generada con BaCl2, con las mediciones en una longitud de onda de 420 nm y considerando la curva de calibración entre 0 y 20 mgL-1.
La concentración de SHA se determinó por el método espectrofotométrico uv/vis, con el equipo Hewlett Packard 8909A0 acoplado a un sistema Peltier, en una λ=240 nm y a partir de la curva de calibración con valores de concentración entre 0 y 80 mgL-1, elaborada con SHA de Xochimilco aisladas previamente bajo la técnica de Thurman y Malcom (1981).
Una vez caracterizada el agua se procedió a realizar 3 diferentes experimentos que se desarrollaron por triplicado. En general las series de reacciones se llevaron a cabo colocando 30 mL de agua de Xochimilco previamente filtradas, 5 mL de disolución amortiguadora de pH (6.5) de acuerdo con el valor determinado originalmente en las muestras y 1 ó 3 mL de disolución del metal, dependiendo de la serie (a partir de una concentración de 500 mgL-1 para cada metal) o dependiendo de la serie de reacciones que se haya desarrollado. Se establecieron dos secuencias de reacciones modificando la concentración de metales adicionada (13 mgL-1), una vez establecida la mejor concentración se desarrolló otra fase de la experimentación en la que se monitoreó la variación de pH producto de la reacción entre las SHA y los diferentes metales.
La cuantificación de cada uno de los metales fue determinada por medio de Espectroscopía de Absorción Atómica, con el equipo Perkin Elmer AAnalyst 200 bajo las condiciones analíticas a continuación descritas en la Tabla 1.
Tabla 1 Las condiciones analíticas de operación del equipo para determinar las concetraciones de Cu, Mn, Pb y Zn que no fueron complejados y se encuentran en las aguas madres de la reacción.
| Elemento | LD (mgL-1) | Concentraciones de la curva de calibración (mgL-1) |
R2 |
|---|---|---|---|
| Cu | 0.25 | 0.5, 1.5, 3 y 4 | 0.9999 |
| Mn | 0.10 | 0.2, 0.6, 1.2 y 2.5 | 0.9989 |
| Pb | 0.5 | 1, 3 y 6 | 0.9998 |
| Zn | 0.05 | 0.1, 0.3, 0.6 y 1 | 0.9998 |
Las reacciones procedieron en condiciones ambientales de la Ciudad de México, temperatura promedio de 20°C con una agitación de 1 h, para posteriormente ultrafiltrar, el precipitado corresponde al complejo formado y en la fase líquida permanece el metal que no reaccionó, por lo que cuantificarlo nos permite determinar la capacidad de complejación, la cual se determina mediante la siguiente ecuación:
En donde
CC = |
Capacidad de complejación. |
[M] = |
cantidad del metal que reaccionó, expresada en mmol. |
[L] = |
cantidad del ligante, expresada en g. |
Los productos aislados se caracterizaron por medio de Espectroscopia de Infrarrojo, desarrollado en la USAII (Unidad de Servicios de Apoyo a la Investigación y a la Industria), mediante la técnica de Reflectancia Total Atenuada (ATR por sus siglas en inglés) con el equipo Perkin Elmer FT-IR SPECTRUM 400 y observados por la técnica de Microscopia Electrónica de Barrido (MEB) con el equipo TM3030 Plus Hitachi Tabletop Microscope A en los laboratorios de Petrografía y Microscopía y de Sedimentología Volcánica del Instituto de Geofísica de la UNAM.
Resultados
La caracterización del agua de Xochimilco nos muestra que es bicarbonatada sódica, con un pH de 6.8 e indica que se cuenta con la presencia de los cationes mayores Mg2+, Ca2+ y Na+, iones que pueden competir con los oligoelementos en ocupar los sitios de complejación en las SHA. En cuanto a los aniones como ya se indicó el principal es el HCO3 -, seguido de Cl- y SO4 2-, como se aprecia en la Figura 1.
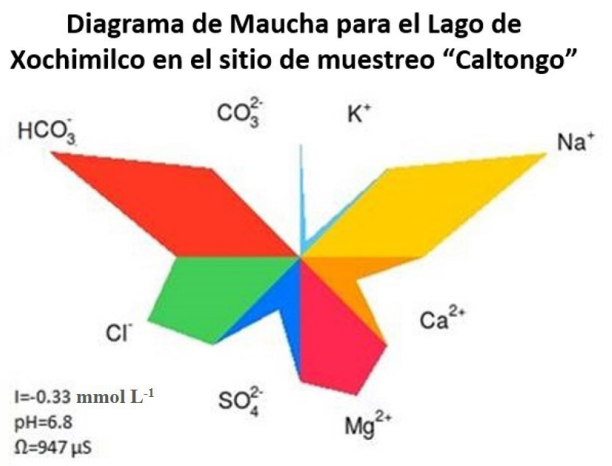
Figura 1 Diagrama de Maucha (Public license GPL-3, GNU) correspondiente al agua del Lago de Xochimilco.
Se determinó la concentración de las SHA y fue de 120 mg L-1, después se realizaron las diferentes reacciones, para lo cual como se indicó en la metodología se emplearon 2 concentraciones para los metales (13 y 32 mgL-1) y se observan pequeñas variaciones en la capacidad de complejación, lo que explica que si aumenta la concentración puede haber más sitios sustituidos por los metales oligoelementos, claro llegando a un equilibrio y es muy importante destacar que ésta también variará en función del pH.
Para identificar las diferentes condiciones de reacción se acotará de la siguiente manera XT que significa la reacción de la muestra de Xochimilco con todos los metales, acompañado de S/A significa sin disolución amortiguadora, XT3 corresponde a la reacción con disolución amortiguadora de pH, con concentración para los metales de 32 mgL-1 y XT1C/A es cuando la reacción procedió con disolución amortiguadora de pH y la concentración para cada metal fue de 13 mgL-1.
La principal diferencia de complejación se encuentra en el caso XT, (Figura 2) en el cual se monitoreó el cambió del pH ya que no hay una disolución reguladora de pH o algún proceso que pueda amortiguar el pH como es el de respiración- fotosíntesis. El pH inicial fue de 6.8, al incorporar los metales fue de 5.8 y al finalizar la reacción fue de 6.3, muestra clara de una reacción ácido-base. En esta secuencia, el elemento que presenta una disminución en cuanto a la reactividad se refiere es el Mn, muy probablemente por la competición con los elementos mayores y porque los bicarbonatos ayudan a estabilizar el compuesto que forman.
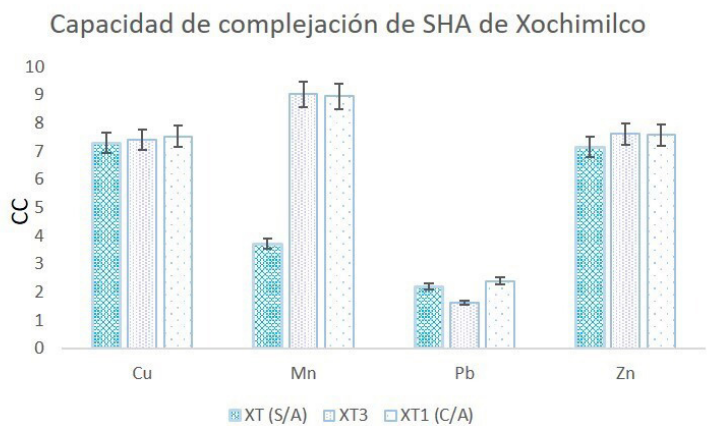
Figura 2 Gráfico que muestra la capacidad de complejación de las SHA de Xochimilco, hacia cada uno de elementos objeto de estudio bajo las diferentes condiciones de reacción, descritas previamente.
Como ha sido descrito por Xue et al. (1995), Davidge et al. (2001), Bryan et al. (2002), Goveia et al. (2010) y otros el Cu tiene una gran afinidad hacia la materia orgánica, especialmente con las SHA. Indican que la reacción es muy afectada por el pH y la reacción más cuantitativa procedió en un pH=6, decreciendo en valores superiores de pH, muy probablemente por la formación de los hidróxidos del metal.
Discusión
Al considerar los cationes mayores en la competencia para reaccionar con las SHA, se percibió que de acuerdo con experimentos previos desarrollados por González-Guadarrama et al. (2018) la capacidad de complejación hacia los oligoelementos se ve disminuida en su valor; sin embargo, no la anula, y sigue teniendo un gran potencial para reaccionar y modificar la especiación de los metales potencialmente tóxicos.
Al tener una mezcla de metales con posibilidad de reaccionar con las SHA es importante identificar si se puede formar el compuesto polinuclear y poliatómico, ya que sería muy interesante saber la repercusión de la formación de estos compuestos en la distribución de nutrientes dentro de los sistemas acuáticos. Un factor muy importante por considerar es el cambio de solubilidad de las especies metálicas y las SHA al reaccionar, lo cual podemos observar en la Figura 3, en donde se aprecia que antes de la reacción todo se encuentra en disolución y una vez finalizada la reacción y agitación el producto formado precipita, clara evidencia de su baja solubilidad.

Figure 3 A la izquierda se puede observar la imagen del periodo de reacción entre las SHA y los metales y a la derecha se observa como precipitan los productos de la reacción y la disolución queda traslúcida.
La evidencia de la precipitación de los compuestos formados es muy importante, porque se evidencía un cambio en la biodisponibilidad de los metales, ya que al formar el complejo se espera que disminuya, incluso de las SHA, que van a presentar un cambio en la ubicación dentro del sistema acuático, es decir, se encontrarán en la columna de agua, en los sedimentos o en la superficie, de ahí que es preciso considerar si se trata un sistema lótico o léntico, polimíctico o monomíctico, además de características como la profundidad, si es época de estiaje o lluvias, características que también condicionan las reacciones al determinar los posibles valores de pH y Eh (Margalef, 1983).
El caso específico de Xochimilco es muy interesante, porque en gran parte de su área se ha visto reducido a canales, lo que disminuye la movilidad y la mezcla, lo que se puede reflejar de dos formas, la primera que la reacción de complejación no se lleve a cabo debido a la poca interacción entre los reactivos, la segunda es que si proceda la reacción y que por la baja solubilidad los compuestos sean precipitados hacia los sedimentos.
En el segundo panorama es preciso verificar las condiciones de pH, ya que puede ser una región anóxica lo que genera una disminución considerable en el pH, y puede provocar que el compuesto sea disociado y reincorporar los metales a la columna de agua, al igual que las SHA (John et al., 1988, Lagier et al. 2000).
En trabajos previos dentro del grupo de trabajo se determinó la capacidad de complejación de cada uno de los elementos propuestos en este trabajo con las SHA de Xochimilco (González-Guadarrama et al. 2018) y permite realizar una comparación con los encontrados en este trabajo al tener la mezcla de todos ellos reaccionando al mismo tiempo, recordando que la capacidad de complejación muestra la relación de la cantidad de metal expresada en mmol, con respecto de la cantidad de ligante expresada en gramos. Dicho comparativo se puede ver en la Tabla 2.
Tabla 2 Capacidad de complejación de las SHA de Xochimilco hacia Cu, Mn, Pb y Zn en soluciones individuales y en presencia simultánea de todos ellos en los experimentos realizados en esta investigación.
| Elemento/ C. C. | Reacción individual | Reacción multielemental | |
|---|---|---|---|
| 1 mL/3 mL | |||
| Cobre | 9.00±0.03 | 6.24±0.01 | 5.66±0.04 |
| Manganeso | 8.30±0.20 | 7.60±0.03 | 6.73±0.03 |
| Plomo | 2.3±0.01 | 1.37±0.01 | 1.78±0.008 |
| Zinc | 11.00±0.01 | 6.41±0.003 | 5.71±0.008 |
C.C. Capacidad de complejación (mmol•g-1)
Se aprecia que los valores de complejación se ven disminuidos como es lógico al tener todos los elementos presentes; sin embargo, los valores para el caso del Mn no presentan una disminución considerable a diferencia de los otros elementos, al considerar que el Cu presenta una disminución de 34±4 %, el Mn de 14±5 %, el Pb de 32±8 % y el Zn de 46±4 %. Lo que es muy importante ya que corrobora que la capacidad de complejación total de las SHA, no es muy cambiante, y que existe la competencia entre los metales para ocupar los sitios de reacción en las SHA.
Otro factor para considerar es que al incrementar la concentración de los metales en la reacción multielemental la capacidad de complejación se ve abatida, salvo para el Pb, elemento para el cual se observa un incremento del 29 %. Los resultados pueden ser un indicador de que las SHA son el reactivo limitante y que la concentración de los metales puede ser un inhibidor de la reacción.
En las reacciones in situ no se puede despreciar la presencia de los cationes mayores, ya que guardan una gran afinidad para ocupar los sitios activos en las SHA, tal es el caso que una de las formas comunes para encontrarlas es en forma de sales con Na principalmente. Un aspecto por destacar es por lo tanto que va a existir una competencia en las reacciones de complejación con las SHA entre los elementos mayores y oligoelementos, generando así complejos con los diferentes metales simultáneamente.
A través del análisis del espectro de infrarrojo (IR) de los complejos aislados se aprecia que los enlaces se producen entre el metal y los grupos carboxilo de las SHA, para todos los metales, lo cual es muy lógico al considerar que dentro de las moléculas precursoras de las SHA se encuentran principalmente estos grupos funcionales. El espectro de IR se puede observar en la Figura 4.
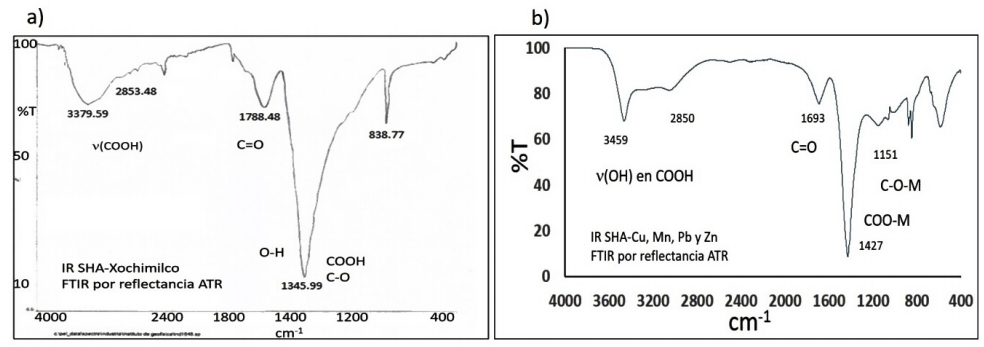
Figura 4 Espectros de IR realizados a las SHA de Xochimilco antes (a) y después de la reacción (b) para monitorear el cambio en las señales y a partir del cambio en la señal de los enlaces O-H se puede observar la interacción entre el oxígeno con enlace sencillo al carbono con los metales.
Además, el análisis realizado con el Microscopio electrónico de barrido, acoplado a EDS corrobora que se forman compuestos complejos, ya que la estructura de la muestra de las SHA de Xochimilco es uniforme y podría parecer limolita a través de la imagen microscópica; sin embargo, una vez que reaccionan se aprecia el cambio morfológico como se puede apreciar en la Figura 5.
Conclusiones
Las condiciones fisicoquímicas de los canales del Lago de Xochimilco favorecen la formación de los compuestos complejos entre las SHA y los metales Cu, Mn, Pb y Zn.
Los compuestos formados presentan poca solubilidad, por lo que, si no hay un flujo turbulento considerable en el lago de Xochimilco, los compuestos precipitarán.
La capacidad de complejación indica que las SHA presentan una gran afinidad hacia los metales de transición, aunque se debe de considerar la competencia con los elementos mayores Na, K, Mg y Ca.











 nueva página del texto (beta)
nueva página del texto (beta)



