Casos clínicos
Coroiditis por hipersensibilidad secundaria a tuberculosis ocular inactiva. Reporte de un caso
Choroiditis due to hypersensitivity secondary to inactive ocular tuberculosis. Case report
-
Publication dates-
Sep-Oct 2021
13 Septiembre 2021
- Article in PDF
- Article in XML
- Automatic translation
- Send this article by e-mail
- Share this article +
Resumen
Objetivo:
Describir que el ojo, ante procesos infecciosos sistémicos diversos que afectan a sus estructuras, tales como tuberculosis, infección por virus Ébola o sida (con sus infecciones oportunistas), una vez curado de su fase activa infecciosa reacciona de manera similar.
Caso clínico:
Presentamos el caso de una paciente que, tras ser tratada con éxito de tuberculosis ocular, desarrolló una coroiditis multifocal por hipersensibilidad retardada, de efectos potencialmente más devastadores que la propia infección activa, con inflamación coroidea y de vasos retinianos, papilitis y edema macular que, sin tratamiento, conduciría a una gran pérdida visual. Para su control, precisó corticoides sistémicos a corto plazo e inmunosupresores sistémicos de mantenimiento a largo plazo.
Conclusiones:
Las reacciones inflamatorias oculares por hipersensibilidad son más destructivas que la infección directa de diversos patógenos, ya que pueden generar una reacción inflamatoria basada en el reconocimiento del sistema inmunitario de restos antigénicos infecciosos en las estructuras oculares. Comprobar el control de la infección activa y posteriormente introducir corticoides sistémicos o inmunosupresores ahorradores de corticoides tiene efectos muy beneficiosos.
Palabras clave:
Coroiditis por hipersensibilidad, Tuberculosis ocular, Síndrome de recuperación inmunitaria, Inmunosupresores
Introducción
El avance en el conocimiento de las enfermedades infecciosas permite profundizar en el abordaje de cuadros oculares mal definidos hasta el momento. En el caso de la tuberculosis (TB), las manifestaciones oculares pueden ser diversas, según la etiopatogenia del proceso1. Así, destacan, por un lado, los cuadros derivados de la invasión directa del tejido ocular por el bacilo, y por otro, las reacciones inflamatorias oculares producidas por mecanismos de hipersensibilidad retardada, en las que el sistema inmunitario reconoce las huellas de los antígenos micobacterianos en las estructuras oculares y reacciona contra ellas2,3. Reconocer y diferenciar ambos cuadros es fundamental, puesto que su tratamiento es radicalmente distinto. Las manifestaciones oculares, si se producen por el primer mecanismo, consisten en tubérculos coroideos y escleritis nodular; en el segundo, desarrollan con más frecuencia vasculitis y coroiditis1. Este último mecanismo de generación de inflamación ocular, una vez resuelto el proceso infeccioso, se basa en el reconocimiento por parte del sistema inmunitario de restos antigénicos infecciosos en las estructuras oculares; es un mecanismo común a otros procesos infecciosos, como la enfermedad por virus Ébola4,5, la sífilis, la leptospirosis, la borreliosis6 y el sida, con su síndrome de uveítis de recuperación inmunitaria (URI)7,8.
-
1Ocular tuberculosis:current perspectivesClin Ophthalmol Auckl NZ, 2015
-
2Avances en el diagnóstico y tratamiento de las infecciones intraocularesMonografías de la Sociedad Española de Oftalmología, 2012
-
3Tuberculosis ocular. Serie de casos en el Hospital General de MéxicoRev Médica Hosp Gen México, 2014
-
1Ocular tuberculosis:current perspectivesClin Ophthalmol Auckl NZ, 2015
-
4An update on ocular complications of Ebola virus diseaseCurr Opin Ophthalmol, 2017
-
5Ebola Virus Persistence in Ocular Tissues and Fluids (EVICT) Study:reverse transcription-polymerase chain reaction and cataract surgery outcomes of Ebola survivors in Sierra LeoneEBioMedicine, 2018
-
6Paradoxical reactions in ocular tuberculosisJ Ophthalmic Inflamm Infect, 2019
-
7Immune-recovery uveitis in patients with cytomegalovirus retinitis taking highly active antiretroviral therapyAm J Ophthalmol, 2000
-
8Effect of anti-cytomegalovirus therapy on the incidence of immune recovery uveitis in AIDS patients with healed cytomegalovirus retinitisAm J Ophthalmol, 2003
Caso clínico
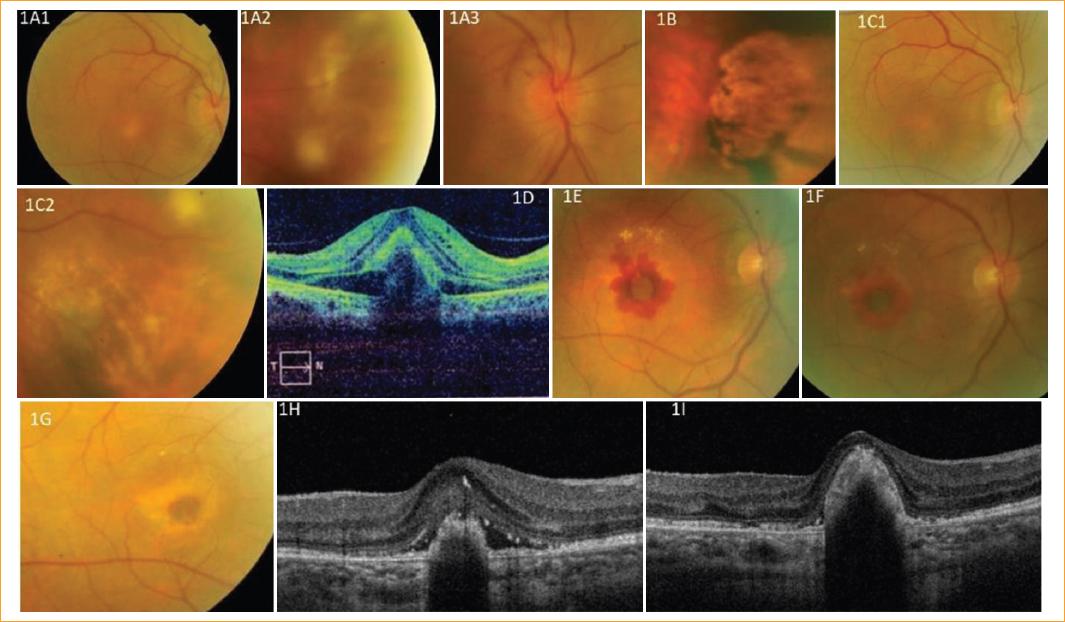
Mujer de 66 años vacunada con BCG (bacilo de Calmette-Guérin) en su juventud. En su historia clínica solo destacaban hipotiroidismo y problemas depresivos. Carecía de patologías o tratamientos inmunosupresores. Cuatro años antes había desarrollado un cuadro de panuveítis bilateral9 con presencia en el ojo derecho (OD) de granulomas coroideos periféricos y maculares, e inflamación del nervio óptico (Fig. 1 A). En el ojo izquierdo (OI) presentaba zonas extensas de atrofia coroidea antigua (Fig. 1 B). Dicho cuadro fue filiado, en colaboración con el servicio de medicina interna, como TB ocular, por presentar una prueba de Mantoux intensamente positiva (> 10), que excluiría un resultado posvacunación10, y una baciloscopia positiva en el esputo espontáneo realizado en tres fases, haciendo una tinción de Ziehl-Neelsen primeramente, menos específica, pero que resultó positiva, y después un cultivo en medio de Lowenstein-Jensen, que resultó positivo para Mycobacterium tuberculosis. No obstante, la radiografía de tórax y la tomografía computarizada pulmonar resultaron negativas. Las pruebas analíticas adicionales (enzima conversora de la angiotensina [ECA], virus de la inmunodeficiencia humana [VIH] y serología antitreponema) resultaron normales. Los anticuerpos contra el citoplasma del neutrófilo (ANCA) y antinucleares (ANA) resultaron negativos. Con todo ello, se descartaron sarcoidosis, granulomatosis de Wegener y enfermedades infecciosas como sífilis y VIH, con todo su cortejo de enfermedades de inmunodepresión asociadas. Finalmente, el diagnóstico al que se llegó fue el de tuberculosis diseminada con afectación traqueal o laríngea, además de ocular. Todos estos análisis y pruebas diagnósticas se realizaron bajo consentimiento informado, siendo la paciente conocedora del interés diagnóstico, terapéutico y científico de su caso.
-
9Guías mexicanas para el manejo de uveítis no infecciosa en adultosCentro Mexicano de Enfermedades Inflamatorias Oculares (CMEIO), 2019
-
10Protocolo de vigilancia y alerta de tuberculosis, 2011
Thumbnail
Figura 1
A1: presencia de granulomas coroideos maculares en OD. A2: granulomas coroideos periféricos en OD. A3: inflamación del nervio óptico en OD. B: zonas extensas de atrofia coroidea antigua en OI. C1 y C2: curación tras tratamiento con tuberculostáticos y corticoides en OD. D: tomografía de coherencia óptica de membrana neovascular de OD. E: membrana neovascular sobre cicatriz de granuloma macular tuberculoso en OD. F, G, H e I: resolución de la membrana en OD tras cinco inyecciones intravítreas de antiangiogénicos.
A1: presencia de granulomas coroideos maculares en OD. A2: granulomas coroideos periféricos en OD. A3: inflamación del nervio óptico en OD. B: zonas extensas de atrofia coroidea antigua en OI. C1 y C2: curación tras tratamiento con tuberculostáticos y corticoides en OD. D: tomografía de coherencia óptica de membrana neovascular de OD. E: membrana neovascular sobre cicatriz de granuloma macular tuberculoso en OD. F, G, H e I: resolución de la membrana en OD tras cinco inyecciones intravítreas de antiangiogénicos.
Fue tratada con éxito con un protocolo de tuberculostáticos (isoniazida 75 mg/día + rifampicina 150 mg/día + pirazinamida 400 mg/día + etambutol 275 mg/día) durante 2 meses, y luego se añadieron durante 4 meses más isoniazida y rifampicina. Ante la grave inflamación ocular en el OD, se aplicaron dosis bajas de cortisona (30 mg/día) (Fig. 1 C). Cinco meses después de remitir el proceso inflamatorio ocular, la paciente presentó una grave pérdida visual en el OD (< 1/10), debido a la aparición de una membrana neovascular sobre la cicatriz del granuloma macular tuberculoso de dicho ojo; por ello, fue sometida a tratamiento con antiangiogénicos (ranizimubab 10 mg/ml, una inyección intravítrea al mes durante 3 meses) (Fig. 1 D y E), consiguiendo una primera remisión del proceso. Sin embargo, 3 meses después hubo una recidiva que precisó dos inyecciones más, a razón de una por mes; con ello, quedó con una agudeza visual (AV) de 3/10 en dicho ojo (Fig. 1 F a I). Durante todo este proceso, la AV del OI era de 10/10, por no sufrir afectación coroidea en ese momento11, aunque, como se ha señalado, en las retinografías (Fig. 1 B) mostraba zonas de atrofia coroidea antigua, que podrían corresponder a algún proceso inflamatorio no controlado que remitió espontáneamente sin llegar a ser diagnosticado.
-
11Granuloma tuberculoso macular asociado a membrana neovascular tratado con terapia anti-factor de crecimiento endotelial vascularArchivos de la Sociedad Canaria de Oftalmología, 2018
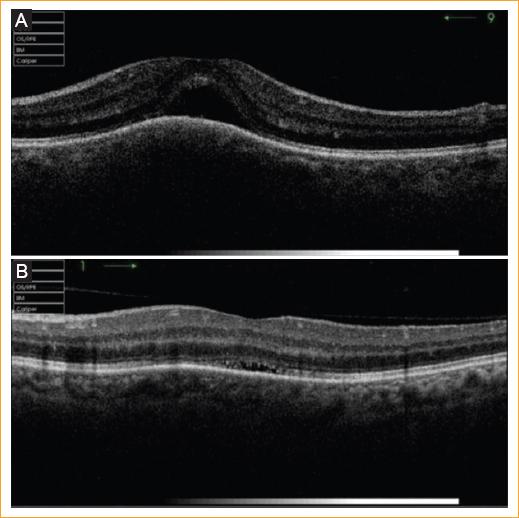
Tras remitir por completo el proceso y efectuar un seguimiento de vigilancia en el que se detectaron brotes esporádicos de uveítis anteriores en el OD y que se solucionaron fácilmente con corticoides tópicos, un año después de la última inyección de antiangiogénicos en el OD acude por urgencias con un descenso de la AV en el OI de 8/10, presentando una uveítis anterior de tres cruces y edema macular (Fig. 2 A). Referida nuevamente al servicio de medicina interna, se comprobó la inactividad del proceso tuberculoso sistémico mediante nueva baciloscopia del esputo (tinción de Ziehl-Neelsen) y cultivo del mismo (medio de Lowenstein-Jensen), que resultó negativo, y negativización de IGRA (Interferon Gamma Release Assay) en sangre. Se realizó, además, un lavado bronquioalveolar que resultó también negativo. La repetición de las pruebas radiológicas, como la tomografía computarizada torácica, también resultó negativa. Además, se le volvió a realizar otra batería de pruebas diagnósticas para ECA, VIH y anticuerpos antitreponema (ELISA), por si se hubieran realizado antes en periodo ventana, y de nuevo también determinación de ANA y ANCA; se añadió una búsqueda antigénica HLA B27 y HLA B7, pero todo resultó negativo. En consecuencia, se aplicaron corticoides sistémicos (deflazacort 30 mg/día) y corticoides tópicos, con lo que remitió la inflamación (Fig. 2 B) y se consiguió la recuperación visual total (AV de 10/10).
Thumbnail
Figura 2
A: un año después, primera aparición del proceso inflamatorio en el OI tras la curación de la tuberculosis activa. Edema macular inflamatorio con despegamiento del epitelio pigmentario retiniano. B: paulatina remisión del edema macular y del despegamiento del epitelio pigmentario retiniano en el OI tras la aplicación de corticoides sistémicos.
A: un año después, primera aparición del proceso inflamatorio en el OI tras la curación de la tuberculosis activa. Edema macular inflamatorio con despegamiento del epitelio pigmentario retiniano. B: paulatina remisión del edema macular y del despegamiento del epitelio pigmentario retiniano en el OI tras la aplicación de corticoides sistémicos.
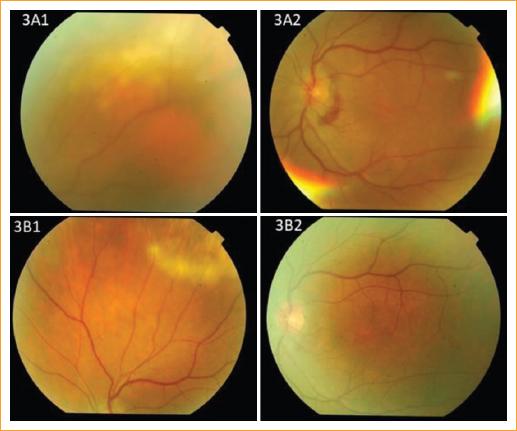
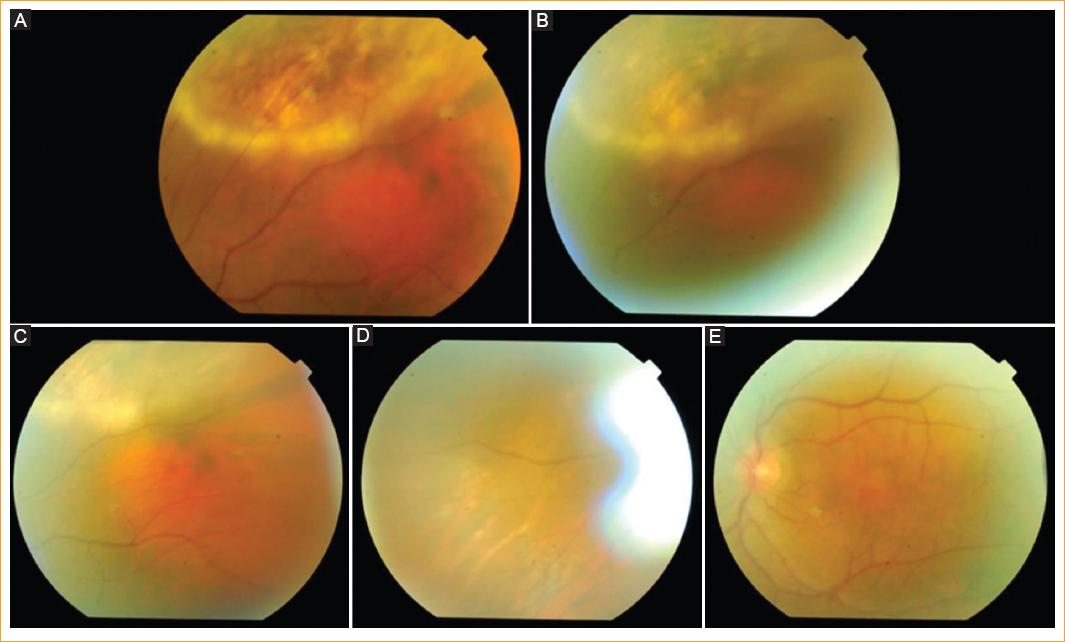
Al mes reaparece el proceso del OI con nuevo descenso visual y focos de coroiditis periférica y papilitis, además de uveítis anterior (Fig. 3 A). Se reintrodujeron los corticoides sistémicos (deflazacort 30 mg/día) y tópicos, y remitió nuevamente el proceso (Fig. 3 B). No obstante, al iniciar el descenso de la terapia corticoidea sistémica comienza a reaparecer el cuadro inflamatorio (Fig. 4 A y B), con lo que se decide la introducción de azatioprina sistémica (tres comprimidos de 50 mg/día) como tratamiento de mantenimiento a largo plazo para evitar las recaídas. Con ello, se pudo finalmente retirar el corticoide sistémico y controlar el proceso inflamatorio (Fig. 4 C a E). Se consiguió conservar una visión final en el OI de 8/10. La paciente lleva en este momento 6 meses con la misma dosis de azatioprina, estando en previsión reducir un comprimido de 50 mg/día cada 2 meses, en función de la respuesta clínica, siempre y cuando no se reactive el cuadro, e intentar su total retirada.
Thumbnail
Figura 3
A1 y A2: un mes después, segunda reaparición del proceso inflamatorio en el OI tras la curación de la tuberculosis activa. Inflamación coroidea periférica (A1) y del nervio óptico (A2). B1 y B2: nueva remisión del proceso tras la reintroducción de los corticoides sistémicos.
A1 y A2: un mes después, segunda reaparición del proceso inflamatorio en el OI tras la curación de la tuberculosis activa. Inflamación coroidea periférica (A1) y del nervio óptico (A2). B1 y B2: nueva remisión del proceso tras la reintroducción de los corticoides sistémicos.
Thumbnail
Figura 4
A y B: un mes después, al descender la terapia corticoidea comienza a reaparecer de nuevo el proceso inflamatorio en el OI. C, D y E: con la introducción de azatioprina sistémica se controla el proceso inflamatorio en el OI y pueden suspenderse los corticoides sistémicos.
A y B: un mes después, al descender la terapia corticoidea comienza a reaparecer de nuevo el proceso inflamatorio en el OI. C, D y E: con la introducción de azatioprina sistémica se controla el proceso inflamatorio en el OI y pueden suspenderse los corticoides sistémicos.
Discusión
El comportamiento del sistema inmunitario y sus manifestaciones oculares actúa de manera similar ante agentes infecciosos de muy diverso tipo. En el caso de la TB, las manifestaciones oculares pueden no ser causadas por la infección activa del bacilo que invade el ojo, sino que, una vez tratada dicha infección, puede producirse una reacción de hipersensibilidad retardada de tipo IV a diversos componentes antigénicos con un enorme poder destructivo, incluso más que la propia infección activa3.
-
3Tuberculosis ocular. Serie de casos en el Hospital General de MéxicoRev Médica Hosp Gen México, 2014
La administración del derivado purificado de proteínas de la tuberculina (PPD) se ha comunicado como causa de panuveítis, lo que sugiere una reacción de hipersensibilidad de tipo IV en las estructuras oculares11. Asimismo, se ha descrito una coroiditis multifocal muy parecida al síndrome de Vogt-Koyanagi-Harada a los 5 días de la administración de la PPD, que mejoró con el uso sistémico de corticoides12.
-
11Granuloma tuberculoso macular asociado a membrana neovascular tratado con terapia anti-factor de crecimiento endotelial vascularArchivos de la Sociedad Canaria de Oftalmología, 2018
-
12Drug induced uveitisArch Soc Esp Oftalmol, 2005
El caso que nos ocupa es especialmente llamativo porque rara vez coinciden de modo tan ordenado dos procesos inflamatorios de una misma etiología infecciosa, pero con mecanismos de actuación diferentes: por un lado, una patología inflamatoria provocada directamente por una infección activa (el bacilo), y posteriormente, cuando esta había sido tratada y había remitido, una reacción por hipersensibilidad debida al mismo agente infeccioso que ya fue correctamente tratado; todo en la misma paciente y en una línea temporal dilatada, pero fácil de seguir y relacionar.
Este comportamiento de activación de una reacción autoinmunitaria ocular contra una infección ya padecida y en remisión fue descrito hace años en el síndrome inflamatorio de URI de los pacientes VIH positivos, que formaba parte del espectro de cuadros del síndrome inflamatorio de reconstitución inmunitaria (SIRI), aunque no es exactamente un proceso de hipersensibilidad retardada, ya que parte de inmunidades deprimidas. En el URI se desarrollaba un cuadro inflamatorio ocular en pacientes con sida que habían padecido una retinitis por citomegalovirus (RCMV), pero cuyo proceso en aquel momento era inactivo7,8 y su estado inmunitario había mejorado gracias a la administración de terapia antirretroviral; esto sucedía en una media de 20 semanas desde el incremento de los linfocitos CD4 (aunque variaba desde meses hasta años después), comenzando un cuadro inflamatorio con vitreítis, papilitis y edema macular, que producía una importante pérdida de visión. Ninguno de los pacientes con URI tuvo reactivación de la RCMV, a diferencia de los otros cuadros de SIRI (retinitis de recuperación inmunitaria desenmascarada y paradójica). La administración de corticoides sistémicos protegía contra el síndrome de URI7,8,13,14, siendo su uso de primera elección, pero estaba contraindicada en los otros síndromes. Por tanto, era muy importante conocer y distinguir el síndrome de URI de la recaída de RCMV, porque el tratamiento de elección de ambas patologías era muy distinto. En el caso de la reactivación de la RCMV se aplicarían los antivíricos específicos contra el citomegalovirus (valganciclovir oral), en principio sin corticoides, ya que en las primeras fases de la reactivación los corticoides sistémicos estaban contraindicados, al favorecer la extensión de la RCMV7,8.
-
7Immune-recovery uveitis in patients with cytomegalovirus retinitis taking highly active antiretroviral therapyAm J Ophthalmol, 2000
-
8Effect of anti-cytomegalovirus therapy on the incidence of immune recovery uveitis in AIDS patients with healed cytomegalovirus retinitisAm J Ophthalmol, 2003
-
7Immune-recovery uveitis in patients with cytomegalovirus retinitis taking highly active antiretroviral therapyAm J Ophthalmol, 2000
-
8Effect of anti-cytomegalovirus therapy on the incidence of immune recovery uveitis in AIDS patients with healed cytomegalovirus retinitisAm J Ophthalmol, 2003
-
13¿TB or not TB?El dilema de la uveítis asociada a tuberculosisOftalmol Clin Exp, 2013
-
14Proposed clinical definition for cytomegalovirus-immune recovery retinitisClin Infect Dis, 2014
-
7Immune-recovery uveitis in patients with cytomegalovirus retinitis taking highly active antiretroviral therapyAm J Ophthalmol, 2000
-
8Effect of anti-cytomegalovirus therapy on the incidence of immune recovery uveitis in AIDS patients with healed cytomegalovirus retinitisAm J Ophthalmol, 2003
Por supuesto, aunque el síndrome de URI presenta algunas similitudes con el cuadro autoinmunitario tuberculoso que describimos, puesto que ambos son procesos inflamatorios autoinmunitarios en infecciones ya inactivas, también muestra marcadas diferencias, dado que en el síndrome de URI hay previamente una enfermedad de base (por VIH) que ha deprimido la inmunidad y tras la administración de terapia antirretroviral ha aumentado el número de CD4 y disminuido más de un logaritmo (en base 10) la carga viral, con lo que se produce una reconstitución inmunitaria14. En cambio, en el cuadro que nos ocupa, la reacción autoinmunitaria coroidea por tuberculosis siempre tuvo lugar en una paciente con la inmunidad conservada y sin enfermedad sistémica añadida.
-
14Proposed clinical definition for cytomegalovirus-immune recovery retinitisClin Infect Dis, 2014
Otra cuestión de sumo interés en relación con lo comentado son las uveítis encontradas en los supervivientes de la enfermedad por virus Ébola4, que en algunos casos producen importantes pérdidas visuales. Estas uveítis fueron observadas en el 13-34% de los supervivientes a la enfermedad por virus Ébola. Se describieron especialmente uveítis posteriores y panuveítis, llegando a empeorar la visión a 20/400 en un 39% de los ojos afectados en pacientes de Liberia. La reacción en cadena de la polimerasa para la determinación de la presencia del virus Ébola mediante paracentesis de cámara anterior de los ojos de estos pacientes resultó negativa, por lo que parece que en la mayoría de los casos no había acantonamiento del virus4,5.
-
4An update on ocular complications of Ebola virus diseaseCurr Opin Ophthalmol, 2017
-
4An update on ocular complications of Ebola virus diseaseCurr Opin Ophthalmol, 2017
-
5Ebola Virus Persistence in Ocular Tissues and Fluids (EVICT) Study:reverse transcription-polymerase chain reaction and cataract surgery outcomes of Ebola survivors in Sierra LeoneEBioMedicine, 2018
Al igual que el caso de TB comentado, la patogénesis de las uveítis en los pacientes recuperados de enfermedad por virus Ébola podría deberse a la reacción de hipersensibilidad a los antígenos del ARN viral residuales en las células de las distintas estructuras oculares, teniendo buena evolución si los pacientes pueden acceder a fármacos como corticoides tópicos o prednisona oral. Sin embargo, en el caso del virus Ébola, al ser una patología tan desconocida y mortal, se administran terapias antirretrovirales (favipiravir) 48 horas antes de los tratamientos corticoideos de manera preventiva4.
-
4An update on ocular complications of Ebola virus diseaseCurr Opin Ophthalmol, 2017
Este mecanismo de empeoramiento paradójico tras la administración de tratamientos específicos contra agentes infecciosos se describió por primera vez en pacientes con sífilis temprana, aunque también se ha visto en neurosífilis, sífilis ocular y sífilis cardiovascular. Los mecanismos propuestos en la reacción de Jarisch-Herxheimer (JHR) incluyen la liberación de endotoxinas por la muerte de organismos, hipersensibilidad retardada y mecanismos supresores disminuidos. La JHR también es común en leptospirosis y en borreliosis6.
-
6Paradoxical reactions in ocular tuberculosisJ Ophthalmic Inflamm Infect, 2019
En el caso clínico que nos ocupa, la paciente había tenido una TB sistémica con repercusiones oculares retinianas de gran extensión, en especial en el OD, que fue correctamente tratada con tuberculostáticos y corticoides sistémicos. Sin embargo, una vez que esta remitió, y el estado general de la paciente mejoró, se produjo una reacción de hipersensibilidad ocular dentro de la línea de los procesos anteriormente comentados en el ojo contralateral, que había sido afectado por la uveítis en menor grado, aunque seguramente había tenido una diseminación de micobacterias menos sintomática y tenía una atrofia coroidea extensa quizá debida a un proceso anterior no detectado.
Al igual que el síndrome de URI o la uveítis tras la enfermedad por virus Ébola, este cuadro fue exitosamente tratado con corticoides sistémicos, sin administrar de nuevo los tuberculostáticos, puesto que todos los test indicaban que no era un caso de recaída infecciosa. No obstante, probablemente debido a la elevada concentración de antígenos del bacilo de la TB en las células oculares, el proceso inflamatorio reaparecía cuando la dosis de corticoides sistémicos se reducían. Por ello, se introdujo azatioprina a dosis de 150 mg/día como terapia ahorradora de corticoides, y se procedió a reducir de manera paulatina la cortisona, intentando evitar los problemas que a medio plazo acarrearía el uso prolongado de cortisona sistémica. Se utilizó azatioprina por su especial papel en la prevención de la proliferación de células involucradas en la determinación y la amplificación de la respuesta inmunitaria. Además, se la ha considerado efectiva para el tratamiento de diversos tipos de panuveítis y uveítis posteriores, en especial para la coroiditis serpiginosa, patología con cierta relación con la TB y con un mecanismo etiopatogénico afín. Otras opciones terapéuticas habrían sido el metotrexato13, administrado con éxito en algunas reacciones de hipersensibilidad similares y con un efecto tuberculostático añadido. No obstante, finalmente, el proceso inflamatorio fue controlado con el fármaco inmunosupresor (azatioprina), con el que de momento continúa desde hace 6 meses sin nuevas reacciones inflamatorias, valorando con el tiempo la supresión a razón de un comprimido cada 2 meses, hasta conseguir controlar el problema inflamatorio ocular de modo definitivo.
-
13¿TB or not TB?El dilema de la uveítis asociada a tuberculosisOftalmol Clin Exp, 2013
Conclusiones
El comportamiento de los cuadros oculares secundarios a reacciones autoinmunitarias por agentes infecciosos diversos tiene, sin embargo, evoluciones y tratamientos similares.
Eliminar la TB activa, sobrevivir al virus del Ébola o frenar las enfermedades oportunistas oculares relacionadas con el sida no asegura el control de los cuadros oculares. Una vez que las enfermedades infecciosas han sido dominadas, las reacciones inflamatorias oculares autoinmunitarias son a veces más destructivas que la infección directa del propio microorganismo.
Comprobar el control de la infección activa y posteriormente introducir corticoides sistémicos y, como en el caso que nos ocupa, administrar inmunosupresores ahorradores de corticoides en caso de recaídas (azatioprina, entre otros), puede tener efectos muy beneficiosos a medio y largo plazo para el control de este tipo de uveítis.
Bibliografía
-
1Shakarchi FI. Ocular tuberculosis:current perspectives. Clin Ophthalmol Auckl NZ. 2015;9:2223-7. Links
-
2Adán Civera A. Avances en el diagnóstico y tratamiento de las infecciones intraoculares. Monografías de la Sociedad Española de Oftalmología;2012. 168 p. Links
-
3Tenorio-Guajardo G, Ramírez-Casanova E, González-Rodríguez E. Tuberculosis ocular. Serie de casos en el Hospital General de México. Rev Médica Hosp Gen México. 2014;77:17-23. Links
-
4Shantha JG, Crozier I, Yeh S. An update on ocular complications of Ebola virus disease. Curr Opin Ophthalmol. 2017;28:600-6. Links
-
5Shantha JG, Mattia JG, Goba A, Barnes KG, Ebrahim FK, Kraft CS, et al. Ebola Virus Persistence in Ocular Tissues and Fluids (EVICT) Study:reverse transcription-polymerase chain reaction and cataract surgery outcomes of Ebola survivors in Sierra Leone. EBioMedicine. 2018;30:217-24. Links
-
6Ganesh SK, Abraham S, Sudharshan S. Paradoxical reactions in ocular tuberculosis. J Ophthalmic Inflamm Infect. 2019;9:19. Links
-
7Robinson MR, Reed G, Csaky KG, Polis MA, Whitcup SM. Immune-recovery uveitis in patients with cytomegalovirus retinitis taking highly active antiretroviral therapy. Am J Ophthalmol. 2000;130:49-56. Links
-
8Song M-K, Azen SP, Buley A, Torriani F, Cheng L, Chaidhawangul S, et al. Effect of anti-cytomegalovirus therapy on the incidence of immune recovery uveitis in AIDS patients with healed cytomegalovirus retinitis. Am J Ophthalmol. 2003;136:696-702. Links
-
9Concha del Río LE, Garza León MA, González Rubio Medina E, Recillas Gispert C, Voorduin Ramos S, Ruiz Cruz M. Guías mexicanas para el manejo de uveítis no infecciosa en adultos. Centro Mexicano de Enfermedades Inflamatorias Oculares (CMEIO);2019. Links
-
10Red Nacional de Vigilancia Epidemiológica. Protocolo de vigilancia y alerta de tuberculosis. Sevilla:Junta de Andalucía;2011. Disponible en:https://www.juntadeandalucia.es/export/drupaljda/salud_5af95879cd47b_pr_tuberculosis2011.pdf. Links
-
11Echevarría Lucas L, Medialdea Hurtado ME, Villena Irigoyen O, De Ramón Garrido E. Granuloma tuberculoso macular asociado a membrana neovascular tratado con terapia anti-factor de crecimiento endotelial vascular. Archivos de la Sociedad Canaria de Oftalmología. 2018;29:77-83. Links
-
12Cano Parra J, Díaz-Llopis M. Drug induced uveitis. Arch Soc Esp Oftalmol. 2005;80:137-49. Links
-
13Julián K. ¿TB or not TB?El dilema de la uveítis asociada a tuberculosis. Oftalmol Clin Exp. 2013;6:35-44. Links
-
14Ruiz-Cruz M, Alvarado de la Barrera C, Ablanedo Terrazas Y, Reyes Terán G. Proposed clinical definition for cytomegalovirus-immune recovery retinitis. Clin Infect Dis. 2014;59:298-303. Links